大黄酸⁃缬氨酸加合物的合成及初步抗肿瘤活性
2016-12-14周昌健谢建伟
张 洁,周昌健,谢建伟,代 斌
(石河子大学化学化工学院,新疆兵团化工绿色过程重点实验室⁃省部共建国家重点实验室培育基地,石河子832003)
大黄酸⁃缬氨酸加合物的合成及初步抗肿瘤活性
张洁,周昌健,谢建伟,代斌
(石河子大学化学化工学院,新疆兵团化工绿色过程重点实验室⁃省部共建国家重点实验室培育基地,石河子832003)
以大黄酸为原料,经酯化、烷基化、水解及缩合等反应步骤合成了12个大黄酸⁃缬氨酸加合物.目标化合物经1H NMR,13C NMR和HRMS进行了结构确证.以顺铂和阿霉素为阳性对照药,采用四甲基偶氮唑盐(MTT)法考察了目标化合物的体外抗肿瘤(Hela,MCF⁃7,HepG2,KB和HEK293T等5株细胞)活性.结果表明,化合物5l显示出较好的抗肿瘤活性,其IC50值在1.6~9.4 μmol/L之间.作用机制研究结果表明,化合物5l能够与DNA发生较强的结合作用.
大黄酸;缬氨酸;加合物;抗肿瘤活性;构效关系
大黄(Rheum palmatum L.)是一种多年生草本植物,是我国的传统中药材之一.大量研究[1]表明,大黄的主要化学成分包括蒽醌类、二蒽酮类及蒽酮甙类等,其中蒽醌类(如大黄酸、大黄素甲醚、大黄素、芦荟大黄素和大黄酚等)约占大黄成分的4%左右,其药理作用极其广泛.现代研究[2]证实,蒽醌甙类为大黄引起腹泻的有效成分;游离蒽醌类能起到抑菌及抗肿瘤的作用;游离蒽醌和蒽醌甙类为大黄降血脂、抗氧化的有效成分;此外,这些蒽醌衍生物还具有抗血管生成等作用.近几十年来的药理学研究表明,大黄酸在保护肝脏[3,4]、抗肿瘤[5~10]、抗菌[11~13]及抗糖尿病[10,14,15]等方面都具有活性.因此,大黄酸的结构修饰备受关注.Ye等[16]合成了系列大黄酸⁃磷酸衍生物,并以HepG2和CNE等肿瘤细胞株为目标进行体外细胞毒性测试,得到一些活性较高的化合物.Liang等[17]从大黄酸出发,合成了2个系列的蒽[2,1⁃d]噻唑⁃6,11⁃二酮衍生物,其对A549和Hela细胞的抑制效果比大黄酸提高了约30倍.纪春梅等[18]研究发现,赖氨大黄酸能够通过抑制顺铂对ERK的激活,影响Capase3,Caspase⁃7和PARP的切割片段蛋白表达,加强了顺铂对肺癌细胞的凋亡诱导进程.
本文以大黄酸为原料,先将3⁃位酯化生成大黄酸乙酯,再对1,8⁃位进行取代,而后将3⁃位的酯水解成羧基进而与缬氨酸乙酯盐酸盐发生缩合,再通过水解及成盐反应得到目标产物.采用四甲基偶氮唑盐(MTT)法考察了目标化合物在细胞水平的体外抗肿瘤活性,并对其作用机理进行了初步研究.
1 实验部分
1.1 试剂与仪器
大黄酸(分析纯)购自上海多点化工有限公司;碘甲烷、溴乙烷、溴丙烷、1⁃溴丁烷和溴化苄等烷基化试剂均为分析纯,购自阿拉丁试剂公司;缬氨酸乙酯盐酸盐(分析纯)购自Adamas试剂公司;ct⁃DNA购自Sigma⁃Aldrich公司;其它试剂及溶剂均为分析纯.
WRS⁃1B型数字熔点仪(上海精密科学仪器有限公司);ZF⁃2型紫外分析仪(上海安亭电子仪器厂);Bruker AVANCEⅢHD 400型核磁共振仪(CDCl3或DMSO⁃d6为溶剂,TMS为内标,瑞士布鲁克公司);AL104型分析天平(瑞士梅特勒公司);Model 680型酶标仪(美国伯乐生命医学产品有限公司);柱色谱用硅胶(200~300目,青岛海洋化工有限公司);F⁃2500型荧光光谱仪(日本日立公司);美谱达UV⁃3200PCS紫外⁃可见吸收光谱仪(上海美谱达仪器有限公司);1 cm石英比色皿(北京瑞泽康生物科技有限公司).
1.2 目标化合物的合成
目标化合物的合成路线如Scheme 1所示.
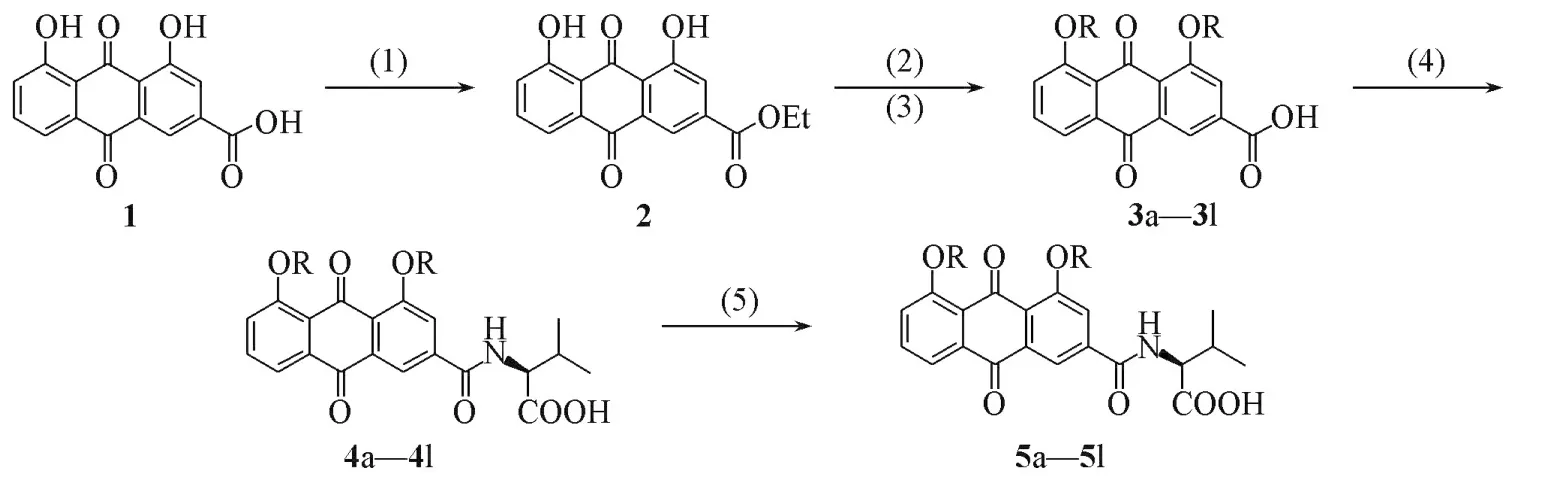
3a,4a,5a:R=Methyl;3b,4b,5b:R=ethyl;3c,4c,5c:R=propyl;3d,4d,5d:R=n⁃butyl;3e,4e,5e:R=benzyl;3f,4f,5f:R=2,6⁃dichlorobenzyl;3g,4g,5g:R=4⁃chlorobenzyl;3h,4h,5h:R=4⁃fluorobenzyl;3i,4i,5i:R=3⁃fluoro⁃benzyl;3j,4j,5j:R=4⁃isopropylbenzyl;3k,4k,5k:R=phenylethyl;3l,4l,5l:R=phenylpropylScheme 1 Synthetic routes of target compounds 5a—5l(1)SOCl2,EtOH,reflux;(2)RX,NaH,DMF;(3)1 mol/L NaOH(aq),then 1 mol/L HCl(aq);(4)NH2CH(R2)COOEt,EDCI,DMAP,CH2Cl2;(5)1 mol/L NaOH,then 1 mol/L HCl(aq).
1.2.1 中间体2的合成 将2.84 g(10 mmol)大黄酸、40 mL无水乙醇和10 mL SOCl2加入250 mL圆底烧瓶中,加热至回流反应24 h,待原料完全转化,将反应液倒入1 L蒸馏水中,抽滤,并用大量蒸馏水洗涤固体,将固体在真空干燥箱中充分干燥,得到2.934 g黄色固体化合物2.产率为94%,m.p. 155.3~156.0℃.1H NMR(400 MHz,CDCl3),δ:12.02(s,1H),11.97(s,1H),8.42(d,J=0.8 Hz,1H),7.94(d,J=1.2 Hz,1H),7.88(d,J=7.2 Hz,1H),7.73(t,J=8.0 Hz,1H),7.34(d,J=8.4 Hz,1H),4.45(q,J=7.6 Hz,2H),1.45(t,J=7.2 Hz,3H).
1.2.2 中间体3a~3l的合成 取3.12 g(10 mmol)化合物2、250 mL N,N⁃二甲基甲酰胺和1.5 g(50 mmol)NaH加入圆底烧瓶中,搅拌10 min后,加入7.5 mL卤代烷烃(0.12 mol).在90~130℃下反应,用TLC监测反应进程.反应结束后,将反应液倒入到300 mL 1 mol/L HCl溶液中,并用二氯甲烷萃取,合并有机相,减压浓缩得到的粗产物,再用硅胶柱层析[V(石油醚)∶V(乙酸乙酯)=5∶1]分离,并将粗产物直接加入到200 mL 1 mol/L NaOH溶液中,在室温至60℃下搅拌,用TLC监测反应进程.待水解完毕后,用HCl(1 mol/L)溶液调节pH=5~6,有固体析出,抽滤,并用大量去离子水洗涤.将固体充分干燥即得到黄色固体化合物3a~3l,其理化性质数据列于表1,1H NMR数据列于表2.
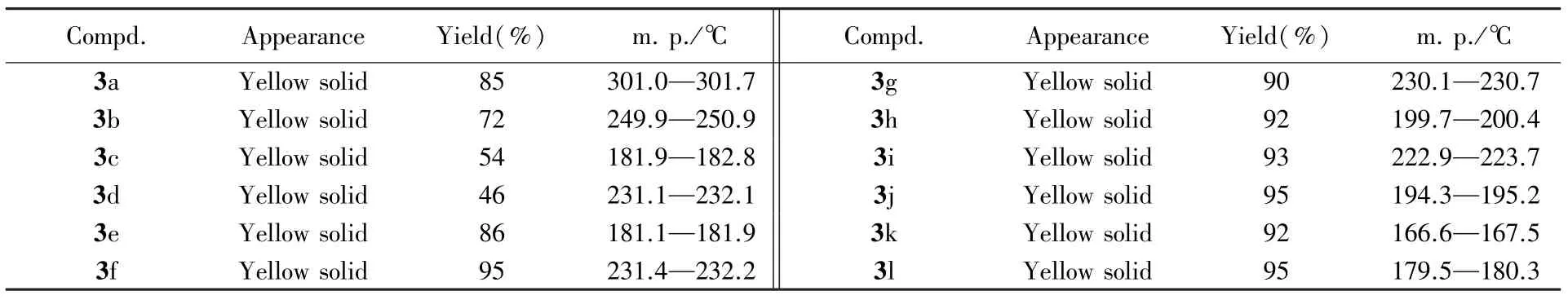
Table 1 Appearances,yields and melting points of compounds 3a—3l

Table 21H NMR data of compounds 3a—3l

Continued
1.2.3 中间体4a~4l的合成 取化合物3a~3l(5 mmol)、1.2 mL 4⁃二甲氨基吡啶(DMAP,10 mmol)、1⁃乙基⁃(3⁃二甲基氨基丙基)碳酰二亚胺盐酸盐(EDCI,7.5 mmol)和1.1 g(6 mmol)缬氨酸乙酯盐酸盐混合,加入100 mL二氯甲烷,在室温下搅拌反应,用TLC监测反应进程.待反应结束后,将反应液缓慢倒入150 mL 0.1 mol/L HCl溶液中,并用二氯甲烷萃取3次,合并有机相,用无水硫酸钠干燥,浓缩.经柱层析分离[V(石油醚)∶V(乙酸乙酯)=2∶1]纯化得黄色液体,减压浓缩至干,得黄色固体化合物4a~4l,其理化性质数据列于表3,1H NMR数据列于表4.
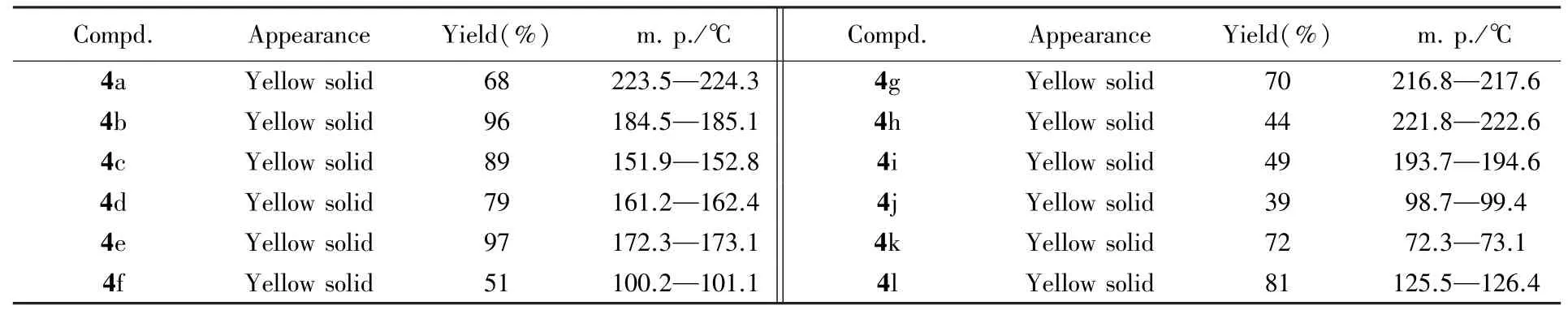
Table 3 Appearances,yields and melting points of compounds 4a—4l

Table 41H NMR data of compounds 4a—4l
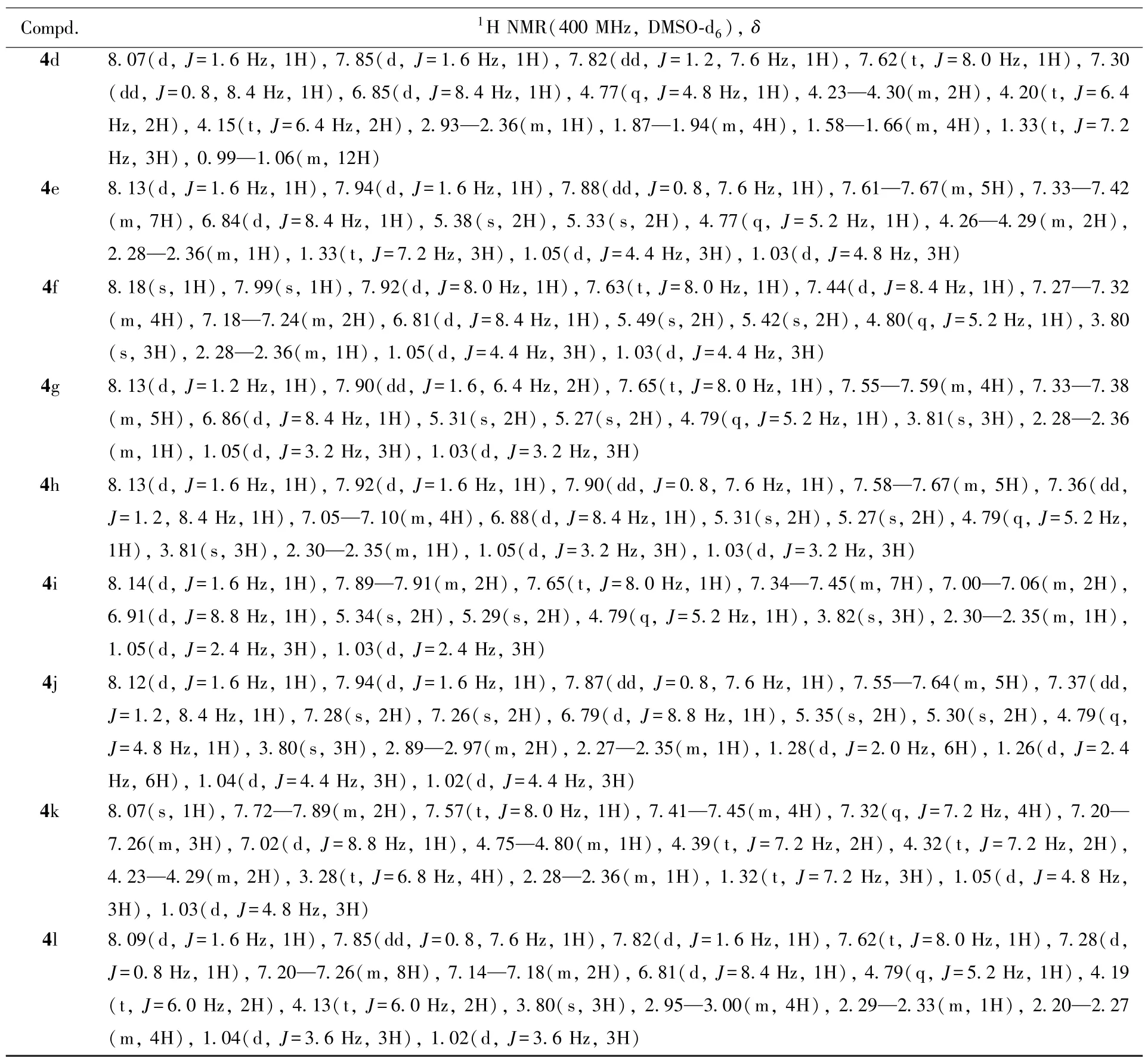
Continued
1.2.4 大黄酸⁃缬氨酸偶联物(5a~5l)的合成 取0.4 g(1 mmol)化合物4a~4l溶于10 mL乙醇中,滴加20 mL 1 mmol/L NaOH溶液,在室温至70℃下搅拌反应,用TLC监测反应进程.待反应结束,将反应液缓慢倒入20 mL 1 mmol/L HCl溶液中,搅拌过程中析出黄色固体,直接将固体过滤,并用大量蒸馏水洗涤,即得大黄酸⁃缬氨酸加合物5a~5l.目标化合物的理化性质数据列于表5,1H NMR和13C NMR数据列于表6.

Table 5 Appearances,yields,melting points and HRMS data of target compounds 5a—5l
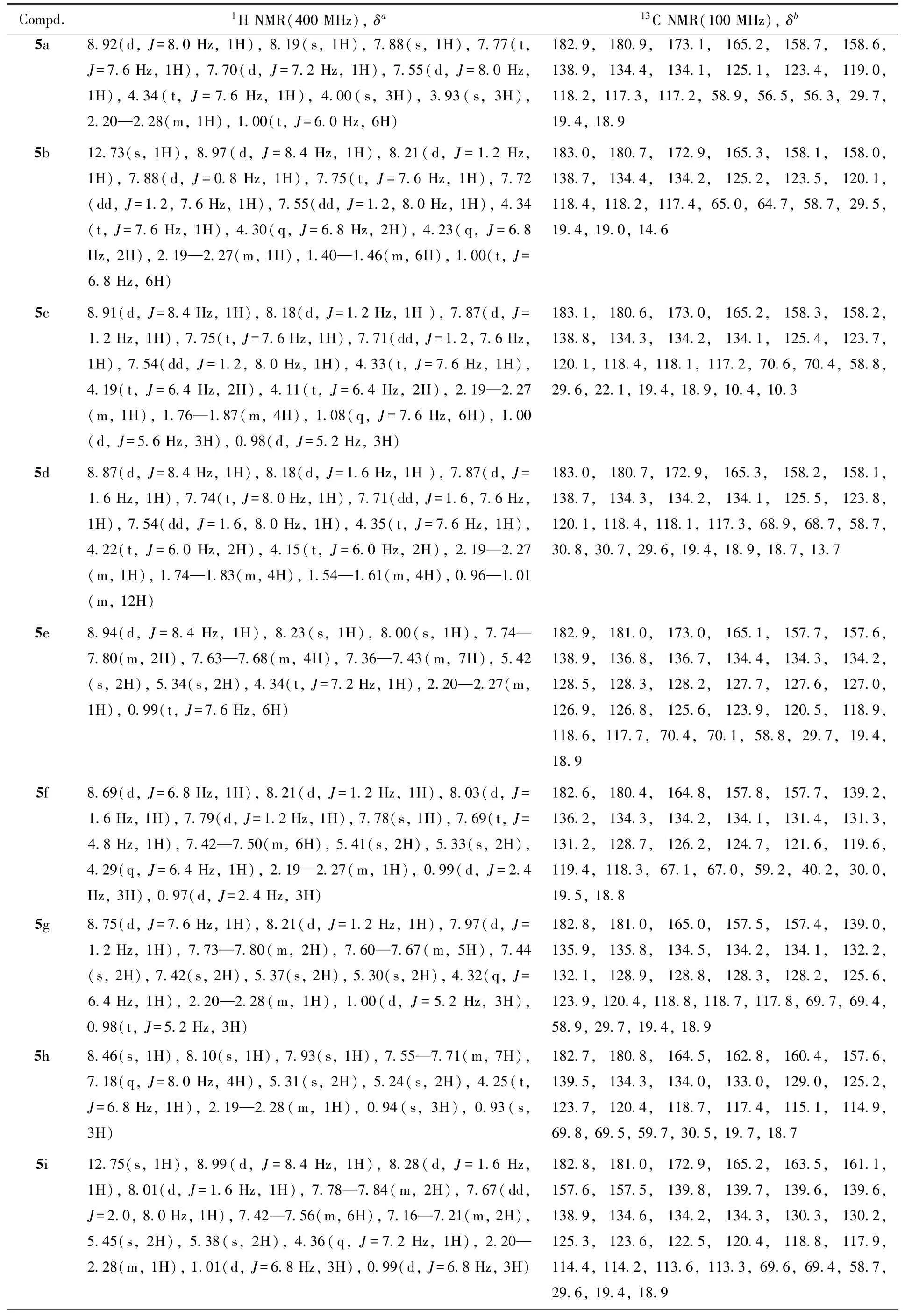
Table 61H NMR and13C NMR data of target compounds 5a—5l

Continued
1.3 体外抗肿瘤活性测试
采用MTT法[19~22]测试了目标化合物5a~5l对子宫颈癌细胞(Hela)、人肝癌细胞(HepG⁃2)、人乳腺癌细胞(MCF⁃7)、人口腔表皮癌细胞(KB)及人胚肾细胞(HEK⁃293T)的体外抑制活性.为提高目标化合物的水溶性,制成钠盐用于实验,活性测试结果见表7.
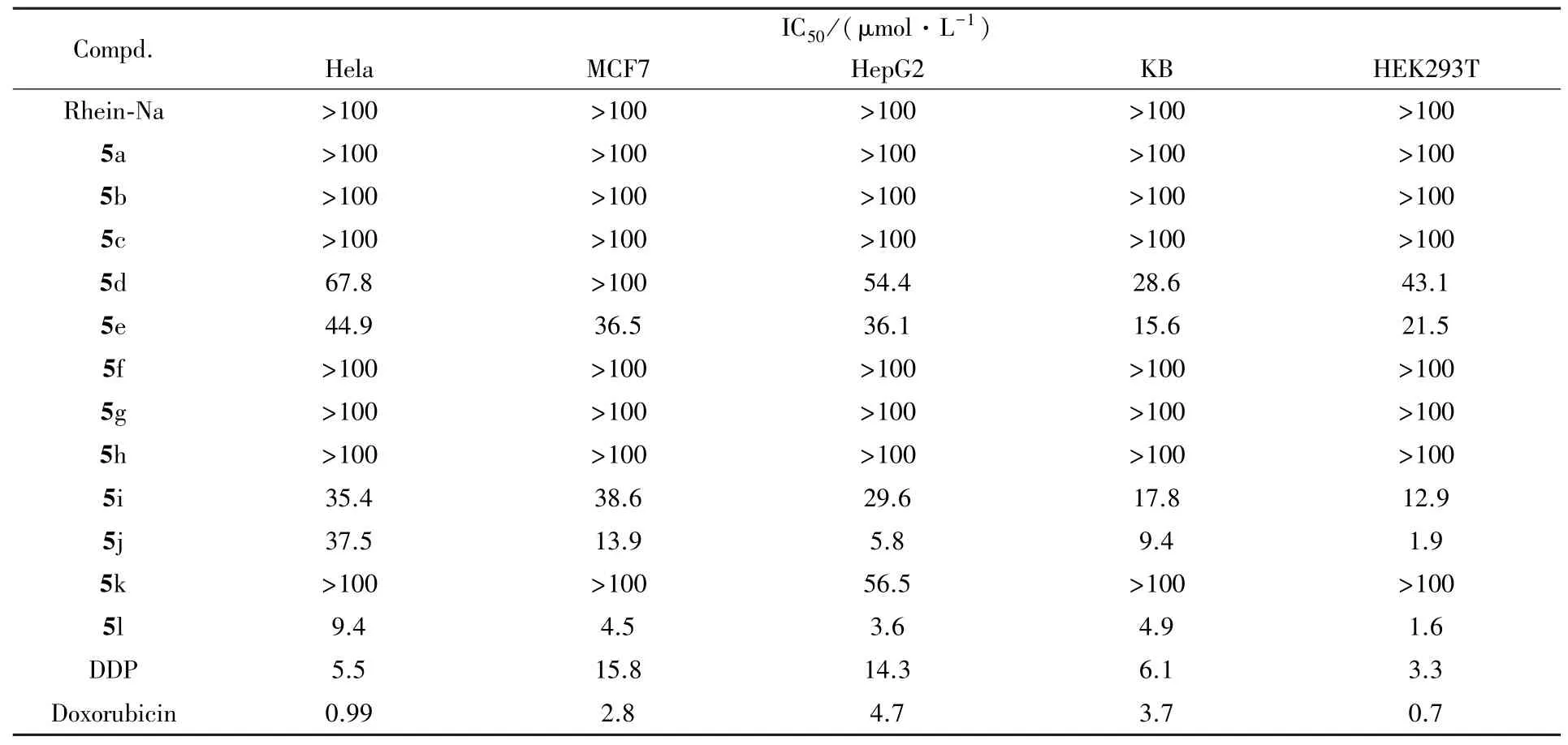
Table 7 Antitumor activity of target compoundsin vitro∗
1.4 化合物5l与ct⁃DNA相互作用研究
研究小分子药物与DNA之间的相互作用模式对于揭示抗肿瘤药物的作用机制、设计新型的以DNA为靶标的抗肿瘤药物具有重要的指导意义.大黄酸类化合物具有共平面的蒽醌环结构,可作为DNA的嵌入剂插入到DNA碱基对中,抑制DNA的转录和复制功能,从而表现出细胞毒性.由于DNA分子本身及作为探针的小分子均具有丰富的光谱活性,而且小分子与DNA结合后,其光谱性质通常会发生变化,因此光谱法是研究小分子与DNA作用的有力手段.本文采用紫外⁃可见光谱法和荧光光谱法研究了化合物5l与DNA的相互作用,初步判定了该衍生物与DNA的结合方式.
将ct⁃DNA固体配制成溶液,通过测定260 nm处的紫外吸收值确定其准确浓度为3.77×10-4mol/L,纯度A260/A280=1.82,保存于1~4℃冰箱中;浓度为0.01 mol/L Tris⁃HCl缓冲溶液(含有0.01 mol/L的NaCl,pH=7.4).实验用水为二次蒸馏水.
紫外⁃可见吸收光谱测试:在一系列10 mL比色管中加入2.0 mL Tris⁃HCl缓冲溶液(pH=7.4),一定浓度的化合物5l溶液和适量的ct⁃DNA溶液,再用缓冲溶液定容.在室温下放置过夜,在200~800 nm的扫描范围内,以相同浓度的纯ct⁃DNA溶液作为参比溶液,依次测试加入不同体积的DNA溶液后溶液的吸光度的变化,得到化合物与DNA相互作用的紫外吸收光谱图.加入DNA溶液的浓度分别为0,8,16,24,32和40 μmol/L.
荧光光谱测试:用Tris⁃HCl缓冲溶液(pH=7.4)配制浓度为1×10-5mol/L的化合物5l溶液,向此溶液中加入不同体积的ct⁃DNA溶液,使DNA浓度分别为0,8,16,24,32和40 μmol/L,在激发波长为260 nm时,依次测试溶液的荧光发射光谱,得到化合物与DNA相互作用的荧光光谱图.
2 结果与讨论
2.1 化合物的合成
以大黄酸为原料,首先以SOCl2为催化剂,乙醇为溶剂,得到3⁃羧酸乙酯(2);化合物2与不同的卤代烃在NaH催化下发生醚化反应,随后在NaOH水溶液中进行酯水解反应,得到1,8⁃二烷氧基大黄酸(3a~3l);化合物3a~3l在EDCI/DMAP存在下,与缬氨酸酯发生缩合反应得到化合物4a~4l,最后氨基酸酯水解得到目标化合物5a~5l.所有化合物的结构经1H NMR,13C NMR和HRMS确证.
2.2 体外抗肿瘤活性及初步构效关系分析
以顺铂(DDP)和阿霉素(Doxorubicin)作为阳性对照药.为提高目标化合物的水溶性,将其制成钠盐用于实验.实验结果表明,甲氧基、乙氧基和丙氧基位于大黄酸C1,8位点时,所有衍生物均未表现出抗肿瘤活性;而丁氧基位于C1,8位时,所有衍生物的抗肿瘤活性有所提高;苄氧基位于C1,8位时,整体抗肿瘤活性进一步提高,化合物5e对所测试的5个细胞株均表现出显著的抑制活性(IC50<50 μmol/L).在不同取代的苄氧基位于C1,8位的化合物中,吸电子基团取代的苄基衍生物整体上未表现出明显的抗肿瘤活性,其IC50值均大于100 μmol/L,仅化合物5i对所测的5株细胞显示出明显的抗肿瘤活性(IC50值:12.9~38.6 μmol/L),但其活性仍略低于连有供电子基团的化合物5j(IC50值:1.9~37.5 μmol/L).对比苄氧基(5e)、苯乙氧基(5k)和苯丙氧基(5l)取代C1,8位时,奇数亚甲基取代的化合物的体外抗肿瘤活性比其它系列化合物的活性都高,其中化合物5l对所测5株细胞的IC50值在1.6~9.4 μmol/L之间.
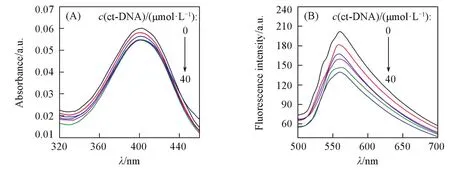
Fig.1 UV⁃Vis spectra(A)and fluorescence spectra(B)for compound 5l with different concentrations of ct⁃DNA
2.3 化合物5l与ct⁃DNA的相互作用
化合物5l与DNA相互作用的紫外⁃可见光谱图如图1(A)所示.当DNA加入化合物5l时,化合物的紫外⁃可见吸收出现减色效应,并随着DNA加入量的增加,减色效应变得更加明显,但红移并不明显.这符合Long等[23]提出的证明小分子与DNA分子发生嵌插作用的依据,由此推测化合物与DNA存在嵌插作用.从化合物5l与DNA相互作用的荧光光谱图[图1(B)]可知,随着DNA浓度的增加,化合物的荧光出现猝灭,表明化合物的蒽醌环部分进入了DNA双螺旋结构的影响区域,与DNA发生结合作用[24].因此,化合物5l具有较强的体外抗肿瘤活性的原因是该化合物能够与ct⁃DNA发生较强的结合作用,其结合方式可能以嵌插为主,多种作用方式并存,从而起到抑制肿瘤细胞的DNA的转录和复制作用.
3 结 论
以大黄酸为原料,设计合成了12个新的大黄酸⁃缬氨酸加合物,通过1H NMR,13C NMR和HRMS确证了目标化合物的结构.初步的构效关系研究表明,在大黄酸的1,8位引入烷基苯,3位引入缬氨酸结构能够有效地增强抑制活性.作用机制研究表明,该类化合物能够与ct⁃DNA较强结合,其结合方式可能以嵌插为主,多种作用方式并存.
[1] Xu X.,Li B.P.,Zhang H.F.,Shanghai J.Tradit.Chin.Med.,2003,37(4),56—59(徐翔,郦柏平,张慧芬.上海中医药杂志,2003,37(4),56—59)
[2] Fu X.S.,Chen F.,Liu X.H.,Xu H.,Zhou Y.Z.,Chin.J.New Drugs,2011,20(16),1534—1538(傅兴圣,陈菲,刘渊红,许虎,周逸芝.中国新药杂志,2011,20(16),1534—1538)
[3] Sheng X.Y.,Wang M.,Lu M.,Xi B.L.,Sheng H.G.,Zang Y.Q.,Am.J.Physiol.Endocrinol.Metab.,2011,300(5),E886—E893
[4] Tang J.C.,Yang H.,Song X.Y.,Song X.H.,Yan S.L.,Shao J.Q.,Zhang T.L.,Zhang J.N.,Phytother.Res.,2009,23(2),159—164
[5] Badria F.A.,Ibrahim A.S.,Drug Discov.Ther.,2013,7(2),84—89
[6] Fernand V.E.,Losso J.N.,Truax R.E.,Villar E.E.,Bwambok D.K.,Fakayode S.O.,Lowry M.,Warner I.M.,Chem.Biol.Inter⁃act.,2011,192(3),220—232
[7] Ip S.W.,Weng Y.S.,Lin S.Y.,Yang M.D.,Tang N.Y.,Su C.C.,Chung J.G.,Anticancer Res.,2007,27(1A),379—389
[8] Wang Q.,Zhang N.N.,Li H.Y.,Jiang M.,Gao J.,Bai G.,Acta Pharm.Sin.,2012,47(12),1618—1622(王倩,张楠楠,李红艳,姜民,高洁,白钢.药学学报,2012,47(12),1618—1622)
[9] Hsia T.C.,Yang J.S.,Chen G.W.,Chiu T.H.,Lu H.F.,Yang M.D.,Yu F.S.,Liu K.C.,Lai K.C.,Lin C.C.,Chung J.G.,Anti⁃cancer Res.,2009,29(1),309—318
[10] Peng L.L.,Yang J.Y.,Ning C.,Zhang J.,Xiao X.C.,He D.,Wang X.Y.,Li Z.P.,Fu S.S.,Ning J.P.,Biol.Pharm.Bull.,2012,35(10),1676—1685
[11] Liu X.,Cheng J.,Zheng X.C.,Chen Y.G.,Wu C.,Li B.,Fu J.F.,Cao H.W.,Lu Y.L.,Li J.,Zheng J.,Zhou H.,Int.Immuno⁃pharmacol.,2009,9(9),1021—1031
[12] Yu L.,Xiang H.,Fan J.W.,Wang D.C.,Yang F.,Guo N.,Jin Q.,Deng X.M.,J.Biotechnol.,2008,135(3),304—308
[13] Chung J.G.,Tsou M.F.,Wang H.H.,Lo H.H.,Hsieh S.E.,Yen Y.S.,Wu L.T.,Chang S.H.,Ho C.C.,Hung C.F.,J.Appl.Toxicol.,1998,18(2),117—123
[14] Hao K.,Qi Q.,Wan P.,Zhang J.W.,Hao H.P.,Liang Y.,Xie L.,Wang G.J.,Sun J.G.,Basic Clin.Pharmacol.Toxicol.,2014,114(2),160—167
[15] Gao Q.,Qin W.S.,Jia Z.H.,Zheng J.M.,Zeng C.H.,Li L.S.,Liu Z.H.,Planta Med.,2010,76(1),27—33
[16] Ye M.Y.,Yao G.Y.,Wei J.C.,Pan Y.M.,Liao Z.X.,Wang H.S.,Int.J.Mol.Sci.,2013,14(5),9424—9439
[17] Liang Y.K.,Yue Z.Z.,Li J.X.,Tan C.,Miao Z.H.,Tan W.F.,Yang C.H.,Eur.J.Med.Chem.,2014,84,505—515
[18] Ji C.M.,Zhen Y.Z.,Fan X.Y.,Wang Z.J.,Jiang S.F.,Zhu L.H.,Zhang G.L.,Basic Clin.Med.,2014,34(2),155—159(纪春梅,甄永占,范晓禹,王志军,蒋守芳,朱丽华,章广玲.基础医学与临床,2014,34(2),155—159)
[19] Guo L.,Cao R.H.,Fan W.X.,Ma Q.,Chem.J.Chinese Universities,2014,35(3),518—523(郭亮,曹日晖,范文玺,马芹.高等学校化学学报,2014,35(3),518—523)
[20] Guo L.,Cao R.H.,Fan W.X.,Gan Z.Y.,Ma Q.,Chem.J.Chinese Universities,2016,37(6),1093—1099(郭亮,曹日晖,范文玺,甘紫云,马芹.高等学校化学学报,2016,37(6),1093—1099)
[21] Zhang S.B.,Qian X.,Zhang D.H.,Zhu J.M.,Wu Y.,Guo Y.,Xu L.,Chem.Res.Chinese Universities,2016,32(1),149—154
[22] Ma J.J.,Hu G.,Xie L.J.,Chen L.,Xu B.X.,Gong P.,Chem.Res.Chinese Universities,2015,31(6),958—963
[23] Long E.C.,Barton J.K.,Acc.Chem.Res.,1990,23(9),271—273
[24] Sirajuddin M.,Ali S.,Badshah A.,J.Photochem.Photobiol.,B:Biol.,2013,124,1—19
(Ed.:P,H,Y,K)
†Supported by the National Natural Science Foundation of China(No.21606153)and the Outstanding Youth Project of Shihezi University,China(No.2013ZRKXYQ⁃YD01).
Synthesis and Antitumor Activities of Rhein⁃Valine Adducts†
ZHANG Jie,ZHOU Changjian,XIE Jianwei∗,DAI Bin
(School of Chemistry and Chemical Engineering,Key Laboratory for Green Processing of Chemical Engineering of Xinjiang Bingtuan,Shihezi University,Shihezi 832003,China)
In order to search for novel leading compounds endowed with better antitumor activities,twelve novel rhein⁃valine derivatives were designed and synthesized by modification of position⁃1,3 and 8 of rhein nucleus,and their structures were confirmed by1H NMR,13C NMR and HRMS.All the target compounds were tested for cytotoxic activity against five cancer cell lines including Hela,MCF⁃7,HepG2,KB and HEK293T by methyl thiazolyl tetrazolium(MTT)method in vitro.The results demonstrate that compound 5l displayed a broad spectrum of cytotoxic activities with IC50value of lower than 10 μmol/L against all tumor cell lines,compounds 5e,5i and 5j only demonstrated moderate cytotoxic activities(IC50<50 μmol/L).Primary structure⁃activity relationships(SARs)analysis indicated that the 3⁃phenylpropoxyl substituents in position⁃1,8 of rhein nucleus were the suitable pharmacophoric group giving rise to significant antitumor agents.In addi⁃tion,compound 5l was found to exhibit remarkable DNA intercalating effects.
Rhein;Valine;Adduct;Antitumor activity;Structure⁃activity relationship
O626
A
10.7503/cjcu20160568
2016⁃08⁃11.网络出版日期:2016⁃11⁃15.
国家自然科学基金(批准号:21606153)和石河子大学优秀青年科技人才培育计划(批准号:2013ZRKXYQ⁃YD01)资助.
联系人简介:谢建伟,男,博士,副教授,主要从事药物化学研究.E⁃mail:cesxjw@foxmail.com
