环丁砜对乙醇胺溶液吸收和解吸CO2的影响
2016-12-14郭东方郜时旺罗伟亮陈健
郭东方,郜时旺,罗伟亮,陈健
环丁砜对乙醇胺溶液吸收和解吸CO2的影响
郭东方1,郜时旺1,罗伟亮2,陈健2
(1中国华能集团清洁能源技术研究院有限公司,北京 102209;2化学工程联合国家重点实验室,清华大学化学工程系,北京 100084)
利用物理溶剂环丁砜替代部分水,采用气液搅拌实验装置和真实热流量热法测定了环丁砜对乙醇胺(MEA)溶液吸收和解吸二氧化碳(CO2)过程的影响,考察了CO2循环负载、吸收速率、吸收热和解吸热等性质变化。研究表明:环丁砜对MEA溶液负载CO2的吸收热影响较小,但对吸收速率、循环吸收容量和解吸过程影响较大。环丁砜可降低MEA溶液对CO2的表观吸收速率,且随CO2负载量的增大,降幅也逐渐变大。环丁砜有利于富液解吸过程,加快解吸速率,增大CO2解吸程度,同时单位热流负荷、单位冷流负荷和单位能耗均有不同程度的降低。在燃煤电厂烟气条件下,20%MEA+20% sulfolane体系相对20%MEA体系,其表观吸收速率平均降低约10%,CO2循环吸收容量增加24%,单位CO2解吸能耗降低18%。
环丁砜;乙醇胺;CO2;吸收;解吸
引 言
伴随化石燃料的使用,全球CO2浓度不断升高,由此而产生的温室效应和气候变化已成为人类必须面对的严峻课题[1-2]。燃煤电厂是CO2长期稳定集中的排放源,从电厂烟道气中捕集CO2将成为减缓温室效应的最直接有效的手段之一[3-4]。化学吸收法是目前最为成熟和有望实现大规模商业化推广应用的CO2排放控制技术,其基本原理是气液吸收过程,CO2低温吸收、高温解吸[4-5]。
然而,燃煤电厂烟道气流量极大、CO2浓度很低、体系组分较为复杂,常规有机醇胺类化学吸收法用于电厂大规模CO2捕集将会消耗大量低品位蒸汽用于吸收剂再生,从而导致汽轮机出力降低,给电厂的蒸汽循环系统带来巨大的负担,使得电厂发电效率下降10%甚至更多[6-7]。如果采用MEA溶液法分离CO2,供电成本将比常规机组增加0.212元/千瓦时,增加73%[8]。
工业上常用的醇胺类化学吸收剂包括一乙醇胺(MEA)、二乙醇胺(DEA)、-甲基二乙醇胺(MDEA)等,其在应用过程中的再生能耗较高,主要原因之一是吸收剂中水的含量较高,富液解吸过程中水的升温与挥发将消耗大量的能量,占再生热耗的一半以上[9-11]。因此,改变再生过程的水环境、减少再生时水的参与度将是降低CO2捕集能耗的有效途径之一。通过添加一些低热容、高沸点有机溶剂替代部分水,有望减少再生过程中水的参与,降低溶液的显热和潜热,从而最大程度上利用蒸汽热量,实现捕集能耗的下降。
环丁砜是一种物理吸收溶剂,具有沸点高、无腐蚀性、热稳定性等特点,常用于天然气、炼厂气、合成氨等行业中脱除原料气中CO2、硫化氢和有机硫等杂质气体,适合在较高的酸气分压下使用,在低分压条件下其负载能力比化学溶剂弱[12-14]。根据质子酸碱理论,水和环丁砜均属于中性溶剂,既能作为酸也能作为碱。但环丁砜的质子自递常数很小,作为溶剂其酸性和碱性都比水弱,介电常数比水小,使得酸和碱在环丁砜中的解离要比在水中困难。在CO2分离工业中,可将环丁砜替代部分水,与化学溶剂混配,使吸收溶液兼具物理吸收和化学吸收的特性,以减少再生能耗[14-15]。
目前对环丁砜与醇胺混配体系的研究主要集中在CO2吸收的气液平衡溶解度和反应动力学数据[16-18],而对吸收和解吸过程的热效应探讨很少。MEA具有较小的分子量,是典型的商业化脱碳吸收剂。本文以MEA与环丁砜为研究对象,采用气液搅拌实验装置和真实热流量热法[19-20]探讨物理溶剂对化学吸收剂吸收和解吸CO2的影响,包括吸收速率、解吸程度、热效应等。
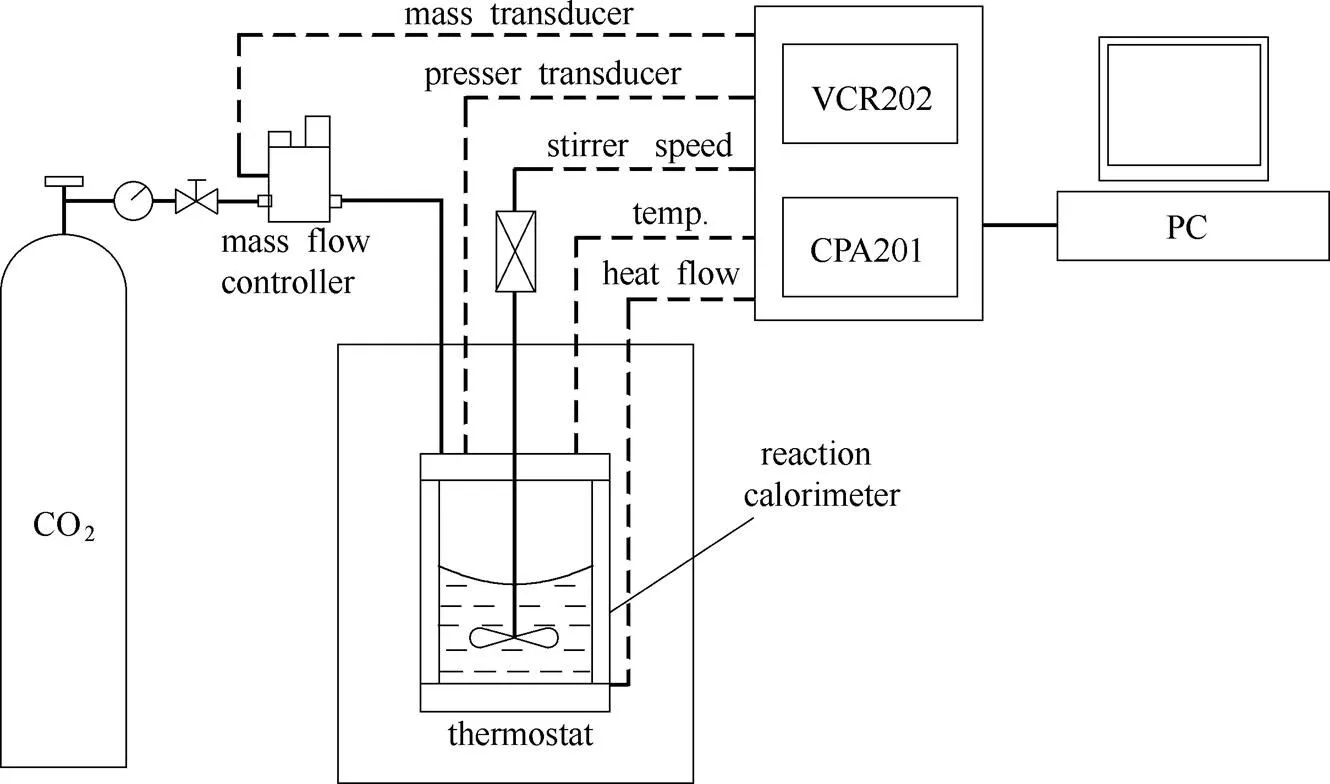
图1 反应量热仪装置示意图
1 实验部分
实验仪器为真实热流量热仪CPA201和总有机碳分析仪TOC。量热仪用于表征CO2与吸收剂相互作用过程的吸收速率、吸收热和解吸热效应;TOC用于测量吸收解吸过程中的溶液中的总有机碳和无机碳的含量,进而可以推算解吸量和解吸程度。
1.1 真实热流反应量热仪
本文所采用的真实热流反应器为ChemiSens公司生产的CPA201型号量热仪,如图1所示,可以用于精确测量反应系统内热量变化情况。该装置包括反应量热仪CPA201、加药剂量控制器VCR202、气体质量流量控制器、过程自动控制软件等部分。反应器有效容积为250 ml,内置叶片搅拌桨,底座和封盖采用316 L不锈钢制成,器壁采用双层玻璃形成中间真空层。实验时反应器置于恒温液体中,热量只能通过反应器底部向下传导,温度传感器控制珀尔贴元件为热流产生必要的温度梯度。
1.2 实验试剂与仪器操作
环丁砜、一乙醇胺由国药集团化学试剂北京有限公司提供,均为分析纯级。CO2气体由液化空气(天津)有限公司提供,纯度99.99%。
本文以MEA溶液为研究对象,通过加入不同比例的物理溶剂环丁砜,来考察MEA吸收体系的热力学和动力学性能变化,吸收温度为40℃,解吸温度为102℃,CO2注入总量设定为6 g,脉冲次数均为6次。
吸收实验时,通过加药剂量控制器VCR202控制单次CO2注入量和脉冲次数,向量热反应釜内注入预定质量的CO2气体,全程跟踪并记录反应釜内的压力、温度、热流、CO2质量流率等数据,如图2所示(此处显示3个脉冲周期)。CO2脉冲注入时刻通过ProFind编程自动控制,每次CO2脉冲后反应釜内热流变化满足预设条件时(200 s内热流变化小于0.05 W),视为反应结束,进行下次CO2脉冲注入。
解吸实验时,需在反应釜上端出口处配置冷凝附件对解吸出的气体进行冷却,模拟实际工艺中的再生气冷却器,冷凝回收随CO2释放所蒸发的水汽。将吸收富液置于反应釜内,通过ProFind编程控制升温时刻、升温速率以及解吸温度。操作时设定温升速率为1 K·min-1,升温至解吸温度时,停止升温并维持解吸温度恒定,随着解吸的进行,当反应釜内热流变化满足200 s内小于0.05 W时,视为解吸过程结束。
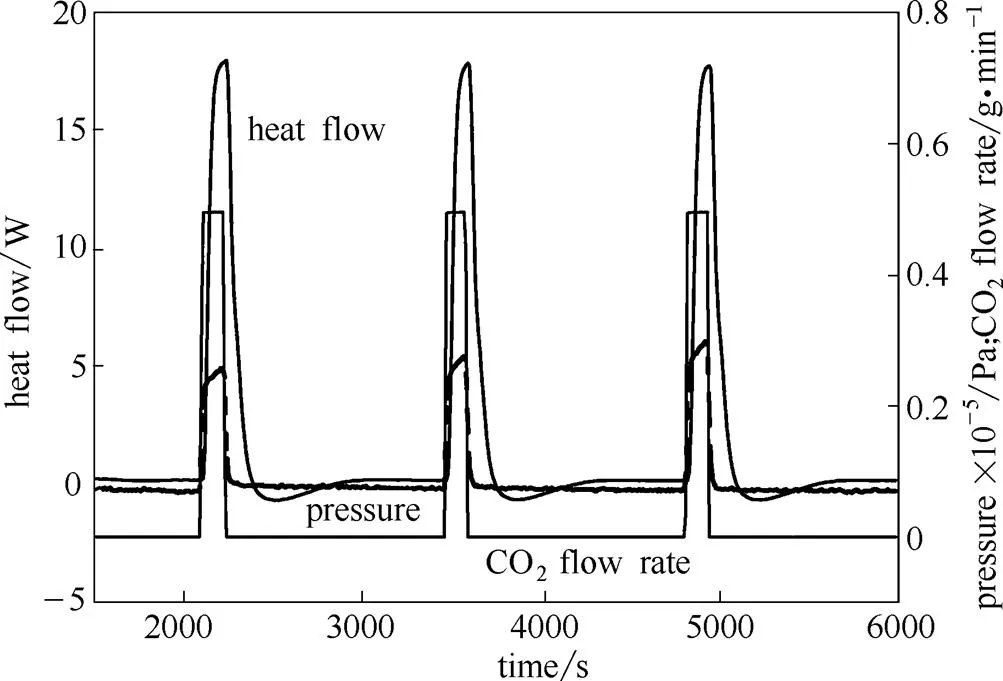
图2 40℃下CO2注入20%MEA体系的实验数据记录
1.3 理论计算与数据处理
1.3.1 吸收热计算 CO2在MEA-环丁砜吸收溶液中的负载可以表示为

CO2与吸收剂反应的过程中,量热仪记录的热量0[由热流曲线(图2)对时间积分求得,积分过程可由量热仪配套数据分析处理软件CCReport完成]包含以下部分。
①CO2由室温升至反应温度所吸收的热量1

其中为CO2的比定容热容,J·g-1·K-1;为注入的CO2质量,g;2为反应温度,K;1为室温, K。
②绝热压缩所产生的热量2

其中Δ为反应釜内压力变化量,Pa;为反应釜内气相体积,m3。
③溶液物理溶解CO2所产生的热量。
④CO2与吸收剂反应所产生的热量。
其中,因③、④产生的热量较难区分开,固通常合为一起计为吸收反应的吸收热。

其中为反应釜内因吸收反应而释放的热量,kJ;(CO2)abs为CO2的吸收量,mol。
一个加药周期内吸收CO2的量可由单次加药量(由质量流率曲线对时间积分求得)扣除反应平衡时反应釜上部空间未吸收的CO2量来求得,反应达平衡时体系残余CO2量可由气体状态方程得到。
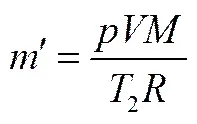
其中,′为达平衡时未反应的CO2质量,g;为反应达平衡时体系内CO2压力,Pa;为反应釜内气相体积,m3;为CO2摩尔质量;为气体常数,J·K-1·mol-1。
1.3.2 表观吸收速率 CO2表观吸收速率通过溶液中CO2负载量的变化来表征。在脉冲周期内,CO2以固定的质量流量注入反应釜中(图2),而反应釜内未吸收的CO2量可由气体状态方程计算。某时刻,CO2注入量与剩余量之差即为该时刻溶液中的CO2吸收量。
1.3.3 循环吸收容量 CO2循环吸收容量定义为富液与贫液的CO2负载量之差。通过TOC分析仪测定富液解吸前后的含碳量,进而推算溶液中CO2含量的变化。
1.3.4 解吸热计算 解吸反应过程中,实验记录的热量曲线包括给热热流曲线和冷凝热流曲线。给热量in和冷凝量c分别定义为给热热流曲线和冷凝热流曲线对时间的积分(in为负值,表示热量输入,c为正值,表示冷凝放热)。CO2解吸热耗为两者的加和,即netinc。
2 实验结果与讨论
2.1 环丁砜对CO2吸收速率的影响
以20%MEA溶液第一次注入CO2脉冲为例(图2),釜内MEA溶液体积111 ml,第一次脉冲起止时刻为2080~2220 s,吸收过程中溶液CO2浓度的变化见图3。
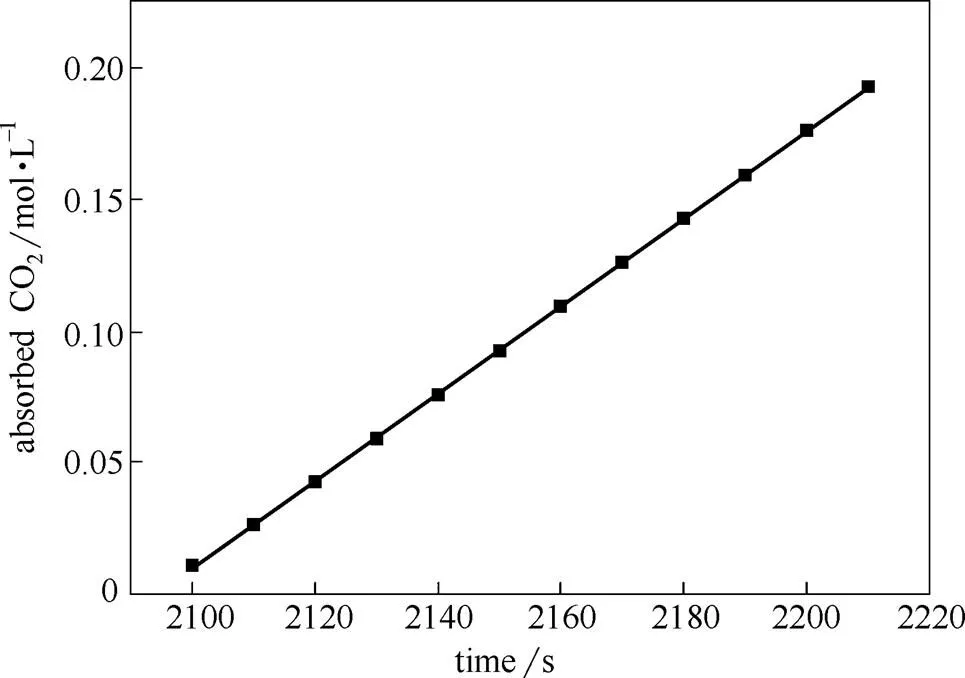
图3 吸收过程中溶液CO2浓度的变化
对图3中的数据进行线性拟合,线性相关度2为0.9999。拟合斜率为1.657×10-3mol·L-1·s-1,即为CO2表观吸收速率。
图4给出了20%MEA和20%MEA+20% sulfolane两种体系下,每次脉冲周期的CO2表观吸收速率。可以看出,添加环丁砜,导致MEA溶液吸收CO2的速率降低,且随着CO2负载量的增大,表观吸收速率的降幅也逐渐变大。20%MEA+20%sulfolane体系相对20%MEA体系,表观吸收速率平均降低约10%。

图4 40℃下CO2表观吸收速率
分析MEA体系的表观吸收速率在加入环丁砜后降低的原因,根据气液传质理论,CO2与MEA的反应过程中实质上包含了CO2从气相溶解进入液相的气-液传质过程、在液体表面(即液膜处)CO2与MEA进行反应过程、未反应的MEA与已反应的产物在液相中进行液-液传质过程等多个过程。环丁砜的加入使得溶液的黏度增大,在不影响CO2与MEA的反应速率的前提下,导致多个气-液、液-液传质过程的速率降低,从而表现为表观吸收速率的降低。随着溶液中CO2负载量的增大,溶液中未反应的MEA浓度降低,此时液-液传质速率降低更为明显,说明CO2与MEA的反应过程主要是受液-液传质速率控制的,而溶液黏度是决定液-液传质速率的主要影响因素之一,因而此时表观吸收速率降低更为明显。
2.2 环丁砜对CO2吸收热的影响
根据上文吸收热的计算方法,测定40℃下不同体系的CO2吸收热数据见图5,该吸收热包含CO2溶解热和反应热。可以看出,随着CO2负载的增加,MEA溶液的CO2吸收热下降趋势明显;但加入环丁砜后,吸收热的变化趋势较为平缓。在实验操作条件下,低CO2负载范围内环丁砜对CO2吸收热的影响强度大于高CO2负载下的影响强度。整体来说,环丁砜的加入对CO2吸收热的影响程度不大,这与2.3节中提到的40℃下体系的CO2平衡溶解度变化不大的热力学结果是一致的。
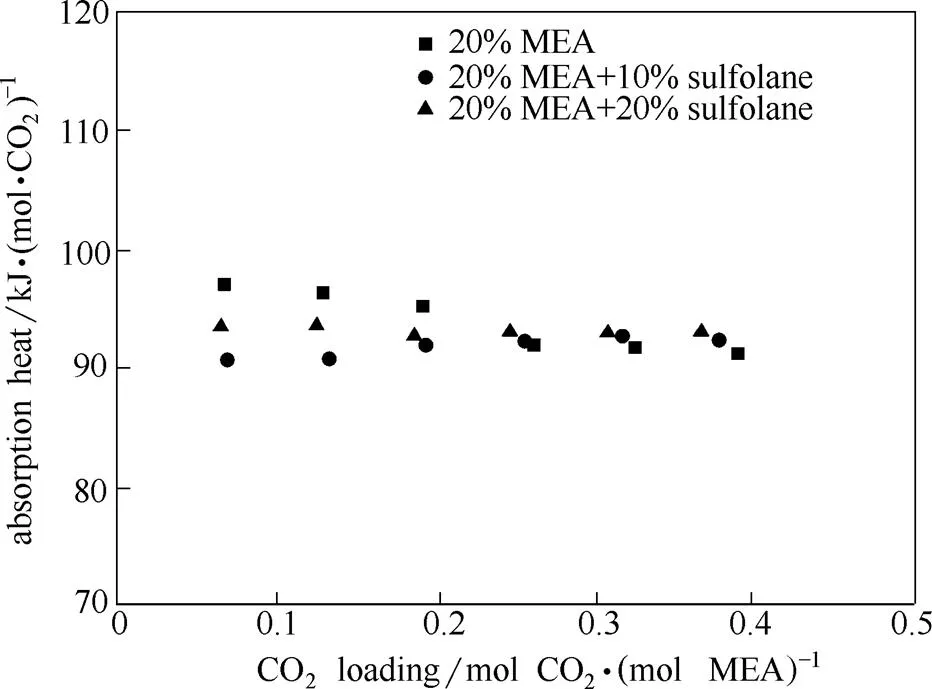
图5 40℃不同吸收溶液体系下CO2的吸收热
2.3 环丁砜对CO2循环吸收容量的影响
解吸实验所用的CO2富液是吸收溶液在40℃下注入固定质量的CO2条件下形成的,以保证富液中的CO2负载量基本相同,CO2注入量根据燃煤电厂烟气CO2分压下的负载量确定。解吸压力为105Pa,温度为102℃,每个体系的解吸均进行两次,即富液在102℃解吸后,待冷却后再次在同样的升温程序下进行第二次解吸。
为考察环丁砜对CO2循环吸收容量(即解吸量)的影响,采用TOC分析仪对每种溶液体系解吸前后的碳含量进行测量分析,结果见表1。可以看出,添加环丁砜,有利于解吸过程,可有效提升CO2循环吸收容量。在相同的CO2吸收负载量情况下,在20%MEA溶液中添加10%和20%的环丁砜后,其CO2解吸量分别增加15%和24%。
已有文献报道了环丁砜与不同醇胺溶液混配后的CO2平衡负载数据,添加环丁砜对醇胺溶液的CO2溶解度平衡均有明显影响[12-18]。环丁砜会分别增大和降低EAE、DEEA体系的CO2循环吸收量。此外,本文根据文献中的CO2溶解度数据,分析了环丁砜对AMP、DIPA、MDEA 3种溶剂的CO2循环吸收量的影响。选取吸收温度40℃,CO2分压为15 kPa时的平衡点作为吸收点,解吸温度为100℃,CO2分压为35kPa时的平衡点为解吸点,计算结果见表2。

表1 富液解吸前后溶液中的含碳量分析

表2 环丁砜对CO2循环吸收容量的影响
结合表1和表2可知:在不同种类的醇胺溶液中添加环丁砜,均会降低溶液的CO2溶解度,降低的程度取决于醇胺种类,而吸收-解吸循环吸收量的变化情况也不同。对伯胺、仲胺水溶液而言,如MEA、AMP、EAE、DIPA等,添加环丁砜将使得体系CO2循环吸收量增大。根据本课题组之前的研究,对于同一种伯胺(或仲胺)溶液,在相同的温度条件下,高浓度体系比低浓度体系拥有更高的CO2平衡负载。而本实验中,在120℃的解吸温度下,加入环丁砜将对伯胺(仲胺)体系的CO2平衡负载产生较大程度的影响(降低50%~70%),这是由于环丁砜的加入使得高温下体系溶剂挥发减少,与添加环丁砜前体系溶剂大量挥发的情况相比,醇胺的实际浓度较小,因而CO2平衡负载较低。而在40℃吸收温度下,加入环丁砜对体系的CO2平衡负载变化并不明显(只降低约10%),这是因为低温下溶剂挥发本身并不明显,因此加入环丁砜与否,对体系的实际浓度影响不大。因此,在伯胺(仲胺)体系中添加环丁砜所造成的循环吸收容量的增大,主要来源于解吸温度下体系的负载降低。而对叔胺水溶液而言,如MDEA、DEEA等,由于叔胺水溶液与CO2的反应机理与伯胺(仲胺)水溶液不同,叔胺的作用主要是给质子提供载体,促进CO2的水合作用,因此,在溶液中加入环丁砜,将会降低作为反应物的水的实际浓度,因而降低CO2的平衡负载。从MDEA体系的例子可以看到,吸收温度下CO2平衡负载的降低比解吸温度下的降低更为显著,因此体系的CO2循环吸收量将会减小。
2.4 环丁砜对CO2解吸热的影响
每个样品的富液解吸均进行两次,即富液102℃下解吸后,冷却至40℃,之后在同样的升温程序下进行第二次解吸,第二次解吸可视为第一次解吸的延续。由于第一次解吸后釜内的CO2并未完全排出,冷却过程中釜内残存的CO2被溶液重新吸收,因此第二次解吸的热流数据并不能严格作为解吸的基准曲线,但能够为判断CO2解吸速率和解吸程度提供有价值的参考。
图6给出了102℃下3种富液体系的第一次解吸的升温曲线、热流曲线和冷流曲线。由图6可知,加入环丁砜后,整个解吸过程所需加热量和冷凝量均大幅下降,同时完成解吸所需时间也变短;而且随着溶液中环丁砜含量的增加,解吸时间、冷却负荷和给热量均呈现逐渐减小的趋势。

图6 富液解吸过程的温度、热流和冷流曲线
分析溶液解吸所需的热流量与冷流量降低的原因,在于MEA体系中加入环丁砜后,部分溶剂水被替代,由环丁砜本身的物理性质使得溶液的热容减小,同时溶液的沸点升高。在原CO2解吸温度(即102℃)下,MEA水溶液由于接近沸点温度,造成大量的溶剂挥发,造成大量额外的热流量用于挥发潜热上,而用于冷凝溶剂的冷流量也相应增大;加入环丁砜后,在该解吸温度下,CO2仍可以顺利解吸脱除,但溶液由于沸点升高,因而挥发较加入环丁砜前大幅降低,所需热流量较小,冷凝溶剂所需的冷流量也对应较小。随着环丁砜含量增大,在高温解吸状态下的溶剂挥发量持续减小,解吸所消耗的热量也相应减小。
表3给出了3种CO2富液两次解吸过程中的热量数据。由表3可以看出,随着环丁砜的添加,两次解吸循环中的给热量in、冷凝量c和净焓变net整体呈下降趋势,而净焓变差值Δnet逐渐增大,这说明环丁砜的添加导致富液更易解吸,且解吸程度增大。

表3 富液解吸过程中的热量分析
Note:Ⅰ means the first desorption process; Ⅱ means the second desorption process.
化学吸收法中衡量溶液解吸能耗的重要指标是单位CO2产量的能量消耗。图7是富液解吸过程的单位CO2产量的能耗对比。添加环丁砜,使得富液解吸的单位热流负荷、单位冷流负荷和单位能耗均有不同程度的降低。在20%MEA溶液中加入10%和20% sulfolane,将使单位CO2能耗分别降低11%和18%。

图7 富液解吸过程的单位能耗
3 结 论
为降低富液再生过程中水的参与度,可通过向醇胺类化学吸收剂中添加低热容、高沸点有机物理溶剂替代部分水,从而降低溶液的显热和潜热,实现捕集能耗的降低。本文以MEA为研究对象,探讨物理吸收溶剂环丁砜对MEA吸收CO2的吸收速率、循环吸收容量、吸收热和解吸热等性能影响。主要结论如下。
(1)环丁砜的添加,导致MEA溶液吸收CO2的速率降低,且随着CO2负载量的增大,表观吸收速率的降幅也逐渐变大。在0.4 mol·mol-1的情况下,20%MEA+20% sulfolane体系相对20%MEA体系,其CO2表观吸收速率平均降低约10%。
(2)环丁砜会减缓吸收热随CO2负载的下降趋势;低CO2负载范围内,环丁砜对CO2吸收热的影响强度大于高CO2负载下的影响强度。但整体来说,环丁砜对MEA溶液的CO2吸收热的影响程度有限。
(3)环丁砜有利于MEA富液解吸过程,可有效提升CO2循环吸收容量。在相同的CO2吸收负载量情况下,在20%MEA溶液中添加10%和20%的环丁砜后,其CO2解吸量分别增加15%和24%。
(4)对伯胺、仲胺水溶液而言,环丁砜会导致CO2循环吸收量增大,如MEA、AMP、EAE、DIPA等;对叔胺水溶液而言,CO2循环吸收量将会减小,如MDEA、DEEA等。
(5)环丁砜的添加,强化了MEA富液再生性能,使得富液解吸时间变短,解吸度增大,同时单位热流负荷、单位冷流负荷和单位能耗均有不同程度的降低。在20%MEA溶液中加入10%和20% sulfolane,将使单位CO2能耗分别降低11%和18%。
符 号 说 明

(CO2)abs——CO2的吸收量,mol c——CO2的比定容热容,J·g-1·K-1 -∆Habs——CO2吸收热,kJ·(mol CO2)-1 M——CO2摩尔质量 m,m′——分别为向反应釜内注入的、达到平衡时未反应的CO2质量,g Δp,p——分别为反应釜内压力变化量、反应达平衡时釜内的CO2分压,Pa Q,Q0,Q1,Q2——分别为反应釜内因吸收反应而释放的热量、量热仪记录的热量、CO2由室温升至反应温度所吸收的热量、绝热压缩所产生的热量,kJ Qin,Qc——分别为给热量、冷凝量,J Qnet,ΔQnet——分别为净焓变、净焓变差值,J R——气体常数,J·K-1·mol-1 T1,T2——分别为室温、反应温度,K V——反应釜内气相体积,m3 α——CO2在溶液中的吸收负载,mol·mol-1
[1] KEITH D W. Why capture CO2from the atmosphere? [J]. Science, 2009, 325 (5948): 1654-1655.
[2] Intergovernment Panel on Climate Change. IPCC Fourth Assessment Report [M]. Cambridge: Cambridge University Press, 2007.
[3] 徐钢, 田龙虎, 刘彤, 等. 中国电力工业CO2减排战略分析 [J]. 中国电机工程学报, 2011, 31 (17): 1-8. XU G, TIAN L H, LIU T,. Strategic analysis of CO2mitigation in Chinese power industry [J]. Proceedings of the CSEE, 2009, 31 (17): 1-8.
[4] 费维扬, 艾宁, 陈健. 温室气体CO2的捕集和分离——分离技术面临的挑战与机遇 [J]. 化工进展, 2005, 24 (1): 1-4. FEI W Y, AI N, CHEN J. Capture and separation of greenhouse gases CO2—the challenge and opportunity for separation technology [J]. Chemical Industry and Engineering Progress, 2005, 24 (1): 1-4.
[5] FIGUEROA J D, FOUT T, PLASYNSKI S,. Advances in CO2capture technology—the U.S. Department of Energy’s carbon sequestration program [J]. International Journal of Greenhouse Gas Control, 2008, 2 (1): 9-20.
[6] 秦锋, 王淑娟, 陈昌和, 等. 氨法脱碳系统再生能耗的研究 [J]. 化工学报, 2010, 61 (5): 1233-1240. QIN F, WANG S J, CHEN C H,. Research on heat requirement of aqua ammonia regeneration for CO2capture [J]. CIESC Journal , 2010, 61 (5): 1233-1240.
[7] DAMEN K, TROOST M, FAAIJ A. A comparison of electricity and hydrogen production systems with CO2capture and storage (A): review and selection of promising conversion and capture technologies [J]. Progress in Energy and Combustion Science, 2006, 32: 215-246.
[8] 刘彦丰, 朱路平, 阎维平. CO2捕集技术在燃煤电厂中应用的经济性评估 [J]. 中国电机工程学报, 2010, 30 (S1): 59-64. LIU Y F, ZHU L P, YAN W P. Economic assessment for the CO2capture technologies applied in the coal-firing power plant [J]. Proceedings of the CSEE, 2010, 30 (S1): 59-64.
[9] 陈健, 罗伟亮, 李晗. 有机胺吸收二氧化碳的热力学和动力学研究进展 [J]. 化工学报, 2014, 65 (1): 12-21. CHEN J, LUO W L, LI H. A review for research on thermodynamics and kinetics of carbon dioxide absorption with organic amines [J]. CIESC Journal, 2014, 65 (1): 12-21.
[10] 张国辉, 王晓光, CONWAY W, 等. 二氧化碳、碳酸氢盐与有机伯胺和仲胺反应机理 [J]. 化工学报, 2013, 64 (8): 2883-2890. ZHANG G H, WANG X G, CONWAY W,. Kinetics of CO2(aq),with primary and secondary amines in aqueous solution [J]. CIESC Journal, 2013, 64 (8): 2883-2890.
[11] 李小飞, 王淑娟, 陈昌和. 胺法脱碳系统再生能耗 [J]. 化工学报, 2013, 64 (9): 3348-3355. LI X F, WANG S J, CHEN C H. Heat requirement for regeneration of a CO2capture system using amine solutions [J]. CIESC Journal, 2013, 64 (9): 3348-3355.
[12] MACGREGOR R J, MATHER A E. Equilibrium solubility of H2S and CO2and their mixtures in a mixed solvent [J]. Can. J. Chem. Eng., 1991, 69: 1357-1366.
[13] ISAACS E E, OTTO F D, MATHER A E. Solubility of H2S and CO2in a sulfinol solution [J]. J. Chem. Eng. Data, 1977, 22: 317-319.
[14] ROBERTS B E, MATHER A E. Solubility of CO2and H2S in a mixed solvent [J]. Chem. Eng. Commun., 1988, 72: 201-211.
[15] JOU F Y, OTTO F D, MATHER A E. Solubility of H2S, CO2and their mixtures in an aqueous solution of 2-piperidineethanol and sulfolane [J]. J. Chem. Eng. Data, 1998, 43: 409-412.
[16] LI Y G, MATHER A E. Correlation and prediction of the solubility of CO2and H2S in an aqueous solution of 2-piperidineethanol and sulfolane [J].Ind. Eng. Chem. Res., 1998, 37: 3098-3104.
[17] MUEEIETA-GUEVARA F, REBOLLEDO-LIBEREOS E, TREJO A. Gas solubility of hydrogen sulfide and carbon dioxide in mixtures of sulfolane with diethanolamine at different temperatures [J]. Fluid Phase Equilibria, 1994, 95: 163-174.
[18] MUEEIETA-GUEVARA F, REBOLLEDO-LIBEREOS E, TREJO A. Gas solubility of CO2and H2S in mixtures of sulfolane with monoethanolamine [J]. Fluid Phase Equilibria, 1993, 86: 225-231.
[19] SVENSSON H, HULTEBERG C, KARLSSON H. Heat of absorption of CO2in aqueous solutions of-methyldiethanolamine and piperazine [J]. International Journal of Greenhouse Gas Control, 2013, 17: 89-98.
[20] NILSSON H. CO2absorption in 30% aqueous methyldiethanolamine: report from reaction calorimetry experiments [R]. Sweden, CPA User, ChemiSens AB, 2011.
Effect of sulfolane on CO2 absorption and desorption by monoethanolamine aqueous solution
GUO Dongfang1, GAO Shiwang1, LUO Weiliang2, CHEN Jian2
(1Huaneng Clean Energy Research Institute, Beijing 102209, China; 2State Key Laboratory of Chemical Engineering,Department of Chemical Engineering, Tsinghua University, Beijing 100084, China)
The effect of sulfolane on carbon dioxide (CO2) absorption and desorption by monoethanolamine (MEA) aqueous solution was measured by gas-liquid stirring rig and true heat flow calorimeter, including CO2cyclic loading, absorption rate, heat of absorption and desorption. The experimental results show that sulfolane effect is significant for absorption rate, CO2cyclic loading and CO2desorption. In the condition of sulfolane addition, CO2absorption rate into MEA solutions decreases and the decreasing amplitude increases with CO2loading increase. Sulfolane can also accelerate desorption process and improve desorption level. Meanwhile, the heat duty, condensation duty and energy consumption are to some extent decreased. Under the condition of flue gas of coal-based power station and 20% sulfolane addition, the apparent CO2absorption rate averagely decreases 10%, CO2cyclic loading increases 24% and unit energy consumption for CO2desorption decreases 18% in comparison with 20% MEA solution.
sulfolane; monoethanolamine; carbon dioxide; absorption; desorption
date: 2016-07-14.
GUO Dongfang, guodf03@163.com
10.11949/j.issn.0438-1157.20160999
TQ 028.2
A
0438—1157(2016)12—5244—08
华能集团清洁能源技术研究院研究与开发基金项目(TY-15-CERI04)。
supported by Huaneng Clean Energy Research Institute Project (TY-15-CERI04).
2016-07-14收到初稿,2016-08-25收到修改稿。
联系人及第一作者:郭东方(1985—),男,博士,高级工程师。
