应用PCR-DGGE方法研究甜酒曲中真菌多样性
2016-12-14姚淑敏陈璐闫华文
姚淑敏,陈璐,闫华文
(曲阜师范大学生命科学学院,山东曲阜273165)
应用PCR-DGGE方法研究甜酒曲中真菌多样性
姚淑敏,陈璐,闫华文
(曲阜师范大学生命科学学院,山东曲阜273165)
提取6种甜酒酒曲的总DNA,利用真菌18S rRNA基因片段的通用引物NS1、Fung-GC,采用变性梯度凝胶电泳(PCR-DGGE)方法,进行不同甜酒酒曲中真菌多样性的分析。结果表明,6种甜酒酒曲中共分离出3属真菌和不可培养真菌,湖南韶山的甜酒曲中主要是扣囊复膜酵母属和根霉属的菌株;湖南湘潭甜酒曲中的真菌为酿酒酵母属、扣囊复膜酵母属和根霉属;湖南祁东、福建福州和浙江丽水甜酒曲中的真菌均为酿酒酵母属、扣囊复膜酵母属、根霉属和不可培养真菌;浙江兰溪甜酒曲中的真菌为根霉属和不可培养真菌。在传统的酒曲中的真菌主要是酿酒酵母属和扣囊复膜酵母属,此外不可培养真菌在甜酒酒曲中也起到非常重要的作用。
变性梯度凝胶电泳;甜酒曲;真菌多样性
甜酒曲(甜酒药)是发酵甜酒酿的发酵剂。大量研究表明,酒曲中主要有三大类微生物,即酵母菌、霉菌和细菌[1-4]。霉菌主要产生淀粉酶和蛋白酶,用于糖化作用;酵母菌主要是利用糖进行酒精发酵,种类主要有扣囊复膜酵母(Saccharomycopsia fibuligera)、毕赤酵母(Pichia pastoris)、异常汉逊酵母(Hansenulaanomala)以及其他的产酯酵母[5-6];细菌主要是乳酸菌,此外还有一些不可培养的细菌,这些细菌在酒曲中起着极其重要的作用。细菌发酵产酸在赋予甜酒酿酸甜口感的同时,还可以与酵母菌产生的乙醇作用生成酯类物质,赋予甜酒酿独有的香气,使其口味独特,香气浓郁。此外,有研究表明,乳酸菌可以产生乳酸菌素,具有抑制细菌的作用,在米酒发酵过程中可以抑制杂菌的生长[4]。
对甜酒曲中微生物多样性的研究由来已久。蔡俊泽等[7]从云南和黑龙江地区的传统米酒中分离得到41株乳酸菌,并从中筛选出产酸能力较强以及产乙醛和双乙酰能力较强的菌株各一株。蔡丽等[8]从孝感地区的甜酒曲中分离得到13株根霉菌,其中6株为米根霉(Rhizopus oryzae),7株为华根霉(Rhizopus chinesis)。信阳民间传统米酒中的优势菌为酿酒酵母(Saccharomyces cerevisiae)和少根根霉(Rhizopus arrhizus),同时还分离得到少量细菌,通过血球计数法测得发酵成熟的米酒中酵母菌数量(约3.0×107个/mL米酒)最多,其次为霉菌(2~3×103个/mL米酒),细菌数量(0~102个/mL米酒)最少且差异最大[9-10]。此外,LV X C等[11]对红曲中的微生物多样性进行了研究,发现在这些传统的酒曲中微生物种子资源极其丰富。
国外学者JEYARM K等[12]研究学者从当地不同村庄共收集54种酒曲,从中分离得到163株酵母菌菌株,最终鉴定得到9株酵母菌,其中酿酒酵母(Saccharomycescerevisiae),异常汉逊酵母(Hansenula anomala)和丝孢酵母(Trichosporon pullulans)为其中的优势菌。DUNG N T P等[13]从米酒中分离鉴定出5株酵母菌和鲁氏毛霉(Amylomycesrouxii)、少孢根霉(Rhizopus oligosporus)、米根霉(Rhizopus oryzae)等霉菌,这些根霉在淀粉糖化过程中还可以产生淀粉葡萄糖苷酶。YANG S Y等[14]对韩国的39种Nuruk样品进行研究,从中分离得到174株丝状真菌。从日本清酒中分离得到耐酒精的酵母,同时还对该菌株在分子生物学上进行研究,同时发现了泛素以及乳酸菌在酒曲优化中的作用[15]。
变性梯度凝胶电泳(denaturinggradientgelelectrophoresis,DGGE)是一种建立在聚合酶链反应(polymerase chain reaction,PCR)扩增技术基础之上的分子生物学技术,通过聚丙烯酰胺变性梯度凝胶将分子质量相同而碱基组成不同的脱氧核糖核酸(deoxyribonucleic acid,DNA)分子分离开来。现在已广泛应用于自然界不可培养微生物的多样性研究[16]。
本研究旨在通过利用PCR-DGGE方法对不同地区甜酒曲中真菌的多样性进行研究,了解不同地区甜酒酿风味迥异的原因,为甜酒酿品质的进一步提高以及甜酒酿的深加工提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
本实验总共研究6种中国不同地区的甜酒曲样品,分别为湖南韶山、湖南湘潭、湖南祁东、福建福州、浙江丽水和浙江兰溪6个地区,并分别用1#、2#、3#、4#、5#、6#来标记。6种甜酒曲形态见图1。

图1 6种甜酒曲样品Fig.1 Six kinds of sweet alcoholic drink's starters samples
1.1.2 培养基
Luria-Bertani(LB)液体培养基:胰蛋白胨10 g,酵母浸粉5 g,NaCl 10 g,pH 7.4,蒸馏水1 000 mL。
Luria-Bertani(LB)固体培养基:胰蛋白胨10 g,酵母浸粉5 g,NaCl 10 g,琼脂20 g,pH 7.4,蒸馏水1 000 mL。
1.1.3 试剂
50×TAE电泳缓冲液:上海信裕生物技术有限公司;CaCl2(0.1 mol/L,含有15%甘油):上海信裕生物技术有限公司;氨苄青霉素(10 mg/mL)、聚丙烯酰胺、双丙烯酰胺、琼脂糖:美国Sigma-Aldrich生物科技有限责任公司。
1.2 仪器和设备
2720 Thermal cycler PCR反应扩增仪、JY-TD331型变性梯度凝胶电泳仪:美国BIO-RAD公司;DYY-8型稳压稳流电泳仪:北京六一仪器厂;YXJ-2离心机:上海玉博生物科技有限公司;H6-1微型电泳槽:上海精益有机玻璃制品仪器厂;805凝胶成像系统:上海山富科学仪器有限公司。
1.3 方法
1.3.1 样品总DNA的提取
利用土壤基因组DNA快速抽提试剂盒(产品编号SK8233/SK8234)提取6种甜酒曲样品的总DNA。
1.3.2 真菌18S rDNA片段的扩增
利用真菌18S rDNA通用引物NS1、Fung-GC(见表1)以提取样品的总DNA为模板进行扩增。反应体系及扩增条件见表2。

表1 带有GC夹子的真菌引物Table 1 Primers of GC-fungi

表2 真菌18S rDNA PCR扩增体系Table 2 PCR amplification system of fungus 18S rDNA
PCR扩增条件为:预变性:94℃4min;变性:94℃,30s;退火:54℃,45s;延伸:72℃,1min;最后延伸:72℃,10min;体系共运行35个循环,4℃保存。
1.3.3 电泳检测
吸取2 μL PCR产物进行电泳检测。配制1.5%的琼脂糖凝胶,放入1×TAE缓冲液中,120 V稳压电泳15 min,电泳结束后用凝胶成像系统拍摄电泳图谱,检测PCR扩增效果。
1.3.4 变性梯度凝胶电泳(DGGE)
取PCR产物各400 ng,利用D-Code突变检测系统对样品进行DGGE分析。凝胶质量分数:8%(丙稀酰胺∶双丙稀酰胺=37.5∶1),变性剂浓度范围:15%~40%(100%的变性剂:7 mol/L尿素,40%甲酰胺)。梯度凝胶放入1×TAE电泳缓冲液中,70 V电压,60℃恒温电泳13 h。电泳结束,首先用超纯水冲洗凝胶,然后将胶放进染液(含TE缓冲液)中,摇床上均匀染色30 min,最后用凝胶成像系统对DGGE图谱进行拍照。
1.3.5 DGGE条带回收
选取6种样品中有代表性的条带,参照SK8131胶回收试剂盒的方法进行回收处理,回收产物放于-20℃备用。
1.3.6 PCR扩增回收验证
反应体系及扩增条件同1.3.2,引物序列如下(见表3)。

表3 真菌引物Table 3 Primers of fungi
PCR产物回收参考SK8131胶回收试剂盒的方法。
1.3.7 目的片断的克隆测序
根据TakarapMDR18-TVector连接试剂盒说明将目的片段和质粒进行连接,转化到宿主菌大肠杆菌(Escherichia coli)DH5α中,菌液均匀涂布于含有100 μL 20 mg/mL5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)和20 μL 100 mmol/L异丙基-β-D-硫代吡喃半乳糖苷(isopropylβ-D-thiogalactoside,IPTG)的氨苄青霉素LB平板上,37℃培养过夜,挑取白斑。提取质粒,片段送至上海生工生物工程公司进行测序。将测序所得序列提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)上,进行BLAST序列比对进行同源性分析,然后下载相关菌株序列信息,使用MEGA5.0软件中的邻接法构建系统树图,并以Bootstrap对进化树进行1 000次可信度分析。
2 结果与分析
2.1 真菌18S rDNA片段PCR扩增结果
以NS1和Fung-GC为扩增引物,以提取的6种甜酒曲样品的总DNA为模板进行18S rDNA片段扩增,取1.5 μLPCR扩增产物进行电泳分析,电泳结果如图2所示。从图2可以看出,6种酒曲中分别克隆到相应的片段,片段大小在350 bp左右。
2.2 变性梯度凝胶(DGGE)结果
取上述6种酒曲的PCR扩增产物,分别进行DGGE分析,电泳图谱如图3所示,选取有代表性的电泳条带进行编号,共13条条带,6种酒曲中的电泳条带编号见表4。从图3和表4可以看出,不同地区的酒曲中所得的电泳条带不同,说明不同地区的酒曲中的真菌的种类有所不同,这也进一步推断其发酵产物甜酒酿的营养成分及口感也会有所不同。
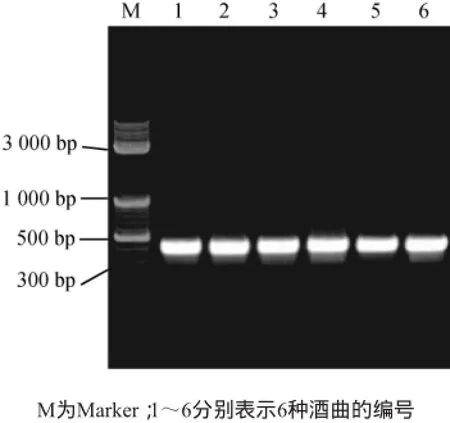
图2 真菌18S rDNA片段PCR扩增产物电泳图Fig.2 PCR amplification product electrophoregram of fungi 18S rDNA fragment

图3 PCR扩增产物DGGE电泳图谱Fig.3 PCR amplification product electrophoregram by DGGE

表4 甜酒曲样品中的条带编号Table 4 Bands number of sweet alcoholic drink's startersamples
2.3 PCR扩增
将编码的13条DGGE片段利用胶回收试剂盒进行回收作为模板,以NS1和Fungi(不含GC夹子)为序列扩增引物进行PCR扩增,取1.5 μL PCR产物进行电泳检测,如图4所示。从图4可以看出,编码的13条条带分别扩增出相应的片段,且扩增片段的长度为350 bp左右。

图4 18S rDNA PCR扩增结果Fig.4 Amplification electrophoresis figure of 18S rDNA
2.4 测序结果分析
对上述PCR扩增产物进行胶回收,对回收片段进行克隆,蓝白斑筛选,挑取白色菌落进行质粒提取,并寄往上海生工生物技术公司进行测序分析,将测序结果在NCBI上进行BLAST序列比对,比对结果见表5。从表5看出,条带编号为1、2的片段属于酿酒酵母属,条带编号为4、5、6、7、13的片段属于扣囊复膜酵母属,条带编号为8、9、10、11的片段为根霉属,而条带编号为12的片段属于不可培养真菌。

表5 13条条带菌种鉴定结果Table 5 Results of the molecular identification of the 13 bands
将这13条带比对结果,利用MEGA5.0邻接法(Neighbor-Joining,NJ)构建系统进化树,结果见图5。如图5所示,所得序列与GenBank数据库中16S rDNA序列的相似性在95%~100%之间。条带编号5、7与扣囊覆膜酵母(Sac chatomycopsis fibuligera)15(KP119822.1)同源性高,其相似性达到100%,4、6与扣囊覆膜酵母(Sacchatomycopsis fibuligera)15(KP119822.1)相似性达到98%;13与扣囊覆膜酵母(Sacchatomycopsis fibuligera)(AB094142.1)同源性高,相似性达到97%;条带编号1、2与酿酒酵母(Saccharomyces cerevisiae)S288cRDN37-2(NR132216.1)同源性高,相似性达到99%;条带编号12与不可培养真菌(Uncultured fungus clone)nco40a10c(KC670800.1)同源性高,相似性达到99%;条带编号8、11与米根霉(Rhizopusoryzae)TY.GF1(JN003654.1)同源性高,相似性达100%,条带编号9、10与米根霉(Rhizopus oryzae)TY.GF1(JN003654.1)相似性达到99%。这说明在不同的酒曲中真菌的种属主要是酿酒酵母属(Saccharomyces)、扣囊覆膜酵母属(Sacchatomycopsis)和根霉属(Rhizopus)的真菌,这些菌在酒的酿造过程中起着及其重要的作用。

图5 基于18S rDNA序列构建的系统进化树Fig.5 Phylogentic tree based on the 18S rDNA sequences
3 结论
本实验利用DGGE技术对甜酒曲样品中的真菌多样性进行了初步的分析,经过DGGE电泳分析,挑取13条清晰条带进行PCR扩增、连接转化、TA克隆进行序列鉴定,结果表明甜酒曲中的真菌主要为酿酒酵母、扣囊复膜酵母、米根霉和不可培养真菌,且6种甜酒曲样品中的真菌种类存在差异。鉴定结果为:1#甜酒曲中的真菌种类为扣囊复膜酵母和米根霉,2#甜酒曲中的真菌为酿酒酵母、扣囊复膜酵母和米根霉,3#甜酒曲中的真菌为酿酒酵母、扣囊复膜酵母、米根霉和不可培养真菌,4#甜酒曲中的真菌为酿酒酵母、扣囊复膜酵母、米根霉和不可培养真菌,5#甜酒曲中真菌为酿酒酵母、扣囊复膜酵母、米根霉和不可培养真菌,6#甜酒曲中的真菌为米根霉和不可培养真菌。由此可见,在传统的甜酒曲中,米根霉是重要的糖化菌株,其次为酿酒酵母,主要用于乙醇的发酵,另外扣囊复膜酵母在酒曲中起着重要的作用。实验结果表明,微生物的非培养鉴定技术结合PCR-DGGE分子生物学手段,非常有利于酒曲微生物资源和不可培养真菌的研究,这比前期利用可培养方法进行的微生物多样性分析结果更加丰富[5]。本实验结果极大的丰富了湖南、福建、浙江三地的酒曲中微生物种子资源,为进一步研究我国南方地区酒酿风味物质特征、改进传统的配料和酿造工艺奠定了理论基础。
[1]闫华文,陈璐,姚淑敏.湖南民间酒酿中酵母菌多样性的研究[J].中国酿造,2014,33(5):81-84.
[2]KIM H R,BAEK S H,SEO M J,et al.Feasibility of Cheonghju brewing withwildtypeyeaststrainsfromNuruks[J].Korean J Microbiol Biotechnol,2006,34(3):244-249.
[3]BAE K H,SHIN K S,RYU H Y,et al.Identification and fermentation characteristics of lactic acid bacteria isolated from the fermentation broth of Korean traditional liquor,Andong-Soju[J].Korean J Microbiol Biotechnol,2007,35(4):310-315.
[4]王则臻,陈朝晖,李敏杰.乳酸菌的抑菌作用及其发酵性能研究[J].食品科技,2012,37(1):2-6.
[5]姚淑敏,陈璐,闫华文.不同甜酒曲中可培养真菌多样性的研究[J].中国酿造,2015,34(9):48-54.
[6]姚淑敏,张艳,秦宗燕,等.甜酒酿中酵母菌多样性的研究[J].中国酿造,2013,32(7):61-64.
[7]蔡浚泽,张兰威,付春梅,等.传统米酒中产酸菌的分离筛选及其发酵性能的研究[J].中国酿造,2007,26(10):23-26.
[8]蔡丽,易响,陈福生.传统米酒酒曲的评价及根霉的分类鉴定[J].中国酿造,2010,29(12):30-33.
[9]李福荣.信阳米酒微生物群落组成[J].信阳师范学院学报:自然科学版,2005,18(1):52-53.
[10]王艳萍,程巧玲,张阳.米酒醪中优势微生物菌相组成的初步研究[J].中国酿造,2008,27(5):12-14.
[11]LV X C,HUANG X L,ZHANG W,et al.Yeast diversity of traditional alcohol fermentation starters for HongQu glutinous rice wine brewing, revealed by culture-dependent and culture-independent methods[J]. Food Control,2013,34(1):183-190.
[12]JEYRAM K,MOHENDO S W,CAPEC A,et al.Molecular identification of yeast species associated with'Hamei'-A traditional starter used for rice wine production in Manipur,India[J].Int J Food Microbiol, 2008,124(2):115-125.
[13]DUNG N T P,ROMBOUTS F M,NOUT M J R.Functionality of select-ed strains of moulds and yeasts from Vietnamese rice wine starters [J].Food Microbiol,2006,23(4):331-340.
[14]YANG S Y,LEE J,KWAK J,et al.Fungi associated with the traditional starter cultures used for rice wine in Korea[J].J Korean Soc Appl Biol Chem,2011,54(6):933-943.
[15]SUJAYA I N,ANTARA N S,SONE T,et al.Identification and characterization of yeasts in brem,a traditional Balinese rice wine[J].World J Microbiol Biotech,2004,20(2):143-150.
[16]高启禹,徐光翠,李小英.变性梯度凝胶电泳(DGGE)在微生物多样性中的研究[J].生物学杂志,2009,26(5):80-82.
Diversity of fungi in sweet alcoholic drink's starters by PCR-DGGE method
YAO Shumin,CHEN Lu,YAN Huawen
(College of Life Science,Qufu Normal University,Qufu 273165,China)
The total DNA in the six kinds of sweet alcoholic drink's starters was extracted,using the universal primer NS1 and Fung-GC of fungus 18S rRNA gene segment,the diversity of fungi in the different starters was analyzed by PCR-DGGE.The results showed that three genera of fungi and unculturable fungi were isolated from six kinds of the starters.The main fungi wereSaccharomycopsisandRhizopusin the Hunan Shaoshan sweet alcoholic drink's starters.Saccharomyces,SaccharomycopsisandRhizopuswere the main fungi in Hunan Xiangtan sweet alcoholic drink's starters.Saccharomyces,Saccharomycopsis,Rhizopusand unculturable fungi were the main fungi in Hunan Qidong,Fujian Fuzhou and Zhejiang Lishui sweet alcoholic drink's starters.Rhizopusand unculturable fungi were main fungi in Zhejiang Lanxi sweet alcoholic drink's starters. SaccharomycesandSaccharomycopsiswere the main fungi in the traditional starters.In addition,the unculturable fungi also played a very important role in sweet alcoholic drink's starters.
PCR-DGGE;sweet alcoholic drink's starter;fungal diversity
TS261.1
0254-5071(2016)11-0044-05
10.11882/j.issn.0254-5071.2016.11.009
2016-07-08
国家自然科学基金资助项目(31200400);曲阜师范大学实验室开放基金项目(sk201407)
姚淑敏(1967-),女,副教授,博士,研究方向为微生物资源和利用。
