自噬在尿毒症小鼠心肌细胞损伤中的作用研究
2016-12-14龚建光梁世凯李一文
龚建光,金 娟,赵 黎,林 波,梁世凯,何 强,李一文
·论著·
自噬在尿毒症小鼠心肌细胞损伤中的作用研究
龚建光,金 娟,赵 黎,林 波,梁世凯,何 强,李一文
目的 探讨自噬与尿毒症小鼠心肌细胞损伤的关系及其发生的可能机制。方法 2015年8—12月选取SPF级C57BL/6-PAX6雄性小鼠50只,采用随机数字表法将小鼠分成对照组(6只)、假手术组(8只)、实验组〔5/6NC组(6只)、5/6NC+生理盐水组(10只)、5/6NC+渥曼青霉素组(10只)以及5/6NC+Beclin-1组(10只)〕。对照组研究过程中不做任何干预。假手术组仅与实验组同期进行两次手术,但不切除肾脏。实验组制备5/6肾切除尿毒症小鼠模型。造模6周时,5/6NC组不进行干预,5/6NC+生理盐水组、5/6NC+渥曼青霉素组、5/6NC+Beclin-1组分别给以0.9%氯化钠溶液1 ml 腹腔内注射,隔日1次;渥曼青霉素1 mg·kg-1·次-1,腹腔内注射,1次/d;腺病毒携带的Beclin-1 1×109pfu腿部肌肉注射,1次/只。造模12周时采用超声心动图检测各组小鼠心功能,ELISA法检测肌酐、尿素氮,采用免疫组化及Western blotting法检测处死后小鼠的心肌细胞自噬相关蛋白表达情况。结果 造模12周时,与对照组及假手术组比较,5/6NC组、5/6NC+生理盐水组左心室舒张末期内径(LVEDD)增厚、左心室短轴缩短率(LVFS)降低,肌酐及尿素氮上升(P<0.05);与5/6NC+生理盐水组比较,与5/6NC+渥曼青霉素组LVEDD降低,LVFS升高,肌酐、尿素氮降低(P<0.05);与对照组、5/6NC+生理盐水组比较,5/6NC+Beclin-1组LVEDD增加,LVFS降低,肌酐及尿素氮升高(P<0.05)。免疫组化染色显示5/6NC组心肌细胞Atg5、Cathepsin-D、Rab 7表达较对照组增强;对照组与5/6NC组Atg5、Cathepsin-D、Rab 7阳性细胞率比较,差异均有统计学意义(P<0.05)。5/6NC+生理盐水组、5/6NC+Beclin-1组心肌组织细胞中自噬相关蛋白LC3、Beclin-1及AKT表达均较对照组升高(P<0.05),5/6NC+渥曼青霉素组LC3、Beclin-1及AKT表达虽较对照组升高,但低于5/6NC+生理盐水组、5/6NC+Beclin-1组(P<0.05),5/6NC+Beclin-1组LC3、Beclin-1、AKT表达较5/6NC+生理盐水和5/6NC+渥曼青霉素组升高(P<0.05)。结论 尿毒症小鼠心肌细胞的损伤与自噬密切相关,增强或抑制自噬可以加重或缓解尿毒症小鼠心肾功能,Beclin-1基因及磷脂酰肌醇3-激酶(PI3K)/丝氨酸/苏氨酸蛋白激酶(AKT)信号蛋白在调节尿毒症心肌细胞自噬中发挥重要作用。
心肌疾病;尿毒症;自噬;自噬相关蛋白;PI3K/AKT信号蛋白
龚建光,金娟,赵黎,等.自噬在尿毒症小鼠心肌细胞损伤中的作用研究[J].中国全科医学,2016,19(36):4489-4494.[www.chinagp.net]
GONG J G,JIN J,ZHAO L,et al.Effect of autophagy on cardiac myocytes injury in uremic cardiomyopathy mice[J].Chinese General Practice,2016,19(36):4489-4494.
尿毒症患者的心血管疾病(CVD) 是一个重要的临床问题,是尿毒症患者的首要死亡原因。有调查显示,我国慢性肾脏病1~5期患者CVD发生率分别为1.28%、17.24%、22.86%、33.33%、56.20%;维持性血液透析治疗的慢性肾脏病5期患者CVD发生率高达78.51%[1]。尿毒症CVD主要为尿毒症心肌病和缺血性心脏病,尿毒症时心脏的病理结构改变主要为左心室肥大、心肌间质纤维化及微血管病变,并伴有心肌细胞的丢失。细胞自噬是一种高度保守的细胞内蛋白再循环机制,其能导致不同于凋亡的不依赖于caspase途经的程序性细胞死亡,营养物质缺乏、过氧化损害等均可以诱导细胞发生自噬。多种CVD(如心肌病、心脏缺血再灌注损伤、心功能不全等)存在心肌细胞自噬现象。有研究表明心肌细胞对自噬引起的细胞内环境改变尤其敏感[2],抑制心肌细胞的自噬可以改善扩张性心肌病的心功能[3]。目前关于尿毒症心肌病自噬的发生情况及其对心功能影响的研究较少。因此,本研究拟制备小鼠模型并观察不同方法干扰尿毒症心肌病心肌细胞自噬的发生和变化情况,探讨自噬在尿毒症心肌病细胞损伤中的作用,为进一步研究尿毒症患者心肌细胞损伤的机制奠定基础。
1 材料与方法
1.1 材料 2015年8—12月选择SPF级C57BL/6-PAX6雄性小鼠50只,周龄为8周,体质量19~21 g,购自中国科学院上海动物研究所;Atg5及Cathepsin D抗体购自DaKo公司;Rab7、LC3、Beclin-1抗体购自Santa Cruz公司,丝氨酸/苏氨酸蛋白激酶(AKT)抗体购自Cell Signal公司;α-Tubulin抗体、渥曼青霉素、肌酐和尿素ELISA检测试剂盒购自Sigma公司;腺病毒携带的Beclin-1由日本岐阜大学竹村教授友情赠送。
1.2 实验分组 采用随机数字表法将实验小鼠分成对照组(6只)、假手术组(8只)、实验组〔5/6NC组(6只)、5/6NC+生理盐水组(10只)、5/6NC+渥曼青霉素组(10只)以及5/6NC+Beclin-1组(10只)〕。对照组研究过程中不做任何干预。假手术组仅与实验组同期进行两次手术,但不切除肾脏。实验组制备5/6肾切除尿毒症小鼠模型。造模6周时,5/6NC组不进行干预,5/6NC+生理盐水组、5/6NC+渥曼青霉素组、5/6NC+Beclin-1组根据文献[4]分别给以0.9%氯化钠溶液1 ml 腹腔内注射,隔日1次;渥曼青霉素1 mg·kg-1·次-1,腹腔内注射,1次/d;腺病毒携带的Beclin-1 1×109pfu腿部肌肉注射,1次/只。造模12周时用超声心动图检测各组小鼠心功能后处死小鼠。分别收集血液及心脏标本。
1.3 5/6肾切除尿毒症模型的制备 采用10%戊巴比妥钠溶液(150 μl)腹腔注射麻醉小鼠。小鼠仰卧位固定于手术台上,小鼠腹部用0.5%洗必泰溶液消毒手术区域皮肤。采用腹部左侧切口开腹后暴露左肾,将肾上腺和肾周脂肪与肾脏分离,游离出左肾。采用聚乙醇酸缝合线结扎左肾上下两极(占肾脏体积各约1/3)后,眼科剪剪去上下极的同时明胶海绵压迫止血2 min。切除完毕后将残肾复位至肾窝,将脏器及腹膜覆盖于上,并逐层缝合腹膜和皮肤。1 周后,同样方法暴露右侧肾脏,分别结扎右肾动静脉及输尿管后,切除右肾。
1.4 小鼠心肾功能测定 造模12周时用超声心动图检测各组小鼠左心室舒张末期内径(LVEDD)和左心室短轴缩短率(LVFS),评估各组小鼠的心功能状况。小鼠检测完心功能后,处死小鼠前从腹主静脉采血,分离血清,采用 ELISA法检测血肌酐和尿素氮。
1.5 小鼠心肌组织病理学处理 对照组、5/6NC组小鼠检测完心功能及采集完血液样本后处死,收集心脏标本,用甲醛溶液固定,乙醇溶液脱水,二甲苯溶液透明及石蜡包埋,切成4 μm厚切片,烤箱过夜。进行Atg5、Cathepsin D、Rab7抗体免疫组化染色,采用卵白素-生物素-酶复合物(ABC)法进行染色,步骤严格按照抗体说明书操作,被染成棕褐色的为阳性细胞,染色后光镜下观察10个高倍镜(×400)视野,计数每个视野下阳性细胞率。
1.6 自噬相关蛋白LC3、Beclin-1及AKT的测定 LC3、Beclin-1及AKT的检测采用Western blotting法。心肌组织蛋白提取:用颈椎脱臼法处死对照组、5/6NC+生理盐水组、5/6NC+渥曼青霉素组、5/6NC+Beclin-1组小鼠,70%乙醇溶液浸泡5 min,开胸摘取心脏,去除心脏周围结缔组织,磷酸盐缓冲液(PBS)冲洗3次,在试管中加入1 ml蛋白提取液,然后将心肌组织超声匀浆化,离心取上清液备测。BCA法进行蛋白定量,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,ECL plus显色,用Image J软件进行图像采集和定量分析。

2 结果
2.1 心肾功能变化 造模12周时,与对照组及假手术组比较,5/6NC组、5/6NC+生理盐水组LVEDD增厚,LVFS降低,肌酐、尿素氮升高;与5/6NC+生理盐水组比较,5/6NC+渥曼青霉素组LVEDD减少,LVFS升高,肌酐、尿素氮降低;与对照组、5/6NC+生理盐水组比较,5/6NC+Beclin-1组LVEDD增加,LVFS降低,肌酐及尿素氮升高;差异均有统计学意义(P<0.05,见表1)。
2.2 心肌组织病理变化 免疫组化染色显示5/6NC组心肌细胞Atg5、Cathepsin-D、Rab7表达较对照组增强(见图1,本文图1彩图见本刊官网www.chinagp.net电子期刊相应文章附件)。对照组与5/6NC组Atg5、Cathepsin-D、Rab7阳性细胞率比较,差异均有统计学意义(P<0.01,见表2)。2.3 心肌组织自噬相关蛋白及AKT的表达 5/6NC+生理盐水组、5/6NC+Beclin-1组心肌组织细胞中自噬相关蛋白LC3、Beclin-1及AKT表达均较对照组升高;5/6NC+渥曼青霉素组LC3、Beclin-1、AKT表达虽较对照组升高,但低于5/6NC+生理盐水组、5/6NC+Beclin-1组;5/6NC+Beclin-1组LC3、Beclin-1、AKT表达较5/6NC+生理盐水组和5/6NC+渥曼青霉素组升高;差异均有统计学意义(P<0.05,见图2、表3)。
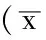
Table1Comparisonofcardiacandrenalfunctionindexamongeachgroups12weeksaftermodelestablished
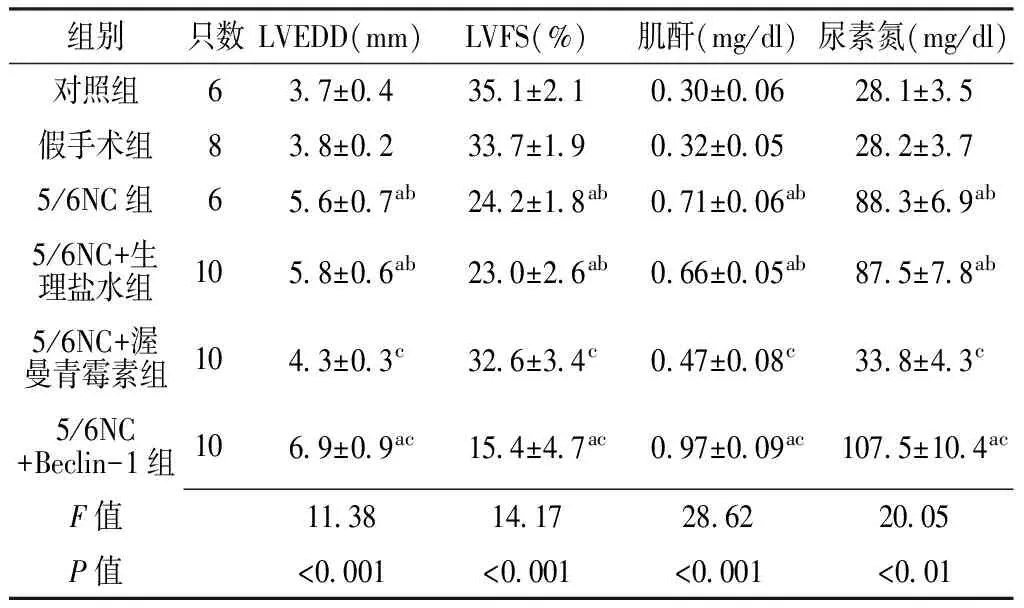
组别只数LVEDD(mm)LVFS(%)肌酐(mg/dl)尿素氮(mg/dl)对照组637±04351±21030±006281±35假手术组838±02337±19032±005282±375/6NC组656±07ab242±18ab071±006ab883±69ab5/6NC+生理盐水组1058±06ab230±26ab066±005ab875±78ab5/6NC+渥曼青霉素组1043±03c326±34c047±008c338±43c5/6NC+Beclin-1组1069±09ac154±47ac097±009ac1075±104acF值1138141728622005P值<0001<0001<0001<001
注:LVEDD=左心室舒张末期内径,LVFS=左心室短轴缩短率;与对照组比较,aP<0.05;与假手术组比较,bP<0.05;与5/6NC+生理盐水组比较,cP<0.05
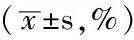
Table 2 Comparison of Atg5,Cathepsin-D,and Rab 7 positive cells rate between control group and 5/6NC group
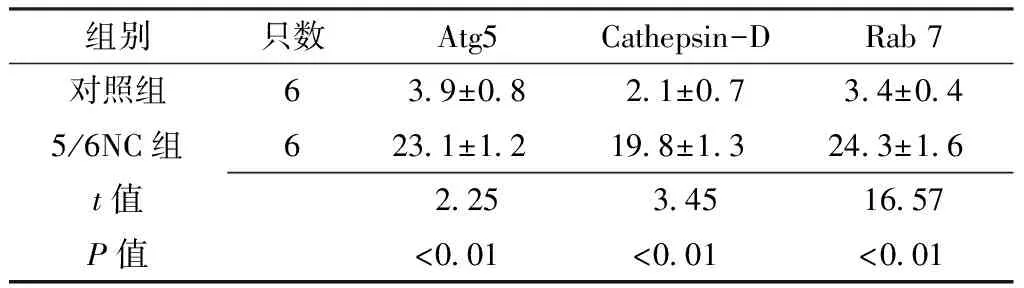
组别只数Atg5Cathepsin-DRab7对照组639±0821±0734±045/6NC组6231±12198±13243±16t值2253451657P值<001<001<001
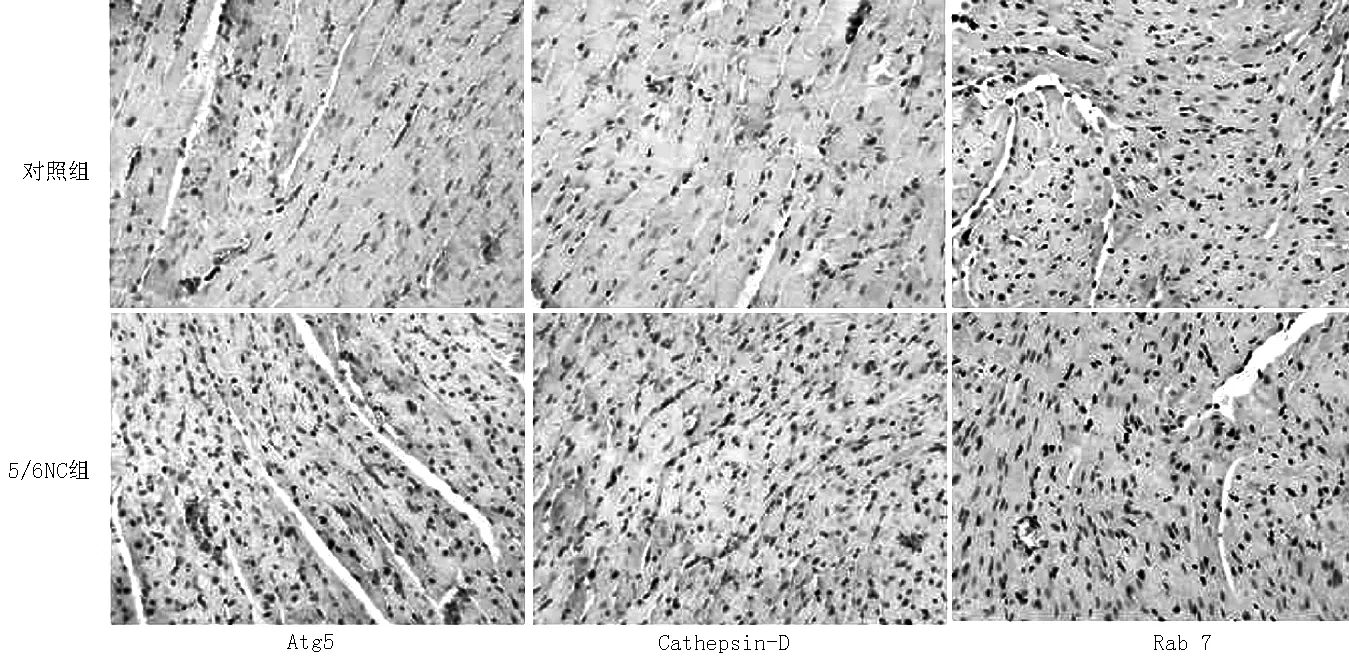
图1 对照组与5/6NC组免疫组织化学染色结果(ABC法,×400)
表3 对照组与5/6NC+生理盐水组、5/6NC+渥曼青霉素组、5/6NC+Beclin-1组心肌组织LC3、Beclin-1及AKT表达比较
Table 3 Comparison of expression of LC3,Beclin-1,and AKT in myocardium among control group,5/6NC+saline group,5/6NC+wortmannin group and 5/6NC+Beclin-1 group
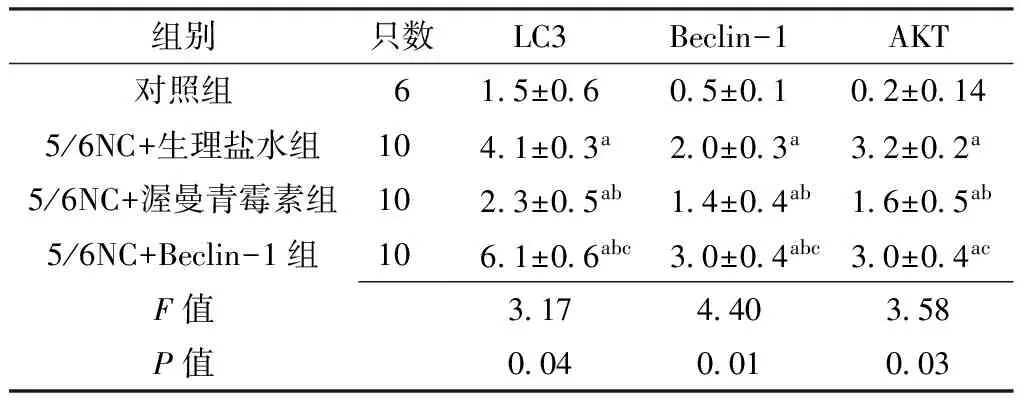
组别只数LC3Beclin-1AKT对照组615±0605±0102±0145/6NC+生理盐水组1041±03a20±03a32±02a5/6NC+渥曼青霉素组1023±05ab14±04ab16±05ab5/6NC+Beclin-1组1061±06abc30±04abc30±04acF值317440358P值004001003
注:AKT=丝氨权/苏氨酸蛋白激酶;与对照组比较,aP<0.05;与5/6NC+生理盐水组比较,bP<0.05;与5/6NC+渥曼青霉素组比较,cP<0.05

图2 对照组、5/6NC+生理盐水组、5/6NC+渥曼青霉素组、5/6NC+Beclin-1组心肌组织LC3、Beclin-1、AKT表达
Figure 2 Expression of LC3,Beclin-1,and AKT in myocardium among control group,5/6NC+saline group,5/6NC+wortmannin group,and 5/6NC+Beclin-1 group
3 讨论
3.1 5/6肾切除尿毒症小鼠模型的建立 本研究采用5/6肾切除的方法建立尿毒症模型,结果显示实验组小鼠LVEDD增加,LVFS降低,肌酐及尿素氮水平显著升高,出现肾功能不全,符合后续研究要求。建立尿毒症动物模型,有高嘌呤食物诱导、电凝烧灼、经液氮冷冻等多种方法,5/6 肾切除模型是根据残存肾单位出现高灌注、高滤过和高压力,进而导致肾小球硬化和残余肾单位进一步破坏更接近于临床高发的肾功能不全。
3.2 5/6肾切除尿毒症小鼠与心肌自噬的关系 有研究发现,多种心脏疾病中存在心肌细胞自噬现象,如心肌病、心肌缺血再灌注损伤、糖尿病心肌病等[5-6]。然而心肌细胞的自噬在不同心脏疾病中对心功能的影响是利是弊,目前尚有较大争议。在心肌缺血再灌注损伤的研究中,多数学者认为在心肌缺血的早期细胞自噬对心肌细胞具有保护作用,而在再灌注期或长期慢性缺血时则导致细胞的自噬性死亡,加剧病情的进展[7]。国外有研究发现在压力负荷所致的慢性心功能不全小鼠中心肌细胞自噬明显增加并伴有心肌细胞的重塑,加重心功能不全[8]。本研究在建立尿毒症小鼠模型12周后,超声心动图显示LVEDD增加,LVFS降低,提示心肌功能受损。Atg5是自噬相关基因的一种表达产物,参与自噬前体双层膜结构的形成;Cathepsin-D是一种天冬氨酸蛋白酶,属于溶酶体酸性蛋白酶家族,其在细胞内蛋白质的分解代谢中起关键作用;Rab7是一种GTP结合蛋白,其在吞噬泡的形成过程中起重要作用,三者均与自噬活性呈正相关[9-10]。本研究免疫组化结果显示尿毒症小鼠Atg5、Cathepsin-D、Rab7表达较正常对照小鼠明显增多,可见尿毒症小鼠心肌自噬活性也增强。由此推测,自噬与尿毒症小鼠心肌功能受损有关。
3.3 调节自噬活性与尿毒症小鼠心肌损伤的关系 Beclin-1是哺乳动物中重要的自噬促进基因,作用于自噬的成核时期,是启动自噬的关键蛋白。LC3是由哺乳动物细胞中酵母自噬相关基因8(ATG8)编码,属于一个介导细胞内膜运输和/或结合的蛋白家族。LC3定位于自噬体的内外膜上,有LC3-Ⅰ和 LC3-Ⅱ两种形式,成型后的 LC3-Ⅱ会稳定地结合于胞内自噬体的膜上,因而,LC3 的表达强度与自噬机制的活性密切相关[11]。Beclin-1与Ⅲ型磷酸酰肌醇3-激酶(PI3K)形成复合体,使磷脂酰肌醇发生磷酸化,生成3-磷酸磷脂酰肌醇,参与了自噬前体复合物的形成,在自噬小体膜的来源中发挥重要作用,其表达与自噬活性密切相关[12]。本研究用Beclin-l刺激尿毒症小鼠,发现5/6NC+Beclin-1组LC3、Beclin-1的表达显著增加,显然Beclin-l促进了自噬的活性。通过比较可以看出5/6NC+Beclin-1组小鼠无论是肾功能还是心功能均较5/6NC+生理盐水组明显加重。故认为过度的自噬可以加重尿毒症小鼠心肌的损伤。这与文献报道的抑制自噬可以减轻糖尿病小鼠的心肌损伤相符合[13]。渥曼青霉素是一种常用的PI3K抑制剂,可以通透细胞,和PI3K的催化亚基相结合,特异性地抑制PI3K,抑制PI3K/AKT信号通路。本研究采用渥曼青霉素刺激尿毒症小鼠,观察其对尿毒症小鼠心肌细胞自噬的影响。结果提示渥曼青霉素抑制了LC3、Beclin-1的表达和AKT的合成,自噬活性被抑制。与5/6NC+生理盐水组比较,5/6NC+渥曼青霉素组小鼠肾功能和心功能明显好转,进一步证明了自噬对尿毒症小鼠心肌细胞以及肾脏功能的影响。本研究显示,渥曼青霉素组的肌酐及尿素氮水平稍高于对照组,但无统计学意义,这可能与样本量以及小鼠自身的代偿功能有关。RINKEVICH等[14]研究发现,驻留在小鼠肾脏的干细胞能通过Wnt信号通路进行自我修复。本组前期研究中也发现5/6肾切除小鼠5周后肌酐和尿素氮开始上升,12周左右趋于稳定,之后又出现小幅的下降。
3.4 尿毒症小鼠心肌自噬调节机制 AKT是一种丝氨酸/苏氨酸激酶,处于PI3K/AKT信号通路的中心环节,PI3K的激活将致AKT磷酸化,活化后的AKT启动通路下游的级联反应,进一步发挥其对细胞的调节作用。因此AKT的表达情况可以反映PI3K/Akt信号通路的活化状态[15]。自噬的调节机制非常复杂,PI3K/Akt信号通路是自噬调节的一条重要途径。本研究利用PI3K抑制剂渥曼青霉素处理尿毒症小鼠,发现AKT表达明显下降,自噬相关蛋白LC3、Beclin蛋白的表达也显著减少,由此可见,PI3K/AKT信号通路参与了尿毒症心肌细胞自噬活性的调节。
综上所述,本研究首次从心肌细胞自噬的角度研究尿毒症心脏病的病理变化。通过体内试验方法研究尿毒症心脏病时其心肌自噬的改变,证明尿毒症小鼠心肌细胞存在细胞自噬现象,且心肌细胞自噬与尿毒症小鼠心功能改变密切相关,Beclin-1基因及PI3K/AKT信号通路在调节尿毒症心肌细胞自噬中起调节作用,这为尿毒症心肌病的预防和治疗提供了新思路。然而自噬的发生是否与尿毒症毒素或炎性因子的刺激有关,尿毒症毒素的清除是否可以改变自噬活性改善心肌功能,还有待进一步研究。
作者贡献:龚建光进行实验设计与实施、资料收集整理、撰写论文并对文章负责;金娟、赵黎、林波、梁世凯进行实验实施、评估、资料收集;何强、李一文进行质量控制及审校。
本文无利益冲突。
本文创新点/不足:
(1)本研究首次从心肌细胞自噬的角度研究尿毒症心脏病的病理变化,并且通过自噬的调节来观察尿毒症小鼠心肾功能的变化,证实了心肌细胞自噬与尿毒症小鼠心功能改变密切相关,同时还发现Beclin-1基因及磷脂酰肌醇3-激酶(PI3K)/丝氨酸/苏氨酸蛋白激酶(AKT)信号通路在调节尿毒症心肌细胞自噬中起调节作用,本研究为开发新的通过调节心肌细胞自噬的方法治疗尿毒症心肌病提供理论依据。
(2)本研究仅进行了小鼠模型体内研究,缺少体外实验的支持;另外本研究仅观察了自噬标记物蛋白表达情况,如果增加mRNA水平的检测将更有说服力;本研究仅证实了Beclin-1基因及PI3K/AKT信号通路在尿毒症心肌细胞自噬中起调节作用,但具体如何调节还有待进一步研究。由于实验设计时存在一些瑕疵,且各组设计的目的有所差别,所以在实验过程中并没有将所有组进行同步实验,在今后实验设计时会吸取经验和教训加以改进。
[1]CHEN X N,PAN X X,YU H J,et al.Analysis of cardiovascular disease in Chinese inpatients with chronic kidney disease[J].Intern Med,2011,50(17):1797-1801.
[2] TANNOUS P,ZHU H,NEMCHENKO A,et al.Intracellular protein aggregation is a proximal trigger of cardiomyocyte autophagy[J].Circulation,2008,117(24):3070-3078.
[3] YU P,ZHANG Y,LI C,et al.Class Ⅲ PI3K-mediated prolonged activation of autophagy plays a critical role in the transition of cardiac hypertrophy to heart failure[J].J Cell Mol Med,2015,19(7):1710-1719.
[4] ZHOU H,QIAN J,LI C,et al.Attenuation of cardiac dysfunction by HSPA12B in endotoxin-induced sepsis in mice through a PI3K-dependent mechanism[J].Cardiovasc Res,2011,89(1):109-118.
[5] KOBAYASHI S,LIANG Q.Autophagy and mitophagy in diabetic cardiomyopathy[J].Biochim Biophys Acta,2015,1852(2):252-261.
[6] FIDZIANSKA A,BILINSKA Z T,WALCZAK E,et al.Autophagy in transition from hypertrophic cardiomyopathy to heart failure[J].J Electron Microsc(Tokyo),2010,59(2):181-183.
[7]MATSUI Y,TAKAGI H,QU X,et al.Distinct roles of autophagy in the heart during ischemia and reperfusion:roles of AMP-activated protein kinase and Beclin 1 in mediating autophagy[J].Circ Res,2007,100(6):914-922.
[8]ZHU H,TANNOUS P,JOHNSTONE J L,et al.Cardiac autophagy is a maladaptive response to hemodynamic stress[J].J Clin Invest,2007,117 (7):1782-1793.
[9]GONG F,PENG X,SANG Y,et al.Dichloroacetate induces protective autophagy in LoVo cells:involvement of cathepsin D/thioredoxin-like protein 1 and Akt-mTOR-mediated signaling[J].Cell Death Dis,2013(4):e913.
[10]TOYOFUKU T,MORIMOTO K,SASAWATARI S,et al.Leucine-rich repeat kinase 1 regulates autophagy through turning on TBC1D2-dependent Rab7 inactivation[J].Mol Cell Biol,2015,35(17):3044-3058.
[11] MIZUSHIMA N.Methods for monitoring autophagy[J].Int J Biochem Cell Biol,2004,36(12):2491-2502.
[12] AL-SHENAWY A S.Expression of Beclin-1,an autophagy-related marker,in chronic hepatitis and hepatocellular carcinoma and its relation with apoptotic markers[J].Apmis,2016,124(3):229-237.
[13] XU X,KOBAYASHI S,CHEN K,et al.Diminished autophagy limits cardiac injury in mouse models of type 1 diabetes[J].J Biol Chem,2013,288(25):18077-18092.
[14]RINKEVICH Y,MONTORO D T,CONTRERAS-TRUJILLO H,et al.InVivo clonal analysis reveals lineage-restricted progenitor characteristics in mammalian kidney development,maintenance,and regeneration[J].Cell Reports,2014,7(4):1270-1283.
[15] HERAS-SANDOVAL D,PÉREZ-ROJAS J M,HERNNDEZ-DAMIN J,et al.The role of PI3K/AKT/mTOR pathway in the modulation of autophagy and the clearance of protein aggregates in neurodegeneration[J].Cell Signal,2014,26(12):2694-2701.
(本文编辑:赵跃翠)
Effect of Autophagy on Cardiac Myocytes Injury in Uremic Cardiomyopathy Mice
GONG Jian-guang,JIN Juan,ZHAO Li,LIN Bo,LIANG Shi-kai,HE Qiang,LI Yi-wen.
Department of Nephrology,Zhejiang Provincial People′s Hospital,Hangzhou 310014,China
LI Yi-wen,Department of Nephrology,Zhejiang Provincial People′s Hospital,Hangzhou 310014,China;E-mail:yiwen1962@163.com
Objective To explore the effect and mechanism of autophagy on cardiac myocytes injury in uremic cardiomyopathy mice.Methods From August to December 2015,fifty male C57BL/6-PAX6 mice in a SPF grade were selected in our study.The mice were randomly divided into control group(6),sham operation group(8),test groups〔5/6 nephrectomy(NC) group (6),5/6NC+saline group(10),5/6NC+wortmannin group(10) and 5/6NC+Beclin-1 group(10)〕.The control group did not receive any intervention in the study.The sham operation group only received surgery and anesthesia procedures simultaneous with the test groups,but the kidneys were not removed.5/6 mice nephrectomy model were established in the test groups.Six weeks after model establishment,5/6 NC group did not receive intervention.5/6NC+saline group was given 0.9% sodium chloride solution 1 ml intraperitoneal injection,1 time every other day.5/6NC+wortmannin group was given wortmannin 1 mg/kg intraperitoneal injection,1 time/day.5/6NC+Beclin-1 group was given adenovirus carrying Beclin-1 1 ×109pfu intramuscular injection,1 time/once.12 weeks after model establishment,mice heart function was measured by ultrasonic cardiograph,and renal function was measured by ELISA.In addition,we analyzed the expression of autophagy and its associated protein in mice myocardium using Western blotting and immunohistochemical staining after sacrificed.Results 12 weeks after model establishment,compared with control group and sham operation group,LVEDD significantly increased,LVFS significantly increased and serum creatinine and urea nitrogen level significantly increased in the 5/6NC group and 5/6NC+saline group(P<0.05).Compared with 5/6 NC+saline group,LVEDD significantly decreased,LVFS significantly increased,serum creatinine and urea nitrogen level significantly decreased in the 5/6NC+wartmannin group(P<0.05).Compared with control group and 5/6 NC+saline group,LVEDD significantly increased,LVFS significantly decreased,serum creatinine and urea nitrogen level significantly increased in the 5/6 NC+Beclin-1 group (P<0.05).Immunohistochemical staining showed that the expression of Atg5,Cathepsin-D and Rab 7 in the myocardial cells of 5/6NC group were significantly higher than that in control group(P< 0.05).There were significant differences in the rate of Atg5,Cathepsin-D and Rab7 positive cells between the control group and 5/6NC group(P<0.05).The expressions of autophagy-related protein LC3,Beclin-1 and AKT in the 5/6 NC+saline group and 5/6NC+Beclin-1 group were significantly higher than those in the control group (P<0.05).The expressions of LC3,Beclin-1 and AKT in 5/6 NC+wortmannin penicillin group were higher than those in control group,but lower than those in 5/6NC+saline group,5/6NC+Beclin-1 group (P<0.05).The expression of LC3,Beclin-1 and AKT in the 5/6 NC+Beclin-1 group were higher than those in 5/6 NC+saline group and 5/6 NC+wartmannin group(P<0.05).Conclusion Autophagy was closely related to cardiomyocytes injury in uremic mice.Enhancement or inhibition of autophagy could aggravate or relieve cardiac and renal function in uremic mice.Beclin-1 gene and PI3K/AKT signal proteins played an important role in regulation cardiomyocytes autophagy.
Cardiomyopathies;Uremia;Autophagy;Autophagy associated protein;PI3K/AKT signal protein
浙江省自然科学基金资助项目(Y2080371);浙江省中医药管理局项目(2016ZA023)
310014浙江省杭州市,浙江省人民医院肾脏病科
李一文,310014浙江省杭州市,浙江省人民医院肾脏病科;E-mail:yiwen1962@163.com
R 692.5
A
10.3969/j.issn.1007-9572.2016.36.017
2016-08-20;
2016-11-25)
