间歇出酶/出菌丝的培养方式对里氏木霉产纤维素酶的影响
2016-12-13王步成白合超余世袁
蒋 露, 王步成, 白合超, 勇 强, 余世袁*
(南京林业大学 林木遗传与生物技术省部共建教育部重点实验室, 江苏 南京 210037)
·研究报告——生物质能源·
间歇出酶/出菌丝的培养方式对里氏木霉产纤维素酶的影响
蒋 露, 王步成, 白合超, 勇 强, 余世袁*
(南京林业大学 林木遗传与生物技术省部共建教育部重点实验室, 江苏 南京 210037)
以微晶纤维素和淀粉水解液作为碳源生产纤维素酶,在里氏木霉Rut C30分批补料生产纤维素酶的过程中通过间歇取出部分酶的培养方式保护纤维素酶。实验结果显示:采用间歇出酶培养方式,在分批补料3 d后,每1、 2或者3天取出部分酶液。当平均每天取出15 %的酶液,酶活显著增加,总纤维素酶酶活较单纯分批补料提高26.5 %~32.6 %,而总β-葡萄糖苷酶酶活提高超过46 %;采用间歇出酶出菌丝培养方式,当每天取出15 %的酶液时,纤维素酶产量比分批补料增长35.4 %,去除和酶液等量的菌丝,酶活和分批补料相比增长32.5 %,而且这两种培养方式所生产的纤维素酶的酶解效率高达82 %,远超商品酶Celluclast(62.03 %)。
纤维素酶;分批补料;β-葡萄糖苷酶;里氏木霉
能源是当今人类生存和发展的重要资源。化石燃料不可再生且会造成环境污染,而可再生能源的发展不仅可以减少环境污染而且可以确保能源安全[1]。利用木质纤维原料生产的生物乙醇被认为是最有前途的可再生能源。在燃料乙醇生产中,纤维素酶的作用至关重要,而商品纤维素酶价格较为昂贵,是目前亟待解决的问题。因此,生产低成本的纤维素酶十分重要。间歇培养、连续培养和分批补料培养是纤维素酶生产的3种主要模式。最常见的培养方法是分批补料培养,即在培养体系中以固定时间间隔补充某些原料和营养元素[2]。然而,分批补料生产纤维素酶存在需要长时间的培养才能实现高酶活性的问题,并且在培养过程中,许多机械、化学和热力学因素可能对酶蛋白产生负面影响,从而造成酶活性的降低。本研究以纤维素酶产量为指标,探讨里氏木霉(Trichodermareesei)Rut C30以微晶纤维素和淀粉水解液作为碳源分批补料培养生产纤维素酶的过程中,间歇出酶和间歇出酶出菌丝两种方式对酶产量的影响,以期为纤维素酶的新的生产方式提供理论依据。
1 材料和方法
1.1 菌种
里氏木霉(Trichodermareesei) Rut C30,纤维素酶生产菌株,于4 ℃保存在马铃薯葡萄糖琼脂(PDA)斜面培养基上,由南京林业大学生物化工实验室提供。
1.2 材料
微晶纤维素:Avciel PH-101,含纤维素82 %(以绝干质量计),相对结晶度72 %,购于Sigma公司。商品纤维素酶(Celluclast,Sigma C2730-50 mL,Cellulose fromTrichodermareeseiATTC 26921),滤纸酶活为72 FPU/g。
淀粉水解液,自制。取玉米淀粉300 g倒入1 L 0.2 mol/L盐酸中在120 ℃下水解90 min。冷却后,用NaOH调节pH值至(5.0± 0.2)。将该水解液稀释至原体积的3~4倍,加入适量活化好的酿酒酵母发酵去除水解液中的葡萄糖,发酵48 h后离心去除酵母,上清液纳滤除去发酵产生的盐、酒精等小分子物质,收集截留液,真空旋转蒸发浓缩至一定浓度,备用。水解液的成分为(g/L):龙胆二糖 5.59、纤维二糖 12.27、麦芽糖 1.56、葡萄糖 0.36。
1.3 培养基
活化培养基:Mandels培养基[3]。
产酶培养基(g/L):淀粉水解液糖浓 6.5(以水解液中二糖质量浓度计,下同)、葡萄糖 1、蛋白胨 1、硫酸铵 1.83、尿素 0.3、 KH2PO42、 MgSO40.3、 CaCl20.3、 FeSO4·7H2O 0.005、 MnSO4·H2O 0.001 6、 ZnSO4·7H2O 0.001 4、 CoC12·6H2O 0.003 7,吐温80 2ml/L,添加柠檬酸缓冲液使pH值在 (4.8±0.1)。
1.4 纤维素酶的制备
里氏木霉Rut C30斜面上的孢子接种于装有50 mL活化培养基的250 mL锥形瓶中,在30 ℃、 170 r/min培养36 h。活化好的菌丝按接种量10 %(体积分数)接入装有50 mL产酶培养基的250 mL三角瓶中,于170 r/min的摇床中培养。产酶第1天温度控制在30 ℃,第2天之后控制在28 ℃。纤维素酶的生产按3种方式进行操作。
1.5 产酶方式
1.5.1 分批补料产酶 每天每升产酶液中补加4 g微晶纤维素、 1 g淀粉水解低聚糖、 1.09 g硫酸铵和0.24 g尿素,连续培养10 d,然后5 000 r/min离心,取上清液即为所得酶液(试样号0-0)。
1.5.2 间歇出酶 在分批补料的基础上从第4天到第8天进行间歇出酶,间歇出酶采用3种方式,每种方式做3个平行样,培养10 d后,5 000 r/min离心,取上清即所得酶液。3种出酶方式如下: 1)第4天开始每天离心将上清液取出15 %(按体积算)剩余部分倒入锥形瓶即出酶15 %,同时补充相同体积的填补液(培养基,下同),然后放入摇床继续培养(试样号1-15),其它出酶量同此操作; 2)从第4天开始每2天出酶,每次出酶量为30 %(按体积算),同时在取出后补充相同体积的填补液,然后放入摇床继续培养(试样号2-30),其它出酶量同此操作; 3)从第4天开始每3天出酶,每次出酶量为45 %(按体积算),同时在取出后补充相同体积的填补液,然后放入摇床继续培养(试样号3-45),其它出酶量同此操作。
1.5.3 间歇出酶出菌丝 间歇出酶出菌丝是在分批补料间歇出酶的情况下进行,如果取出酶液和菌丝的量一样,只要直接摇匀取出所需要量的发酵液,然后填补相同体积的填补液,然后放入摇床继续培养。如果取出酶液量和菌丝量不一样,菌丝体的量多于酶,取出所需要体积的菌丝量的发酵液高速离心后将多于酶液体积的部分的上清液返回摇瓶,填补相同体积的填补液,然后放入摇床继续培养。培养10 d后, 5 000 r/min离心,取上清液即为所得酶液。3种出酶出菌丝方式如下: 1)第4天开始每天离心将上清液取出 15 %(按体积算)剩余部分倒入锥形瓶即出酶 15 %,无菌丝取出,同时补充相同体积的填补液(培养基,下同),然后放入摇床继续培养(试样号1-15-0),其它间歇时间及出酶量同此操作; 2)从第4天开始每天出酶,将酶液和菌丝混匀直接取出15 %(按体积算)的发酵液,在取出后补充相同体积的填补液,然后放入摇床继续培养(试样号1-15-15),其它间歇时间及出酶出菌丝量同此操作; 3)从第4天开始每天出酶,每次出酶量为15 %(按体积算),同时将50 %的菌丝取出,在取出后补充相同体积的填补液,然后放入摇床继续培养(试样号1-15-50),其它间歇时间及出酶出菌丝量同此操作。
1.6 酶水解性能测定
对1.5节3种生产方式所生产的纤维素酶和商品酶进行酶解性能测定,酶解条件如下:酶水解底物为稀HCl预处理玉米秸秆,酶解底物质量浓度为5 g/L,纤维素酶用量为20 FPU/g(以纤维素计),酶解体系为50 mL,用1 mol/L柠檬酸缓冲液调节pH值到4.8, 50 ℃,150 r/min下振荡培养48 h。酶解得率计算式为:
酶解得率=还原糖质量×0.9/纤维素质量×100 %
1.7 分析方法
1.7.1 酶活测定 纤维素酶的活性用滤纸酶活力测定[4]。一个滤纸酶活力的国际单位(FPU)定义为:在标准反应条件下每分钟生成 1 μmol 葡萄糖所需的酶量。
β-葡萄糖苷酶酶活使用4-硝基苯基-β-D-吡喃葡萄糖苷测定[4]。一个β-葡萄糖苷酶活力单位(U)定义为:每分钟水解生成1 μmol对硝基苯酚所需要的酶量。
1.7.2 糖质量浓度测定 葡萄糖和纤维二糖的测定采用Agilent technology 1100 series,高效液相色谱系统。待测样品经10 000 r/min离心10 min,上清液经离心后过0.22 μm滤膜。在Agilent 1100型高效液相色谱仪上,采用Bio-Rad Aminex HPX-87H(300 mm×7.8 mm)色谱柱,0.005 mol/L硫酸作为流动相,流速为0.6 mL/min,检测器采用视差折光检测器,进样量为10 μL。外标法测定糖组分质量浓度。
1.7.3 菌丝质量浓度测定 测里氏木霉菌丝浓度。由于固体纤维素和菌丝同时存在,无法用称重法测定菌丝。为避免固体纤维素干扰[5],对细胞内蛋白质浓度进行测定,发酵液离心后,收集固体量的25 %并用蒸馏水洗涤两次。将固体转移入15 mL 0.2 mol/L的NaOH中,在100 ℃煮沸20 min[6]。然后使用标准Bradford法[7]测细胞内蛋白质质量浓度以此推算菌丝质量浓度。在595 nm处的吸光度以分光光度计测定。菌丝质量浓度(g/L)按下式计算:
菌丝质量浓度=细胞内蛋白质质量浓度×6.886-0.192
2 结果与讨论
2.1 间歇出酶对产酶的影响
2.1.1 间歇出酶方式的影响 按1.5.2节的操作进行间歇出酶,间歇出酶量选择10 %~20 %(每天,试样号1-10、 1-15和1-20)、 20 %~40 %(每2天,试样号2-20、 2-30和2-40)、 40 %~50 %(每3天,试样号3-40、 3-45和3-50),结果见表1。
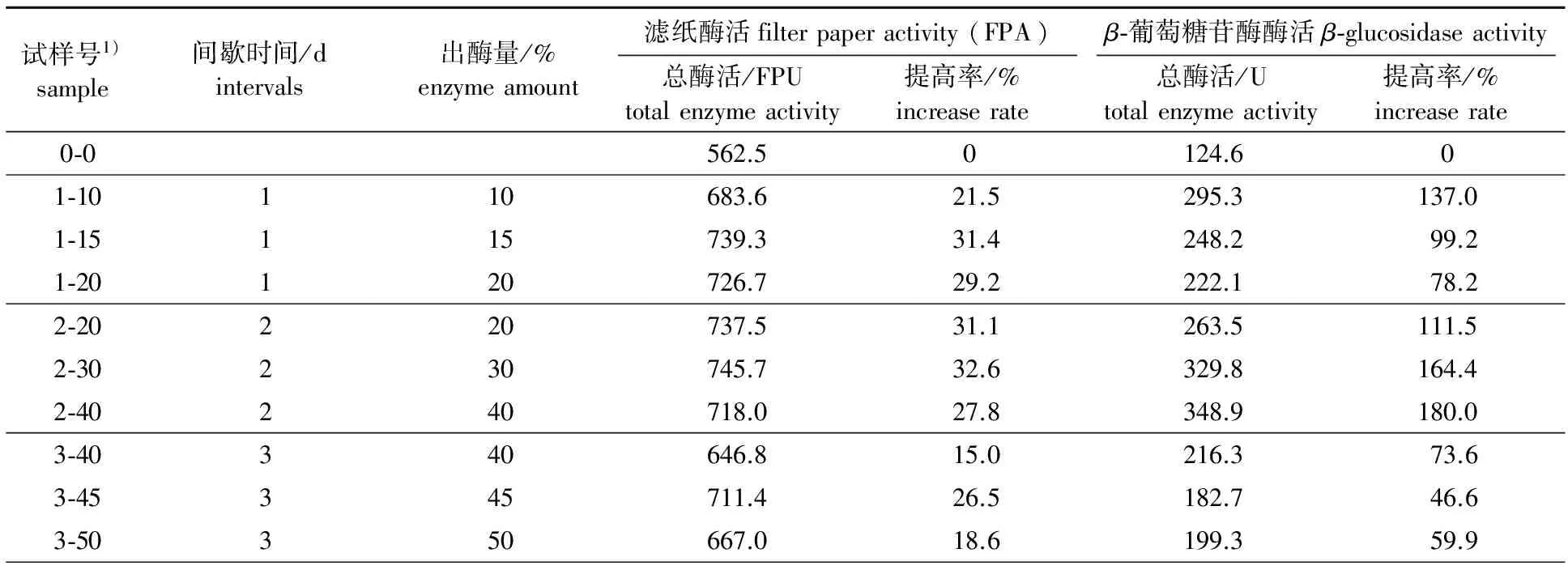
表 1 间歇出酶方式对补料纤维素酶生产的影响
1)0-0:对照样,为分批补料方式生产纤维素酶 ,下表同control,fed-batch process,similarly hereinafter
如表1所示,3种方式的间歇出酶都增加了纤维素酶的总酶活。由此可见,间歇出酶可以提高里氏木霉产纤维素酶的能力。当每天回收10 %~20 %的酶液时,总的纤维素酶酶活和分批补料(对照样0-0)相比提高21.5 %~31.4 %。其中每天回收15 %的酶液时总酶活提高率最大,可以达到31.4 %,同样每2天或者每3天使总酶活提高量最大的出酶量分别为30 %和45 %,提高率可以达到32.6 %和26.5 %。由此可以看出,间歇出酶有利于纤维素酶的生产,出酶量的大小对产酶量影响较大。
由表1数据可以看出,合理的出酶量为平均每天回收15 %,即从培养第4天开始每天出酶15 %(1-15)、每2天出酶30 %(2-30)、每3天出酶45 %(3-45),在培养结束时总酶活提高率可达到26.5 %~32.6 %。因此,每隔一段时间取出部分酶液并没有对菌丝生长和酶的生产造成不利影响。
目前,许多学者采用的发酵方式是分批补料式培养。例如,Ahamed等[8]用高浓度纤维素、乳糖和乳糖酸的混合物为碳源,用分批补料的培养方式生产纤维素酶最后得到酶产量为5.02 FPU/mL,菌丝浓度达到14.7 g/L。Dos Reis等[9]用40 g/L的纤维素为主要碳源,辅加以蔗糖、豆粕、小麦麸等,分批补料7 d以后可以得到8.3 FPU/mL的酶活。在培养期间,许多因素可能对酶蛋白产生负面影响,使酶活降低。发酵液长时间的受剪切力、酶与纤维素等固形物的碰撞、气液接触的影响以及产物抑制等会对酶蛋白产生损害从而影响纤维素酶的生产[10]。在本研究中,在分批补料生产纤维素酶的基础上采用间歇出酶技术很大程度上避免了β-葡萄糖苷酶长期留在摇瓶中所带来的负面影响,保护了酶蛋白,有利于长期产酶。由结果可以看出,与对照组相比,纤维素酶酶活提高了18.6 %~32.6 %,证明该方法可行。
间歇出酶也有利于β-葡萄糖苷酶的生产,具体亦见表1。由表1可知,经过10 d的培养,分批补料(对照)生产的总β-葡萄糖苷酶的酶活为124.6 U,而当采用间歇出酶方式生产纤维素酶后,β-葡萄糖苷酶酶活有显著提高,其总β-葡萄糖苷酶活均达到了182 U以上,与分批补料生产(对照)相比,总酶活提高率均高达46 %以上,其中以每2天出酶这种培养方式提高最为明显。
里氏木霉被认为不善于产β-葡萄糖苷酶。有研究显示,低聚糖,特别是龙胆二糖,被认为是β-葡萄糖苷酶的良好诱导剂。Juhász等[11]用Solka Floc 200和乳糖作为诱导物对β-葡萄糖苷酶诱导,在培养7 d后最高β-葡萄糖苷酶酶活可达到1.4 U/mL。也有人为节省成本,用廉价的玉米秸秆为碳源诱导里氏木霉生产β-葡萄糖苷酶,其酶活最高也可达到1.31 U/mL[12]。在本研究中,淀粉水解液中含有低聚糖,如龙胆二糖、纤维二糖和麦芽糖,可以用作碳源诱导纤维素酶和β-葡萄糖苷酶。分批补料培养(对照)β-葡萄糖苷酶酶活达到124.6 U,而间歇出酶产β-葡萄糖苷酶酶活最高可达348.9 U。因为β-葡糖苷酶具有较高的分子质量,很容易在长时间培养中变质,而酶定期回收可以有效保护β-葡萄糖苷酶,这可能是在回收酶后β-葡萄糖苷酶和纤维素酶总酶活提高的原因。
2.1.2 间歇出酶填补液的影响 在此研究中,出酶是指在离心后取出一定量的培养液,菌丝残渣返回摇瓶,随后加入一定量培养基作为填补液补足体系继续培养。为了检测填补液的pH值和营养盐对酶生产的影响,将培养基成分分为3种类型的填补液即水、0.05 mol/L柠檬酸盐缓冲液(pH值4.8)和营养盐(FeSO4·7H2O、 MnSO4·H2O、 ZnSO4·7H2O和CoCl2·6H2O,质量浓度同1.3节),其对纤维素酶生产的影响如表2所示。
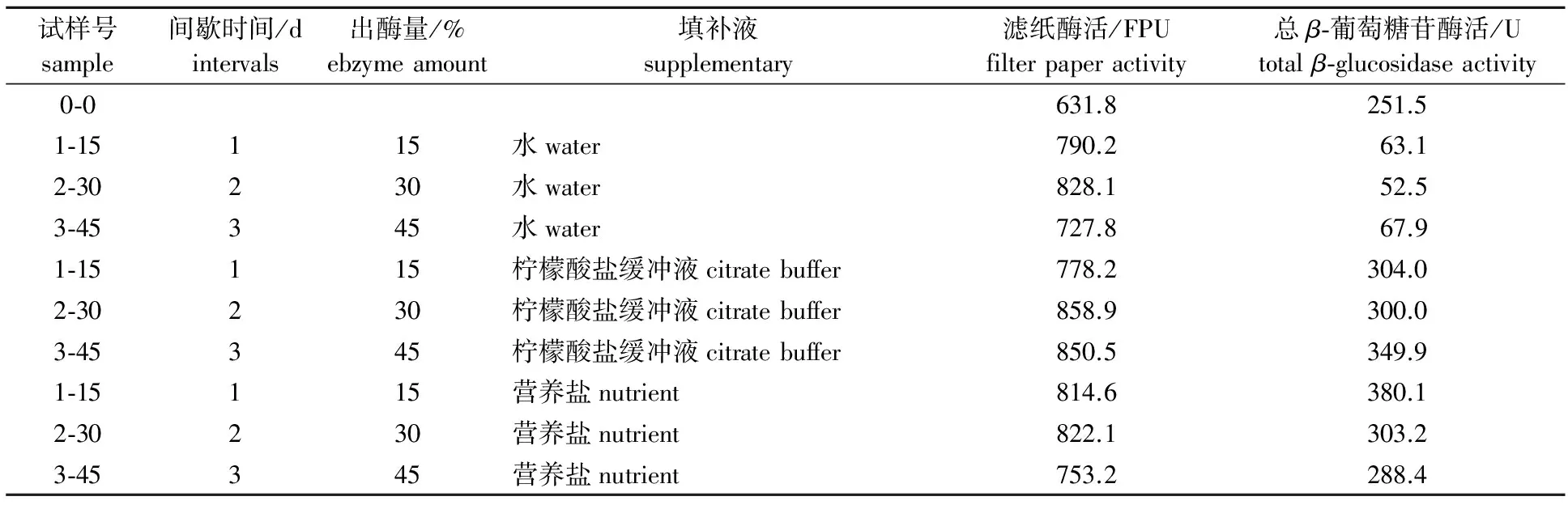
表 2 间歇出酶过程中不同填补液对纤维素酶生产的影响
由表2可知,采用间歇出酶培养方式产酶,纤维素酶总酶活均有较大提高,尤其是当平均每天出酶量为15 %时,无论哪种填补液总纤维素酶活都比对照提高了25 %~35 %,可见填补液的pH值和营养盐对纤维素酶生产的影响很小,但是β-葡萄糖苷酶在填补液是0.05 mol/L柠檬酸缓冲液和营养盐时提高不少,而用水做填补液时总β-葡萄糖苷酶活较对照样明显降低。这可能是因为β-葡萄糖苷酶对pH值和营养盐较敏感。可见培养基填补液中柠檬酸缓冲液和营养盐溶液能有效地控制pH值并提供相应的营养物质,有利于β-葡萄糖苷酶合成。
2.2 间歇出酶出菌丝对产酶的影响
2.2.1 对产纤维素酶和β-葡萄糖苷酶的影响 分批出酶是将部分酶液取出并将菌丝返回到培养液继续培养,这样的大规模的操作会有染菌的风险。既然在补料前大部分碳源和氮源已经耗完(通过对产酶酶液中的糖进行分析得知),那就可以考虑是否可以在出酶时将部分菌丝一并带出,这样既保证了无杂菌感染又可以保证不会因为碳源过早消耗尽而对产酶有影响。间歇出酶出菌丝按1.5.3节中的操作步骤进行,在出酶时带出的菌丝将不会被倒入摇瓶继续产酶,以培养基为填补液,补加量和出酶量一致,连续培养10 d。表3给出了间歇出酶出菌丝对产酶的影响。
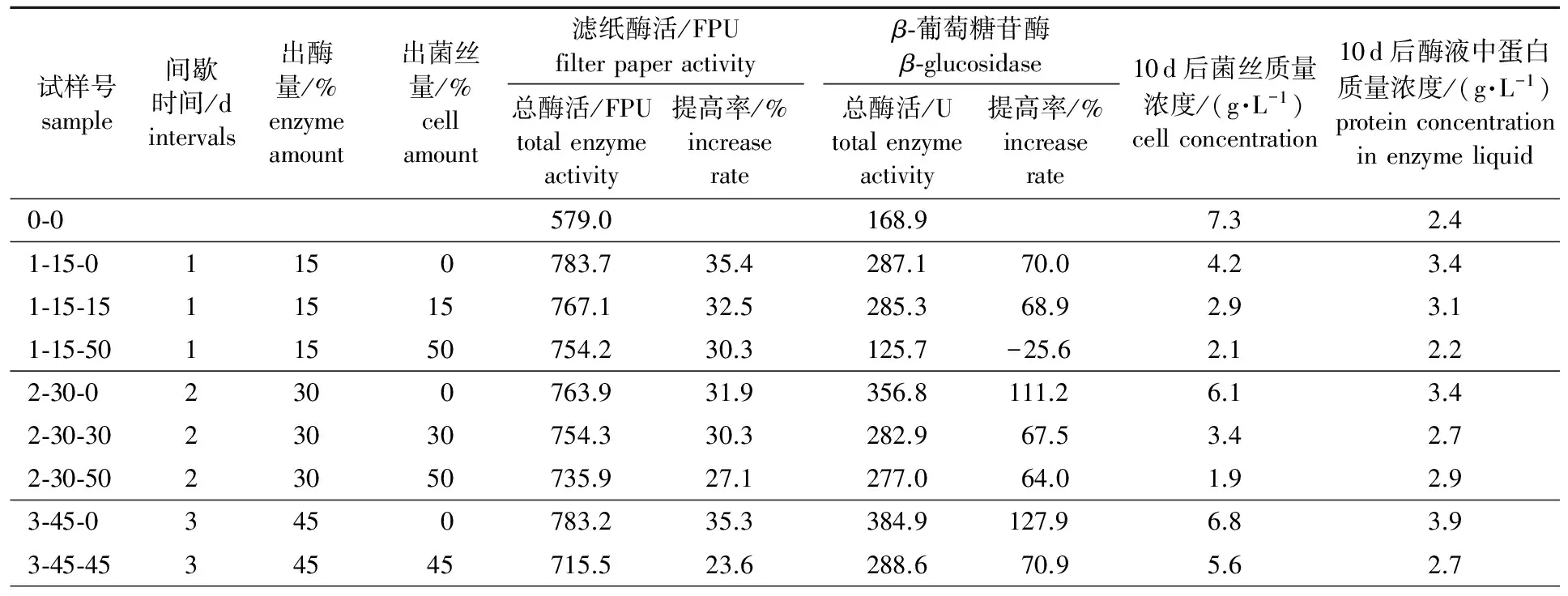
表 3 间歇出酶出菌丝对产酶及菌丝的影响
如表3所示,纤维素酶总酶活提高率为23.6 %~35.4 %,但是出菌丝量不同对酶的生产还是有影响的。当每天出15 %酶液,不出菌丝时,纤维素酶总酶活较对照样提高了35.4 %,而当出相同量的菌丝时,纤维素酶总酶活提高了30 %左右,β-葡萄糖苷酶提高了60 %以上;总β-葡萄糖苷酶酶活最大达到287.1 U相当于3.3 U/mL,其比Sukumaran等[13]同样用里氏木霉生产纤维素酶所报告的1.72 U/mL更高;尽管如此,如果每天取出50 %的菌丝体,β-葡萄糖苷酶的产量明显低于对照。这表明菌丝浓度控制酶的生产,特别是对于β-葡萄糖苷酶。将少量的菌丝体丢弃对纤维素酶生产并未产生明显影响,还具有方便生产和降低染菌的优点。重复2~3次测试均是类似的结果。
2.2.2 对产酶菌丝和蛋白浓度的影响 表3还给出了分批补料生产10 d后蛋白和菌丝质量浓度的变化。纤维素的存在极大地干扰菌丝体浓度的测定,不同研究者采用不同的方法去解决这个问题,例如用氢氧化钠溶解细胞测蛋白质浓度[6,14]、高氯酸[15]或超声波的方法[16]、 DNA含量的测定[17]和用乙酸与硝酸的混合物去除菌丝体细胞[18]等方法。本研究采取的是氢氧化钠溶解细胞测蛋白质的方法。由表3所示,无论是分批补料、出酶还是出菌丝其蛋白质量浓度均控制在2.2~3.9 g/L,然而菌丝质量浓度却有显著差异。对照试验,即分批补料培养未进行出酶,最终菌丝质量浓度 7.3 g/L,当每天出15 %酶液,最终菌丝质量浓度降低到4.2 g/L(无菌丝去除)和2.9 g/L(15 %的菌丝体去除),而纤维素酶总酶活的增加量分别为35.4 %和32.5 %。然而,如果除去50 %的菌丝体,则该菌丝质量浓度下降到 2.1 g/L。虽然纤维素酶的产量并没有受到太大影响但是β-葡萄糖苷酶酶活大量减少。每2天和每3天出酶的样品也有类似趋势。由此可见,虽然分批补料菌丝较多,但是产酶能力不见得是最好,而当部分菌丝取出,菌丝质量浓度维持在3~4 g/L时,产酶能力较好。
Ahamed等[8]使用50 g/L的纤维素、 10 g/L葡萄糖和10 g/L酵母提取物作为起始碳源,在7 L生物反应器分批补料培养里氏木霉Rut C30,5 d后得到纤维素酶酶活5.02 U/mL,菌丝质量浓度为9 g/L。Mohagheghi等[19]用木糖和纤维素为碳源分批补料培养里氏木霉10~14 d,其纤维素酶活可达到12~12.5 FPU/mL,菌丝质量浓度达到16 g/L。虽然碳源和氮源的连续补给有利于细胞的增殖,但是由本研究上述结果可知分批补料所产生的高浓度的菌丝对产酶并不是都有促进作用。出酶和出菌丝可以使菌丝保持在一个相对合理的浓度,例如本实验中3~4 g/L的菌丝就足够维持产酶。该培养方法的优点在于不仅可以增强酶的生产率,也降低了冗余的真菌细胞对碳源和氮的消耗。
2.3 纤维素酶对稀盐酸预处理玉米秸秆的水解性能
为了评估各种纤维素酶的水解能力,对3 种自产纤维素酶酶解盐酸预处理的玉米性能进行了研究,并和商品酶Celluclast作对比,结果见表4。
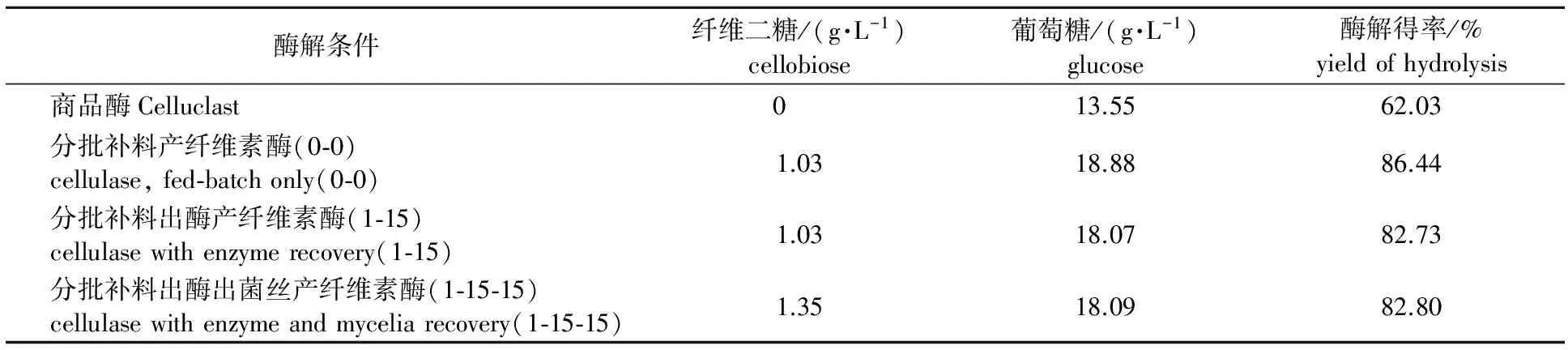
表 4 不同纤维素酶酶解48 h后酶解得率比较
从表4看出, 3种自产酶的酶解能力都比商品酶好。商品酶酶解48 h后酶解得率仅为62.03 %,而分批补料生产的自产酶酶解得率为86.44 %,比商品酶提高了39 % 。间歇出酶和间歇出酶出菌丝的酶解得率也都高达82.73 %和82.80 %,与商品酶相比均提高34 %以上。上述研究表明,3种酶制剂的水解能力几乎相同。这表明,分批补料生产中采用间歇出酶或者间歇出酶出菌丝的生产方式都能提高纤维素酶酶活,并且这些操作并未影响酶的水解能力,酶仍然有很好的酶解性能。钟健等[20]用特异腐质霉所产的中性纤维素酶并添加葡萄糖苷酶和木聚糖酶酶解汽爆玉米秸秆120 h后,其纤维素水解得率为64.9 %,该种纤维素酶的酶解性能远小于本研究所产的纤维素酶。而本研究自产纤维素酶是内切葡聚糖酶、纤维二糖水解和β-葡萄糖苷酶的复合物,木质纤维原料转化成可利用的糖是由纤维素酶不同组分酶的协同作用完成的。张伟等[21]用里氏木霉产纤维素酶酶解碱处理小麦秸秆,当酶投加量为35 FPU/g(以玉米秸秆质量计),水解96 h,最高酶水解得率为60.73 %,远低于本研究的自产纤维素酶的酶解得率,说明本研究自产的纤维素酶具有较好的酶解性能。
3 结 论
3.1 以微晶纤维素和淀粉水解液作为碳源生产纤维素酶,在里氏木霉(Trichodermareesei)Rut C30分批补料生产纤维素酶的过程中,间歇出酶和间歇出酶出菌丝的生产方式都有利于纤维素酶的生长。当每天取出酶液量平均为15 %时,与对照样相比,总纤维素酶酶活提高26.5 %~32.6 %,总β-葡萄糖苷酶酶活提高46 %以上。
3.2 采用间歇出酶出菌丝方式时,当出酶同时取出适量菌丝使菌丝质量浓度保持在3~4 g/L时,里氏木霉的产酶能力较好,同时,菌丝的适当去除也降低了冗余的真菌细胞对碳和氮的消耗。
3.3 对采用3种方式自产的纤维素酶进行酶解性能研究,结果显示:与商品酶Celluclast的酶解性能对比,自产纤维素酶对盐酸预处理的玉米秸秆的酶解能力相当,且预处理玉米秸秆的酶解得率均超过80 %,远高于商品酶的酶解能力(62.03 %)。
[1]BERNDERS G,HANSSON J. Bioenergy expansion in the EU:Cost-effective climate change mitigation,employment creation and reduced dependency on imported fuels[J]. Energy Policy,2007,35(12):5965-5979.
[2]BAILEY M J,TAHTIHARJU J. Efficient cellulase production byTrichodermareeseiin continuous cultivation on lactose medium with a computer-controlled feeding strategy[J]. Applied Microbiology and Biotechnology,2003,62(2/3):156-162.
[3]MANDELS M,MEDEIROS J E,ANDREOTTIR E,et al. Enzymatic hydrolysis of cellulose:Evaluation of cellulase culture filtrates under use conditions[J]. Biotechnology and Bioengineering,1981,23(9):2009-2026.
[4]GHOSE T K. Measurement of cellulase activities[J]. Pure and Applied Chemistry,1987,59(2):257-268.
[5]OHNISHI S T,BARRJ K. A simplified method of quantitating protein using the biuret and phenol reagents[J]. Analytical Biochemistry,1978,86(1):193-200.
[6]ZHANG Q,LO C M,JU L K. Factors affecting foaming behavior in cellulase fermentation byTrichodermareeseiRut C-30[J]. Bioresource Technology,2007,98(4):753-760.
[7]BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1):248-254.
[8]AHAMED A,VERMETTE P. Culture-based strategies to enhance cellulase enzyme production fromTrichodermareeseiRUT-C30 in bioreactor culture conditions[J]. Biochemical Engineering Journal,2008,40(3):399-407.
[9]DOS REIS L,FONTANA R C,DA SILVA DELABONA P,et al. Increased production of cellulases and xylanases byPenicilliumechinulatumS1M29 in batch and fed-batch culture[J]. Bioresource Technology,2013,146:597-603.
[10]GUNJIKAR T P,SAWANT S B,JOSHI J B. Shear deactivation of cellulase,exoglucanase,endoglucanase,andβ-glucosidase in a mechanically agitated reactor[J]. Biotechnology Progress,2001,17(6):1166-1168.
[12]赵士明,陆青山,谷峰,等. 绿液预处理玉米秸秆产纤维素酶的研究[J]. 生物质化学工程,2012,46(3):13-19.
[13]SUKUMARAN R K,SINGHANIA R R,MATHEW G M,et al. Cellulase production using biomass feed stock and its application in lignocellulose saccharification for bio-ethanol production[J]. Renewable Energy,2009,34(2):421-424.
[14]OHNISHI S T,BARR J K. A simplified method of quantitating protein using the biuret and phenol reagents[J]. Analytical Biochemistry,1978,86(1):193-200.
[15]YU X B,YUN H S,KOO Y M. Production of cellulase byTrichodermareeseiRut C30 in wheat bran-containing media[J]. Journal of Microbiology and Biotechnology,1998,8(3):208-213.
[16]JUN H,BING Y,KEYING Z,et al. Strain improvement ofTrichodermareeseiRut C-30 for increased cellulase production[J]. Indian Journal of Microbiology,2009,49(2):188-195.
[17]GHOSE T K,SAHAI V. Production of cellulases byTrichodermareeseiQM 9414 in fed-batch and continuous-flow culture with cell recycle[J]. Biotechnology and Bioengineering,1979,21(2):283-296.
[18]AHAMED A,VERMETTE P. Enhanced enzyme production from mixed cultures ofTrichodermareeseiRUT-C30 andAspergillusnigerLMA grown as fed batch in a stirred tank bioreactor[J]. Biochemical Engineering Journal,2008,42(1):41-46.
[19]MOHAGHEGHI A,GROHMANN K,WYMAN C E. Production of cellulase on mixtures of xylose and cellulose in a fed-batch process[J]. Biotechnology and Bioengineering,1990,35(2):211-216.
[20]钟健,岳洋,石家骥,等. 中性纤维素酶糖化中性汽爆玉米秸秆工艺优化[J]. 生物质化学工程,2013,47(2):9-14.
[21]张伟,张琦,阮馨怡,等. 响应曲面法优化小麦秸秆纤维素酶水解条件[J]. 生物质化学工程,2015,49(2):39-46.
Influence of Periodic Enzyme and Mycelia Recovery on Cellulase Production by Trichoderma reesei
JIANG Lu, WANG Bu-cheng, BAI He-chao, YONG Qiang, YU Shi-yuan
(Key Laboratory of Forest Genetics & Biotechnology,Ministry of Education,Nanjing Forestry University, Nanjing 210037, China)
The cellulase was produced by fed-batch cultivation ofTrichodermareeseiRut C30 with microcrystalline cellulose and starch hydrolysate as carbon source under the protection of periodic enzyme recovery.The results showed that after three days of fed-batch cultivation,cellulase was partially recovered 15 %,30 % or 45 % at every 1,2 or 3 days.The total enzyme activites of cellulase andβ-glucosidase obtained by the methods significantly increased by 26.5 %-32.6 % and over 46 % more than that of fed-bath.Mycelia could also be removed to avoid infection.When enzymes were recovered 15 % every day, the cellulase production increased by 35.4 % (without mycelia removal) and 32.5 % (with 15 % mycelial removal) compared with those of normal fed-batch cultivation.A high hydrolytic ability of the produced cellulase with enzyme and mycelia recovery was also detected and the hydrolysis efficiency could reach more than 82 %,far more than that of Celluclast(62.03 %).
cellulase;fed-batch culture;β-glucosidase;Trichodermareesei
2016-01-06
“十二五”国家科技支撑计划资助(2015BAD15B09)
蒋 露(1990— ),女,江苏宜兴人,硕士生,研究方向为生物质能源科学与技术;E-mail:544915512@qq.com
*通讯作者:余世袁,教授,博士生导师,主要从事生物质能源转化研究;E-mail:syu@njfu.edu.cn。
10.3969/j.issn.1673-5854.2016.06.008
TQ351
A
1673-5854(2016)06-0049-07
