废弃虾壳制备改性甲壳素凝胶球及其对金属离子的吸附性能
2016-12-13钱建瑛丁振中史劲松
钱建瑛, 丁振中, 杨 涛, 李 恒, 史劲松
(1. 江南大学 药学院, 江苏 无锡 214122; 2. 扬州日兴生物科技股份有限公司, 江苏 扬州 225601)
·研究报告——生物质材料·
废弃虾壳制备改性甲壳素凝胶球及其对金属离子的吸附性能
钱建瑛1, 丁振中2, 杨 涛1, 李 恒1, 史劲松1
(1. 江南大学 药学院, 江苏 无锡 214122; 2. 扬州日兴生物科技股份有限公司, 江苏 扬州 225601)
以虾壳酶解残渣为原料,经5 %盐酸脱钙处理4 h后,用45 %氢氧化钠和460 W微波辅助脱乙酰处理10 min,得到脱乙酰度为40.4 %的改性甲壳素。将改性甲壳素加入海藻酸钠水溶液中混合均匀,挤压滴入氯化钙水溶液中固化12 h,制备得到直径为1.5~3.2 mm的凝胶小球,研究了该凝胶球对Pb2+、 Cr3+、 Ni2+、 Cu2+、 Co2+和Zn2+的吸附效果。结果表明:凝胶球对Cu2+、 Co2+和Zn2+的吸附效果最好, 300 mg/L重金属离子溶液吸附处理8 h是较适宜的吸附条件,此条件下, Cu2+、 Co2+和Zn2+的吸附率分别达到94.2 %、75.6 %和57.3 %。在Cu2+-Co2+-Zn2+共存溶液体系中,凝胶球对3种离子的吸附率均有所提高, Cu2+、 Co2+和Zn2+的吸附率分别为95.1 %、 82.5%和67.5 %。
改性甲壳素;金属离子;吸附性能
随着人类社会生活的进步,随之而来的污染问题也越来越严重,其中水体污染在环境污染中占据相当大的比例[1]。污染水体的重金属离子、染料、有机物等以多种物理和化学形态存在,并不断产生迁移和累积,严重影响着人类的生命健康及正常的生活[2]。因此,重金属离子污染的治理已成为研究热点。重金属污染可采用稀释法、絮凝沉淀法、吸附法、生物修复法等进行处理,其中吸附法的使用最为广泛,除了采用石灰、碳酸钙、淀粉磺酸酯以及单宁含量高的农产品残渣(如花生皮和胡桃皮粉)之外,甲壳素及其衍生物类也是良好的吸附剂之一。甲壳素在节肢动物(如虾和蟹)中大量存在,分布广泛,每年生物合成的甲壳素有10亿吨之多[3],在自然界中的储量仅次于纤维素。甲壳素分子中含有大量氨基与羟基,可通过离子交换、螯合等方式与染料、重金属离子等进行作用,在处理含有有机物、重金属离子、染料等污染成分的废水时有较好的表现[4-8]。由于甲壳素及其脱乙酰所得的壳聚糖在C2上有一个乙酰氨基或氨基,在C3上有一个羟基,羟基可以螯合重金属离子,氨基质子化后也可以吸附重金属离子,因此甲壳素和壳聚糖都能有效吸附溶液中的Cd2+、 Zn2+、 Ni2+、 Cu2+、 Ag+、 Au3+、 Pt4+、 Pd2+等[9]。王文全等[7]研究了从卤虫卵壳中提取并处理后的粗甲壳素对重金属离子(Cd2+、 Cu2+、 Zn2+、 Pb2+)的吸附性能,发现其吸附效果优于活性炭,对质量浓度为200 mg/L的Pb2+和Cu2+的吸附率达到98.32 %和84.91 %。然而,天然甲壳素中的氨基几乎全部被乙酰化,活性没有得到充分体现,可采取碱处理方法对甲壳素进行脱乙酰化处理,增强其生物活性[10-12]。当脱乙酰度在55 %以上时,甲壳素就转化为壳聚糖。壳聚糖对重金属离子的吸附作用强,但是其制备过程中需要使用大量的酸和碱,对环境污染严重。再者,壳聚糖作为吸附性材料使用时,首先需要进行溶解,然后再加入到水体中,使其絮凝,再通过过滤、离心的方式分离出絮凝物[13],处理过程复杂,对固液分离设备要求较高。此外,壳聚糖的使用是一次性的,使用成本相对较高。这些方面都制约了壳聚糖的应用,因此,需要开发出基于甲壳素的酸碱用量少、生产过程污染低、能重复使用的改性吸附剂。本研究以虾壳酶解后的残渣为原料,经洗涤、脱钙及适当脱乙酰处理,获得改性甲壳素,将其与海藻酸钠混合复配制备凝胶球作为新型的重金属离子吸附剂,进一步分析了凝胶球对重金属离子的吸附性能,以期为甲壳素制备重金属离子吸附剂提供新的途径。
1 实 验
1.1 材料
虾壳,江苏戚伍水产股份有限公司虾仁生产车间的废弃物,用自来水漂洗2遍,沥干后用电热鼓风干燥箱105 ℃加热4 h烘干;氢氧化钠、盐酸、海藻酸钠、氯化钙、甲基橙、苯胺蓝、二水合乙酸锌、六水合硫酸镍、五水合硫酸铜、三水合乙酸铅、重铬酸钾、六水合氯化钴均为分析纯,国药集团化学试剂有限公司;碱性蛋白酶, 5 000 U/g,江苏博立生物科技有限公司。
1.2 样品的制备
1.2.1 虾壳酶解 干燥虾壳粉碎至粒径0.9 mm以下,配成质量浓度为20 g/L的混悬液,加入100 U/mL的碱性蛋白酶,以0.1 mol/L NaOH溶液调节pH值至8.5,60 ℃反应6 h,过滤,取残渣[14]。
1.2.2 改性甲壳素的制备 将虾壳酶解残渣用水洗涤3次,纱布过滤后置于烘箱中烘干备用。将烘干后样品与一定浓度的盐酸按固液比1∶5(g∶mL,下同)混合,搅拌混匀后,静置处理一定时间以脱除残渣中的钙。处理结束,将样品洗涤至中性,烘干后测定其灰分。然后将样品按照固液比1∶5浸泡于质量分数30 %~60 %的氢氧化钠溶液中,在460 W微波辅助下脱乙酰处理一段时间后,沥干,再用少量水洗涤至中性,固液分离获得改性甲壳素, 105 ℃下烘干,测其脱乙酰度。
1.2.3 海藻酸钠-改性甲壳素凝胶球的制备 将改性甲壳素用粉碎机粉碎成粒径为100~250 μm的细粉,取细粉20 g,加入到质量分数1 %的海藻酸钠水溶液中,搅拌使其混合成均匀的溶液,挤压滴入质量分数5 %氯化钙溶液中固化12 h,获得海藻酸钠-改性甲壳素凝胶小球。取10粒凝胶球排列成一排,用标尺测量其总长,计算小球平均直径,重复数次,确定凝胶小球直径为1.5~3.2 mm。
1.3 分析方法
1.3.1 灰分的测定 甲壳素的灰分参照GB 5009.4—2010进行测定。
1.3.2 脱乙酰度测定 改性甲壳素的脱乙酰度参考文献[15]测定。准确称取在105℃烘干至质量恒定的改性甲壳素样品0.3~0.5 g,置于250 mL三角瓶中,加入0.1 mol/L盐酸标准溶液30 mL,在20~25 ℃搅拌至完全溶解,加入2~3滴混合指示剂(1 %甲基橙和1 %苯胺蓝按体积比1∶2混合),用0.1 mol/L氢氧化钠标准溶液滴定。计算公式如下:
N=(C1V1-C2V2×0.016)/m×100 %
(1)
D=N/9.94
(2)
式中:N—含自由氨基的量,%;C1—盐酸标准溶液的浓度,mol/L;C2—氢氧化钠标准溶液的浓度,mol/L;V1—加入的盐酸标准溶液体积,mL;V2—滴定耗用的氢氧化钠标准溶液体积,mL;m—样品质量,g;D—脱乙酰度,%。
1.4 海藻酸钠-改性甲壳素凝胶球吸附效果的测定
1.4.1 吸附重金属离子 分别取0.1 g凝胶球置于6个150 mL三角瓶中。配制质量浓度为300 mg/L的Pb2+、 Zn2+、 Cr3+、 Ni2+、 Co2+和Cu2+水溶液,并分别取100 mL加入到含有凝胶球的三角瓶中,在恒温培养箱中室温处理8 h。另取0.08 g改性甲壳素同样条件下吸附作为对照。处理结束后,将溶液稀释一定倍数后,用岛津AA-7000原子吸收分光光度计检测溶液中各离子的残余浓度。按式(3)计算改性甲壳素及海藻酸钠-改性甲壳素凝胶球对重金属离子的吸附率,按式(4)计算凝胶球对重金属离子的吸附量:
y=(C-C′)/C×100 %
(3)
Q=(C-C′)×V/m
(4)
式中:y—吸附率,%;Q—吸附量,mg/g;C—重金属离子的初始质量浓度,mg/L;C′—吸附完成后重金属离子的残余质量浓度,mg/L;V—重金属离子溶液体积,L;m—凝胶球质量,g。
1.4.2 离子浓度对吸附效果的影响 分别配制质量浓度为50~400 mg/L的Zn2+、 Co2+和Cu2+溶液,各取100 mL加入到三角瓶中,分别加入0.1 g凝胶球,用凝胶球处理各浓度离子溶液6 h。处理结束,将溶液稀释一定倍数后,用原子吸收分光光度计检测溶液中各离子的残余浓度。
1.4.3 吸附时间对吸附效果的影响 分别配制300 mg/L的Zn2+、 Co2+、 Cu2+溶液以及铜-钴-锌离子共存的溶液体系,各取100 mL加入到三角瓶中,分别加入0.1 g凝胶球,用凝胶球处理后,将溶液稀释一定倍数,用原子吸收分光光度计检测溶液中各离子的残余浓度。其中,铜-钴-锌共存溶液体系的吸附实验是将Cu2+、 Co2+和Zn2+质量浓度均为300 mg/L的溶液,用3倍量的凝胶小球处理8 h,稀释溶液后测定3种离子各自的残余浓度。
2 结果与讨论
2.1 脱钙效果的分析
脱钙是由虾壳残渣制备改性甲壳素或壳聚糖的必要步骤,操作中盐酸浓度和酸处理时间对脱钙效果有明显影响。因酶解后的虾壳残渣几乎只含钙盐(以碳酸钙为主)和甲壳素,因此可以用测定灰分含量的方法来监测钙盐的脱除情况[16]。使用不同质量分数的盐酸溶液按固液比1∶5处理虾壳残渣3 h后,灰分测定结果如图1(a)所示,随着盐酸质量分数从1 %增加到5 %,灰分不断降低;盐酸质量分数在5 %时,灰分降到最低,为4.82 %,之后盐酸质量分数继续增加,甲壳素灰分含量不再降低。因此,盐酸质量分数选择5 %。
采用5 %盐酸以固液比1∶5处理虾壳残渣,研究了不同处理时间的脱钙效果,结果如图1(b)所示。随着酸处理时间从1 h增加到4 h,灰分含量逐渐降低,当酸处理时间达到4 h后,灰分含量达到最低,再延长时间灰分含量不再降低,表明能与盐酸反应的碳酸钙已经反应完全。因此,确定脱钙处理中适宜的盐酸质量分数为5 %、适宜的处理时间为4 h。
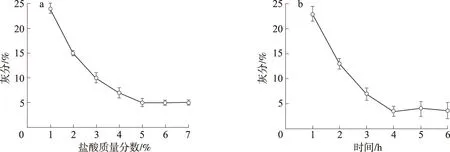
a. 盐酸质量分数mass fraction of HCl; b. 处理时间processing time
2.2 脱乙酰度的分析
改性甲壳素能够吸附重金属离子,主要是靠其分子中含有的氨基、羟基以及其他活性基团对金属离子的螯合作用实现的,其中氨基是吸附金属离子的主要官能团。但天然甲壳素中的氨基几乎都是以乙酰化形式存在的,因此需要对其进行脱乙酰化处理,脱乙酰处理一般需要强碱、高温条件。通常脱乙酰度越大,对金属离子的配位能力越强。但脱乙酰度过高会增加碱用量且将甲壳素转变为壳聚糖,不利于后续处理及使用。本研究中将甲壳素进行简单的脱乙酰处理,用于金属离子吸附试验。实验中使用氢氧化钠溶液,并在微波辅助下处理甲壳素,研究了碱质量分数和处理时间对脱乙酰度的影响,以获得碱用量和脱乙酰度均较为适中的改性产品。
在460 W微波辅助下处理30 min,研究了NaOH质量分数对甲壳素脱乙酰度的影响,结果如图2(a)所示,随着NaOH质量分数的增加,脱乙酰度呈现先升高后降低的趋势,当NaOH质量分数为45 %时,脱乙酰度最高,达到了86.2 %;继续提高NaOH质量分数,脱乙酰度反而有所降低,且NaOH用量过高还会造成环境污染。综合考虑,适合的NaOH质量分数为45 %。
在NaOH质量分数45 %、微波功率460 W条件下,通过控制微波处理的时间,以获得合适脱乙酰度且较好质量的改性甲壳素,如图2(b)所示。随反应时间延长,脱乙酰度先快速上升后略微下降,处理30 min时,脱乙酰度最高,达到84 %。但反应10 min之后,反应物开始变色,随着反应时间的延长,反应物颜色越来越深,甚至变黑,与文献[17~18]报导的微波处理甲壳素脱乙酰时容易出现焦糊的现象一致,其原因可能是: 1)微波加热过程中,水分挥发,NaOH溶液浓度增大; 2)微波处理时缺少对反应物的搅拌,炉腔内部能量分布不均匀,部分反应剧烈的甲壳素容易焦糊[17]。本研究采用微波间歇处理,为防止反应时间过长对产品造成不良影响,选择总反应时间为10 min。
为降低处理成本和防止甲壳素焦糊,选择处理条件为45 % NaOH在微波460 W辅助下处理10 min,最终获得脱乙酰度为40.4 %的改性甲壳素。
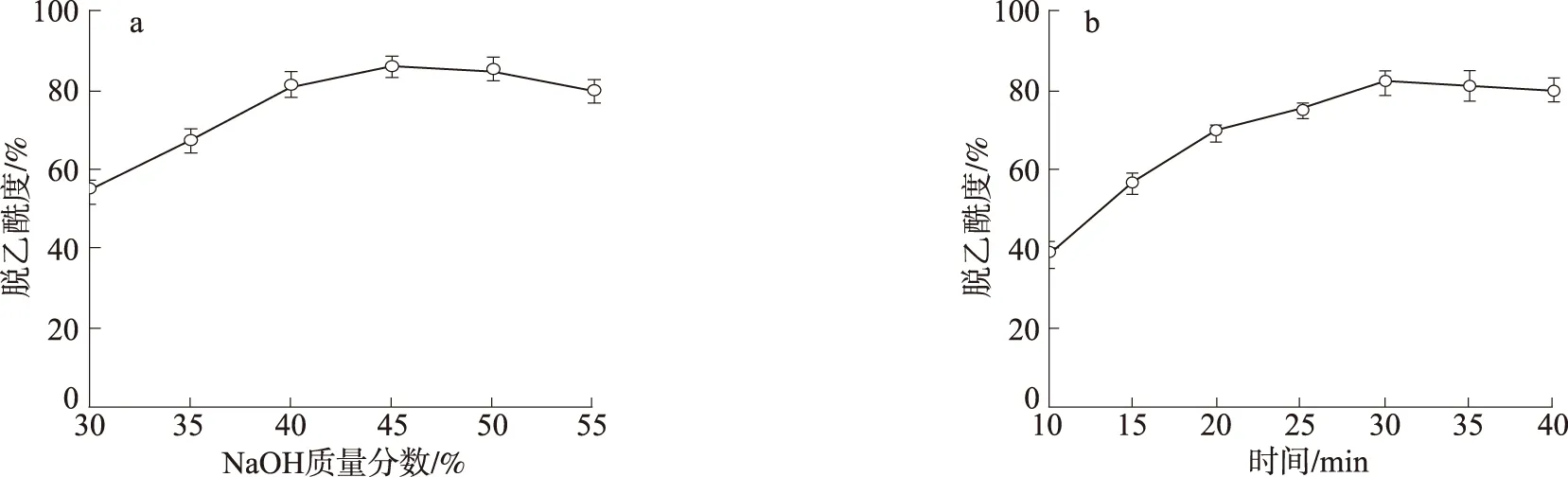
a. NaOH质量分数mass fraction of NaOH; b. 微波处理时间microwave processing time
2.3 海藻酸钠-改性甲壳素凝胶球对重金属离子的吸附效果分析
2.3.1 对不同金属离子的吸附率 表1给出了海藻酸钠-改性甲壳素及其凝胶球对6种金属离子Pb2+、 Cr3+、 Ni2+、 Cu2+、 Zn2+和Co2+的吸附情况。

表 1 改性甲壳素及其凝胶球对金属离子的吸附率
从表1可以看出,凝胶球较改性甲壳素的吸附性能均有不同程度的提高(Ni2+除外)。凝胶球对Cu2+、 Co2+和Zn2+的吸附效果最好,吸附率分别达到92.1 %、 76.7 %和56.2 %。因此,该体系在净化污水吸附重金属离子方面有较大的应用前景,以这3种金属离子为例研究了吸附条件对吸附的影响。
2.3.2 离子浓度对吸附效果的影响 海藻酸钠-改性甲壳素凝胶球对Cu2+、 Co2+和Zn2+的吸附能力随着离子浓度的增大而变化,如图3(a)所示。由图3(a)可知,金属离子质量浓度较低时,凝胶球的吸附量随着3种离子质量浓度增加而迅速增加,当质量浓度达到300 mg/L时吸附量趋于稳定。程珊珊等[19]研究壳聚糖对Cd2+、 Pb2+吸附作用时发现了相同的现象,并采用热力学方程进行了解释:随着金属离子浓度的增大,吸附反应推动力增大,吸附量增大,最终达到平衡。胡惠媛等[20]利用Freundlich方程模型解释壳聚糖-金属离子吸附体系时认为,金属离子首先在吸附剂表面结合力较强的吸附位点作用,然后才与结合力较弱的吸附位点作用,随着吸附过程的进行,吸附剂与被吸附离子间的结合力越来越弱,最终吸附与解吸达到平衡,即达到最大吸附容量。Cu2+、 Co2+和Zn2+离子质量浓度超过300 mg/L后,凝胶球吸附能力基本平衡,所以后续试验选择离子质量浓度为300 mg/L。
2.3.3 吸附时间的影响 吸附率也是衡量吸附效果的重要指标。以凝胶球为吸附剂,Cu2+、 Co2+和Zn2+为吸附质,分别在不同时间取样检测,绘制时间-吸附率曲线,如图3(b)所示。随吸附时间的延长,3种离子的吸附率逐渐升高,直到吸附饱和,即使时间延长也不再增加。Cu2+和Co2+在8 h后,吸附率达到最大,分别为94.2 %和75.6 %; Zn2+在处理10 h后,吸附率达到最大,为58.1 %,与8 h的吸附率57.3 %相比,差别不大。综合考虑,选定后续对3种离子共存体系的吸附处理时间为8 h。

a. 离子质量浓度ion mass concentrations; b. 吸附时间processing time
2.3.4 对铜-钴-锌共存共存体系的吸附效果 Cu2+、Co2+和Zn2+的混合溶液用海藻酸钠-改性甲壳素凝胶球处理8 h后,测定各离子的残余质量浓度,得到在混合体系下凝胶球对各金属离子的吸附率,结果见表2。

表 2 离子共存体系下各离子吸附率
由表2可知, Cu2+吸附率是95.1 %, Co2+的吸附率为82.5 %, Zn2+的吸附率为67.5 %, 3者均比单一离子体系时有所提高。根据姚瑞华等[9]的研究,甲壳素/壳聚糖主链上的氨基官能团是对金属离子吸附的主要位点,但并不是唯一的吸附位点,对于不同的重金属离子,参与吸附的官能团不同,相同的官能团对于不同的重金属离子的配位能力也不相同,因此导致了吸附性能的差异。以Cu2+为例,参与吸附的基团有—NH2和C3位上的—OH; Co2+的吸附基团除了有—NH2和C3位上的—OH,还有C6位上的—OH; Zn2+则只有C3位上的—OH,—NH2很少参与配位。因此,当Cu2+、 Co2+和Zn2+3种离子同时存在并用3倍量的凝胶球处理时,3者的吸附率均有所提高。
3 结 论
3.1 以虾壳酶解后的残渣为原料,经洗涤、盐酸脱钙和NaOH脱乙酰处理得到了改性甲壳素。研究了盐酸质量分数和处理时间对脱钙效果的影响, NaOH质量分数和处理时间对脱乙酰效果的影响。结果表明:适宜的脱钙处理条件为盐酸质量分数5 %、处理时间4 h,处理后的甲壳素灰分含量最低;适宜的脱乙酰处理条件为NaOH质量分数为45 %、微波460 W辅助处理10 min,得到脱乙酰度为40.4 %的改性甲壳素。
3.2 将改性甲壳素与海藻酸钠制成复合凝胶球进行重金属离子吸附获得了良好效果,尤其对Cu2+、 Co2+和Zn2+吸附性能最佳,300 mg/L重金属离子吸附处理8 h后,吸附率分别达到94.2 %、 75.6 %和57.3 %。在Cu2+-Co2+-Zn2+共存溶液体系中,凝胶球对3种离子的吸附率均有所提高,分别为Cu2+95.1 %、 Co2+82.5 %和Zn2+67.5 %。因此,通过处理可以很好地利用虾壳酶解后剩余残渣,变废为宝,将其用于含重金属离子的污水处理领域。
[1]陈学敏. 环境卫生学[M]. 北京:人民卫生出版社,2001.
[2]BERVOETS L,BLLUST R,VERHVEN R. Accumulation of metals in the tissues of three spined stickleback (Gasterosteusaculeatus) from natural fresh waters[J]. Ecotoxicology and Environmental Safety,2001,48(2):117-127.
[3]蒋挺大. 甲壳素[M]. 北京:化学工业出版社,2001.
[4]苏广宇,刘四新,李从发. 甲壳素/壳聚糖的研究与应用概况[J]. 广东农业科学,2008 (2):107-112.
[5]孟范平,易怀昌. 各种吸附材料在印染废水处理中的应用[J]. 材料导报,2009,23(7):69-73.
[6]ANNADURAI G,LING L Y,LEE J F. Adsorption of reactive dye from an aqueous solution by chitosan:Isotherm kinetic and thermodynamic analysis[J]. Journal of Hazardous Materials,2008,152(1):331-337.
[7]王文全,郑春霞,郝俊蓉,等. 卤虫卵壳及粗甲壳素对重金属离子的吸附性[J]. 环境科学与技术,2005,28(1):51-52.
[8]李萌,马霞,马巧燕,等. 甲壳素及其衍生物的制备与应用[J]. 广东化工,2015,42(15):97-98.
[9]姚瑞华,孟范平,张龙军,等. 改性壳聚糖对重金属离子的吸附研究和应用进展[J]. 材料导报,2008,22(4):65-70.
[10]ROBERTS G A F. Chitin Chemistry[M]. London:Macmillan Press,1992.
[11]孙璠,徐民,李克让,等. 甲壳素和壳聚糖在离子液体中的溶解与改性[J]. 化学进展,2013,25(5):832-837.
[12]邹耀邦,王璐,刘孝波. 生物质材料:甲壳素/壳聚糖的溶解性与应用研究进展[J]. 材料导报,2003,17(5):51-54.
[13]林静雯,索志强,王冠,等. 改性壳聚糖絮凝剂处理印染废水的研究[J]. 环境保护科学,2005,31(129):16-18.
[14]刘锡红,赵灵希,张成杰,等. 酶法从虾壳中提取甲壳素工艺优化的研究[J]. 食品工业科技,2013,34(22):209-213.
[15]邓春梅,杨丹,刘毅,等. 虾壳制备甲壳素和壳聚糖的研究[J]. 广东化工,2007,34(11):26-29.
[16]季锦林,汤立新,钱清华. 间歇法提取甲壳素和制备壳聚糖的工艺优化[J]. 食品科技,2013,38(4):200-205.
[17]张洁,史劲松,孙达峰,等.微波法制备壳聚糖研究[J]. 中国野生植物资源,2011,30(6):38-43.
[18]张立彦,曾庆孝,林珣. 微波条件下甲壳素脱乙酰反应的条件研究[J]. 化学世界,2003,44(10):543-547.
[19]程珊珊,杨锡洪,章超桦,等. 壳聚糖对Cd2+和Pb2+的吸附作用[J]. 水产学报,2011,35(3):410-416.
[20]胡惠媛,朱虹. 壳聚糖及其衍生物对重金属离子的吸附[J]. 化学进展,2012,24(11):2212-2223.
Preparation of Modified Chitin Gel Bead from Waste Shrimp Shell and Its Adsorption Properties for Metal Ions
QIAN Jian-ying1, DING Zhen-zhong2, YANG Tao1, LI Heng1, SHI Jing-song1
(1. School of Pharmaceutical Science,Jiangnan University, Wuxi 214122, China; 2. Yangzhou Rixing Bio-Tech CO.,LTD., Yangzhou 225601, China)
Modified chitin with 40.4 % deacetylation degree was obtained from enzymatic hydrolysis residue of shrimp shell,which was treated by 5 % HCl for 4 h and 45 % NaOH coupled with 460 W microwave for 10 min,and then prepared into gel beads with diameter of 1.5-3.2 mm by adding sodium alginate,mixing evenly,and squeezing in calcium chloride solution for 12 h.The adsorption performances of the gel beads to metal ions (Pb2+,Cr3+,Ni2+,Cu2+,Zn2+and Co2+) were investigated.The adsorption rates of Cu2+, Co2+and Zn2+were found to be 94.2 %,75.6 % and 57.3 % in 300 mg/L ion solutions by treating for 8 h,and 95.1 %, 82.5 %, 67.5 % in the Cu2+, Zn2+and Co2+coexisting system,respectively.
modified chitin;metal ion;adsorption property
2016-06-15
江苏省重大成果转化项目(BA2015006)
钱建瑛(1982— ),女,江苏无锡人,实验师,硕士,研究方向为生物制药;E-mail:jackieqian@163.com。
10.3969/j.issn.1673-5854.2016.06.006
TQ35;TQ917
A
1673-5854(2016)06-0037-06
