分子印迹柱净化-UPLC-MS/MS测定果蔬制品中展青霉素
2016-12-13马雪涛谭建林牛之瑞冯雷
马雪涛,谭建林,牛之瑞,冯雷
(云南省产品质量监督检验研究院,云南昆明650223)
分子印迹柱净化-UPLC-MS/MS测定果蔬制品中展青霉素
马雪涛,谭建林*,牛之瑞,冯雷
(云南省产品质量监督检验研究院,云南昆明650223)
建立分子印迹亲和柱净化-超高效液相色谱串联质谱检测果蔬制品中展青霉素的方法。样品经2.5%乙酸水提取,分子印迹亲和柱净化,超高效液相色谱串联质谱测定,外标法定量。展青霉素在2.0 ng/mL~50.0 ng/mL范围内线性良好(R2≥0.999 8),方法的检出限为2.0μg/L。在添加水平为5.0和50.0μg/L时,4种果蔬制品回收率为78.4%~92.0%,相对标准偏差低于7.2%。该方法准确、稳定、灵敏,能够满足果蔬制品中展青霉素检测与确证的需要。
分子印迹亲和柱;超高效液相色谱串联质谱;展青霉素;果蔬制品
展青霉素(4羟基-4H-呋[3,2c]吡喃2(6H)-酮),主要是青霉属、曲霉属和Byssochlamys菌种产生的一种真菌毒素,主要存在于苹果、梨、葡萄等多种水果及其制品中,是影响水果及果汁饮料品质的主要因素之一[1]。展青霉素通过巯基的强亲和力抑制多种酶的活性[2],主要是含有-SH基的酶,如乳酸脱氢酶、磷酸果糖激酶、Na+-K+ATP酶等。此外,它能够扰乱线粒体和质膜的功能[3]。展青霉素对免疫系统有不同程度的抑制作用,可以明显地抑制腹膜巨噬细胞的化学荧光反应,降低淋巴细胞,特别是B细胞的数量[4]。展青霉素对人类的急性毒理反应包括恶心,呕吐和其他胃肠道创伤,慢性接触展青霉素被证明能够诱导肿瘤细胞的形成,引起基因突变,胚胎发育缺陷[5-6],它也能诱导白血病的产生[7]。展青霉素检测方法主要有薄层色谱法(TLC)[8-9]、高效液相色谱法(HPLC-UV/DAD)[10-12]、气相色谱质谱法(GC-MS)[13-14]、串联质谱法(LC-MS/MS)[15-17]。这些方法能够快速的对展青霉素进行检测,也能达到令人满意的检出限。这些方法中HPLC方法是目前使用最广泛的分析水果及其制品中展青霉素的方法,但必须注意的是HPLC-UV/DAD分析果汁样品时可能会出现干扰峰[11],从而影响结果的判断,而一般的气相色谱法则要求衍[18],所需要的时间较长。
分子印迹亲和柱的固定相是三维交联的高分子聚合物网络结构,可以很好的识别目标分子结构及功能团位置,模拟抗原抗体的高度选择性。展青霉素分子印迹亲和柱可选择性吸附样品中的展青霉素,从而对样品起到非常针对性的净化和富集作用,将样品中待测物浓缩。分子印迹亲和柱与UPLC-MS/MS配合使用可到达快速测定的目的,以改善信噪比,提高检测方法的准确度。
1 材料与方法
1.1 仪器与试剂
LC-30A超高效液相色谱仪:日本岛津公司;API 3200 MS/MS三重四极杆质谱仪:美国AB公司;E12140电子天平:美国OUAUS公司;微型氮吹仪:上海精密仪器公司;SB25-12型超声波清洗机:宁波新芝生物科技股份有限公司;色谱柱:SHIMADUODS III(1.7μm,50mm×2.0mm,日本岛津)、Phenomenon XDC18(1.7μm,75mm×2.1mm,美国菲罗门)、Waters UPLCBEH Phenyl column(1.7μm,50mm×2.1mm,美国Waters)、展青霉素分子印迹亲和柱和228多功能净化柱(北京泰乐祺科技有限公司)、HLB柱(美国菲罗门)。
乙腈和甲醇为色谱纯;水为超纯水;其他试剂均为分析纯;展青霉素标品(纯度为98%):百灵威科技有限公司;果胶酶(酶活力≥1 400U/g):Sigma公司;果蔬制品为本地市场采购。
1.2 色谱和质谱条件
色谱条件:柱温40℃;流动相:A水、B乙腈;流速:0.4mL/min;进样量:10μL;梯度洗脱程序见表1。

表1 梯度洗脱程序Tab le1 Gradientelution program
质谱条件:电离方式为电喷雾离子化负离子模式(ESI-);电喷雾电压(IS):5 500 V,雾化气压力(GS1):4.13 Pa,气帘气压力(CUR):1.38 Pa,辅助气流速(GS2):4.13Pa;离子源温度(TEM):650℃;扫描模式:多反应监测(MRM),检测离子对及碰撞能量:定量离子对,m/z152.9>108.9(-13 U/eV),定性离子对,m/z 152.9>81.0(-18U/eV)。
1.3 标准溶液的配制
准确称取展青霉素标准品10mg于10mL容量瓶中,用乙腈溶解并定容至刻度,配制成1.0mg/mL展青霉素标准储备液。于-4℃下避光保存。准确量取适量展青霉素标准储备溶液,用0.1%乙酸水溶液逐级稀释该标准溶液,配制2.0、5.0、10.0、20.0、50.0 ng/mL的标准工作溶液,现用现配。
1.4 样品处理
取20mL样品,加入150μL果胶酶,混合均匀后放置过夜,于5000 r/min离心5min,准确移取超2.5mL上清液并加入2.5mL 2%乙酸水溶液,混匀后过分子印迹亲和柱净化(净化前先后上2mL乙腈和1mL水平衡分子印迹亲和柱),取1mL1%NaHCO3水溶液清洗柱子,再立即加入2mL水清洗,加压将柱体内的水排干。加入1mL乙醚洗涤,然后加入4mL乙酸乙酯洗脱,随后在洗脱液中加10μL纯乙酸以防止展青霉素降解。将洗脱液用氮气吹至近干,立即加入1mL 0.1%乙酸水溶液溶解,漩涡1min后过0.22μm滤膜待UPLC-MS/MS分析测定。
2 结果与分析
2.1 展青霉素质谱信号优化
目前对真菌毒素的质谱检测方法中,大多采用电喷雾离子源(ESI),对于展青霉素来说,大气压化学电离源(APCI)所获得的质谱信号比ESI弱。在ESI负离子模式下,展青霉素的质谱信号也比ESI正离子模式强[19-20]。采用展青霉素的10μg/mL标准溶液以流动注射的方式在ESI负离子模式下,确定其分子离子,以其分子离子为母离子,对其子离子进行全扫描,选取两个丰度较强、干扰较小的子离子,最后在多反应监测(MRM)负离子模式下优化其质谱参数。
本试验考察了10种流动相(见表2)和3种色谱
柱(柱A:SHIMADUODS III;柱B:Phenomenon XDC18;柱C:WatersUPLCBEH Phenyl column)对展青霉素电离效率的影响,结果见图1。

表2 电离效率试验中10种流动相Table2 10 kindsofmobilephase in theexperimentof ionization efficiency
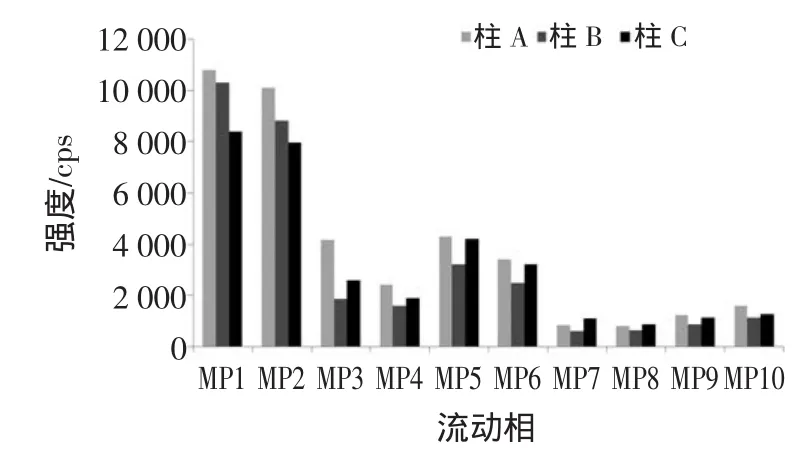
图1 不同流动相和色谱柱对展青霉素质谱信号的影响Fig.1 Effectofdifferentm obilephasesand chrom atographic columnson the developmentof patulinmassspectrometry
从图1可以看出,在水相中加入乙酸铵和碳酸氢铵会降低展青霉素的电离效率,所以本次试验选择水和甲醇作为流动相,色谱柱为SHIMADUODSIII。
2.2 假阳性现象
固相萃取技术(SPE)是一种常用的水果及其制品中展青霉素的提取和净化方法,使用较为普遍的是HLB柱和228多功能净化柱。HLB属于反相吸附柱,对极性化合物和非极性化合物都有较好的保留,在食品分析前处理中较为常见;而228多功能净化柱(MFC)则是一种特殊的SPE柱,以极性、非极性及离子交换等组成填充剂,可选择性吸附样液中的脂类、蛋白类等杂质,展青霉素不被吸附而直接通过。HLB柱和228多功能净化柱在使用中都有一个共同的缺点,即它们都只能除去大分子物质和展青霉素极性相差较大的杂质,对于与展青霉素极性相似或结构相似的化合物,则不能达到除杂的效果。分别使用HLB、多功能净化柱、分子印迹亲和柱对水果及其制品中的展青霉素进行净化比较分析中发现,3种固相萃取柱在处理苹果汁、梨汁、葡萄汁等色素含量少的样品时,都能达到良好的净化效果。但是在处理色素较多的样品时,例如紫薯,HLB和多功能净化柱处理后的样品中都存在假阳性现象(定量离子对和定性离子对都出峰,但是丰度比与展青霉素标准物质相差较大),而分子印迹亲和柱则能很好的去除紫薯干扰,如图2所示。
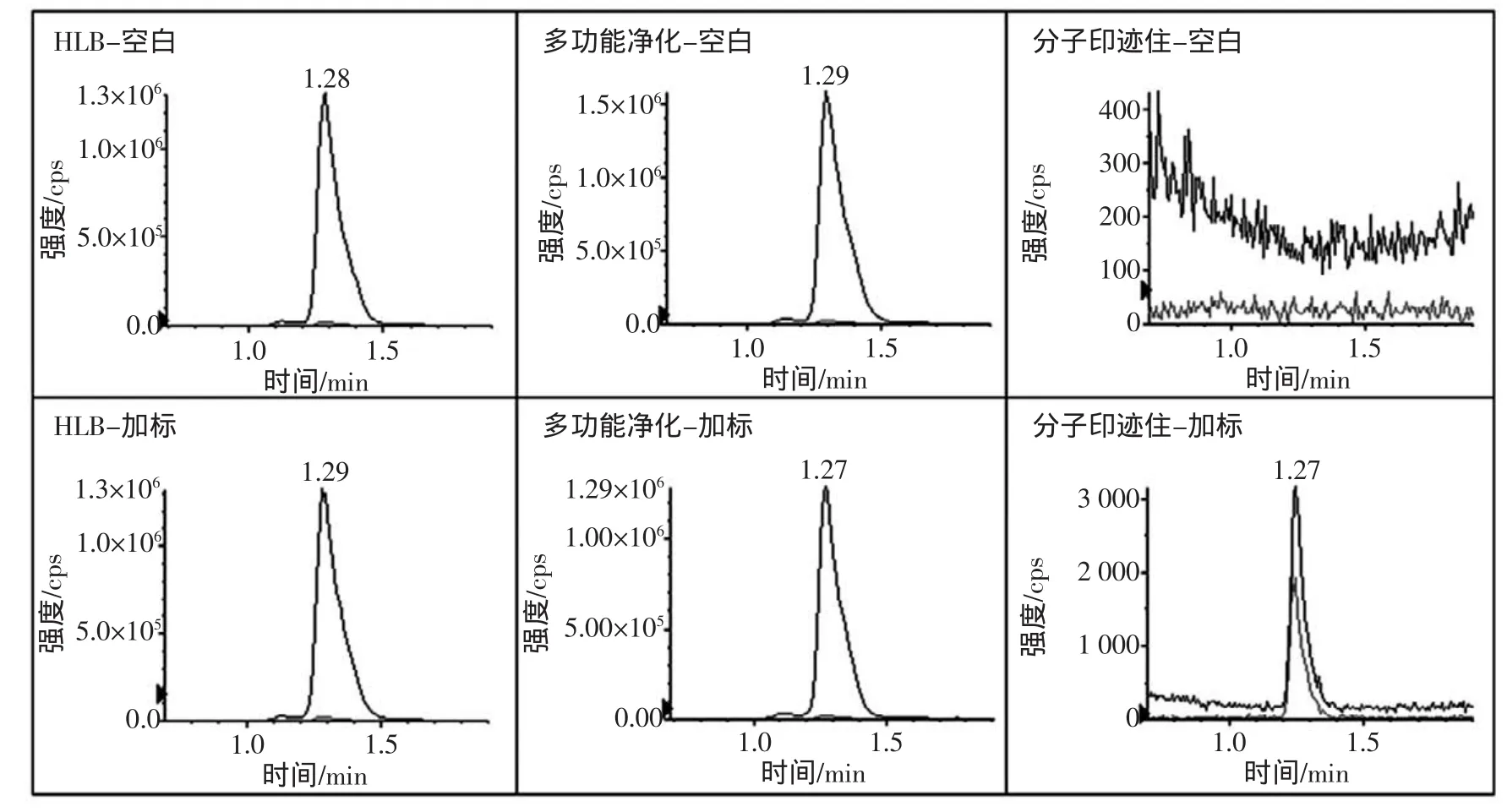
图2 比较分析3种固相萃取柱对紫薯净化效果Fig.2 Analysisand comparison of three kindsof solid phaseextraction colum n for purification of purplesweet potato
2.3 方法评价
对2.0 ng/mL~50.0 ng/mL的展青霉素标准溶液进行测定,以质量浓度为横坐标,相应峰面积为纵坐标,线性回归方程为Y=472X-1360;相关系数R2≥0.9998。结果表明,在此浓度范围内,其质量浓度与峰面积之间线性关系良好。
方法检出限是依据1.4操作步骤进行添加回收,根据3倍信噪比确定该方法的检出限2.0μg/L,10倍信噪比确定该方法的定量限5.0μg/L。
选取阴性的典型样品,向试样中添加展青霉素的标准溶液,分别进行5.0μg/L和50.0μg/L的加标回收试验,每份样品检测6次,采用基质标准品进行定量和回收率计算。试验结果表明本方法的回收率为78.4%~92.0%,相对标准偏差小于7.2%。空白试样的添加浓
度和回收率的试验数据见表3。
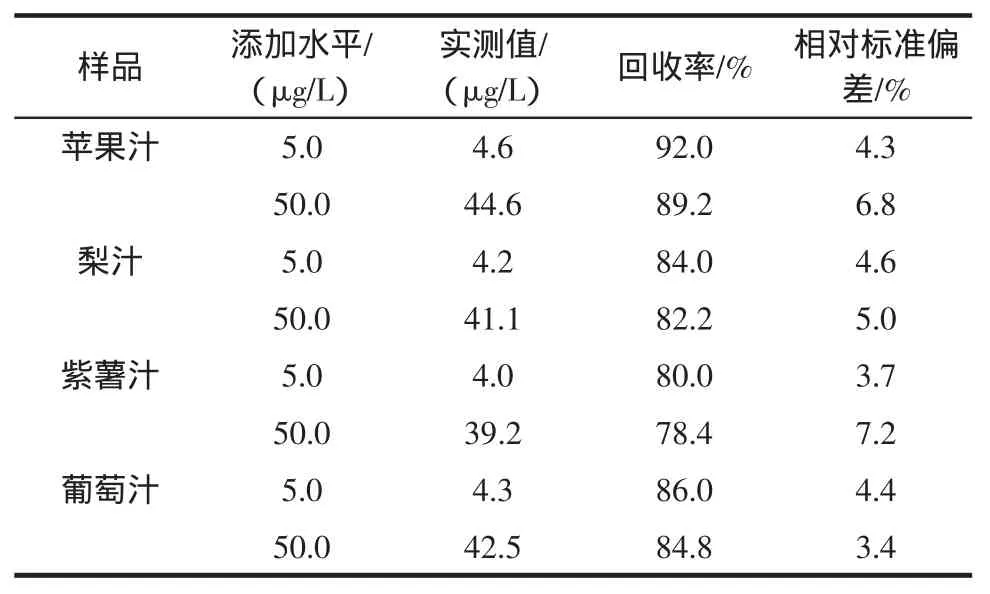
表3 展青霉素的回收率和回收率Table3 Recovery and precision(RSD)of patulin
3 结论
从云南本地市场采购的水果及其制品样本,应用本方法对苹果汁、梨汁、葡萄汁、紫薯汁等不同种类的果蔬制品共计18个样品进行分析测定,均未检出展青霉素。本试验采用分子印迹亲和固相萃取技术进行样品前处理,建立了果蔬制品中展青霉素的液相色谱-串联质谱检测方法,该方法能够很好的排除复杂样品中的假阳性现象,提高检测的准确性,方法的检出限、准确度、精密度、稳定性和线性关系均满足展青霉素的分析检测要求。
[1]Moake M M,Padilla-Zakour O I,Worobo RW.Comprehensive review of patulin controlmethods in foods[J].Comprehensive Reviews in Food Scienceand Food Safety,2005,4(1):8-21
[2]Wouter M F A,Speijers G JA.Toxicological evaluations of certain food additives and contaminants in food:Patulin[M].World Health Organization:Geneva,Switzerland,1996:337-402
[3]Sewram V,Nair JJ,Nieuwoudt TW,etal.Determination of patulin in apple juice by highperformance liquid chromatography-atmospheric pressure chemical ionization mass spectrometry[J].Journal ofchromatographya,2000,897(1):365-374
[4]Escoula L,Thomsen M,BourdiolD,etal.Patulin immunotoxicology: effecton phagocyteactivation and the cellular and humoral immune system ofmice and rabbits[J].International journal of immunopharmacology,1988,10(8):983-989
[5]World Health Organization.Evaluation of certain food additivesand contaminants.44th Reportof the Joint FAO/WHOExpertCommittee on Food AdditiVes[M].Technical Report Series 859;Geneva, Switzerland,1995:36-38
[6]World Health Organization,International Agency for Research on Cancer.IARC Monograph on the Evaluation of the Carcinogenic Risk ofChemicals to Humans40[M].IARC:Lyon,France,1986:92-93
[7]Sheu F,Shyu Y T.Analysis of patulin in apple juice by diphasic dialysisextraction with in situ acylation andmass spectrometric determination[J].Journal of agricultrual and food chemistry,1999,47 (7):2711-2714
[8]Welke JE,HoeltzM,DottoriH A,etal.Effictofprocessing stagesof apple juice concentrate on patulin levels[J].food control,2009,20 (1):48-52
[9]MartinsM L,Gimeno A,Martins H M,etal.Co-occurrence of patulin and citrinin in Portugueseappleswith rotten spots[J].Food additives&contaminants,2002,19(6):568-574
[10]Barreira M J,Alvito PC,Almeida CM M.Occurrence of patulin in apple-based-foods in Portugal[J].Food chemistry,2010,212(3): 653-658
[11]Boonzaaijer G,Bobeldijk I,Van OsenbruggenW A.Analysisof patulin in dutch food,anevaluation of a SPE based method[J].Food control,2005,16(7):587-591
[12]仇农学,牛鹏飞,苏肖洁.RP-HPLC法同时检测苹果汁中乳酸、富马酸、5-HMF和展青霉素的条件优化[J].食品科学,2008,29 (6):312-317
[13]Al-Hazmi N A.Determination of Patulin and Ochratoxin A using HPLC in apple juice samples in Saudi Arabia[J].Saudi journal of biologicalsciences,2010,17(4):353-359
[14]Cunha SC,Faria M A,Fernandes JO.Determination of patulin in apple and quince productsby GC-MSusing 13C5-7 patulin as internalstandard[J].Food chemistry,2009,115(1):352-359
[15]Marta V,Zbynek D,Ondrej L,etal.Monitoring survey of patulin in a variety of fruit-based products using a sensitive UHPLC-MS/MS analyticalprocedure[J].Food control,2015,47:577-584
[16]Christensen H B,Poulsen M E,Rasmussen PH,etal.Development of an LC-MS/MSmethod for the determination of pesticides and patulin in apples[J].Food additives&contaminants,2009,26(7): 1013-1023
[17]牛华,冯雷,牛之瑞,等.超高效液相色谱-串联质谱法测定果汁中的展青霉素[J].色谱,2012,30(9):957-961
[18]Kataoka H,Itano M,Ishizaki A,et al.Determination of patulin in fruit juice and dried fruit samplesby in-tube solid-phasemicroextraction coupled with liquid chromatography-mass spectrometry[J]. Journalofchromatography a,2009,1216(18):3746-3750
[19]Michael S,Rudolf K,Rainer S.Application ofan LC-MS/MSbased multi-mycotoxin methodfor the semi-quantitative determination of mycotoxins occurring in different types of food infected bymoulds [J].Food chemistry,2010,119(1):408-416
[20]Svetlana V,Malyshevaa,Jose DDM,etal..Improved positive electrospray ionization ofpatulin byadduct formation:Usefulness in liquid chromatography-tandem mass spectrometry multi-mycotoxin analysis[J].Journalof chromatography a,2012,1270:334-339
Determ ination of Patulin in Fruit and Vegetable Products by UPLC-MS/MSCoupled w ith M olecular Im printing Colum n
MA Xue-tao,TAN Jian-lin*,NIU Zhi-rui,FENG Lei
(Yunnan Instituteof ProductQuality Supervision and Inspection,Kunming650223,Yunnan,China)
Amolecular imprinting affinity column coupled with ultra performance liquid chromatography tandem mass spectrometric(UPLC-MS/MS)method for the determination of patulin in fruitand vegetable products.Sampleswere extracted 2.5%acetic acid water.The crude extractwas purified onmolecular imprinting affinity column.Sample determined and confirmed by UPLC-MS/MS.Patulin chosen showed good linearity the rangeof2.0 ng/mL-50.0 ng/mL(R2≥0.999 8).The limitofdetection(LOD)was2.0μg/L.The averge recoveries of patulin in four kinds of fruit and vegetable products at spiked levels of 5.0 and 50.0μg/L ranged from 78.4%to92.0%with relative standard deviations(RSDs)smaller than 7.2%.Themethod isaccurate,stable,sensitiveand suitable for thedetermination ofpatulin in fruitand vegetable products.
molecular imprintingaffinity column;UPLC-ESI-MS/MS;patulin;fruitand vegetable products
10.3969/j.issn.1005-6521.2016.23.031
2015-10-08
国家质检总局科技计划项目(2013zjjz308)
马雪涛(1974—),女(回),副高级工程师,硕士,研究方向:食品中非法添加剂的检测。
*通信作者:谭建林(1985—),男(汉),硕士。
