亚剂量硫酸新霉素对黄羽肉鸡回肠黏膜菌群组成的影响
2016-12-13刘志昌李书宏
容 庭,刘志昌,王 刚,李书宏,张 洁,蔡 追,陈 庄
(1.广东省农业科学院动物科学研究所,畜禽育种国家重点实验室,广东省动物育种与营养公共实验室,广东省畜禽育种与营养研究重点实验室,广州 510640;2.广东省农业科学院,广州 510640)
亚剂量硫酸新霉素对黄羽肉鸡回肠黏膜菌群组成的影响
容 庭1,刘志昌1,王 刚1,李书宏1,张 洁1,蔡 追1,陈 庄2*
(1.广东省农业科学院动物科学研究所,畜禽育种国家重点实验室,广东省动物育种与营养公共实验室,广东省畜禽育种与营养研究重点实验室,广州 510640;2.广东省农业科学院,广州 510640)
以1日龄岭南黄肉鸡(♂)为试验动物,研究在日粮中长期添加亚剂量硫酸新霉素对黄羽肉鸡回肠黏膜菌群动态变化与组成的影响。于1、7、14、21、28、35及42日龄分别从A组(饲喂基础日粮)和D组(饲喂基础日粮+50 mg·kg-1硫酸新霉素)采集鸡回肠肠段并提取黏膜细菌基因组DNA,采用PCR-DGGE技术分析鸡回肠黏膜菌群结构,同时应用16S rDNA基因序列技术,建立42日龄鸡回肠黏膜细菌16S rDNA的随机克隆文库。DGGE图谱分析发现,A、D两组1~28日龄回肠黏膜细菌结构存在明显差异,其相似性为40%~60%;A、D两组肉鸡1~35日龄菌群结构发生变化的程度不同,A组的动态变化值(%change)为9%~33%,D组的动态变化值为17%~45%。分析回肠文库发现,A组文库有94个序列,共产生9个OTUs(Operational Taxonomic Units),其中未知菌属(微杆菌属)所占克隆总数比例最大为48.94%(46/94),其次是乳杆菌属占38.30%(36/94);D组文库有93个序列,共产生6个OTUs,其中乳杆菌属所占克隆总数比例最大为49.46%(46/93),其次是微杆菌属占45.16%(42/93);两组回肠文库中其他菌属的组成种类与数量存在差异,且未发现与大肠杆菌相关的序列。A组与D组42日龄肉鸡回肠黏膜菌群的组成及多样性存在差异,尤其是乳杆菌属的组成比例,这种差异可能是抗生素持续压力的影响所致。
硫酸新霉素;岭南黄肉鸡;肠道黏膜菌群;16S rDNA克隆文库
硫酸新霉素(Neomycinsulfate)为弗氏链霉菌(Streptomycesfradiae)的发酵产物,属于氨基糖苷类广谱抗生素[1-2],广泛用于防治各种动物局部感染[3],适用于胃肠道和呼吸道感染。相比其他抗生素类,它具有抗菌能力强、作用范围广、口服无毒副作用、口服后大部分以原形排出、无过敏反应、安全和不易产生耐药性和交叉耐药性等优点,在国外作为常用的兽药。但硫酸新霉素有一定的毒性,长期使用会引起耳毒性和肾毒性[4],许多国家和地区对其规定了最大限量,欧盟明确规定,禁止使用氨基糖苷类抗生素作为家畜的生长促进剂。畜禽生产中抗生素的长期使用除了发挥促生长作用外,也扰乱宿主与肠道菌群之间的正常平衡,造成菌群失调[5-6]。大多数的报道都基于抗生素对畜禽肠道内容物微生物的研究,而抗生素作为预防用药对畜禽胃肠道黏膜微生物的研究国内外未见报道。因此,以岭南黄肉鸡作为试验素材,采用PCR-DGGE技术与16S rDNA基因序列技术分析亚剂量硫酸新霉素作为预防用药对黄羽肉鸡回肠黏膜菌群组成及多样性的影响,探讨在家禽日粮中长期添加亚剂量抗生素是否会导致肠道黏膜菌群失调、影响宿主健康,为今后深入开展饲用抗生素的应用研究提供新的思路。
1 材料与方法
1.1 试验动物与饲养管理
试验于2014年10月29日至2014年12月9日在广东省农业科学院畜牧研究所试验场地完成,饲养期42 d;试验选择同1天孵化的1日龄健康岭南黄肉鸡400羽,随机分为2组(分别编号为A组和D组),每组5个重复,每个重复40羽,各组间体重均无显著差异,A组饲喂基础日粮,D组饲喂基础日粮+50 mg·kg-1硫酸新霉素(干品效价为675 U·mg-1)。仔鸡均在封闭式肉鸡舍内地面平养,地面铺放木屑,全天24 h光照,自由采食和饮水。试验选用玉米—豆粕型基础日粮,参照NRC(1994)鸡的营养需要、中国鸡饲养标准(NY/T 33-2004)、中国饲料成分及营养价值表(2005)按1~21 d和22~42 d 2个阶段日粮进行配制,主要营养指标:1~21日龄粗蛋白质21%,能值为12.12 MJ·kg-1;22~42日龄,粗蛋白质19%,能值为12.54 MJ·kg-1。试验采用常规免疫程序,鸡舍平均温度约22 ℃,相对湿度控制在60%~65%。期间鸡未发生疾病,采用常规消毒。
1.2 指标测定
试验开始(1日龄)、21日龄、42日龄,以重复为单位进行空腹称重。称重前12 h撤料,不停水,于第二天早上8:00进行空腹称重。计算每个重复鸡只的平均日增重(ADG)、试末均重(Final Weight);记录各重复投料量及剩余量,计算每个重复平均日采食量(ADFI)和耗料增重比(F/G)。
1.3 回肠黏膜样品采集与前处理
试验于第1、7、14、21、28、35及42天早上喂料前,分别从每个重复组中挑选2只健康的试验鸡屠宰,采集回肠肠段(中部2 cm)黏膜样品,截取1 cm用于试验,1 cm留样,样品立即放入液氮中速冻后,于-80 ℃保存备用。前处理方法参照文献[7、8]。然后合并10只鸡肠段菌体置于1.5 mL的TE缓冲液(10 mmol·L-1Tris pH8.0,1 mmol·L-1EDTA)中,取500 μL来提取DNA,其余1 mL立即置于液氮中速冻,于-80 ℃保存备用。
1.4 细菌基因组 DNA提取与纯度测定
采用EZgeneTM Bacterial gDNA Kit(Biomiga,USA)试剂盒提取10只鸡回肠黏膜混合样品基因组DNA[8-9],其操作步骤按说明书进行。基因组DNA浓度和纯度采用ND-1000核酸蛋白质分析仪检测。DNA的A260/A280值作为评价纯度的指标。
1.5 变性梯度凝胶电泳(DGGE)
根据参考文献[10]设计出16S rDNA的V3区PCR扩增引物 (由上海生物工程有限公司合成),341F-GC(5′-CGCCCGCCGCGCGCGGCGGGCGG-GGCGGGGGCACGGGGGGCCTACGGGAGGCA-GCAG-3′) 和518R (5′-ATTACCGCGGCTGCTGG-3′)。PCR反应体系(50 μL):10×buffer(with MgCl2)5 μL,dNTPs(10 mmol·L-1) 4 μL,引物(10 μmol·L-1)各0.5 μL,模板DNA(20 ng·μL-1)5 μL,TaqDNA 聚合酶(5 U·μL-1) 0.25 μL,ddH2O补足50 μL,同时设不添加模板的阴性对照;PCR扩增条件:94 ℃预变性3 min;94 ℃变性30 s,57.5 ℃退火40 s,72 ℃延伸50 s,30个循环,最后72 ℃延伸7 min。取5 μL PCR产物用1.2%的1×TAE琼脂凝胶电泳检测。PCR产物回收采用试剂盒(购买于上海生物工程有限公司)回收,其方法依试剂盒使用说明。
采用Bio-Rad Dcode进行DGGE凝胶电泳。凝胶梯度为40%~60%,变性方向与电泳方向一致。100%变性剂溶液含7 mol·L-1尿素和40%去离子甲酰胺。使用1×TAE缓冲液,70 V,60 ℃电泳14 h,PCR产物上样量为20 μL。参照文献方法用硝酸银染色[10],将银染的DGGE凝胶放置在白光投射仪上,用数码相机拍照并保存图片。
1.6 DGGE凝胶图像与数据分析
采用BIO-RAD Quality One 4.6.2软件对PCR-DGGE图像进行聚类分析。
动态变化性(Dynamics)计算公式[11]:%change=100-%similarity;%similarity是比较两个相邻时间点的相似性得出;%change称为变化值或者改变值,表示在一段时间内某个微生态系统的改变或更新程度。
1.7 16S rDNA随机克隆文库的构建
1.7.1 细菌16S rDNA V3区PCR扩增 以42日龄回肠黏膜细菌基因组DNA为模板,根据参考文献[10]设计出16S rDNA V3区的引物(无GC夹)进行PCR扩增。引物(由上海生物工程有限公司合成):341F(5′-CCTACGGGAGGCAGCAG-3′)和518R (5′-ATTACCGCGGCTGCTGG-3′)。操作方法同“1.5”。取5 μL PCR产物用1.2%的1×TAE琼脂凝胶电泳检测。PCR产物回收采用试剂盒回收(购买于上海生物工程有限公司),其方法依试剂盒使用说明。
1.7.2 随机克隆文库构建 PCR回收产物连接到pMD18-T载体(试剂盒购于大连TaKaRa公司),置于4 ℃冰箱连接过夜,后用DH5α感受态细胞(购于TaKaRa Bio Group)进行重组载体转化,将转化产物加入LB培养液中(37 ℃,160 r·min-1),培养1 h后,取适量培养物涂布在LB抗性平板(含50 μg·mL-1Amp、20%IPTG及2.5%X-gal)上,将平板移置培养箱(37 ℃)中培养12~14 h,取出置于4 ℃冰箱过夜。从平板中挑取100个白色单菌落,接入LB培养液(含50 μg·mL-1Amp)中,移入摇床(170 r·min-1,37 ℃)振荡培养12~14 h。以菌液作为模板,用引物BcaBEST Primer M13-47[购于宝生物工程(大连)有限公司]扩增pMD18-T载体目的片段,进行阳性克隆PCR鉴定,并挑选阳性克隆子的菌液进行测序(华大基因,BGl),建立克隆文库。
1.8 随机克隆文库数据分析[12-14]
克隆文库覆盖度的大小用库容(Coverage)来表示:C=1-n1/N,N代表文库总克隆数,n1代表在文库中仅出现一次的OTU的数量;肠道菌群的多样性指数分析采用:Simpson′index(D)=1-ΣPi2,Shannon-Weiner index(H′):H′=-ΣPilnPi,Pi=ni/N,Pi表示第i个种占总数的比例,ni为第i个物种的克隆数,N为总克隆数;Shannon evenness(E)=H′/H′max,H′max = lnS,其中H'max为H'的最大值;Margalef index(DMa)=(S-1)/ lnN,S为克隆文库总的物种数。
1.9 试验数据处理
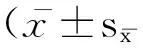
测序得到的16SrDNAV3区基因序列经DNASTAR找出目的片段,并在GenBank数据库中进行比对分析,寻找最相似已知与已知分类地位的序列。
2 结 果
2.1 岭南黄肉鸡生产性能统计
由表1可看出,两组间生产性能的各项指标(末重、平均日增重、平均日采食量及料重比)差异均不显著(P>0.05)。由此可见,日粮中长期添加50mg·kg-1硫酸新霉素对岭南黄肉鸡不同阶段的生产性能均无显著影响。
2.2 回肠黏膜细菌DNA提取和16SrDNAV3区PCR扩增
黏膜细菌DNA电泳结果发现,片段大小约23kb,经核酸蛋白质仪测定可作为PCR扩增16SrDNAV3区序列的模板。16SrDNAV3区PCR产物的相对分子质量大小约为240bp,片段大小与预期的一致(图略)。经克隆子PCR鉴定结果显示(图略),用引物BcaBESTPrimerM13-47扩增的PCR产物大小约330bp。条带单一无引物二聚体,片段大小正确的鉴定为阳性克隆子。两组分别从LB抗性平板上随机挑选100个阳性克隆子,A组回肠符合测序的克隆子总数为94个;D组符合测序的克隆子总数为93个。
阶段Stages末重/gFinalweight平均日增重/gADG平均日采食量/gADFI料重比F/G1~21dA组GroupA417.89±5.50a18.75±0.26a32.21±0.55a1.73±0.04aD组GroupD419.85±5.57a18.85±0.26a31.22±0.59a1.68±0.02a22~42dA组GroupA1314.28±30.48a42.69±1.59a91.89±3.31a2.32±0.06aD组GroupD1337.20±17.66a43.68±1.04a95.05±1.03a2.34±0.05a1~42dA组GroupA1314.28±30.48a31.08±0.75a62.05±1.75a2.13±0.05aD组GroupD1337.20±17.66a31.65±0.43a63.14±0.52a2.13±0.03a
同列数据肩标有相同字母或无字母表示差异不显著(P>0.05),不相同小写字母表示差异显著(P<0.05)
In the same row,values with the same letter superscripts or no letter superscripts mean no significant difference (P>0.05),while with different small letter superscripts mean significant difference (P<0.05)
2.3 回肠黏膜菌群结构的相似性聚类与动态变化分析
DGGE图谱(图1)显示,A、D两组基因组DNA的主要特征性条带相似(见标识1、2),1~28日龄两组的泳道条带数存在明显差异(见白色框)。BIO-RAD Quality One软件分析DGGE图谱发现(表2),1~28日龄两组鸡回肠黏膜细菌结构的相似性较低(40%~60%),35~42日龄相似性相对较高(70%~80%)。聚类分析发现(图2),A组和D组第42日龄聚为一大类,D组第1日龄至35日龄聚为一小类。动态变化趋势图分析发现(图3),1~42日龄时两组鸡回肠黏膜细菌结构发生变化的程度不同,1~28日龄A组的动态变化值(%change)为9%~33%,D组的动态变化值为17%~45%;35~42日龄A组的动态变化值仅为11%~17%,而D组均为33%。由此可见,在日粮中持续添加亚剂量硫酸新霉素,导致D组肉鸡1~35日龄回肠黏膜菌群结构发生极大变化,35~42日龄回肠黏膜菌群结构趋于稳定。
2.4 回肠黏膜菌群多样性指数分析
从现有回肠文库所包含信息量可知(表3),A组的库容值与D组相当,OTU(Operational Taxonomic Unit)、H′、E、DMa及D指数略高于D组,说明A组回肠黏膜菌群的多样性略高于D组,细菌多样性信息丰富,物种丰富度高。
2.5 回肠黏膜菌群随机克隆文库分析
由表4可知,A组回肠文库94个序列,共9个属,归为7个科和3个门;D组盲肠随机克隆文库93个序列,共6个属,归为6个科和3个门。两组中厚壁菌门(Firmicutes)所占比例最大,分别为95.74%和95.70%;其次是拟杆菌门(Bacteroidetes)、古细菌门(Euryarchaeota)、变形菌门(Proteobacteria)及放线菌门(Actinobacteria)分别占3.19%、1.06%、2.15%及2.15%。两组厚壁菌门中芽胞杆菌科(Bacillaceae)和乳杆菌科(Lactobacillaceae)所占比例最大,分别为51.06%、45.16%和38.30%、49.46%;A组中未知菌属(微杆菌属)所占克隆总数比例最大为48.94%(含46个克隆子),其次是乳杆菌属占38.30%(含36个克隆子);D组中乳杆菌属所占克隆总数比例最大为49.46%(含46个克隆子),其次是未知菌属(微杆菌属)占45.16%(含42个克隆子);A与D组回肠文库中其它菌属的种类与数量存在差异,且未发现与大肠杆菌相关的序列。由此可见,在日粮中长期添加亚剂量硫酸新霉素会影响42日龄岭南黄肉鸡回肠黏膜细菌的种类和组成比例。
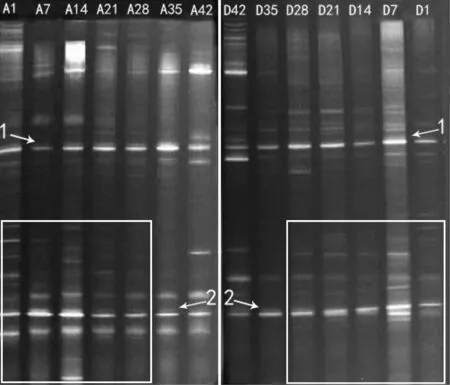
图1 两组肉鸡不同日龄回肠黏膜细菌基因组DNA的PCR-DGGE图Fig.1 Polymerase chain reaction-denaturing gradient gel electrophoresis (PCR-DGGE) profiles generated from the V3 region gene of 16S rDNA of the mucosa-associated microbiota of the intestinal segments from 1 to 42 days old
表2 A、D两组肉鸡回肠黏膜细菌相似性矩阵分析
Table 2 Analysis of the similarity matrix of the mucosa-associated microbiota in ileum between group A and D
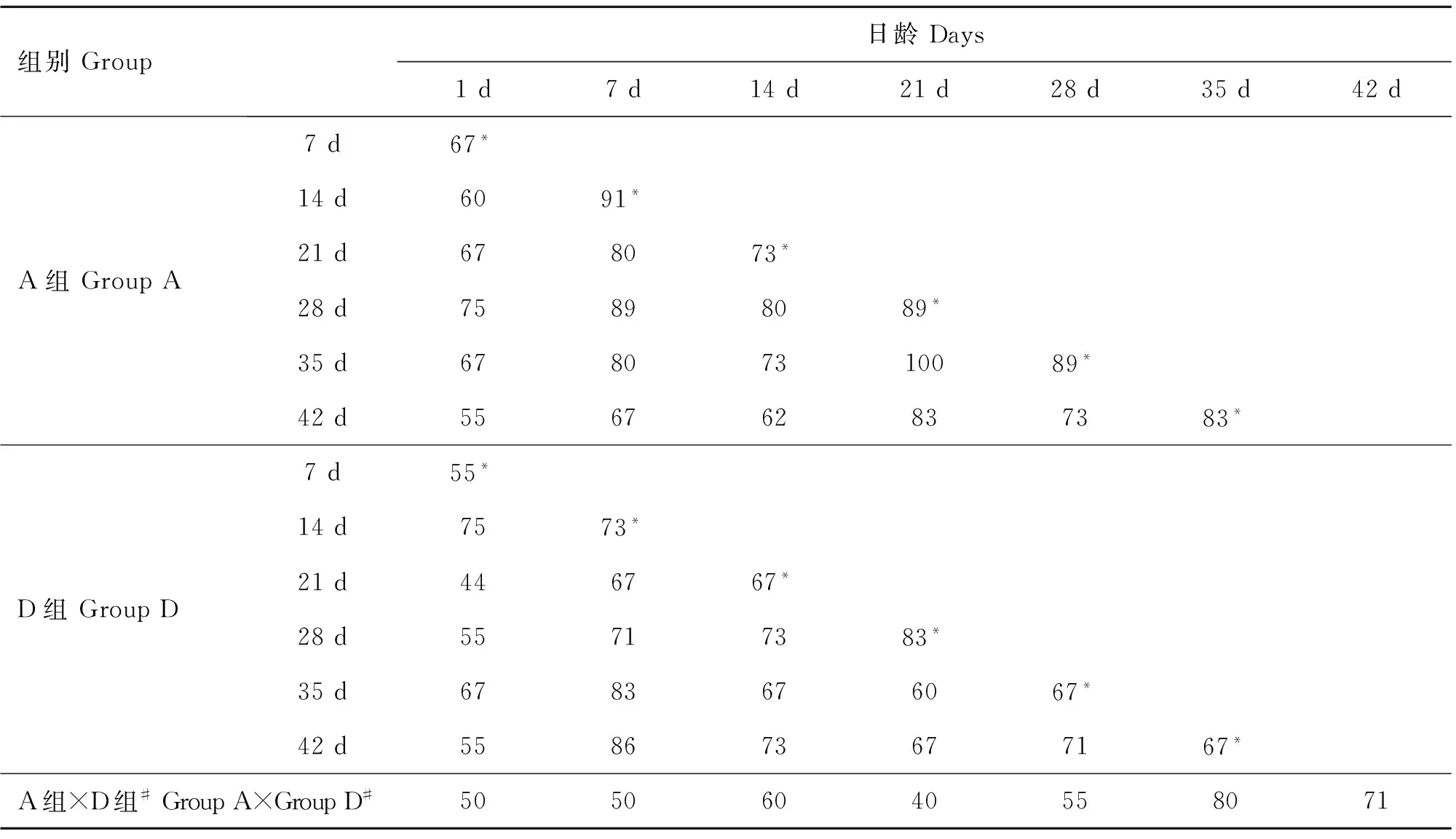
组别Group日龄Days1d7d14d21d28d35d42dA组GroupA7d67*14d6091*21d678073*28d75898089*35d67807310089*42d556762837383*D组GroupD7d55*14d7573*21d446767*28d55717383*35d6783676067*42d558673677167*A组×D组#GroupA×GroupD#50506040558071
*表示比较两个相邻时间点的相似性得出的数据;#指A、D两组同一日龄回肠黏膜细菌相似性比较
*Datas obtained from comparison of the similarity of the ileal mucosa-associated microbiota in group A (or group D) at two adjacent days of age;#Comparison of the similarity of the mucosa-associated microbiota in ileum between group A and D at 1,7,14,21,28,35 and 42 days old,respectively
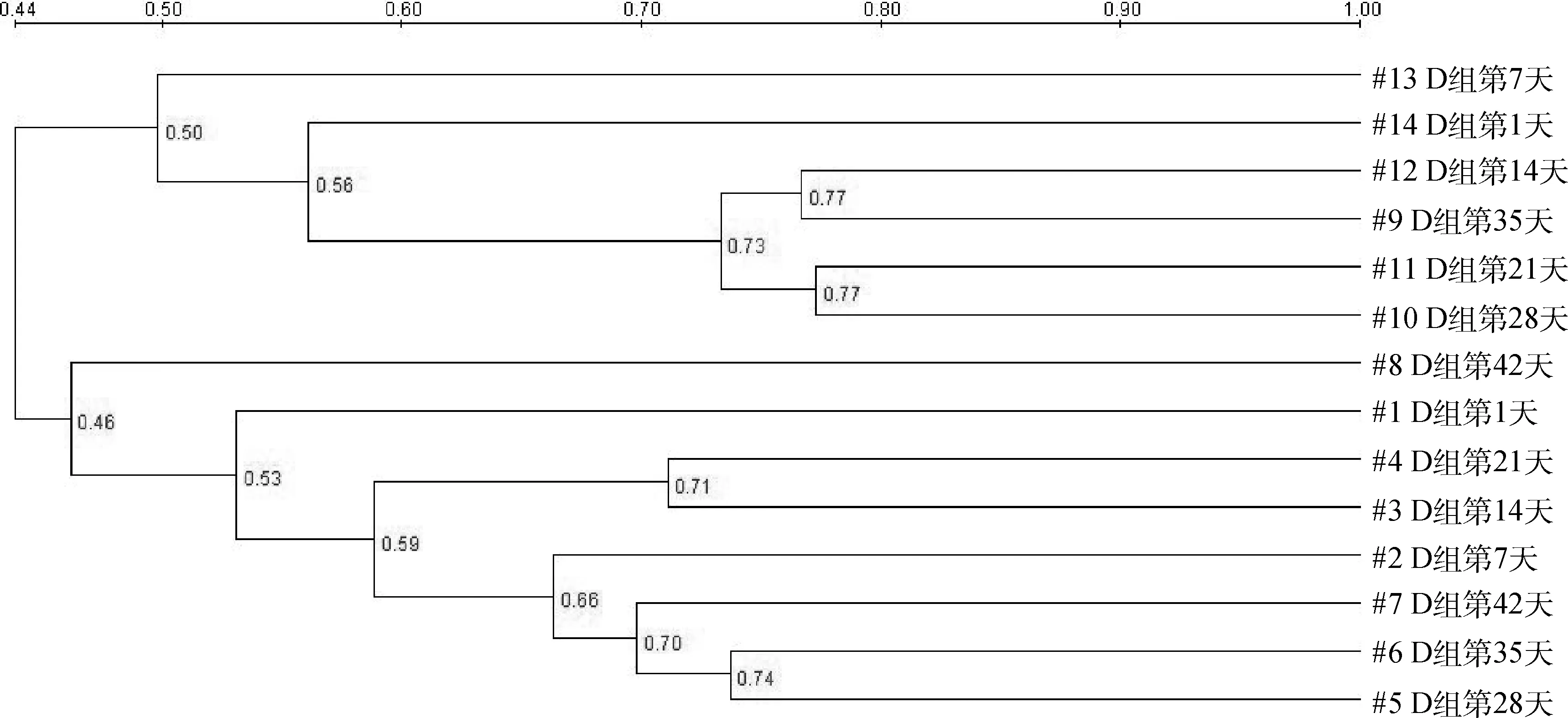
图2 两组肉鸡不同日龄回肠黏膜细菌相似性聚类树状图Fig.2 The similarity dendrogram of 16S rDNA of the mucosa-associated microbiota of ileum between group A and D at 1,7,14,21,28,35 and 42 days old,respectively
表3 A与D组岭南黄肉鸡42日龄回肠黏膜菌群多样性分析
Table 3 Analysis of the diversity of the mucosa-associated microbiota in ileum between group A and D at 42 days old

文库LibraryOTUs库容(C)Coverage指数(H')Shannon均匀度(E)Evenness丰富度(DMa)Richness(DMa)指数(D)SimpsonA组GroupA990.42%1.760.791.760.61D组GroupD693.55%1.350.751.100.55
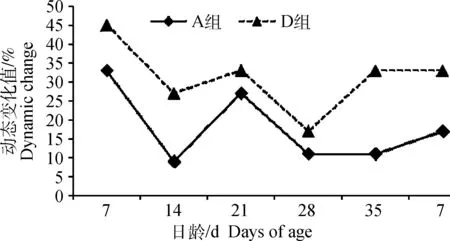
图3 A、D两组鸡回肠黏膜细菌随时间动态变化趋势Fig.3 The dynamic change trend curves of the mucosa-associated microbiota of ileum between group A and D at different days old
3 讨 论
栖居于动物肠道中不同种类、数量庞大的微生物对宿主的营养、生理及免疫产生深刻的影响[15-16]。从人和鸡胃肠道微生物丛的有关研究发现,胃肠道内容物和黏膜微生物丛的组成不同[17],研究黏膜微生物丛的组成和动态变化更能反映微生物丛与宿主的各种关系[18-19]。
表4 两组岭南黄肉鸡42日龄回肠黏膜细菌16S rDNA 随机克隆文库分析
Table 4 Analysis of the random clone library of 16S rDNA of the mucosa-associated microbiota in ileum between group A and D at 42 days old
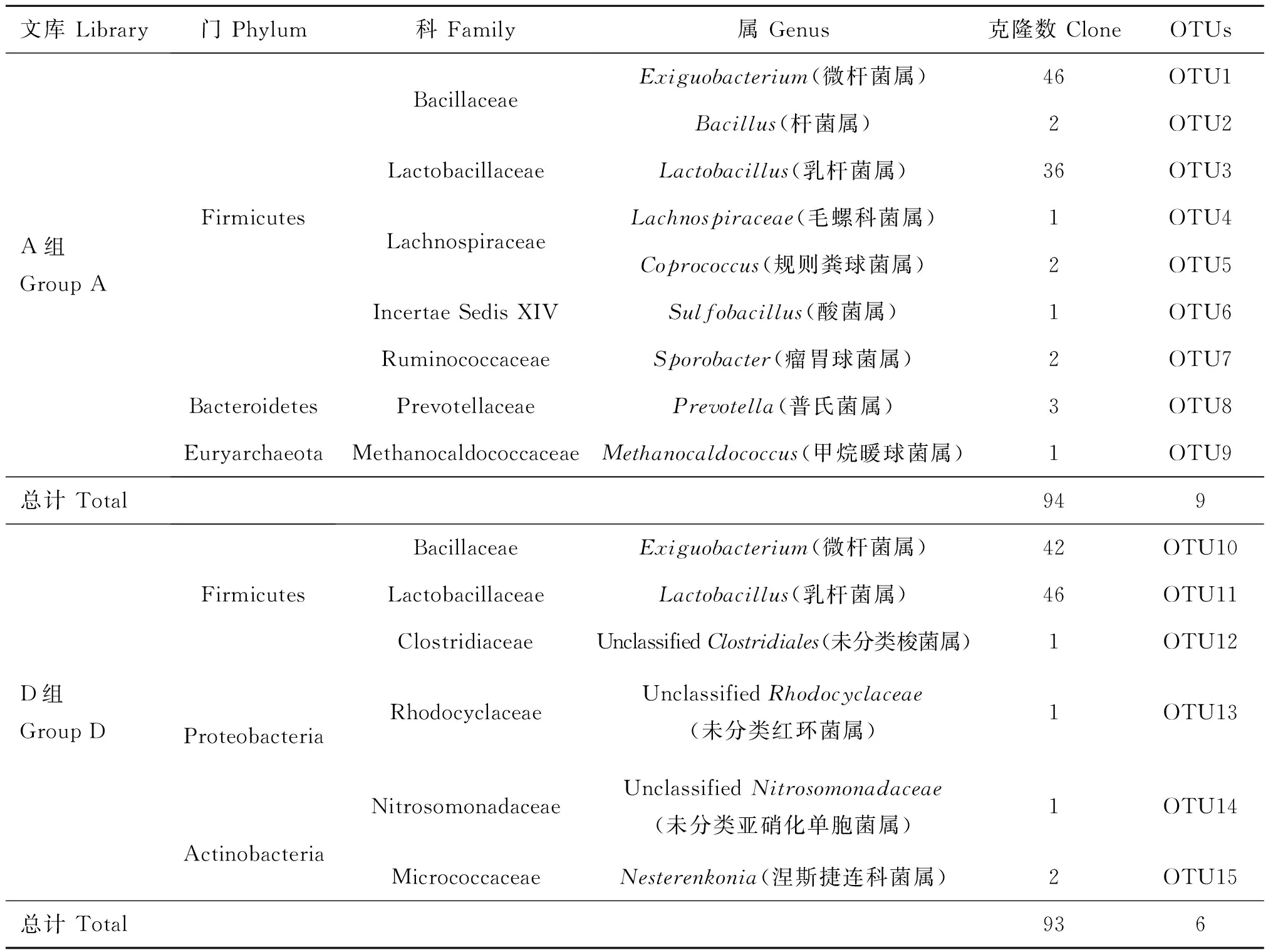
文库Library门Phylum科Family属Genus克隆数CloneOTUsA组GroupAFirmicutesBacteroidetesEuryarchaeotaBacillaceaeLactobacillaceaeLachnospiraceaeIncertaeSedisXIVRuminococcaceaePrevotellaceaeMethanocaldococcaceaeExiguobacterium(微杆菌属)46OTU1Bacillus(杆菌属)2OTU2Lactobacillus(乳杆菌属)36OTU3Lachnospiraceae(毛螺科菌属)1OTU4Coprococcus(规则粪球菌属)2OTU5Sulfobacillus(酸菌属)1OTU6Sporobacter(瘤胃球菌属)2OTU7Prevotella(普氏菌属)3OTU8Methanocaldococcus(甲烷暖球菌属)1OTU9总计Total949D组GroupDFirmicutesProteobacteriaActinobacteriaBacillaceaeExiguobacterium(微杆菌属)42OTU10LactobacillaceaeLactobacillus(乳杆菌属)46OTU11ClostridiaceaeUnclassifiedClostridiales(未分类梭菌属)1OTU12RhodocyclaceaeUnclassifiedRhodocyclaceae(未分类红环菌属)1OTU13NitrosomonadaceaeUnclassifiedNitrosomonadaceae(未分类亚硝化单胞菌属)1OTU14MicrococcaceaeNesterenkonia(涅斯捷连科菌属)2OTU15总计Total936
相似性≥95%序列列出;OTUs.Operational Taxonomic Units
Cloned sequence similarity≥95% was listed.OTUs.Operational Taxonomic Units
国外多数报道主要集中在常见几种抗生素促生长剂(AGPs)对鸡肠道内容物微生物丛的影响,如阿维霉素、亚甲基水杨酸杆菌肽、恩拉霉素、维吉霉素、抗球虫药盐霉素等[20-25]。然而,AGPs已被世界各国禁止在畜禽饲料中添加使用或限制其最高用量,近年来关于饲用抗生素与动物肠道微生态的报道文献极少。本研究旨在探讨允许使用药物硫酸新霉素(《中华人民共和国兽药典》一部)作为预防用药对黄羽肉鸡回肠黏膜菌群的影响,DGGE图谱分析发现,1~28日龄A、D两组鸡回肠黏膜细菌结构的相似性较低(40%~60%),D组肉鸡1~35日龄回肠黏膜菌群结构发生剧烈变化,35~42日龄回肠黏膜菌群结构趋于稳定,建立新的平衡。试验期间观察鸡食料、饮水等行为方面均表现正常,两组肉鸡生产性能差异不显著(P>0.05),显示了抗生素持续压力,造成肠道内环境发生改变,迫使黏膜细菌重新选择与定植,导致黏膜细菌的多样性相对减少(表3)和两组回肠文库中其他菌属的种类与组成比例存在差异(表4)。肠道菌群的稳定性取决于胃肠道的成熟,同时受诸多因素的影响,如年龄、饲料组分、抗生素、遗传基因等均可影响宿主的生产性能和肠道菌群,进而影响宿主的营养、生理及免疫[22,26-27]。
回肠文库发现(表4),两组42日龄岭南黄肉鸡回肠黏膜的优势菌群均是芽孢杆菌科菌属51.06%(48/94)和45.16%(42/93)及乳杆菌属38.30%(36/94)和49.46%(46/94),这与J.H.Gong等的研究报道有差异[30],研究结果显示6周龄ROSS肉鸡回肠黏膜的优势菌群为乳杆菌属45%(23/51)和肠球菌29%(15/51),这种差异有多种因素造成,我们推测主要原因是两种肉鸡遗传基因不同,导致肠道黏膜优势菌群选择的寄宿范围具有种属特异性;B.S.Lumpkings等[28]解释现代肉鸡比1957年雅典加拿大随机育成(ACR)的肉鸡有较大的屠体产量、高脂肪垫及屠体脂肪比例,其原因可能是遗传基因影响肠道菌群致使外源性食物能更好得满足宿主需求。遗传基因影响动物肠道菌群的组成已经被越来越多的研究证实[27-28,30],深入开展动物遗传基因与肠道黏膜某一特定菌群相关性研究将是未来的发展方向。抗生素的大量、违规使用,导致动物肠道菌群失调已形成共识,关于抗生素、肠腔微生物及黏膜微生物三者间的相互影响研究目前尚未清楚。本研究的结果发现,在日粮中长期添加亚剂量硫酸新霉素造成黄羽肉鸡回肠黏膜菌群的组成及数量发生变化,尤其是优势菌群的组成比例。由于本研究处于初步探索阶段,很多关于饲用抗生素与肠道黏膜菌群的相互影响需进一步研究,才能更深入地了解抗生素、肠道微生物及宿主之间的相互作用。
4 结 论
(1)DGGE图谱分析发现,A、D两组回肠黏膜细菌结构存在差异,1~28日龄两组的相似性为40%~60%,35~42日龄相似性为70%~80%;D组肉鸡1~35日龄回肠黏膜菌群结构发生剧烈的变化,其动态变化值为17%~45%;35~42日龄黏膜菌群结构趋于稳定,其动态变化值均为33%。
(2)A与D组42日龄岭南黄肉鸡回肠黏膜菌群的组成存在差异,尤其是优势菌群的组成比例。A组的优势菌群是未知菌属(微杆菌属)48.94%(46/94)和乳杆菌属38.30%(36/94);D组的优势菌群是乳杆菌属49.46%(46/93)和未知菌属(微杆菌属)45.16%(42/93)。
[1] WASKMAN S A,LECHEVALIER H A.Neomycin,a new antibiotic active against streptomycin-resistant bacteria,including tuberculosis organisms[J].Science,1949,109(2830):305-307.
[2] CLAROT I,REGAZZETI A,AUZEIL N,et al.Analysis of neomycin sulfate and framycetin sulfate by high-performance liquid chromatography using evaporative light scattering detection[J].JChromatograA,2005,1087:236-244.
[3] THONGSRISOMBOON P,LIAWRUANGRATH B,LIAWRUANGRATH S,et al.Flow injection chemiluminescence determination of Neomycin in pharmaceutical formulations[J].JFlowInjectionAnal,2010,27(1):36-41.
[4] ISOHERRANEN N,SOBACK S.Determination of gentamicins C1,C1a,and C2in plasma and urine by HPLC[J].ClinChem,2000,46(6):837-842.
[5] HUYGHEBAERT G,DUCATELLE R,IMMERSEEL F V.An update on alternatives to antimicrobial growth promoters for broilers[J].VetJ,2011,187(2):182-188.
[6] DIBNER J J,RICHARDS J D.Antibiotic growth promotersin agaculture:history and mode of action[J].PoultSci,2005,84(4):634-643.
[7] LI M,GONG J H,COTTRILL M,et al.Evaluation of QIAampR@DNA Stool Mini Kit for ecological studies of gut microbiota[J].JMicrobiolMeth,2002,54(1):13-20.
[8] 张 洁,容 庭,刘志昌,等.两纯系鸡胃肠道黏膜细菌l6S rDNA的PCR-DGGE分析比较[J].畜牧兽医学报,2013,44(2):204-210. ZHANG J,RONG T,LIU Z C,et al.Comparative analysis of 16S rDNA of the gastrointestinal mucosa-associated microbiota between two chicken pure lines by PCR-DGGE[J].ActaVeterinariaetZootechnicaSinica,2013,44(2):204-210.(in Chinese)
[9] 容 庭,张 洁,王 刚,等.16S rDNA克隆文库方法分析两纯系鸡回肠及盲肠细菌的组成[J].畜牧兽医学报,2014,45(8):1218-1227.
RONG T, ZHANG J, WANG G, et al. Analysis of composition of the mucosa-associated microbiota in ileum and cecum between two chicken pure lines by 16S rDNA clone library[J].ActaVeterinariaetZootechnicaSinica, 2014,45(8):1218-1227.(in Chinese)
[10] MUYZER G,DE WAAL E C,UITTERLINDEN A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S Rrna[J].ApplEnvironMicrobiol,1993,59(3):695-700.
[11] MARZORATI M,WITTEBOLLE L,BOON N,et al.How to get more out of molecular fingerprints:practical tools for microbial ecology[J].EnvironMicrobiol,2008,10(6),1571-1581.
[12] GOOD I L.The population frequencies of species and the estimation of population parameters[J].Biometrika,1953,40:237-264.
[13] ELISHAHED M S,SENKO J M,NAJAR F Z,et al.Bacterial diversity and sulfur cycling in a mesophilic sulfide-rich spring[J].ApplEnvironMicrobiol,2003,69(9):5609-5621.
[14] HILL T C J,WALSH K A,HARRIS J A,et al.Using ecological diversity measures with bacterial communities[J].FEMSMicrobiolEcol,2003,43(1):1-11.
[15] SAVAGE D C.Microbial ecology of the gastrointestinal tract[J].AnnuRevMicrobiol,1977,31(70):107-133.
[16] ZOETENDAL E G,COLLIER C T,KOIKE S,et al.Molecular ecological analysis of the gastrointestinal microbiota:A review[J].JNutr,2004,134(2):465-472.
[17] ZHU X Y,ZHONG T,PANDYA Y,et al.16SrRNA-based analysis of microbiota from the cecum of broiler chickens[J].ApplEnvironMicrobiol,2002,68(1):124-137.
[18] ZOETENDAL E G,VON WRIGHT A,VILPPONEN-SALMELA T,et al.Mucosa-associated bacteria in the human gastrointestinal tract are uniformly distributed along the colon and differ from the community recovered from feces[J].ApplEnvironMicrobiol, 2002,68(7):3401-3407.
[19] LEPAGE P,SEKSIK P,SUTREN M,et al.Biodiversity of the mucosa-associated microbiota is stable along the distaldigestive tract in healthy individuals and patients with IBD[J].InflammBowelDis, 2005,11(5):473-480.
[20] KNARREBORG A,SIMON M A,ENGBERG RMJENSEN B B,et al.Effects of dietary fat source and subtherapeutic levels of antibiotic on the bacterial community in the ileum of broiler chickens at various ages[J].ApplEnvironMicrobiol,2002,68(12):5918-5924.
[21] SMIRNOV A,PEREZ R,AMIT-ROMACH E,et al.Mucin dynamics and microbial populations in chicken small intestine are changed by dietary probiotic and antibiotic growth promoter supplementation[J].JNutr,2005,135(2):187-192.
[22] PEDROSO A A,MENTEN J F M,LAMBAIS M R,et al.Intestinal bacterial community and growth performance of chickens fed diets containing antibiotics[J].PoultSci,2006,85(4):747-752.
[23] DUMONCEAUX T J,HILL J E,SEAN M,et al.Characterization of intestinal microbiota and response to dietary virginiamycin supplementation in the broiler chicken[J].ApplEnvironMicrobiol,2006,72(4):2815-2823.
[24] ZHOU H,GONG J,BRISBIN J T,et al.Appropriate chicken sample size for identifying the composition of broiler intestinal microbiota affected by dietary antibiotics,using the Polymerase Chain Reaction-Denaturing Gradient Gel Electrophoresis Technique[J].PoultSci,2007,86(12):2541-2549.
[25] JOHANSEN C H,BJERRUM L, PEDERSEN K.Impact of salinomycin on the intestinal microflora of broiler chickens[J].ActaVetScand,2007,49(1):30.
[26] VAN HEMERT S,HOEKMAN A J,SMITS M A,et al.Gene expression response to aSalmonellainfection in the chicken intestine differ between lines[J].VetImmunolImmunopathol, 2006,114(3-4):247-258.
[27] BJERRUM L,PEDERSEN K,ENGBERG R M.The influence of whole wheat feeding onSalmonellainfection and gut flora composition in broilers[J].AvianDis,2005,49(1):9-15.
[28] LUMPKINGS B S,BATAL A B,LEET M D.Evaluation of the bacterial community and intestinal development of different genetic lines of chickens[J].PoultSci,2010,89(8):1614-1621.
[29] GONG J H,FORSTER R J,YU H,et al.Molecular analysis of bacterial populations in the ileum of broiler chickens and comparison with bacteria in the cecum[J].FEMSMicrobiolEcol,2002,41(3):171-179.
(编辑 白永平)
Impact of Subclinical Doses of Neomycin Sulfate on the Ileal Mucosa-Associated Microbiota Composition of Broiler Chickens
RONG Ting1,LIU Zhi-chang1,WANG Gang1,LI Shu-hong1,ZHANG Jie1,CAI Zhui1,CHEN Zhuang2*
(1.StateKeyLaboratoryofLivestockandPoultryBreeding,GuangdongPublicLaboratoryofAnimalBreedingandNutrition,GuangdongKeyLaboratoryofAnimalBreedingandNutrition,InstituteofAnimalScience,GuangdongAcademyofAgriculturalSciences,Guangzhou510640,China;2.GuangdongAcademyofAgriculturalSciences,Guangzhou510640,China)
The experiment was conducted to study on the effects of subclinical doses of neomycin sulfate on the ileal mucosa-associated microbiota (MAM) composition and dynamic change of broiler chickens at 1 to 42 days old.Chicken ileal segments were collected in group A (basal diet) and B (basal diet with 50 mg·kg-1Neomycin Sulfate),and MAM DNA were extracted at day 1,7,14,21,28,35 and 42,respectively.The community of the ileal MAM between two groups were analyzed by Polymerase chain reaction-denaturing gradient gel electrophoresis (PCR-DGGE)at various ages,and the random clone library of 16S rDNA V3 region of the MAM in ileum at 42 days old between Group A and D was established by analysis of 16S rDNA gene sequences.DGGE profiles showed that the structure of the MAM in ileum between the two groups were of remarkable difference during day 1-28,and the similarity of the MAM in ileum was 40%-60%.The alterations of MAM of ileum were remarkably different between the two groups during day 1-35,with 9%-33% change in group A and 17%-45% change in group D.Analysis of the library in ileum indicated that nine operational taxonomic units (OTUs) (form 94 gene sequences or clones) were detected in the group A,as compared with 6 OTUs (form 93 clones) in the group D.ExiguobacteriumandLactobacilluswere predominant in the group A and D,counting for 48.94%,38.30% and 45.16%,49.46%, respectively.The amount of other species found in ileum in group A were different from that in group D.In addition,sequence known being related toColibacilluswere not detected in group A and D.These results indicated that the composition and diversity of the MAM in ileum at day 42 does exist difference between group A and D,especially the proportion ofLactobacillus,these difference might be caused by the continuous antibiotic pressure selection.
neomycin sulfate;lingnan yellow broiler;intestinal mucosa-associated microbiota;16S rDNA clone library
11.11843/j.issn.0366-6964.2016.11.019
2016-06-15
广东省科技计划项目(2009B020307001);广东省农业科学院院长基金项目(201621)
容 庭(1983-),男,海南乐东人,硕士,高级畜牧师,主要从事动物肠道微生态研究,E-mail: blueskyrt@163.com
*通信作者:陈 庄(1963-),男,研究员,硕士生导师,E-mail: Chenzh1963@vip.sina.com
S852.6
A
0366-6964(2016)11-2301-09
