吡格列酮对MZT期小鼠胚胎发育阻滞的影响
2016-12-13徐礼杰李钟淑方南洙
徐礼杰,李钟淑,方南洙
(延边大学农学院 动物科学系,延边 133002)
吡格列酮对MZT期小鼠胚胎发育阻滞的影响
徐礼杰,李钟淑,方南洙*
(延边大学农学院 动物科学系,延边 133002)
本研究旨在了解活性氧(Reactive oxygen species,ROS)、发育阻滞与抗氧化物吡格列酮(Pioglitazone,PIO)之间的关系。试验分3组:对照组、H2O2处理组和H2O2+PIO处理组。通过H2O2建立小鼠胚胎氧化损伤模型,添加抗氧化物质PIO对胚胎进行氧化修复, DCHFDA测定胚胎内部ROS水平,半定量PCR测定母型-合子型胚胎内部相关母性效应基因和合子型基因的表达。结果表明:(1)1-细胞和2-细胞胚胎H2O2处理组的ROS水平明显比对照组和H2O2+PIO处理组的高(P<0.05);(2)H2O2处理组的2-细胞向4-细胞过渡率明显比对照组和H2O2+PIO处理组低(P<0.05),但各处理组之间1-细胞向2-细胞过渡率差异不显著(P>0.05);(3)H2O2处理组的母性效应基因Hsf1、Zfp3612、Zp3和合子型基因Eif1-α、Zscan4d和Muerv-L的表达明显比对照组和H2O2+PIO处理组低(P<0.05)。综上表明,氧化应激通过下调2-细胞胚胎母型效应基因和合子型基因表达,导致小鼠胚胎2-细胞发育阻滞,抗氧化物质吡格列酮可促进胚胎发育,有效克服胚胎体外2-细胞发育阻滞现象。
吡格列酮;氧化应激;发育阻滞;母性效应基因;合子型基因
小鼠胚胎早期发育期间,2-细胞胚胎形成标志着胚胎发育从母性效应基因向合子型基因过渡(Maternal to Zygotic transition, MZT)[1],这是大部分多细胞动物的一个现象[2]。卵子发生时期,卵母细胞合成母性效应mRNA和蛋白质直至卵子形成,这些物质将执行早期胚胎生物合成,指导第一次减数分裂以及指定最初的细胞命运和模式[3]。受精后,卵母细胞启动母性mRNA降解,这个过程是在2-细胞末期完成的。随着母性效应mRNA降解,受精卵的合子型基因激活(Zygotic gene activation, ZGA)并进一步加快母性mRNA降解[3]。胚胎的发育调控实现从母性效应基因向合子型基因过渡,合子型转录物指导胚胎进一步发育。因此,ZGA是胚胎继续发育的基本条件。延伸启动因子1a(Elongation initiation factor 1a, Eif1-a)、热休克蛋白70.1(Heat-shock protein 70.1, Hsp70.1)、鼠内源逆转录病毒样基因(Murine endogenous retrovirus-like, Muerv-L)以及锌指和SCAN结构域4d(Zinc finger and SCAN domain-containing protein 4d, Zscan4d)是ZGA的内源性标记基因[4]。通过基因敲除的方法,越来越多的母性效应基因及其功能得到确认。如早期胚胎中缺失热休克因子1(Heat-shock factor 1, Hsf1)[5]、合子阻滞因子1(Zygote arrest 1, Zar1)[6]等将会导致胚胎1-细胞发育阻滞,缺失ZFP36环指蛋白2(ZFP36 ring finger protein like 2, Zfp36l2)[7]、透明带蛋白3(Zona pellucida protein 3, Zp3)[8]、胚胎必要的母体抗原(Maternal antigen that embryos require, Mater)[9]等导致2-细胞发育阻滞。
在体外培养过程中,许多胚胎由于ZGA延迟导致胚胎发育阻滞而死亡[10]。小鼠胚胎发育阻滞通常发生在2-细胞时期而被称为“2-细胞发育阻滞”。在过去的几十年里,人们花费了大量时间去探究2-细胞阻滞的原因。M.H.Nasr-Esfahani等[11]通过分析小鼠植入前胚胎中H2O2水平发现,2-细胞中期小鼠胚胎中H2O2含量上升,这个时期刚好与小鼠胚胎ZGA时期相吻合。因此,有学者将小鼠2-细胞发育阻滞与胚胎内部上升的活性氧(Reactive oxygen species,ROS)水平相关并证实高浓度ROS抑制胚胎分裂,影响母性效应基因向合子型基因过渡[12]。孕前砷暴露可导致胚胎ROS水平明显升高[13],使小鼠植入前胚胎大部分阻滞在1-细胞和2-细胞。此外,培养基中添加过氧化氢酶抑制剂可导致胚胎发育阻滞的发生[14]。结果表明,ROS是导致哺乳动物胚胎体外发育阻滞的原因之一。
活性氧是指氧自由基和氧化作用较强的非自由基含氧产物。体外培养条件能造成各种细胞应激因子增加,包括氧化剂和异常细胞成分[15],从而导致体外胚胎ROS积累,降低胚胎的质量[16]和阻碍胚胎的发育[17]。利用抗氧化酶能够提高胚胎体外发育效率,降低胚胎氧化应激,如CAT[18]、SOD[18-19]和GSH[20]。PPARγ被认为是一种新型的抗氧化因子[21],参与氧化应激相关信号通道中。PPARγ可增加NRF2表达,激活的NRF2可促进ARE介导抗氧化基因表达[22-24]。PPARγ可抑制ROS主要生产场所之一的NADPH氧化酶的表达[25]。PPARγ的其中一种特异性激动剂,吡格列酮可降低NOX1的mRNA和蛋白水平以及NADPH氧化酶活性,提高抗氧化物Cu/Zn-SOD和Mn-SOD蛋白的水平,从而调节细胞内部ROS水平[26]。
本研究通过检测氧化损伤胚胎及吡格列酮修复氧化损伤胚胎中相关母性效应基因和合子型基因的表达水平,进一步探明ROS、胚胎发育阻滞与吡格列酮的关系,为吡格列酮抑制ROS诱导的胚胎发育阻滞提供理论依据。
1 材料与方法
1.1 试验动物
所用的动物为性成熟的昆明白系小鼠,购自延边大学实验动物中心。饲养在24 ℃环境中,光周期为12 h(8:00-20:00),暗周期为12 h(20:00-8:00)。
1.2 试剂
孕马血清促性腺激素(PMSG)、人绒毛膜促性腺激素(hCG)购自宁波激素有限公司;吡格列酮(Pioglitazone, PIO)购自Selleckchem;Qiagen RNeasy Mini Kit试剂盒购自凯杰公司;PrimeScriptTMRT reagent Kit with gDNA Eraser购自宝生物公司;2×Taq PCR MasterMix购自天根基因公司;其他相关药品非特殊说明均购自Sigma公司。
1.3 试验方法
1.3.1 胚胎的收集及培养 挑选健康母鼠于第1天的17:00腹腔注射10 IU PMSG,时隔48 h腹腔注射10 IU hCG,然后与公鼠1∶1合笼,合笼15 h后检查阴道栓。注射hCG 22 h后,脱颈处死见栓母鼠,打开腹腔取出输卵管,显微镜下挑破输卵管壶腹部。300 mg·L-1透明质酸酶脱去卵丘细胞,然后用M2清洗3遍,除去透明质酸酶。收集的胚胎在相应培养液中清洗3遍后,转移到相应培养液小滴中,在饱和湿度、5% CO2气相条件、37 ℃的培养箱中培养48 h,之后将其换成M16培养液孵育。
1.3.2 氧化损伤以及氧化修复胚胎模型的建立 收集的胚胎置于25 μmol·L-1的H2O2中孵育30 min后,分别在M16培养液和添加有5 μmol·L-1吡格列酮的培养液中清洗3遍,转移到相应培养液小滴中进行培养。未经H2O2处理的胚胎用作对照组。
1.3.3 胚胎内部ROS含量的检测 胚胎置于1 g·L-1PVA小滴中,洗涤2遍,然后避光置于10 μmol·L-1的2’7’-二氯荧光素二乙酸盐(DCHFDA)染色液微滴中,放入培养箱孵育15 min。将孵育后的胚胎用M2洗3遍,在荧光显微镜下荧光显色。用Image J 1.49对荧光图片量化分析,结果用平均相对荧光强度相对值表示。
Type: Vietnam. Transplant collected from Son La Province, Van Ho District, Tan Xuan Municipality, Cot Moc Village, at ca. 1000 m a.s.l. 20°40′33.3″N, 104°39′0.3″E, 10 Nov 2015, L. Averyanov, CPC 7158a,b /13279 (holotype, LE, not seen).
1.3.4 总RNA的提取及cDNA合成 胚胎培养5和20 h,分别收集1-细胞和2-细胞胚胎各200个。胚胎总RNA提取根据Qiagen RNeasy Mini Kit试剂盒用法说明进行操作。总RNA提取后,根据PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒用法说明进行反转录。合成的cDNA保存在-20 ℃备用。
1.3.5 半定量PCR 应用2×Taq PCR Master Mix进行PCR反应,25 μL体系:模板4 μL,5 μmol·L-1上下游引物(表1)各1 μL,2×TaqPCR MasterMix 13 μL,ddH2O26 μL。反应程序:95 ℃预变性3 min; 95 ℃变性30 s, 59~64 ℃退火30 s,72 ℃延伸30 s,共40个循环; 72 ℃延伸5 min。5 μL的PCR产物用于1%琼脂糖凝胶电泳检测,随后用Lane 1D Analysis Software进行IOD值分析。
表1 引物序列
Table1 Primer sequences

引物名称Primername基因链接号AccessionNo.上游引物(5'-3')Forwardprimer下游引物(5'-3')Reverseprimer退火温度/℃Annealingtemperature扩增产物/bpProductHsf1NM008296ACAACAACATGGCTAGCTTCGGGAGTCCATACACTCCTGTTT59901Zar1NM174877CTCAGGACCCCGGTGATTCACTCGGCAGAACTGTTTGA592050Zfp36l2NM001001806CCTCCTTTGTGGTGGTTGTTACACTACGTGGTGGCAATGA59121MaterNM011860GAGCATCATGGAGGTGAAGAGCTTCTGGTTAATCAGCAGCCA59301ZP3NM011776ATGGCGTCAAGCTATTTCCTCCGTGCCAAAAAGGTCTCTACT59186Zscan4dNM001100186CCATCTCATAGTTCTGGTGTGCGCTCCTTAGTCTGCTTTTCTGG59166Eif1aNM010120CCAAAGAATAAAGGCAAAGGAGCTCACACCGTCAAAGCACATT59164Hsp70.1NM010478AAGAGGAAGCACAAGAAGGACAGCGTGATGGATGTGTAGAAGTC59160Muerv-LY12713CGCACAGCAGCAGTCTATTATCTCTTCTCCTCTTCGGTCAGTTG64203GAPDHBC023196CATCACCATCTTCCAGGAGCGGAGGGGCCATCCACAGTCTTC59357
1.4 数据分析
数据应用SPSS 17.0进行差异显著性分析,结果用“平均值±SEM”表示,P<0.05表示差异显著。
2 结 果
2.1 吡格列酮对小鼠1-细胞发育的影响
2.1.1 吡格列酮对小鼠胚胎1-细胞向2-细胞过渡的影响 H2O2诱导小鼠胚胎氧化损伤后,再经5 μmol·L-1吡格列酮处理,其对胚胎1-细胞期过渡到2-细胞期的影响见表2,重复5次。对照组、H2O2处理组和H2O2+PIO处理组的1-细胞向2-细胞过渡率无显著性差异(P>0.05)。说明H2O2不会对小鼠胚胎1-细胞发育形成阻滞。
表2 吡格列酮对小鼠1-细胞胚胎向2-细胞过渡的影响
Table 2 The effect of pioglitazone on mouse 1-cell embryos to 2-cell transition
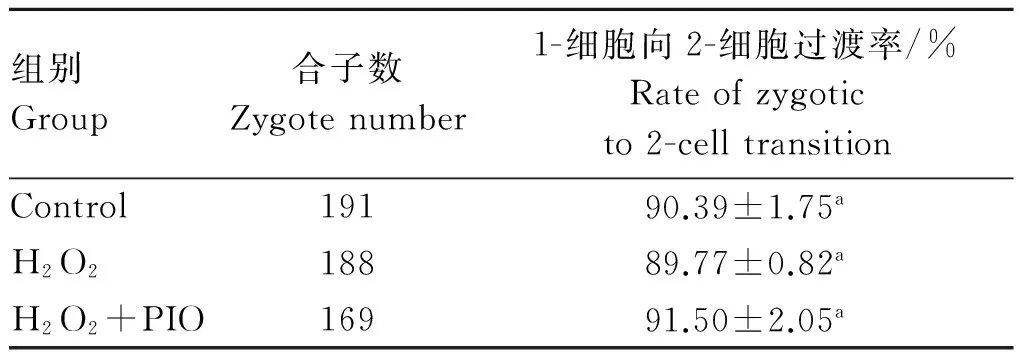
组别Group合子数Zygotenumber1-细胞向2-细胞过渡率/%Rateofzygoticto2-celltransitionControl19190.39±1.75aH2O218889.77±0.82aH2O2+PIO16991.50±2.05a
同一列不同字母代表处理组之间存在显著差异(P<0.05)。下同
Different letters in the same column means significant difference between the treatments (P<0.05). The same as below
2.1.3 吡格列酮对小鼠1-细胞胚胎母性效应基因表达的影响 1-细胞胚胎母性效应基因电泳条带见图2A,其量化结果见图2B。H2O2处理组母性效应基因Hsf1的表达水平明显比对照组和H2O2+PIO处理组低(P<0.05),但H2O2+PIO处理组仍显著低于对照组(P<0.05)。Zar1在H2O2处理组和H2O2+PIO处理组中均没有表达。
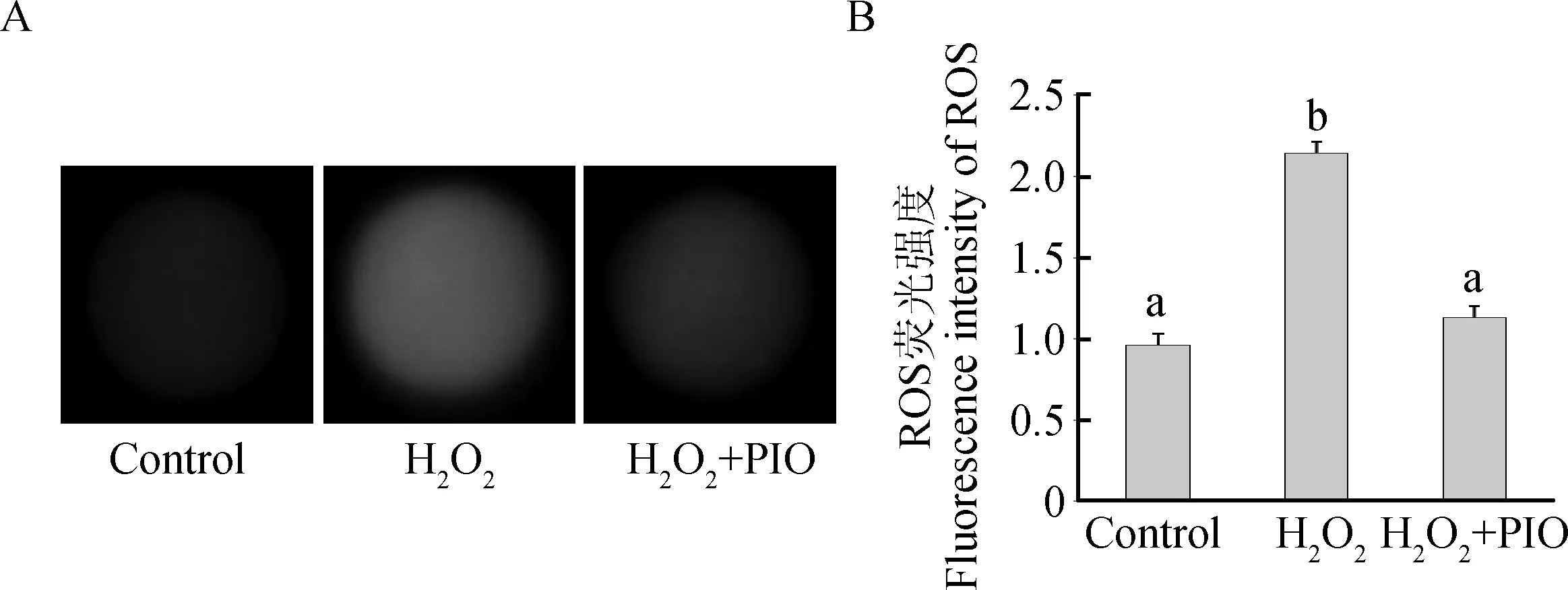
A.1-细胞胚胎内部ROS荧光染色图(10×40);B.1-细胞胚胎内部ROS荧光强度图A. Fluorescence imaging of ROS in 1-cell embryos(10×40);B.Fluorescence intensity of ROS in 1-cell embryos图1 1-细胞胚胎ROS荧光染色图及其量化图Fig.1 Fluorescence imaging of ROS and quantification in 1-cell embryos
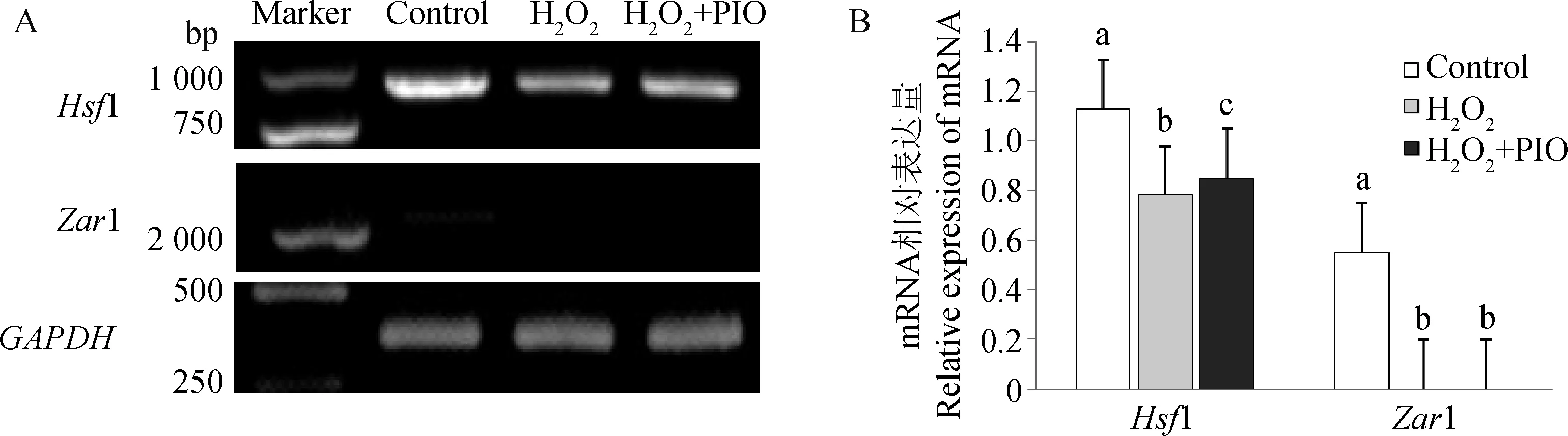
A.Hsf1、Zar1和GAPDH基因PCR扩增产物1%琼脂糖凝胶电泳图;B.Hsf1和Zar1基因mRNA相对表达量A.1% agarose gel electrophoresis for the PCR amplification products of the Hsf1, Zar1 and GAPDH; B.Relative expression of Hsf1 and Zar1图2 小鼠胚胎1-细胞期母性效应基因的表达Fig.2 The expression of maternal-effect genes in mouse 1-cell embryos
2.2 吡格列酮对小鼠2-细胞发育的影响
2.2.1 吡格列酮对小鼠胚胎2-细胞向4-细胞过渡的影响 H2O2诱导小鼠胚胎氧化损伤后,再经5 μmol·L-1吡格列酮处理,其对胚胎2-细胞向4-细胞过渡的影响见表3,试验重复5次。对照组和H2O2+PIO处理组的2-细胞向4-细胞过渡率显著比H2O2处理组高(P<0.05)。初步说明H2O2参与小鼠2-细胞胚胎发育阻滞。
2.2.2 吡格列酮对小鼠2-细胞胚胎ROS的影响 收集各处理组2-细胞胚胎,DCHFDA避光染色后,蓝色波长光(535 nm)激发,荧光显微镜下观察ROS的荧光强度(图3A),荧光图片量化分析见图3B。对照组和H2O2+PIO处理组在2-细胞时期显著低于H2O2处理组(P<0.05),而对照组与H2O2+PIO处理组没有显著性差异(P>0.05)。
表3 吡格列酮对小鼠2-细胞胚胎向4-细胞过渡的影响
Table 3 The effect of pioglitazone on mouse 2-cell embryos to 4-cell transition
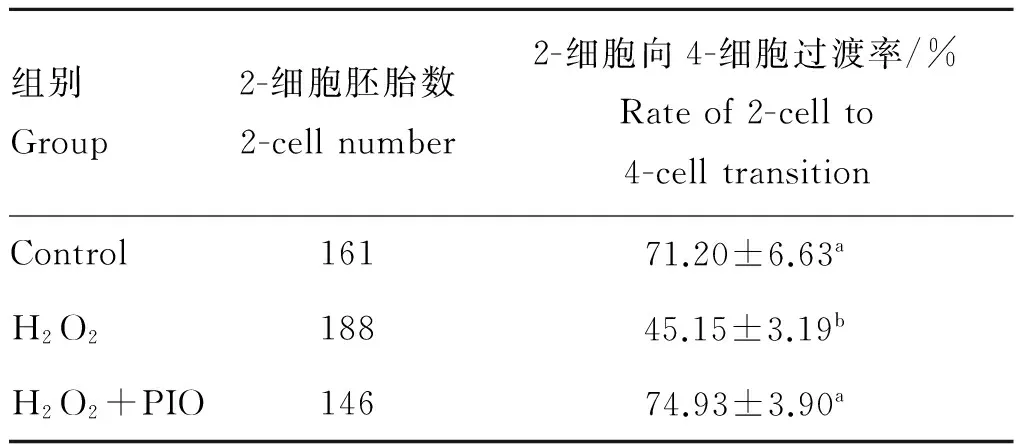
组别Group2-细胞胚胎数2-cellnumber2-细胞向4-细胞过渡率/%Rateof2-cellto4-celltransitionControl16171.20±6.63aH2O218845.15±3.19bH2O2+PIO14674.93±3.90a
2.2.3 吡格列酮对小鼠2-细胞胚胎母性效应基因表达的影响 2-细胞胚胎母性效应基因电泳条带见图4A,其量化结果见图4B。H2O2均能降低母性效应基因Mater、Zfp3612和Zp3的表达水平(P<0.05)。添加吡格列酮后,Zfp3612和Zp3的表达水平显著比H2O2处理组高(P<0.05),但仍然显著低于对照组(P<0.05)。H2O2+PIO处理组Mater的表达水平比H2O2处理组低(P>0.05)。
2.3 吡格列酮对2-细胞胚胎合子基因表达的影响
2-细胞胚胎合子型基因电泳结果见图5A,其量化结果见图5B。H2O2均能降低合子型基因的表达水平,其中Eif1a、Muerv-L和Zscan4d显著下降(P<0.05)。添加吡格列酮后,Eif1a、Hsp70.1、Muerv-L和Zscan4d的表达水平显著比H2O2处理组高(P<0.05)。
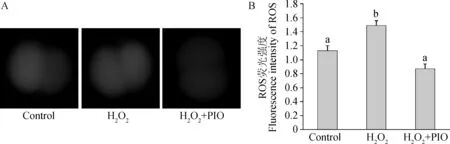
A.2-细胞胚胎内部ROS荧光染色图(10×40);B.2-细胞胚胎内部ROS荧光强度图A.Fluorescence imaging of ROS in 2-cell embryos(10×40);B.Fluorescence intensity of ROS in 2-cell embryos图3 2-细胞胚胎ROS荧光染色图及其量化图Fig.3 Fluorescence imaging of ROS and quantification in 2-cell embryos
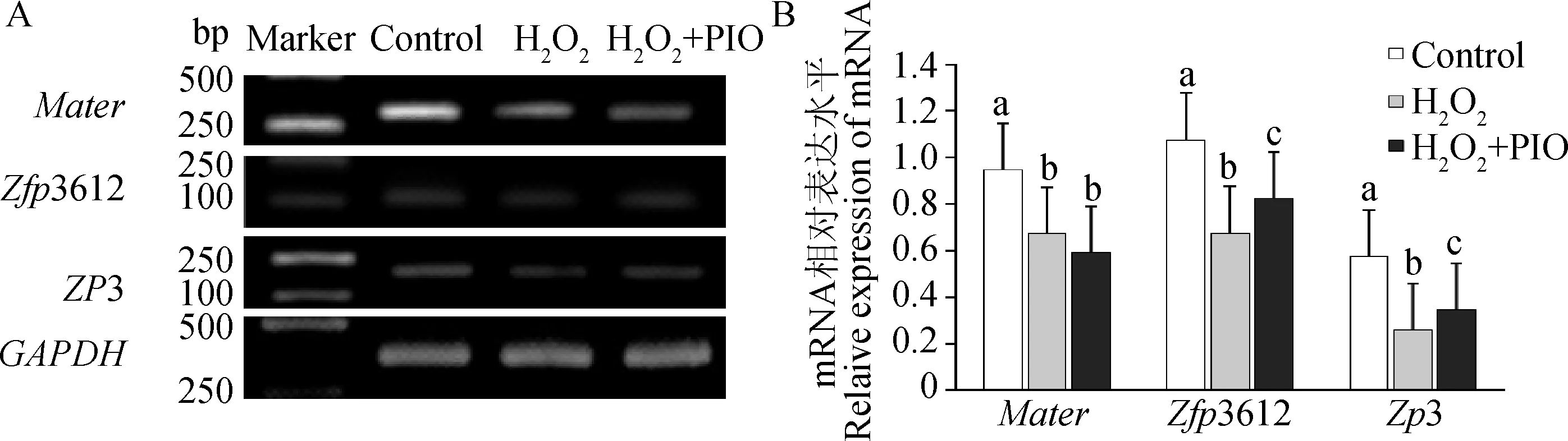
A.Mater、Zfp3612、Zp3和GAPDH基因PCR扩增产物1%琼脂糖凝胶电泳图;B.Mater、Zfp3612和Zp3基因mRNA相对表达量A.1% agarose gel electrophoresis for the PCR amplification products of the Mater,Zfp3612,Zp3 and GAPDH; B.Relative expression of Mater,Zfp3612 and Zp3图4 小鼠胚胎2-细胞母性效应基因的表达Fig.4 The expression of maternal-effect genes in mouse 2-cell embryos
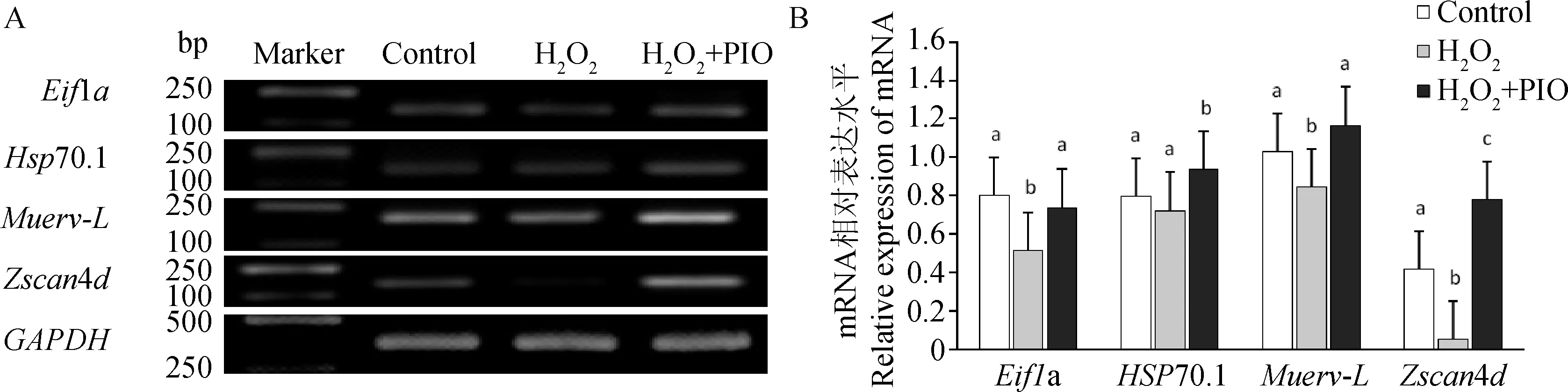
A. Eif1a、Hsp70.1、Muerv-L、Zscan4d和GAPDH基因PCR扩增产物1%琼脂糖凝胶电泳图;B. Eif1a、Hsp70.1、Muerv-L和Zscan4d基因mRNA相对表达量A.1% agarose gel electrophoresis for the PCR amplification products of the Eif1a,Hsp70.1,Muerv-L,Zscan4d and GAPDH; B.Relative expression of Eif1a,Hsp70.1,Muerv-L and Zscan4d图5 小鼠胚胎2-细胞合子基因的表达Fig.5 The expression of zygotic genes in mouse 2-cell embryos
3 讨 论
已有研究报道,PPARγ激动剂具有抗氧化效果。GW1929可增加人多巴胺能神经元活性和保护它们免受H2O2诱导的氧化应激伤害[27]。罗格列酮通过上调UCP2的表达减轻ROS损伤以及血管平滑肌增殖和迁移,从而抑制内膜增生相关的血管疾病[28]。吡格列酮通过调控人冠状动脉内皮细胞的脂过氧化反应,改善TNF-α诱导的氧化应激,从而减少细胞凋亡[29]。本研究通过DCHFDA测定2-细胞期胚胎内部ROS水平时发现,H2O2+PIO处理组的ROS水平显著低于H2O2处理组,证实吡格列酮能够降低H2O2诱导的胚胎内部ROS水平。
导致胚胎体外发育阻滞可分为外因和内因。外因是指植入前胚胎体外培养过程中,培养液的高渗透压、辐射、胚胎代谢和试验操作都会使胚胎产生过多ROS[13]。由于植入前胚胎尚不具有成熟的抗氧化系统,因此早期胚胎对氧化应激十分敏感,容易导致胚胎发育阻滞或延迟[13-14]。在CZB培养液中,谷氨酰胺被用来替代葡萄糖作为能量物质,其在克服2-细胞发育阻滞中起到积极作用[30]。这是由于CZB培养液中缺少由葡萄糖引起氧化应激[31],这间接说明了ROS是导致小鼠2-细胞发育阻滞的原因之一。本研究中,H2O2诱导胚胎氧化应激并不能导致小鼠1-细胞胚胎发育阻滞,但可明显导致小鼠2-细胞胚胎发育阻滞,添加吡格列酮后可有效改善小鼠2-细胞胚胎发育阻滞。
此外,胚胎发育阻滞也受内因影响。受精前,卵母细胞在体内储备大量母性效应转录物和蛋白质,这些物质在ZGA前指导和调控胚胎早期发育,如果卵母细胞或胚胎中ROS积聚,造成母性效应基因损伤或减少,将危害随后的细胞分裂[13]。J.T.Flood等[32]通过转胞浆的研究提出,早期发育胚胎内母型mRNA缺乏可导致胚胎发育阻滞。本试验通过测定1-细胞胚胎母性效应基因Hsf1、Zar1以及2-细胞母性效应基因Mater、Zfp36l2、Zp3的mRNA表达,证实H2O2可加快胚胎内部母性效应基因的降解,吡格列酮可延缓氧化损伤胚胎部分母性效应基因的减少,促进胚胎的发育。虽然H2O2导致Hsf1、Zar1表达量明显下降,但是并没有使胚胎发生1-细胞阻滞,这可能是氧化应激初期,胚胎内部结构和功能还完善,母型效应因子储备量充足,从而使合子顺利过渡到2-细胞。至于本次研究中Zar1经过处理后H2O2不显条带,可能是由于胚胎发育初期Zar1的表达量开始迅速下降[6],再加上H2O2使部分Zar1降解,以致电泳不足以显示微量DNA条带的缘故。
2-细胞胚胎向4-细胞胚胎过渡还需要合子型基因的调控,而ZGA启动依赖母性效应物质。氧化应激下,母性效应物质降解加快,使大部分胚胎在2-细胞缺少这些物质,ZGA启动延迟,最终导致2-细胞发育阻滞。本试验通过测定MZT期胚胎合子基因的表达情况,证实H2O2抑制合子基因Zscan4d、Eif1a和Muerv-L的表达,这与D.P.Chu等[33]利用邻苯二甲基-单-乙基己基酯(MEHP)暴露建立胚胎氧化应激模型,导致合子基因Muerv-L表达下降相一致。然而,H2O2并不能明显抑制Hsp70.1表达,与Y.Zhang等[34]利用ER抑制剂处理小鼠胚胎后得出的结论类似。添加吡格列酮处理后,氧化损伤胚胎内Eif1a、Hsp70.1、Muerv-L和Zscan4d的表达水平显著升高,说明能促进氧化损伤胚胎合子型基因的表达,促进小鼠2-细胞胚胎向4-细胞过渡。
从氧化应激的角度推断:氧化应激下,小鼠胚胎启动自身防御系统,加快母性效应物质的消耗以抵御ROS对胚胎的伤害。在这个过程中,大部分母性效应物质的过度消耗甚至耗尽,导致合子型基因激活失败,最终发生2-细胞发育阻滞。抗氧化物吡格列酮通过降低胚胎氧化应激水平,延缓母性效应基因的降解,增加合子型基因的表达,一定程度上促进了胚胎的发育。
[1] NOTHIAS J Y, MAJUMDER S, KANEKO K J, et al. Regulation of gene expression at the beginning of mammalian development[J].JBiolChem,1995,270(38):22077-22080.
[2] KANEKO K J, DEPAMPHILIS M L. Regulation of gene expression at the beginning of mammalian development and the TEAD family of transcription factors[J].DevGenet,1998,22(1):43-55.
[3] TADROS W, LIPSHITZ H D. The maternal-to-zygotic transition: a play in two acts[J].Development, 2009,136(18):3033-3042.
[4] SHIN S W, TOKORO M, NISHIKAWA S, et al. Inhibition of the ubiquitin-proteasome system leads to delay of the onset of ZGA gene expression[J].JReprodDev,2010,56(6):655-663.
[5] CHRISTIANS E, DAVIS A A, THOMAS S D, et al. Maternal effect of Hsf1 on reproductive success[J].Nature, 2000,407(6805):693-694.
[6] WU X, VIVEIROS M M, EPPIG J J, et al. Zygote arrest 1 (Zar1) is a novel maternal-effect gene critical for the oocyte-to-embryo transition[J].NatGenet,2003,33(2):187-191.
[7] RAMOS S B, STUMPO D J, KENNINGTON E A, et al.The CCCH tandem zinc-finger protein Zfp36l2 is crucial for female fertility and early embryonic development[J].Development,2004,131(9): 4883-4893.
[8] RANKIN T, SOYAL S, DEAN J. The mouse zona pellucida: folliculogenesis, fertility and pre-implantation development[J].MolCellEndocrinol,2000,163(1-2):21-25.
[9] TONG Z B, GOLD L, PFEIFER K E, et al. Mater, a maternal effect gene required for early embryonic development in mice[J].NatGenet,2000,26(3):267-268.
[10] QIU J J, ZHANG W W, WU Z L, et al. Delay of ZGA initiation occurred in 2-cell blocked mouse embryos[J].CellRes,2003,13(3):179-185.
[11] NASR-ESFAHANI M H, AITKEN J R, JOHNSON M H. Hydrogen peroxide levels in mouse oocytes and early cleavage stage embryos developedinvitroorinvivo[J].Development,1990,109(2):501-507.
[12] LEGGE M, SELLENS M H. Free radical scavengers ameliorate the 2-cell block in mouse embryo culture[J].HumReprod,1991,6(6):841-846.
[13] 张传领,刘春梅,陆彩玲,等.性未成熟雌性小鼠孕前砷暴露导致植入前胚胎体外发育阻滞[J].中国生物化学与分子生物学报,2010,26(9):841-846.
ZHANG C L, LIU C M, LU C L, et al.Invitrodevelopmental retardation of preimplantation embryos from sexually immature female mice by pregestational arsenic administration[J].ChineseJournalofBiochemistryandMolecularBiology,2010,26(9):841-846. (in Chinese)
[14] 邱佳菁,李逸平.“生存还是毁灭”,发育还是阻滞──小鼠早胚体外发育2-细胞阻滞产生机制初析[J].生命科学, 2000,12(5):193-198.
QIU J J,LI Y P.“To be or not to be”,to develop or to be blocked──The mechanism of 2-cell block in the early mouse embryo culturedinvitro[J].ChineseBulletinofLifeSciences,2000, 12(5):193-198.(in Chinese)
[15] OU X H,LI S,WANG Z B,et al.Maternal insulin resistance causes oxidative stress and mitochondrial dysfunction in mouse oocytes[J].HumReprod,2012,27(7):2130-2145.
[16] DAS S,CHATTOPADHYAY R,GHOSH S,et al.Reactive oxygen species level in follicular fluid—embryo quality marker in IVF?[J].HumReprod,2006,21(9):2403-2407.
[17] AL-GUBORY K H,FOWLER P A,GARREL C.The roles of cellular reactive oxygen species, oxidative stress and antioxidants in pregnancy outcomes[J].IntJBiochemCellBiol,2010,42(10): 1634-1650.
[18] LEGGE M,SELLENS M H.Free radical scavengers ameliorate the 2-cell block in mouse embryo culture[J].HumReprod,1991,6(6):867-871.
[19] ALI A A,BILODEAU J F,SIRARD M A.Antioxidant requirements for bovine oocytes varies duringinvitromaturation, fertilization and development[J].Theriogenology, 2003,59(3-4):939-949.
[20] HUANG Y,TANG X,XIE W,et al.Vitamin C enhancesinvitroandinvivodevelopment of porcine somatic cell nuclear transfer embryos[J].BiochemBiophysResCommun,2011,411(2):397-401.
[21] POLVANI S,TAROCCHI M,GALLI A.PPARγ and oxidative stress: Con(β) catenating NRF2 and FOXO[J].PPARRes,2012,2012(2): 641087.
[22] COLLINS A R, LYON C J, XIA X, et al. Age-accelerated atherosclerosis correlates with failure to upregulate antioxidant genes[J].CircRes,2009,104(6):42-54.
[23] PARK E Y, CHO I J, KIM S G. Transactivation of the PPAR-responsive enhancer module in chemopreventive glutathione S-transferase gene by the peroxisome proliferator-activated receptor-γ and retinoid X receptor heterodimer[J].CancerRes,2004, 64(10):3701-3713.
[24] ISHII T, ITON K, RUIZ E, et al. Role of Nrf2 in the regulation of CD36 and stress protein expression in murine macrophages: activation by oxidatively modified LDL and 4-hydroxynonenal[J].CircRes,2004,94(5): 609-616.
[25] KOVAC S, ANGELOVA P R, HOLMSTRÖM K M, et al. Nrf2 regulates ROS production by mitochondria and NADPH oxidase[J].BiochimBiophysActa,2015,1850(4): 794-801.
[28] ZHOU Y,ZHANG M J,LI B H,et al.PPARγ inhibits VSMC proliferation and migration via attenuating oxidative stress through upregulating UCP2[J].PLoSOne,2016,11(5):e0154720.
[29] CHEN J, LI D, ZHANG X, et al.Tumor necrosis factor-alpha-induced apoptosis of human coronary artery endothelial cells: modulation by the peroxisome proliferator-activated receptor-gamma ligand pioglitazone[J].JCardiovascPharmacolTher,2004,9(1):35-41.
[30] SCHINI S A, BAVISTER B D. Two-cell block to development of cultured hamster embryos is caused by phosphate and glucose[J].BiolReprod,1988,39(5):1183-1192.
[31] YANG P, ZHAO Z, REECE E A. Activation of oxidative stress signaling that is implicated in apoptosis with a mouse model of diabetic embryopathy[J].AmJObstetGynecol,2008,198(1):1-7.
[32] FLOOD J T, CHILLIK C F, VAN UEM J F, et al. Ooplasmic transfusion:prophase germinal vesicle oocytes made developmentally competent by microinjection of metaphase II egg cytoplasm[J].FertilSteril,1990,53(6):1049-1054.
[33] CHU D P, TIAN S, QI L, et al. Abnormality of maternal-to-embryonic transition contributes to MEHP-induced mouse 2-cell block[J].JCellPhysiol,2013,228(4):753-763.
[34] ZHANG Y, JIANG Y, LIAN X,et al. Effects of ERα-specific antagonist on mouse preimplantation embryo development and zygotic genome activation[J].JSteroidBiochemMolBiol,2015,145: 13-20.
(编辑 程金华)
Effect of Pioglitazone on Development Block of Mouse Embryos during Maternal to Zygotic Transition
XU Li-jie,LI Zhong-shu,FANG Nan-zhu*
(DepartmentofAnimalScience,AgriculturalCollegeofYanbianUniversity,Yanji133002,China)
The aim of this study was to investigate the relationship of ROS, developmental block and pioglitazone as an antioxidant. The experiment was divided into 3 groups:Control group, H2O2group and H2O2+PIO group. The oxidative damage model of mouse embryos induced by H2O2was established and treated with or without pioglitazone. The ROS level after treatment with pioglitazone was measured by DCHF-DA and the expression of maternal effect genes and zygotic genes were analyzed by Semi-quantitative reverse transcription PCR. The results showed that: (1) the ROS level of H2O2group was significantly higher than control group and H2O2+PIO group in both 1-cell and 2-cell embryos (P<0.05); (2) the rate of 2-cell to 4-cell transition in H2O2group was significantly lower than control group and H2O2+PIO group (P<0.05), while the difference of 1-cell to 2-cell transition rate among the groups was not significant (P>0.05);(3) the expression of maternal effect genes (Hsf1,Zfp3612,Zp3) and zygotic genes (Eif1-α,Muerv-L,Zscan4d) in H2O2group was lower than control group and H2O2+PIO group (P<0.05). The results provided a clear molecular aspect regarding the mechanism by which pioglitazone promoted embryos development and overcome 2-cell block.
pioglitazone; oxidative stress; development block; maternal effect gene; zygotic gene
10.11843/j.issn.0366-6964.2016.11.011
2016-05-11
国家自然科学基金项目(31360546)
徐礼杰(1984-),男,广东顺德人,博士生,主要从事动物遗传育种与繁殖研究,E-mail:dsd0765@163.com
*通信作者:方南洙,教授,E-mail: nzfang@ybu.edu.cn
Q813.7
A
0366-6964(2016)11-2240-08
