肾癌组织中HMGB1、MMP9的表达与临床分期、预后的相关性研究
2016-12-13郑红芳丁厚中李巧星曹方
郑红芳,丁厚中,李巧星,曹方
(江苏大学附属昆山医院泌尿外科,江苏 苏州 215300)
论著
肾癌组织中HMGB1、MMP9的表达与临床分期、预后的相关性研究
郑红芳,丁厚中,李巧星,曹方
(江苏大学附属昆山医院泌尿外科,江苏 苏州 215300)
目的探讨高迁移率族蛋白B1(HMGB1)、基质金属蛋白酶9(MMP9)在肾癌组织中的表达,及与肾癌临床病理特征、预后的相关性。方法采用免疫组织化学、实时定量聚合酶链反应法,检测67例肾透明细胞癌患者癌组织、癌旁组织中HMGB1、MMP9的表达,采用Person法分析其与临床病理学特征的相关性,采用Kaplan-Meier方法进行生存曲线分析,采用Cox比例风险模型分析影响患者预后相关因素。结果肾癌组织中HMGB1、MMP9表达高于癌旁肾组织,差异有统计学意义;肾癌肿瘤TNM分期、淋巴结转移度、肿瘤直径与HMGB1、MMP9表达相关,而不同性别、年龄间HMGB1、MMP9的表达差异无统计学意义;HMGB1、MMP9低表达肾癌患者的生存期要高于中、高表达患者,HMGB1、MMP9的表达水平与预后呈负相关;HMGB1、MMP9、肿瘤TNM分期、淋巴结转移度是影响肾癌患者预后的独立危险因素。结论HMGB1、MMP9可能在肾癌的浸润、转移机制中起着非常重要的作用,联合检测肾癌组织中HMGB1和MMP9的表达水平可能有助于评估肾癌的生物学特征和患者预后。
肾癌;HMGB1;MMP9;预后
大量文献报道,高迁移率族蛋白B1(high mobility group box 1 protein,HMGB1)在应激状态下可从真核细胞的核内释放到细胞核外,参与晚期炎症的病理过程,最终导致炎症迁延[1-2]。最新研究表明HMGB1在前列腺癌、胰腺癌等实体肿瘤中表达上调,肿瘤细胞通过分泌HMGB1调节细胞间的黏附特性、改变细胞外基质组分促进肿瘤转移[3-4]。基质金属蛋白酶(matrix metalloproteinase,MMP)通过降解细胞外基质参与肿瘤的转移,其中MMP9是MMPs家族中研究较多的一个蛋白,MMP9通过水解黏附分子参与肿瘤的发生、发展过程如肿瘤血管生成和免疫逃避等。目前,有关HMGB1、MMP9在肾癌中的表达及其与预后相关性的研究文献报道较少,本研究采用实时定量聚合酶链法检测肾癌组织、癌旁肾组织中HMGB1、MMP9的表达,分析其与临床病理特征、预后的关系,从而对肾癌的侵袭、转移机制、预后作初步探讨。
1 资料与方法
1.1 临床资料
选取2008年9月-2015年9月于江苏大学附属昆山医院收治的67例肾癌患者为研究对象。病例纳入标准:①成年原发性肾癌患者,首次行肾癌根治术;②术后病理证实为肾细胞癌;③术前未行化疗或放疗治疗。排除标准:转移性肾癌;未行手术治疗或手术治疗前已行化疗或放疗治疗。67例肾癌患者行肾癌根治性切除手术,术后病理切片均证实为肾透明细胞癌。其中,男性41例,女性26例,患者平均年龄(53.4±8.7)岁,切取的部分肿瘤组织放入液氮中保存,同时选取距癌灶3 cm处癌旁组织(手术切缘组织,经HE染色未发现癌细胞)作为配对样本的对照,行实时定量聚合酶链反应(polymerase chain reaction,PCR)检测肾癌组织和癌旁组织中HMGB1、MMP9 mRNA的转录水平,免疫组织化学法观察HMGB1蛋白的定位。
1.2 主要试剂
SYBR Premix Ex Taq(日本TAKARA公司),Taq DNA Polymeras(美国Promega公司),羊抗人HMGB1多克隆抗体(美国Santa Cruz公司),HMGB1(NM_001313893.1)正向引物:5′-GCCTTCTT CCTCTTCTGCTCT-3′,反向引物:5′-TGTTATTCCAC ATCTCTCCCAG-3′,扩增片段长度106 bp;MMP9(NM_004994.2)正向引物:5′-GCTGGCAGAGGAAT ACCTGTAC-3′,反向引物:5′-CAGGGACAGTTGCT TCTGGA-3′,扩增片段长度112bp;β-actin(X00351.1)正向引物:5′-CCAGGTCATCACCATCGG-3′,反向引物:5′-CCGTGTTGGCGTAGAGGT-3′,引物长度158 bp,引物均由上海捷瑞生物有限公司合成。
1.3 实验方法
1.3.1 实时定量PCR取出保存于液氮中的肾癌与癌旁组织标本,切取100 mg组织放入研钵迅速研磨成粉;使用Trizol法提取肾癌与癌旁组织总RNA,加入1 ml Trizol试剂,冰上研磨5 min,加入氯仿0.2 ml后剧烈振荡,4℃低温12 000 r/m离心15 min,吸取上层水相(总RNA)至另一离心管中,依次加入异丙醇0.5 ml、75%乙醇并低温离心后,用20μl的DEPC处理水溶解沉淀,即可得到总RNA。取1μl的总RNA,按照TaKaRa公司逆转录试剂盒配置反应液,逆转录反应条件如下:42℃,15 min(逆转录反应);95℃,2 min(灭活逆转录酶的活性),所获产物即为cDNA,取2μl的cDNA加入EP管中,同时加入15μl的SYBR Green PCR Master Mix,1μl的HMGB1、MMP9正、反向引物以及8.5μl的ddH2O,反应条件:95℃预变性3 min;95℃变性15 s,60℃退火15s,72℃延伸40s,总计40个循环。根据公式Folds= 2-△△Ct来计算目的基因的相对表达量,其中△△Ct=(Ct检测基因-Ctβ-actin)实验组-(Ct检测基因-Ctβ-actin)对照组。
1.3.2 免疫组织化学法石蜡切片常规脱蜡水化,蒸馏水冲片3次,磷酸缓冲盐溶液冲洗5 min,高温水煮30 min,磷酸缓冲盐溶液冲洗5 min,滴加羊抗人HMGB1多克隆抗体(抗体稀释比例为1∶100),37℃温箱孵育30 min后置于4℃冰箱过夜,擦净组织标本周围的水分,置湿盒内滴加二抗,37℃温箱孵育1 h,滴加DAB显色液,显微镜下观察染色效果。本实验采用阳性细胞百分率结合染色强度来判断蛋白免疫组织化学的结果,选择5个高倍镜视野,对视野下的阳性细胞计数:<5%计0分,5%~25%且染色较浅计1分,26%~50%且染色较深计2分,>50%且染色深计3分,免疫组织化学染色得分大于1视为阳性,得0、1分视为阴性。
1.4 统计学方法
采用SPSS 16.0统计软件进行数据分析,计量数据用均数±标准差(±s)表示,两组间的比较使用t检验,两组以上均数比较用one-way ANOVA;HMGB1、MMP9之间的相关分析用Person法;采用Kaplan-Meier方法进行生存曲线分析,并用Log-rank
检验不同组间的统计学意义;采用Cox比例风险模型分析影响预后指标的多因素,P<0.05为差异有统计学意义。
2 结果
2.1 HMGB1、MMP9 mRNA在肾癌组织、癌旁肾组织中的表达
HMGB1 mRNA在67例肾癌组织、癌旁肾组织中的相对表达水平分别为(0.79±0.062)、(0.32± 0.026),肾癌组织中HMGB1 mRNA表达明显高于癌旁肾组织,差异有统计学意义(t=57.62,P=0.000);MMP9 mRNA在肾癌组织中的表达(0.52±0.073)也高于癌旁肾组织(0.14±0.029),差异有统计学意义(P<0.05)。免疫组织化学结果显示,HMGB1主要定位于在肾癌细胞的胞浆中,肾癌细胞内出现大量的棕黄色颗粒,部分癌细胞中甚至呈散在片状分布,癌旁肾组织中大部分细胞阴性表达,少数细胞HMGB1阳性表达,但表达较为分散,67例肾癌TNM分期Ⅰ、Ⅱ、Ⅲ、Ⅳ期HMGB1阳性率分别为20.0%(3/15)、69.6%(16/23)、77.8%(14/18)、81.8%(9/11),癌症分期越高,肾癌组织HMGB1阳性率越高,差异有统计学意义(χ2=15.62,P=0.001)。见图1、2。

图1 HMGB1、MMP9 mRNA在肾癌组织、癌旁肾组织中的表达

图2 肾癌组织、癌旁肾组织中HMGB1的表达
2.2 HMGB1、MMP9 mRNA与肾癌临床病理学特征的关系
如表1所示,肾癌组织中肿瘤直径≤5 cm与>5cm的HMGB1(t=2.252,P=0.028)、MMP9 mRNA(t=8.248,P=0.000)表达差异有统计学意义;TNM分期为Ⅳ期的HMGB1(F=223.3,P=0.000)、MMP9 mRNA(F=335.3,P=0.000)的表达高于Ⅰ期、Ⅱ期、Ⅲ期;淋巴结转移度(淋巴结转移数/淋巴结取材病理数)≤0.5与>0.5的HMGB1(t=17.99,P=0.000)、
MMP9 mRNA(t=19.32,P=0.000)的表达差异有统计学意义,而不同性别、年龄HMGB1、MMP9 mRNA的表达差异无统计学意义。
表1 肾癌临床病理学特征与HMGB1、MMP9 mRNA的相关性(±s)
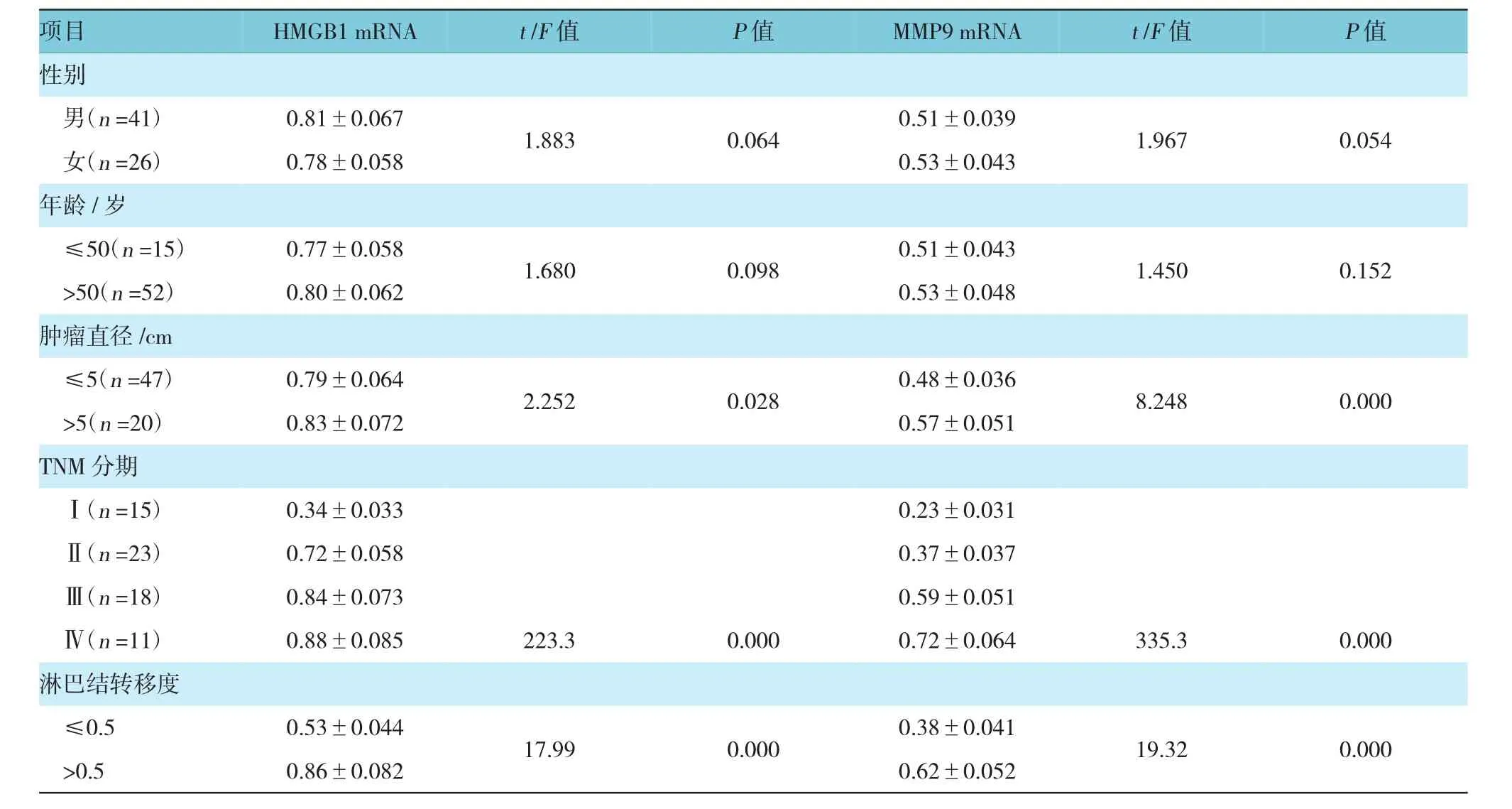
表1 肾癌临床病理学特征与HMGB1、MMP9 mRNA的相关性(±s)
项目HMGB1 mRNAt/F值P值MMP9 mRNAt/F值P值性别男(n=41)0.81±0.0671.8830.0640.51±0.0391.9670.054女(n=26)0.78±0.0580.53±0.043年龄/岁≤50(n=15)0.77±0.0581.6800.0980.51±0.0431.4500.152>50(n=52)0.80±0.0620.53±0.048肿瘤直径/cm≤5(n=47)0.79±0.0642.2520.0280.48±0.0368.2480.000>5(n=20)0.83±0.0720.57±0.051 TNM分期Ⅰ(n=15)0.34±0.033 0.23±0.031Ⅱ(n=23)0.72±0.0580.37±0.037Ⅲ(n=18)0.84±0.0730.59±0.051Ⅳ(n=11)0.88±0.0850.72±0.064淋巴结转移度≤0.50.53±0.04417.990.0000.38±0.04119.320.000>0.50.86±0.0820.62±0.052 223.30.000335.30.000
2.3 HMGB1、MMP9 mRNA的表达与预后
Kaplan-Meier生存曲线分析结果显示,67例肾癌患者的平均生存时间为53.8个月,中位生存期63.9个月,1、3、5年的生存率分别为89.6%、77.5%、67.6%;对HMGB1和MMP9表达以及与预后的相关性采用Person法分析,HMGB1、MMP9两者在肾癌组织中表达呈正相关(r=0.562,P<0.01),HMGB1 mRNA的表达与预后呈负相关(r=-0.591,P<0.01),MMP9 mRNA的表达与预后呈负相关(r=-0.486,P<0.01);以67例肾癌患者HMGB1 mRNA表达水平的P25(0.32)、P75(0.86)作为高、低表达的分级指标,Log-rank检验结果显示HMGB1 mRNA低表达肾癌患者的生存期要高于中、高表达患者(χ2= 30.518,P<0.01),以MMP9 mRNA表达水平的P25(0.35)、P75(0.75)作为高、低表达的分级指标,Log-rank检验结果显示MMP9 mRNA低表达肾癌患者的生存期要高于中、高表达患者(χ2=16.432,P<0.01);采用Cox多因素比例风险模型分析,结果显示HMGB1、MMP9、肿瘤TNM分期、淋巴结转移度与预后相关(P<0.05),而性别、年龄、肿瘤直径与预后无相关性(P>0.05)。见图3~5和表2。

图367 例肾癌患者的生存曲线

图467 例肾癌患者预后与HMGB1、MMP9的相关性

图5 HMGB1、MMP9 mRNA表达水平与患者预后的关系

表2 Cox多因素比例风险模型分析影响肾癌患者预后的因素
3 讨论
肾癌是泌尿系统较为常见的恶性肿瘤之一,文献报道晚期肾癌中位生存期为67个月,5年生存率波动于50%~60%[5],本研究中67例肾癌患者的中位生存期为53.8个月,5年生存率为67.6%。目前,有学者认为肿瘤TNM分期、淋巴结或远处转移是影响肾癌患者长期存活的重要危险因素,本研究中67例肾癌患者的淋巴结转移度<0.5共23例(34.3%),TNM分期Ⅰ+Ⅱ期共38例(56.8%),这可能是67例肾癌患者5年生存率为67.6%的原因,而且Cox多因素比例风险模型分析结果也证实了这一点。
HMGB1是细胞核内重要的非组蛋白成分,WANG等[6]首次发现HMGB1是一种重要的晚期炎症递质。然而,最新研究结果表明在喉癌、前列腺癌、胰腺癌等多种恶性肿瘤中高表达,HMGB1的表达水平与肿瘤的发生、发展密切相关[7-8]。然而,关于HMGB1在肾癌组织中表达却鲜有报道,笔者通过实时荧光定量PCR检测HMGB1在肾癌组织以及癌旁组织中的表达,结果提示HMGB1在肾癌组织呈高表达状态,而且HMGB1的表达水平与肾癌患者的预后密切相关(r=-0.591,P<0.01),HMGB1高表达患者的预后较差,是影响患者预后的独立危险因素。本研究发现肾癌组织中HMGB1的表达水平与TNM分期、淋巴结转移相关,且癌组织中HMGB1的表达高于癌旁组织,表明肾组织中HMGB1的表达水平可能与肿瘤良恶性以及病情进展有关。有研究发现,抑制HMGB1或其受体晚期糖基化终产物受体(receptor for advanced glycation end products,RAGE)的表达可以抑制肿瘤增殖[9]。因此,肾癌组织中HMGB1的表达可以作为评估病情、判断预后的重要肿瘤标志物,抑制HMGB1或RAGE基因的表达可能是治疗肾癌的新途径,以HMGB1、RAGE为靶基因的治疗为肾癌的临床诊治提供新的思路和方法。MMPs是依赖金属离子(锌、铜等)的内肽酶家族,MMP9是该家族重要的成员之一[10-11]。高表达的MMP9通过降解肿瘤细胞外基质,降低细胞间的黏附性,促进肿瘤的转移,从而影响患者的预后。本研究中MMP9在肾癌组织中的表达要高于癌旁组织,MMP9低表达肾癌患者的预后要好于高表达,是影响肾癌患者预后的的关键危险因素,MMP9的表达与患者预后呈负相关(r= -0.486,P<0.01)。通过分析HMGB1、MMP9的表达水平与肾癌患者的临床病理特征间的相关性,结果显示HMGB1、MMP9的表达水平与肿瘤大小、TNM分期、淋巴结转移有关,提示监测肾癌组织HMGB1、MMP9的表达水平可以作为判断患者预后的重要手段之一。
本研究67例肾癌患者的癌组织中HMGB1、MMP9两者表达水平存在一定的相关性(r=0.562,P<0.01),表明两者之间可能存在相关的调控机制。TAGUCHI等[9]报道,HMGB1通过结合RAGE,进一步激活P38、JNK等丝裂原活化蛋白激酶信号通路,继而上调MMP9的表达,从而促进肿瘤的浸润及转移,这可能是肾癌组织中HMGB1、MMP9两者之间的表达水平呈正相关的原因,LIU等[12]在研究HMGB1、MMP9在小细胞肺癌细胞的浸润和转移中的作用机制时发现,HMGB1结合受体RAGE后,通过激活PI3K/Akt、NF-κB信号通路,从而使MMP-9过表达。因此,笔者推测肾癌组织中MMP9的上调可能继发于HMGB1的升高,但对肾癌组织中HMGB1升高的主要原因仍未得知,有关HMGB1在肾癌中如何调控MMP9的机制研究较少,本研究的下一步工作方向是研究HMGB1在肾癌中调控MMP9的分子机制以及调控HMGB1升高的可能信号通路,笔者将通过生物信息技术筛选调控HMGB1的microRNA,并利用逆转录聚合酶链反应加以验证,同时利用siRNA干扰HMGB1在人肾癌细胞GRC-1中的表达,检测MMP9的变化趋势,进一步探讨HMGB1、MMP9在肾癌发生、发展中的可能机制。
综上所述,HMGB1、MMP9在肾癌组织中高度表达,两者表达水平有一定的相关性;肾癌组织中HMGB1、MMP9的表达水平与肿瘤直径、肿瘤TNM分期、淋巴结转移有关,可能在肾癌的浸润、转移机制中起着非常重要的作用;HMGB1、MMP9表达水平是影响肾癌患者预后的独立危险因素,HMGB1、MMP9低表达患者的长期生存要好于高表达患者,联合检测肾癌组织中HMGB1和MMP9的表达水平可能有助于评估肾癌的生物学特征和患者预后。
[1]YU Y,XIE M,KANG R,et al.HMGB1 is a therapeutic target for leukemia[J].Am J Blood Res,2012,2(1):36-43.
[2]MOURI F,TSUKADA J,MIZOBE T,et al.Intracellular HMGB1 transactivates the human IL-1B gene promoter through association with an Ets transcription factor PU.1[J].Eur J Haematol,2008, 80(1):10-19.
[3]SIMS G P,ROWE D C,RIETDIJK S T,et al.HMGB1 and RAGE in inflammation and cancer[J].Annu Rev Immunol,2010,
28:367-388.
[4]王伶利,晏维,付妤.高迁移率族蛋白B1在肠道炎症和肿瘤中的作用[J].临床消化病杂志,2015,1:49-51.
[5]刘国栋,刘晓.肾细胞癌转移潜能的分子学研究进展[J].现代泌尿外科杂志,2013,1:1-3.
[6]WANG H,BLOOM O,ZHANG M,et al.HMG-1 as a late mediator of endotoxin lethality in mice[J].Science,1999,285(5425): 248-251.
[7]汤夏冰,沈晓辉,钱晓云,等.高迁移率族蛋白B1和基质金属蛋白酶-2、9在喉癌组织中的表达及其与预后的关系[J].临床耳鼻咽喉头颈外科杂志,2013,4:181-187.
[8]OHMORI H,LUO Y,KUNIYASU H.Non-histone nuclear factor HMGB1 as a therapeutic target in colorectal cancer[J].Expert Opin Ther Targets,2011,15(2):183-193.
[9]TAGUCHI A,BLOOD D C,DEL TORO G,et al.Blockade of RAGE-amphoterinsignallingsuppressestumourgrowthand metastases[J].Nature,2000,405(6784):354-360.
[10]SAUSSEZ S,CLUDTS S,CAPOUILLEZ A,et al.Identification ofmatrixmetalloproteinase-9asanindependentprognostic marker in laryngeal and hypopharyngeal cancer with opposite correlations to adhesion/growth-regulatory galectins-1 and-7[J]. International Journal of Oncology,2009,34(2):433-439.
[11]YAO X,ZHAO G,YANG H,et al.Overexpression of highmobility group box 1 correlates with tumor progression and poor prognosis in human colorectal carcinoma[J].J Cancer Res Clin Oncol,2010,136(5):677-684.
[12]LIU P L,TSAI J R,HWANG J J,et al.High-mobility group box 1-mediated matrix metalloproteinase-9 expression in nonsmall cell lung cancer contributes to tumor cell invasiveness[J]. Am J Respir Cell Mol Biol,2010,43(5):530-538.
(张蕾 编辑)
Expressions of HMGB1 and MMP9 and their clinical significance in renal carcinoma
Hong-fang Zheng,Hou-zhong Ding,Qiao-xing Li,Fang Cao
(Department of Urology,Kunshan Hospital Affiliated to Jiangsu University, Suzhou,Jiangsu 215300,China)
Objective To investigate the expressions of high mobility group box 1 protein(HMGB1)and matrix metalloproteinase 9(MMP9)in renal carcinoma tissue and their relationship with clinic pathological characteristics of renal carcinoma.Methods The expressions of HMGB1 and MMP9 in 67 patients with renal carcinoma were determined using real-time PCR and immunohistochemistry.Statistical analysis was then conducted using Person, Kaplan-Meier and Cox proportional hazards analyses.Results The expressions of HMGB1 and MMP9 in the carcinoma tissues were higher than those in the para-carcinoma tissues,and closely related to TNM stage,lymph node ratio and diameter of tumor.The life time of the patients with low expressions of HMGB1 and MMP9 was longer than the patients with high expressions.The expressions of HMGB1 and MMP9 were negatively correlated with the prognosis. HMGB1,MMP9,TNM stage and lymph node metastasis were independent risk factors for the prognosis of renal carcinoma.Conclusions HMGB1 and MMP9 may play crucial roles in the infiltration and metastasis of renal carcinoma. Joint detection of HMGB1 and MMP9 in renal carcinoma tissues may help to evaluate the prognosis of patients.
renal carcinoma;high mobility group box 1 protein;matrix metalloproteinase 9;prognosis
R737.11
A
10.3969/j.issn.1005-8982.2016.22.006
1005-8982(2016)22-0028-06
2016-04-13
丁厚中,E-mail:qingxyz139964126@163.com;Tel:13962675759
