MT-3通过激活NF-κB信号通路抑制食管癌病理进展
2016-12-13王海军陆欣张彦芬刘聚良韩永强
王海军,陆欣,张彦芬,刘聚良,韩永强
(河北医科大学附属邢台人民医院1.胸外科,2.血液科,河北 邢台 054001)
论著
MT-3通过激活NF-κB信号通路抑制食管癌病理进展
王海军1,陆欣2,张彦芬1,刘聚良1,韩永强1
(河北医科大学附属邢台人民医院1.胸外科,2.血液科,河北 邢台 054001)
目的食管癌的发生与多种基因突变相关,基因的表达异常产生肿瘤,本文集中探讨食管癌的发生发展机制。方法选取河北医科大学附属邢台人民医院2009年7月-2011年2月肿瘤科食管癌患者92例。选取其肿瘤组织及其癌旁组织样本,检测金属硫蛋白3(MT-3)在食管癌组织和其癌旁组织中的表达,在食管癌细胞系中构建过表达MT-3和低表达MT-3的细胞系,检测这些MT-3表达不同时,NF-κB信号通路在其中是否处于激活状态。采用Western blot检测P65、pP65蛋白的表达,免疫荧光检测pP65是否在MT-3过表达时有入核表达。结果定量聚合酶链反应(qPCR)结果显示食管癌肿瘤组织中MT-3的表达高于癌旁组织(P=0.001)。通过qPCR检测构建的高表达和低表达MT-3的食管癌细胞系均成功构建,进而检测P65、pP65,显示在过表达MT-3时,pP65蛋白表达增多,低表达MT-3时pP65蛋白表达减少,P65则显现出相反的结果,且表达均有统计学意义,所以认为MT-3高表达时NF-κB信号激活。免疫荧光检测高表达MT-3的食管癌细胞时,细胞核入核明显增多,进一步说明MT-3激活了NF-κB信号通路。结论MT-3在食管癌中通过激活NF-κB信号通路进而抑制食管癌的病理进程。
MT-3;NF-κB;信号通路;食管癌
食管癌的发生发展是一个复杂的过程,涉及一系列的生理变化,包括细胞凋亡、增殖、转移及侵袭的异常。正常生理条件下,细胞内乙酰化与去乙酰化水平处于动态平衡,而在多种肿瘤中金属硫蛋白3(metallothionein 3,MT-3)活性异常,被募集结合在特定的启动子区,导致一系列基因的转录抑制,涉及细胞增殖、分化、迁移、侵袭转移等相关基因[1-3]。MT-3是一类调节基因转录因子的酶。MT-3是与肿瘤关系最为密切的一种基因,可作用于相应的组蛋白而调节基因转录[4]。文献[5-6]证实肿瘤细胞中MT-3的缺失能使肿瘤细胞周期阻滞在G1期或G2/M期,导致有丝分裂细胞的丢失,细胞生长抑制,及凋亡细胞比例的增加。充分说明了MT-3的表达与肿瘤细胞周期、细胞增殖及凋亡密切相关。
其中MT-3基因定位于人6号染色体,可抑制细胞Cyclin-CDK复合物或细胞增殖抗原的活性,当MT-3蛋白表达的升高,阻止了CyclinD1与CDK4结合,使细胞周期阻滞在G1期,抑制细胞的增殖[7-8]。研究已证实MT-3作为细胞周期负性调控因子,与食管癌细胞增生、转移有关,并且具有良好的预后价值。NF-κB是一个与炎症相关的信号通路,有人报道肿瘤的发生发展是由炎症慢慢演化而成的,炎症的发生导致机体很多基因表达异常,进而进一步激活相关信号通路[9-10]。很多肿瘤疾病的发生都与NF-κB信号通路密切相关。主要通过外源性的因素导致P65入核增多,进而发生细胞核的磷酸化,激活该信号通路,促进炎症的发生,进一步影响肿瘤的发生发展。
但是MT-3在食管癌中的表达及其发生机制还需更进一步的研究,本研究拟探讨MT-3在食管癌中的发病机制。
1 资料与方法
1.1 临床资料
收集河北医科大学附属邢台人民医院2009年7月-2011年2月肿瘤科食管癌患者92例作为研究对象。取患者肿瘤组织和癌旁组织。所有患者临床资料完整,包括一般情况、病理诊断、肿瘤分期、治疗方式和生存状况等,有较为完整的随访资料完整,患者各类临床资料均保存良好。
1.2 定量聚合酶链反应(qPCR)
逆转录试剂盒购自TaKaRa公司,等量组织,加入同等比例的Trizol,12 000 r/min,4℃离心10 min;吸取上清液至一新的EP管中,静置5 min,裂解充分;加入200μl氯仿,振荡器上震荡15 s,放置3 min;12 000 r/min,4℃离心15 min,离心完成后分为3层,取最上层(中间一层为蛋白)至一新的EP管中,在吸取的最上层EP管中加入等体积异丙醇,4℃进行,来回颠倒数次,室温沉淀10 min;12 000 r/min,4℃离心10 min,弃去上清液;加入75%乙醇(DEPC水溶解),混匀液体;7 500 r/min,4℃5 min,弃上清液,小心吸尽液体(此时可以看到白色沉淀即为RNA);RNA略干后加入20μl DEPC水。用核酸染料法进行实时荧光定量PCR检测MT-3在食管癌中的表达研究。引物序列为:MT-3,正向:GCCGGUCAUGUCCAAAGUATT,反向:UACU UUGGACAUGACCGGCTT;GAPDH,正向:GCCCTGA GGGCCCGAACTGTTACT,反向:CAGACGCACGGCT TTGACCTTCTT。反应程序为:预变性95℃,10 min;循环中变性95℃,30 s;退火55℃,30 s延伸72℃,30秒,反应40个循环,融解曲线分析。
1.3 稳定转染过表达和低表达的MT-3的食管癌细胞株
将处于对数期的TE-1细胞(购自于ATCC)种于6孔板中,保证每孔细胞量约为3×105,lipo 2000加入5μl用100μl无血清培养基混匀,静置5 min,同时高表达和低表达的MT-3的质粒(购买自广州锐博生物有限公司)12μl于100μl无血清的培养基中混匀,5 min后两者混匀20 min,然后加入1 800μl的无血清培养基,48 h后提取RNA进行检测。过表达和低表达的MT-3的质粒MT-3序列合成于广州锐博生物公司,相应的对照组为该段序列的无意替换。MT-3和U6的引物序列前面已经提及。
1.4 蛋白免疫印迹法(Western blot)
提取血清蛋白,运用碧云天蛋白试剂盒提取组织蛋白。用BCA进行定量。按照A液∶B液以50∶
1的比例进行配置BCA溶液。取收集的细胞上清2μl,加入18μl PBS,200μl AB混合液。将所有蛋白样品用补足液调至等浓度,同时加入5X的溴酚蓝,占比总体积的1/5。上样前将胶板下的气泡赶走,所有蛋白样品调至等浓度后上样,蛋白上样量保证在一定浓度上进行,同时加入6μl蛋白marker。以初始电压为80V跑浓缩胶,然后升至120 V跑分离胶。在目的蛋白泳动至距胶下缘1 cm以上结束。浸泡PVDF膜:将PVDF膜泡在甲醇中5 min。恒流250 mA,90 min,然后将膜从电转槽中取出,TBST稍加漂洗,5%脱脂牛奶封闭液中缓慢摇荡1 h。TBST稍加漂洗,一抗孵育过夜,第2天将其放在常温复温40 min,然后TBST漂洗膜3次,每次5 min。根据一抗来源选择二抗,室温轻摇1 h。二抗孵育结束后,用TBST漂洗膜3次,每次5 min。对洗后的PVDF膜发光显影,用ECL发光液进行发光显影,配置方法为A液∶B液1∶1进行配置,进行发光显影。
1.5 免疫荧光检测
组织经过固定后,蔗糖梯度脱水,冷冻切片,切片厚度为6μm,高温修复5 min,待其冷却后,PBS洗涤(3次,每次5 min),10%BSA封闭50 min,加入pP65抗兔一抗(美国CST公司),二抗兔抗鼠(美国CST公司),然后进行DAPI染色,1∶100(美国Santa公司)。
1.6 统计学方法
用SPSS 11.0统计软件进行数据分析,统计学方法采用t检验,Pearson相关分析,χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 MT-3在食管癌中的表达
PCR检测食管癌患者组织标本92例及癌旁食管癌组织标本92例,检测结果发现MT-3在癌组织中高表达,且与癌旁组比较,差异有统计学意义(P= 0.001)。如图1所示,检测结果提示MT-3在食管癌的发生发展中可能扮演者重要的角色。
2.2 MT-3激活NF-KB信号通路
本研究成功构建了MT-3过表达和MT-3低表达的2种食管癌TE-1细胞株,图2A所示为成功构建的MT-3高表达的TE-1细胞系,图2B所示为成功构建的低表达MT-3的TE-1,在2种细胞株中分别检测NF-κB中P65和pP65的蛋白表达。如图2C所示为高表达MT-3的TE-1,相比于对照组,在P65减少的情况下,pP65表达量增多,细胞入核增多,与低表达MT-3的TE-1比较,当转入低表达的MT-3时,pP65表达减少,细胞入核减少,所以从过表达和低表达两方面正反验证了NF-κB信号处于激活状态。
2.3 在MT-3高表达时pP65入核
检测在TE-1细胞系中加入MT-3重组蛋白后NF-κB信号变化。分别在TE-1细胞系中加入DMSO和MT-3重组蛋白,检测结果显示在加入MT-3后pP65入核明显增多,即NF-κB信号被激活,相反在加入DMSO后,TE-1细胞系中pP65基本没有入核,NF-κB信号未被激活。见图3。
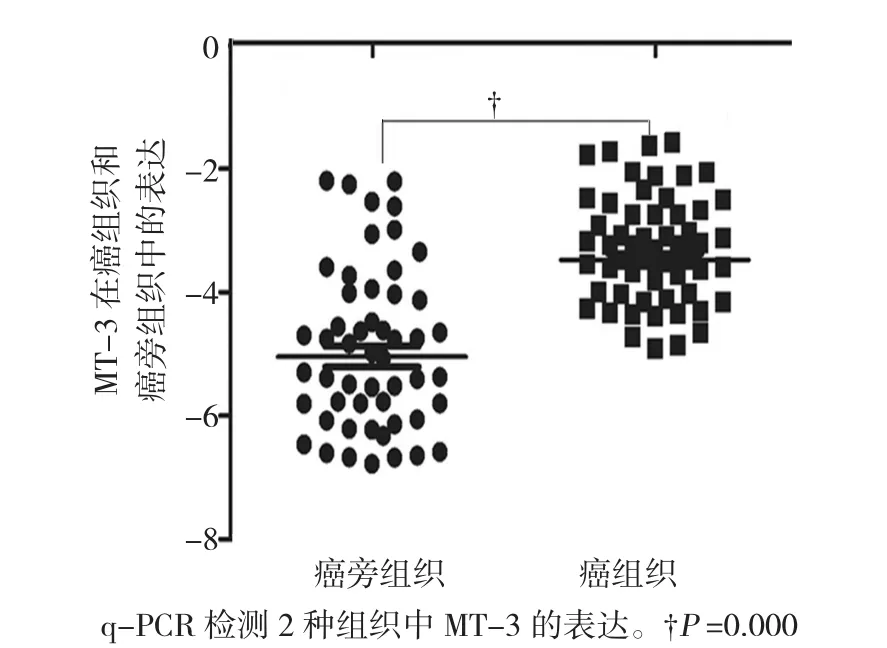
图1 MT-3的表达检测

图2 MT-3激活NF-κB信号通路
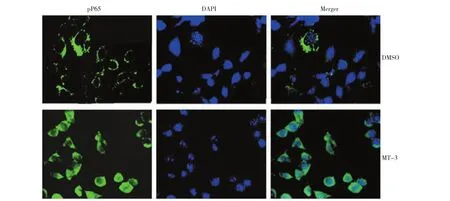
图3 MT-3激活NF-κB信号
3 讨论
大量的研究证实了MT-3功能异常与多种肿瘤的发生发展密切相关[9]。有学者通过免疫组织化学检测MT-3在170例外科手术切除的原发性肝癌组织及癌旁正常组织表达,发现较肝癌组织中MT-3的表达显著高于癌旁正常组织,并与肿瘤级别密切相关。并且有研究[10-12]证实运用MT-3抑制剂可抑制肝癌、肺癌、宫颈癌、前列腺癌及乳腺癌等一系列恶性肿瘤细胞的生长,诱导其分化或凋亡。这些发现充分说明了MT-3的异常与恶性肿瘤的发生发展密切相关,但是其在食管癌中的作用还未被研究[13],因此本实验进一步通过qPCR检测MT-3在食管癌中的表达,本次研究结果显示在肿瘤患者中肿瘤组织部位MT-3的表达明显高于其癌旁组织。
NF-κB是一条经典的炎症信号通路相关因子,参与细胞分裂、增殖及凋亡的调控,对炎症或者免疫应答等相关的反应进行调节,NF-κB是一种关键性的转录因子,也参与中枢神经系统众多生理活动或病理过程,如神经元可塑性、炎症、突触传递和疼痛。炎症因子的上调又可以活化其他炎症细胞因子形成正反馈调节,最终导致炎症的泛化[14-15]。NF-κB这个信号通路已被较广泛的研究,NF-κB pP65蛋白由胞浆向胞核转移的核定位信号是NF-κB信号通路激活的关键点,该信号通路可调控上百个靶基因的转录,产生广泛的生物学效应[16-18]。为了研究NF-κB是否参与了MT-3调控的食管癌发病机制,本研究成功构建MT-3高表达和低表达的TE-1细胞系,检测pP65在其中的变化,发现MT-3高表达时,pP65明显增多,初步猜测NF-κB这个信号通路被激活,在TE-1中加入重组蛋白MT-3后发现pP65细胞入核明显,即肯定NF-κB这一信号通路是由于MT-3高表达而被激活。有研究显示,在肿瘤发生后,如果可以有效地控制炎症因子的释放,减轻炎症反应,将有可能阻止脊髓组织的进一步损伤,从而改善预后。笔者猜测MT-3的低表达可能会减轻食管癌患者的病情,当然这种猜测还需更进一步的研究证实。
[1]张思维,张敏,李光琳,等.2003-2007年中国食管癌发病与死亡分析[J].中国肿瘤,2012,21(4):241-247.
[2]SENESE S,ZARAGOZA K,MINARDI S,et al.Role for histone deacetylase 1 in human tumor cell proliferation[J].Mol Cell Biol, 2007,27(13):4784-4795.
[3]曾剑,周星明.食管癌微创外科治疗的发展与现状[J].中国肿瘤, 2013,22(9):728-732.
[4]ORTHMANN A,PEIKER L,FICHTNER I,et al.Improved treatment of MT-3 breast cancer and brain metastases in a mouse xenograftby LRP-targetedoxaliplatinliposomes[J].J Biomed Nanotechnol,2016,12(1):56-68.
[5]TIAN Z Q,XU Y Z,ZHANG Y F,et al.Effects of metallothionein-3 and metallothionein-1E gene transfection on proliferation,cell cycle,and apoptosis of esophageal cancer cells[J].Genet Mol Res,2013,12(4):4595-4603.
[6]DUTTA R,SENS DA,SOMJI S,et al.Metallothionein isoform 3
expression inhibits cell growth and increases drug resistance of PC-3 prostate cancer cells[J].Prostate,2002,52(2):89-97.
[7]郑芸,张有为,陈龙邦,等.食管鳞癌患者血清RUNX3基因甲基化检测及临床意义[J].癌症进展,2010,8(3):290-294.
[8]黄思语,尹东,邓彦超,等.新疆哈萨克族食管癌患者ALDH1L1基因甲基化及其与预后的关系[J].癌变·畸变·突变,2014,26(1): 35-39.
[9]张志勉.食管癌患者PBMCs表面MHC-I类分子表达改变及其机制的初步探讨[D].山东大学,2011.
[10]李许锋.食管鳞癌甲基化谱和表达谱的联合分析及早期诊断标志物的筛选[D].南方医科大学,2014.
[11]于伟娜.MMP-2、TIMP-2、PINCH在食管鳞状细胞癌中的表达意义及相关研究[D].河北医科大学,2011.
[12]武志.MMP-2、MMP-9在食管癌中表达的研究[D].泰山医学院, 2010.
[13]王洪涛,周清华.E-钙粘蛋白复合体与肺癌的侵袭转移[J].中国肺癌杂志,2010,13(3):254-259.
[14]路晓雯,刘林祥,崔新建,等.18F-FDG PET/CT对结直肠癌术后血清CEA升高病例的临床诊断价值[J].泰山医学院学报,2010, 31(2):83-85.
[15]VON-BURSTIN J,ESER S,PAUL M C,et al.E-cadherin regulates metastasis of esophageal carcinoma in vivo and is suppressed by a NF-κB repressor complex[J].Gastroenterology,2009,137(1): 361-371.
[16]林建清,朱世泽,林若柏,等.基质金属蛋白酶(MMP-9)及其抑制剂(TIMP-1)在食管鳞癌中表达的临床意义[J].中国肿瘤临床, 2003,30(10):708-711.
[17]李曼,潘琳娜,张志燕,等.b-FGF在食管癌中的表达及临床意义[J].实用肿瘤学杂志,2006,20(4):324-325.
[18]BERNARDO M M,MENG Y,LOCKETT J,et al.Maspin reprograms the gene expression profile of prostate carcinoma cells for NF-KB[J].Genes Cancer,2011,2(11):1009-1022.
(张蕾 编辑)
MT-3 aggravates pathological process of esophageal cancer through activation of NF-κB signaling passway
Hai-jun Wang1,Xin Lu2,Yan-fen Zhang1,Ju-liang Liu1,Yong-qiang Han1
(1.Department of Thoracic Surgery;2.Department of Hematology,Xingtai Pepole's Hospital of Hebei Medical University,Xingtai,Hebei 054001,China)
Objective To research the development mechanism of esophageal cancer.Methods Ninety-two cases of esophageal cancer patients treated in Xingtai Pepole's Hospital of Hebei Medical University from July 2009 to February 2011 were selected for the study.MT-3 expression was detected in esophageal cancer tissues and the peri-cancerous tissues.MT-3 overexpression and low-expression cell lines were constructed.The activation state of NF-κB signaling pathway was checked at different levels of MT-3 expression.Then the expressions of P65 and pP65 were tested by Western blot.Immunofluorescence was used to further test whether pP65 was expressed in the nuclei when MT-3 was over-expressed.Results The expression of MT-3 in the tumor tissues was higher than that in the adjacent tissues(P=0.001).A high MT-3 expression esophageal cancer cell line and a low MT-3 expression cell line were successfully constructed.pP65 protein expression was enhanced when MT-3 was over-expressed,but decreased at low MT-3 expression;in contrast,P65 showed the opposite results with significant differences,which
MT-3;NF-κB;esophageal cancer
R735.1
A
10.3969/j.issn.1005-8982.2016.22.005
1005-8982(2016)22-0023-05
2016-04-06
suggested NF-κB signal was activated when MT-3 was over expressed.Immunofluorescence revealed that in MT-3 overexpression cells,more pP65 was expressed in the nuclei,which further supported that MT-3 activated NF-κB signaling pathway.Conclusions MT-3 suppresses the pathological process of esophageal cancer through activation of NF-κB signals.
