神经降压素受体1在大鼠肺缺血再灌注损伤中的表达及作用*
2016-12-13周志毅朱幸沨孙洁陈静瑜杨国仪
周志毅,朱幸沨,孙洁,陈静瑜,杨国仪
(江苏省无锡市人民医院1.病理科;2.胸外科,江苏 无锡 214023;3.江苏省人体器官移植重点实验室,江苏 无锡 214023)
论著
神经降压素受体1在大鼠肺缺血再灌注损伤中的表达及作用*
周志毅1,朱幸沨2,孙洁3,陈静瑜2,杨国仪1
(江苏省无锡市人民医院1.病理科;2.胸外科,江苏 无锡 214023;3.江苏省人体器官移植重点实验室,江苏 无锡 214023)
目的观察神经降压素受体1(NTR1)在大鼠肺缺血再灌注损伤LIRI模型中的表达和作用及其与Toll样受体4(TLR4)和缺氧诱导因子(HIF-1α)的关系,探讨NTR1在LIRI中的病理作用机制。方法40只雄性SD大鼠,分为8组进行观察。①假手术组;②LIRI组;③LIRI+生理盐水对照组;④LIRI+DMSO对照组;⑤LIRI+脂多糖干预组(TLR4激活组);⑥LIRI+TAK-242干预组(TLR4抑制组);⑦LIRI+NT干预组(NTR1激活组);⑧LIRI+SR48692干预组(NTR1抑制组)。制作大鼠原位LIRI模型,取各组大鼠左肺组织,观察肺组织病理变化、行逆转录-聚合酶链反应(RT-PCR)及蛋白质印迹法检测,统计分析NTR1在大鼠LIRI模型中的表达及作用及其与TLR4和HIF-1α的关系。结果肺IRI组NTR1 mRNA及蛋白的表达较假手术组增加(P<0.05);NT可进一步增加LIRI的炎症因子水平、细胞凋亡及肺组织病理损伤,而SR48692可减轻上述改变(P<0.05);与LIRI组比较,脂多糖干预组NTR1表达进一步增强,而TAK-242干预组NTR1表达则受到抑制(P<0.05);与LIRI组比较,HIF-1α mRNA和蛋白表达被SR48692抑制,而被NT增强(P<0.05)。结论 NT-NTR1与LIRI关系密切,参与了LIRI的发病机制,在LIRI中,可能存在TLR4-NTR1-HIF-1α信号通路,本研究为发现新的LIRI有效治疗靶点提供了理论依据。
大鼠;肺;缺血再灌注损伤;NTR1;TLR4
肺移植是终末期肺疾病患者的唯一治疗方案,但约20%肺移植会发生肺缺血再灌注损伤(lung ischemia-reperfusion injury,LIRI),LIRI是原发性移植肺功能衰竭的最主要原因,后者的死亡率高达60%[1]。炎症性损伤是LIRI的重要相关因素,与LIRI的成因密切相关。目前,神经降压素(neurotensin,NT)及神经降压素受体1(neurotensin receptor 1,NTR1)已被证实与炎症病理过程有密切关系。炎症因子Toll样受体4(TLR4)特异性激动剂LPS刺激可促进NTR1介导的炎症作用,如上调IL-8表达[2]。说明NTR1可能参与了缺血再灌注损伤病理过程,NTR1是否参与LIRI及TLR4介导的炎症病理过程还不明确。另有研究表明,NT-NTR1可通过活化缺氧诱导因子(HIF-1α)调控大肠炎的炎症过程[3]。本实验通过建立大鼠LIRI及干预模型,观察NTR1在LIRI中的表达、NTR1对LIRI的作用及NTR1与TLR4和HIF-1α的关系,从而探讨NTR1在LIRI中的病理作用机制及可能存在的信号通路,为寻找新型治疗手段提供理论依据。
1 材料与方法
1.1 实验动物及分组
清洁级雄性SD大鼠,体重250~300 g,40只,购于扬州大学比较医学中心。采用随机数字表法将SD大鼠分为8组,每组5只:①假手术组;②LIRI组;③LIRI+生理盐水对照组,静脉注射生理盐水2 ml;④LIRI+DMSO对照组,静脉注射2 ml DMSO;⑤LIRI+脂多糖干预组,将1.5 mg的TLR4特异性激活剂脂多糖溶于2 ml生理盐水中,静脉注射;⑥LIRI+TAK-242干预组,将TLR4特异性抑制剂TAK-242 10 mg/kg溶于2 ml DMSO,静脉注射;⑦LIRI+NT干预组,将4 nmol/kg的NT溶于2 ml生理盐水,静脉注射;⑧LIRI+SR48692干预组,将2 mg/kg的SR48692溶于2 ml DMSO,腹腔注射。各组均在阻断肺门前30 min进行上述相应的处理。
1.2 大鼠LIRI模型的建立
参照FARVIAI等[4]的制作方法建立原位大鼠LIRI模型,阻断大鼠左肺门1 h,再灌注3 h。具体为:经大鼠腹腔注射15 g/L的戊巴比妥钠溶液60 mg/kg进行麻醉,并腹腔注射0.5 mg/ml阿托品0.1 mg,皮下注射肝素1 000 IU/kg。大鼠经口气管插管,置入14G静脉留置针套管(长度45 mm),接动物呼吸机维持呼吸,通气频率为70~75次/min,潮气量为10 ml/kg,呼气末正压为2 cmH2O(0.196 kPa),吸入氧浓度为21%。动物保持右侧卧位,沿左侧第5肋间作3 cm切口,切开胸廓,暴露左肺门,游离下肺韧带。于吸气时完全阻断左肺门,1 h后恢复血流灌注,实验过程中腹腔注射生理盐水0.5 ml/h,于恢复血流后3 h时完整切取左肺。假手术组不阻断肺门,其他操作同LIRI组。
1.3 检测项目
1.3.1 各组肺组织中NTR1、HIF-1α、白细胞介素6(IL-6)及肿瘤坏死因子α(TNF-α)等mRNA表达的检测采用逆转录-聚合酶链反应(RT-PCR)进行检测,引物序列详见表1。用超纯RNA提取试剂盒提取组织样本中总RNA。用HiFi-MMLV cDNA第一链合成试剂盒进行反转录,实验操作按产品说明书进行,然后以cDNA为模板,利用各基因的检测引物进行PCR。扩增程序为:95℃10 min,然后以95℃15 s、60℃60 s、为1个循环,进行40个循环。用ABI7900HT型荧光定量PCR仪,采用2-△△CT法进行数据的相对定量分析。

表1 相关基因的引物序列
1.3.2 各组肺组织中相关蛋白的表达采用蛋白质印迹法进行定量检测。取-80℃冻存各组大鼠肺组
织各100 mg,加入2~3 ml的组织蛋白裂解液,匀浆器将组织研碎,取出匀浆液4℃离心(16 000 r/min)15 min。取上清液,按BCA法测定蛋白浓度。等量蛋白上样进行SDS聚丙烯酰胺凝胶电泳,用PVDF膜转膜(湿转法)。一抗包括NTR1(1∶500,美国abcam公司)及HIF-1α(1∶300,美国abcam公司),并在同样情况下测定内参β肌动蛋白(β-actin),将同一条件下待测蛋白与β-actin的吸光度值进行统计。
1.3.3 各组肺组织病理学检查取大鼠左肺中部1/3肺组织,加入4%多聚甲醛固定,行HE染色,显微镜下观察肺泡和间质水肿、中性粒细胞浸润以及出血情况,肺损伤严重性评分参考相关文献[5]。
1.3.4 各组肺组织细胞的凋亡采用原位末端标记法(TUNEL)进行检测。采用TUNEL技术标记肺组织石蜡切片中凋亡细胞核DNA3’OH,替代TUNEL反应液作阴性对照,方法参照试剂盒说明书,显微镜下观察凋亡细胞核为棕褐色,正常细胞核呈淡蓝色。每张玻片随机选取6个视野(×400倍),观察凋亡细胞,并计算凋亡指数(凋亡细胞数/整个视野细胞数×100%)。
1.4 统计学方法
采用SPSS 18.0统计学软件进行数据处理,计量资料采用均数±标准差(±s)表示。各组间的数据用单因素方差分析One-way ANOVA进行比较,P<0.05为差异有统计学意义。
2 结果
2.1 假手术组及LIRI组中NTR1 mRNA及蛋白的表达
两组肺组织中NTR1 mRNA及蛋白的表达情况详见图1。LIRI组NTR1 mRNA及蛋白的表达较假手术组增加,两组比较,差异有统计学意义(P<0.05,图1)。
2.2 各组肺组织中炎症因子、细胞凋亡、肺损伤及肺组织病理改变情况的比较
为了进一步探讨NTR1表达在LIRI中的作用,应用NT及特异性NTR1抑制剂SR48692,发现NT可进一步增加炎症因子水平(TNF-α和IL-6,图2)、细胞凋亡(图3)及肺组织病理损伤,而SR48692可减轻LIRI模型的上述改变;LIRI组肺组织呈现明显的弥漫性肺泡损伤,包括炎症、肺间隔水肿、肺泡内出血、肺不张及充血,NT可增强上述肺损伤,肺损伤严重性评分增加,而SR48692则起减轻作用(表2、图4)。
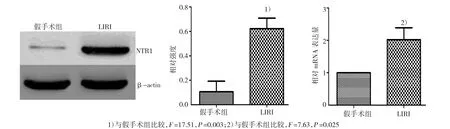
图1 两组大鼠肺组织中NTR1蛋白及mRNA的表达

图2 各组肺组织中IL-6、TNF-α mRNA表达的比较
2.3 各组肺组织中TLR4对NTR1表达的影响
经蛋白质免疫印迹检测发现,与LIRI组比较,脂多糖干预组NTR1表达进一步增强,TAK-242干预组NTR1表达则受到抑制(P<0.05)(图5)。
与LIRI组比较,HIF-1α mRNA和蛋白表达被SR48692抑制,而被NT增强(P<0.05,图6)。
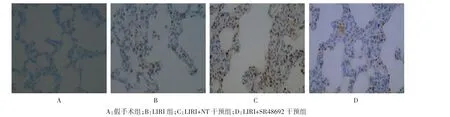
图3 各组肺组织中细胞凋亡情况(TUNEL×200)

图4 各组肺组织的病理改变情况(HE×200)
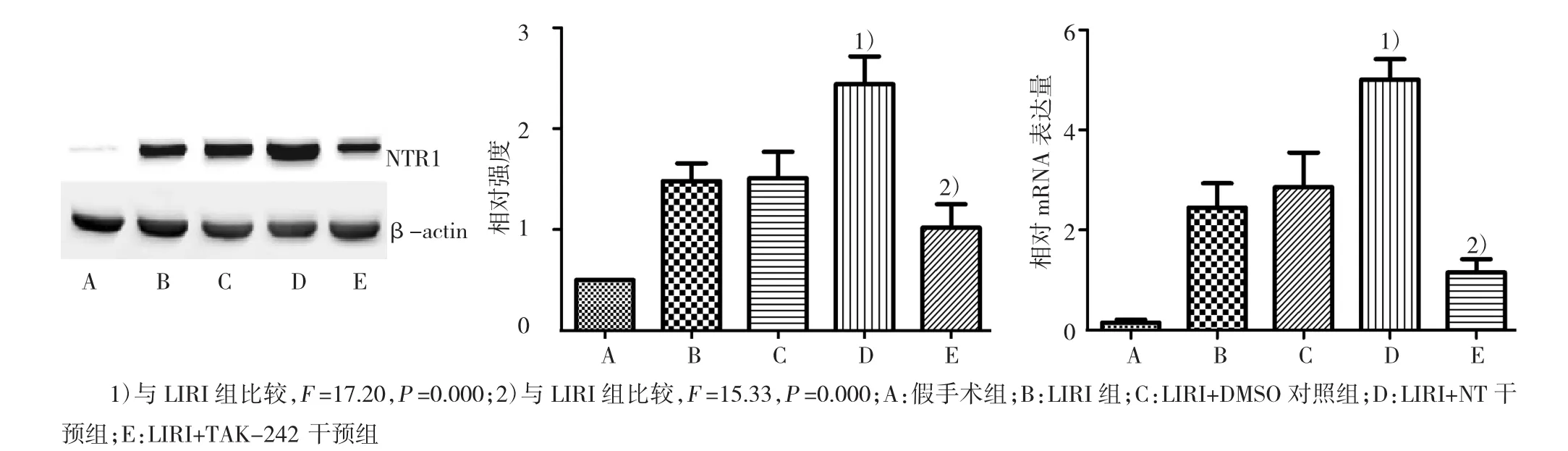
图5 在LIRI模型中,TLR4调控NTR1蛋白及mRNA的表达
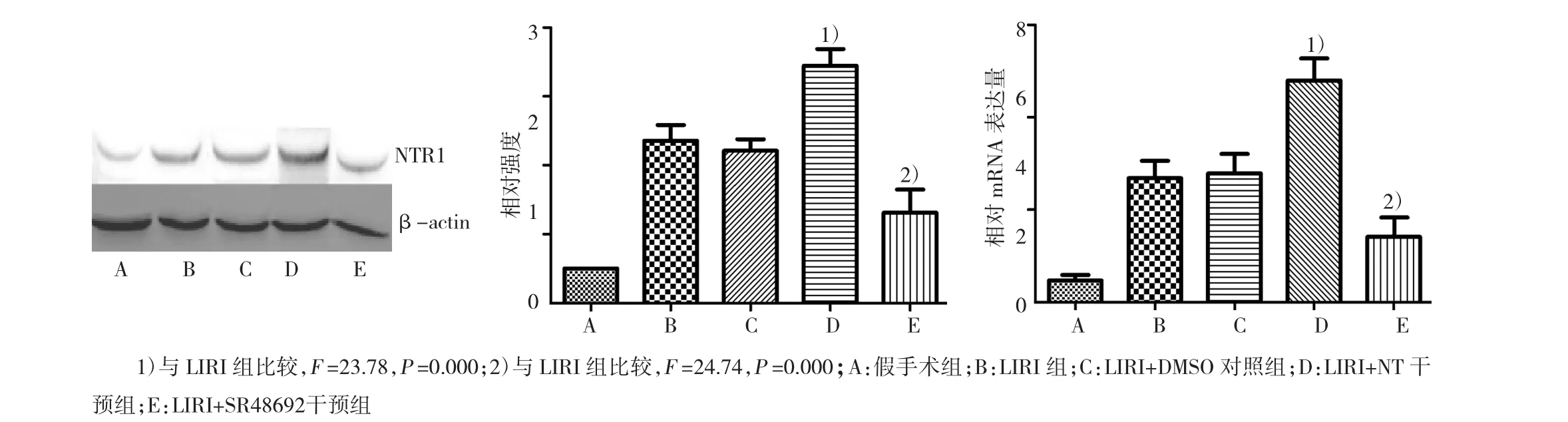
图6 在LIRI模型中,NTR1调控HIF-1α蛋白及mRNA的表达
表2 各组凋亡指数及肺缺血再灌注(IRI)损伤严重性评分的比较(±s)

表2 各组凋亡指数及肺缺血再灌注(IRI)损伤严重性评分的比较(±s)
注:与LIRI组比较,1)F=71.46,P=0.000;2)F=60.48,P=0.000;3)F=48.05,P=0.000;4)F=22.17,P=0.000
组别凋亡指数肺损伤严重性评分假手术组0.60±0.402.40±0.24 LIRI组22.60±1.699.60±0.40 LIRI+DMSO对照组23.00±1.649.00±0.71 LIRI+NT干预组30.40±1.891)12.80±0.732)LIRI+SR48692干预组12.80±1.883)7.00±1.104)
3 讨论
在组织缺血基础上恢复血流后炎症反应介质增多,导致组织损伤反而加重,甚至发生不可逆性损伤的现象称为缺血再灌注损伤。因此,炎症性损伤是缺血再灌注损伤的重要相关因素,与其成因密切相关。在本研究中,LIRI的NTR1表达显著上调,NT-NTR1在LIRI中促进了炎症反应,发挥了损伤性病理作用,而炎症相关因子TLR4显著正调控NTR1表达,说明NT-NTR1参与并调节LIRI的病理过程,并且受TLR4的调控,可能是TLR4的下游信号,而NTR1信号可正调控HIF-1α表达,因此,本研究显示,在LIRI的发生发展中可能存在TLR4-NTR1-HIF-1α的信号通路。
NT参与炎症病理过程的早期证据是由LAZARUS等[6]发现的,他们发现NT可通过高亲和力受体与肥大细胞紧密结合,通过钙动员及磷脂酶C激活释放组胺,NTR1特异性抑制剂SR48692可阻止这一过程,表明该受体可直接激活肥大细胞,参与炎症过程。研究表明,NT-NTR1参与了多种炎症病理过程[2,7]:NT可作用于中性粒细胞、T淋巴细胞及巨噬细胞,促进炎症细胞的增殖,并具有趋化作用,增强人血中性粒细胞的吞噬作用。配体结合研究表明,NT可通过外周血淋巴细胞表面的高亲和力NT受体正调控淋巴细胞系MOLT-4的生长。在梭菌毒素A介导假膜性结肠炎模型中,梭菌毒素A注入结肠绊后,在发生分泌性及炎症性病变前,结肠黏膜的NT/NTR1 mRNA及蛋白表达短期内即明显增多,SR48692可抑制降低肠渗透性,减轻中性粒细胞浸润、肠损伤及肥大细胞活性,并具有剂量依赖性。在炎症肠病中,肠黏膜毛细血管内皮细胞表达的NTR1及NT结合可导致炎症相关细胞因子的活化。NT可增强支气管活化巨噬细胞IL-1β的表达,可刺激中性粒细胞黏附支气管上皮细胞,调节气道的炎症反应。NT可显著增加腹腔淋巴细胞的黏附性和化学趋向性,作用于硫胶质诱导的鼠腹膜巨噬细胞及骨髓来源巨噬细胞,可刺激两者的吞噬活性。以上说明NT-NTR1与炎症有着密切关系,在炎症中发挥了重要的作用,也可能是LIRI发生发展的重要作用机制。在本研究中,LIRI组的NTR1 mRNA及蛋白表达较假手术组均增强,说明NTR1与LIRI具有密切相关性,为了进一步研究NTR1在LIRI中的作用机制,研究人员应用NTR1的激动剂NT及特异性抑制剂SR48692对LIRI组进行干预,发现NT可进一步增加LIRI的炎症及病理损伤(包括炎症因子、细胞凋亡及肺组织病理损伤),而SR48692可减轻LIRI模型的上述改变,进一步表明NTR1在LIRI的发生发展中起了重要作用。
至于NT-NTR1参与LIRI发生发展的分子信号机制目前还不清楚。在本组LIRI中,TLR4信号可正调控NTR1的表达,而NTR1可正调控HIF-1α的表达。PEREIRA等[8]研究发现,在稳定的内环境中,施加LPS炎症刺激,可上调成纤维细胞系的NT/NTR1表达,促进NT信号介导的炎症过程,如上调IL-8表达,IL-8是一种强有力的中性粒细胞趋化因子。并有研究表明,NT-NTR1可通过活化HIF-1α调控大肠炎的炎症及血管形成过程[3]。HIF-1α信号通路在能量代谢、炎症反应及细胞增生与凋亡中起非常重要的作用,抑制HIF-1α的活性被认为是治疗许多疾病的新靶点,这些疾病包括局部缺血、脂多糖介导的败血症、恶性肿瘤和慢性炎症等[9-10]。在缺血性损伤或IRI预处理模型中,HIF-1α通常被认为是一种适应性因子,对器官起保护性作用[11],事实是,HIF-1α的作用是保护性还是损害性可能依赖于损伤的类型及性质[12]。PEYSSONNAUX等[13]发现在早期脓毒症中,脂多糖诱导的TLR4依赖性HIF-1α可引发炎症细胞活素类的产生,抑制HIF-1α可减轻上述过程及脓毒症的死亡率。有关研究已报道了HIF-1α在LIRI之TLR4信号中的损害性作用[14]。据上所述,在LIRI中,可能存在TLR4-NTR1-HIF-1α信号通路,或是LIRI发生发展的分子机制之一,NTR1是其中重要的信号传递因子。NT–NTR1在炎症中还可能存在其他信号通路。ZHAO[15-17]等发现,在NCM460肠上皮细胞中,NT–NTR1的作用依赖RhoA-NF-κB信号,NT使IkBα磷酸化降解,并促进NF-κB亚基
P65的磷酸化及转录,经由细胞内钙动员及PKCα活性,促进IL-8转导活性。老鼠空肠缺血再灌注损伤的NF-kB/IκB系统激活也与NT相关。以上表明炎症中还存在NT-NTR1-NF-κB信号通路。
总之,本研究表明,NT-NTR1与LIRI关系密切,参与了LIRI的发病机制。在LIRI中,可能存在TLR4-NTR1-HIF-1α信号通路,从而为发现新的LIRI有效治疗靶点提供了理论依据。近来,有文献表明[18],NT-NTR1除了具有促急性炎症的作用外,还可促进慢性黏膜炎症的愈合。在炎症及炎症修复中起双重作用。在急性炎症中,NT通过NF-κB信号起促炎症作用,而在慢性炎症中,NT-NTR1可通过金属蛋白酶-EGFR信号促进炎症的修复。因此,需要以后在LIRI中做进一步的研究。
[1]DE PERROT M,LIU M,WADDELL T K,et al.Ischemia-reperfusion-induced lung injury[J].Am J Respir Crit Care Med,2003,167(4):490-511.
[2]ZHAO D,POTHOULAKIS C.Effects of NT on gastrointestinal motility and secretion,androle inintestinal inflammation[J]. Peptides,2006,27(10):2434-2444.
[3]BAKIRTZIK,WESTG,FIOCCHIC,etal.Theneurotensin-HIF-1α-VEGFαaxisorchestrateshypoxia,colonic inflammation,and intestinal angiogenesis[J].Am J Pathol,2014, 184(12):3405-3414.
[4]FARIVAR A S,MERRY H E,FICA-DELGADO M J,et al. Interleukin-6 regulation of direct lung ischemia reperfusion injury[J].Ann Thorac Surg,2006,82(2):472-478.
[5]VAN DER KAAIJ N P,KLUIN J,LACHMANN R A,et al. Alveolar preservation with high inflation pressure and intermediate oxygen concentration reduces ischemia-reperfusion injury of the lung[J].J Heart Lung Transplant,2012,31(5):531-537.
[6]LAZARUS L H,PERRIN M H,BROWN M R.Mast cell binding of neurotensin.I.Iodination of neurotensin and characterization of the interaction of neurotensin with mast cell receptor sites[J]. J Biol Chem,1977,252(20):7174-7179.
[7]ZHAO D,BAKIRTZI K,ZHAN Y,et al.Insulin-like growth factor-1 receptor transactivation modulates the inflammatory and proliferative responses of neurotensin in human colonic epithelial cells[J].J Biol Che,2011,286(8):6092-6099.
[8]PEREIRA D A,MIGUEL N B,MOURA L,et al.Neurotensin decreases the proinflammatory status of human skin fibroblasts and increases epidermal growth factor expression[J].Int J Inflam, 2014,2014:248240.
[9]NICHOLAS S A,SUMBAYEV V V.The role of redox-dependentmechanismsinthedownregulationofligand-induced Toll-like receptors 7,8 and 4-mediated HIF-1 alpha prolyl hydroxylation[J].Immunol Cell Biol,2010,88(2):180-186.
[10]HIERHOLZER C,HARBRECHT B G,BILLIAR T R,et al. Hypoxia-induciblefactor-1activationandcyclo-oxygenase-2 induction are early reperfusion-independent inflammatory events in hemorrhagic shock[J].Arch Orthop Trauma Surg,2001,121 (4):219-222.
[11]FRAISL P,ARAGONÉS J,CARMELIET P.Inhibition of oxygen sensors as a therapeutic strategy for ischaemic and inflammatory disease[J].Nat Rev Drug Discov,2009,8(2):139-152.
[12]FEINMAN R,DEITCH E A,WATKINS A C,et al.HIF-1 mediatespathogenicinflammatoryresponsestointestinalischemia-reperfusion injury[J].Am J Physiol Gastrointest Liver Physiol,2010,299(4):833-843.
[13]PEYSSONNAUX C,CEJUDO-MARTIN P,DOEDENS A,et al. Cutting edge:Essential role of hypoxia inducible factor-1alpha in development of lipopolysaccharide-induced sepsis[J].J Immunol,2007,178(12):7516-7519.
[14]周志毅,朱幸枫,陈静瑜,等.缺氧诱导因子-1α在TLR4信号通路介导的大鼠肺缺血再灌注损伤中的影响[J].中华器官移植杂志,2014,35(09):561-566.
[15]ZHAO D,KEATES A C,KUHNT-MOORE S,et al.Signal transduction pathways mediating neurotensin-stimulated interleukin-8 expression in human colonocytes[J].J Biol Chem,2001,276(48): 44464-44471.
[16]ZHAO D,KUHNT-MOORE S,ZENG H,et al.Neurotensin stimulates IL-8 expression in human colonic epithelial cells through Rho GTPase-mediated NF-kappa B pathways[J].Am J Physiol Cell Physiol,2003,284(6):C1397-1404.
[17]ZHAO D,POTHOULAKIS C.Rho GTPases as therapeutic targets for the treatment of inflammatory diseases[J].Expert Opin Ther Targets,2003,7(5):583-592.
[18]ZHAO D,ZHAN Y,KOON H W,et al.Metalloproteinase-dependent transforming growth factor-alpha release mediates neurotensin-stimulatedMAPkinaseactivationinhumancolonic epithelial cells[J].J Biol Chem,2004,279(42):43547-43554.
(张蕾 编辑)
Effect of NTR1 expression in rats with lung ischemia-reperfusion injury and mechanism*
Zhi-yi Zhou1,Xing-feng Zhu2,Jie Sun3,Jing-yu Chen2,Guo-yi Yang1
(1.Department of Pathology,Wuxi People's Hospital,Wuxi,Jiangsu 214023,China;2.Department of Thoracic Surgery,Wuxi People's Hospital,Wuxi,Jiangsu 214023,China;3.Jiangsu Key Larboratory of Human Organ Transplantation,Wuxi,Jiangsu 214023,China)
Objective To investigate neurotensin receptor 1(NTR1)expression and the effect and mechanism of NTR1 expression in rats with lung ischemia-reperfusion injury(LIRI).Methods Forty SD rats were randomly grouped as Sham group,LIRI group,LIRI+saline control group,LIRI+DMSO control group,LIRI+TLR4-activated group, LIRI+TAK-242 group(TLR4-inhibited group),LIRI+NTR1-activated group and LIRI+NTR1-inhibited group.The NTR1 expression and the role of NTR1 in the LIRI rats were detected with RT-PCR and Western blot and statistically analyzed.Results NTR1 mRNA and protein expressions in the LIRI group were significantly increased comparing with the sham group(P<0.05).NT further increased the levels of inflammatory cytokines,apoptosis and lung pathological injury in the LIRI group,while SR48692 significantly reduced the above changes(P<0.05). Compared with the LIRI group,NTR1 expression was further enhanced in the LIRI+LPS group and was significantly inhibited in the LIRI+TAK-242 group(P<0.05).HIF-1α mRNA and protein expressions were significantly inhibited
rats;lung;ischemia-reperfusion injury;NTR1;TLR4
R-332
A
10.3969/j.issn.1005-8982.2016.22.002
1005-8982(2016)22-0007-06
2016-04-06
无锡市医院管理中心重大扶持项目(No:YGZF1110);江苏省人体器官移植重点实验室开放课题(No:YK201303)
杨国仪,E-mail:yanggywin2013@163.com
by SR48692 and was significantly enhanced by NT compared with the LIRI group(P<0.05).Conclusions There is a close relationship between NTR1 and LIRI.NT-NTR1 is involved in the pathogenesis of LIRI.There may be TLR4-NTR1-HIF-1α signal pathway in LIRI and the theoretical basis is provided to find new effective therapeutic targets in LIRI.
