双环醇对大鼠口服他克莫司和阿托伐他汀后血浆药代动力学的影响
2016-12-12王燕扈金萍
王燕 扈金萍
双环醇对大鼠口服他克莫司和阿托伐他汀后血浆药代动力学的影响
王燕 扈金萍
目的 研究双环醇对大鼠口服他克莫司和阿托伐他汀后血浆药代动力学的影响,为双环醇与其他临床药物合理应用提供实验依据。方法 SD大鼠分为空白对照组和双环醇组,分别口服给予0.5%羧甲基纤维素(CMC)和双环醇200 mg·kg-1·d-1,连续给药7 d。实验第8天两组动物分别口服给予他克莫司(2 mg/kg)和阿托伐他汀(10 mg/kg)。应用LC/MS/MS分析方法测定各组动物给药后不同时间点的血药浓度。采用WinNonLin软件进行非房室模型分析,计算血浆药代动力学参数。结果 空白对照组和双环醇给药组大鼠(200 mg·kg-1·d-1,7 d)口服他克莫司及阿托伐他汀后的血浆血药峰浓度(Cmax)及药时曲线下面积(AUC)差异无统计学意义(P>0.05)。结论 双环醇多次给药后对合用药物他克莫司和阿托伐他汀在大鼠体内血浆药代动力学无明显影响。
双环醇;他克莫司;阿托伐他汀;药代动力学;相互作用
联合用药是目前临床协同治疗或降低毒副作用的重要手段,但合用药物间代谢性相互作用可导致血液或靶器官中药物浓度降低或升高,在一定程度上改变药物的安全性和疗效[1]。
他克莫司和阿托伐他汀是目前临床最常用的肾移植术后免疫抑制剂和他汀类降脂药物,但在长期临床应用中,可出现肝损伤等不良反应[2],因此在免疫治疗和降脂过程中常使用保肝药治疗药物引起的肝损伤。双环醇片(Bicyclol,商品名:百赛诺)是我国首个上市的治疗肝脏炎症的1.1类化学新药。以往研究结果表明,双环醇可预防和治疗肾移植术后抗排斥药物以及降脂药引起的肝损伤[3]。应用双环醇进行抗炎保肝治疗的同时是否会影响合用药物的代谢,是临床关注的热点问题之一。本研究拟观察双环醇多次给药后对上述两种药物在大鼠体内血药浓度的影响,旨在降低临床用药风险,避免因药物代谢性相互作用而引起的不良反应,为临床合理用药提供参考依据。
资料和方法
一、材料
(一)药物和试剂 双环醇由北京协和药厂提供,纯度>99%;他克莫司(普乐可复胶囊)由华北制药集团新药研究开发中心惠赠;阿托伐他汀钙(批号:100590-200802)购自中国食品药品检定研究院;环孢素A(CAS:59865-13-3)购自百灵威公司;辛伐他汀(CAS:79902-63-9)购自美仑生物技术有限公司。甲醇和乙腈为色谱纯(Fisher,美国),其他试剂均为分析纯。超纯水由Milli-Q 纯水仪制备(Millipore,MA,美国)。
(二)实验动物 雄性SD大鼠,体重180~200 g,购自北京维通利华实验动物技术有限公司。动物许可证编号: SCXK(京)2012-0001。
(三)实验仪器 美国AB公司API 4000液相色谱串联质谱,包括ESI源、自动进样器、质谱泵及Analysist 1.5.2数据处理系统;岛津LC-30AD液相色谱仪。
二、方法
(一)动物给药及处理 双环醇、他克莫司、阿托伐他汀分别用0.5% 羧甲基纤维素(CMC)配制成浓度为20 mg/mL、0.2 mg/mL、1 mg/mL混悬液,用于口服给药。将20只SD大鼠分成两组,每组10只,分别为空白对照组和双环醇给药组。双环醇给药组口服双环醇 200 mg·kg-1·d-1,连续给药7 d,空白对照组给予同体积0.5% CMC。实验第8天空白对照组和双环醇给药组大鼠分别口服给予他克莫司(2 mg/kg)和阿托伐他汀(10 mg/kg)。大鼠口服他克莫司后0、2、5、10、15、30、45 min、1、2、3、4、6、8、12、24 h各时间点自大鼠眼眶静脉丛取血约300 μL,肝素抗凝后离心分离血浆备用;大鼠口服阿托伐他汀后0、5、10、20、30、45 min、1 h,1.5 h、2 h、3 h、4 h,6 h,8 h,12 h各时间点自大鼠眼眶静脉丛取血约300 μL,肝素抗凝离心后,分离血浆备用。
(二)标准曲线配制 ①他克莫司:取大鼠空白血浆样品50 μL,加入不同浓度他克莫司(0.0015,0.0025,0.005,0.025,0.05,0.125,0.25,0.5,1,1.5 μg/mL)标准品各10 μL,再加入10 μL内标环孢素A(1.25 μg/mL),混匀后加入乙腈180 μL沉淀蛋白,高速离心14000×5 min两次,取上清液5 μL进行LC/MS分析。②阿托伐他汀:取大鼠空白血浆样品50 μL,加入不同浓度阿托伐他汀钙(0.001, 0.0025,0.005,0.025,0.05,0.1,0.25,0.5,1,2.5,5 μg/mL)标准品各10 μL,再加入10 μL内标辛伐他汀(1.25 μg/mL)混匀后加入乙腈180 μL沉淀蛋白,高速离心14000×5 min两次,取上清液5 μL进行LC/MS分析。
(三)血浆样本处理 取他克莫司组血浆样品50 μL,加入10 μL内标环孢素A(1.25 μg/mL),再加190 μL乙腈沉淀蛋白;取阿托伐他汀组血浆样品50 μL加入10 μL内标辛伐他汀(1.25 μg/mL),再加190 μL乙腈沉淀蛋白,高速离心14000×5 min两次,取上清液进样10 μL。
(四)LC-MS检测条件 ①他克莫司:色谱柱:CAPCELL PAK(2.1 mm×100 mm, 5 μm),柱温:40 ℃,流动相:甲醇:水(10 mM NH4Ac)=95∶5,流速:0.2 mL/min,SRM检测:m/z 826.0→616.0(他克莫司),m/z 1202.8→425.4(环孢素A)。②阿托伐他汀:色谱柱:Zorbax SB-C18(2.1 mm×100 mm, 3.5 μm);柱温:25 ℃,流动相:乙腈(0.1%甲酸)∶水(0.1%甲酸)=70∶30,流速:0.2 mL/min,SRM检测:m/z 559.4→440.2(阿托伐他汀),m/z 419.9→199.4(辛伐他汀)。
三、统计学处理
结 果
一、大鼠血浆标准曲线
如表1所示,血浆中各药物的响应值和浓度线性关系良好,未见明显杂质干扰。
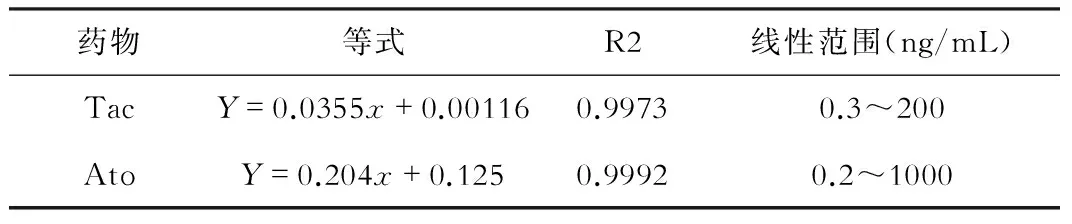
表1 大鼠血浆他克莫司(Tac)和阿托伐他汀(Ato)标准曲线
二、双环醇多次给药大鼠口服他克莫司后的血药浓度经时间变化
大鼠多次口服双环醇(200 mg·kg-1·d-1,7 d)后口服他克莫司(2 mg/kg),空白对照组和双环醇给药组相比,两者的血浆Cmax分别为97.72±91.32 ng/mL和60.82±26.95 ng/mL,AUC(0-∞)分别为190.32±128.8 h·ng/mL和148.4±64.93 h·ng/mL。虽然双环醇给药后的 Cmax降低37.8%,AUC(0-∞)降低22.0%,但与空白对照组相比差异均无统计学意义(P>0.05)。两组动物的血药浓度-时间曲线比较见图1,药代动力学参数见表2。

图1 空白对照组和双环醇给药组大鼠口服他克莫司(2 mg/kg)后的血浆药时曲线(n=5例)
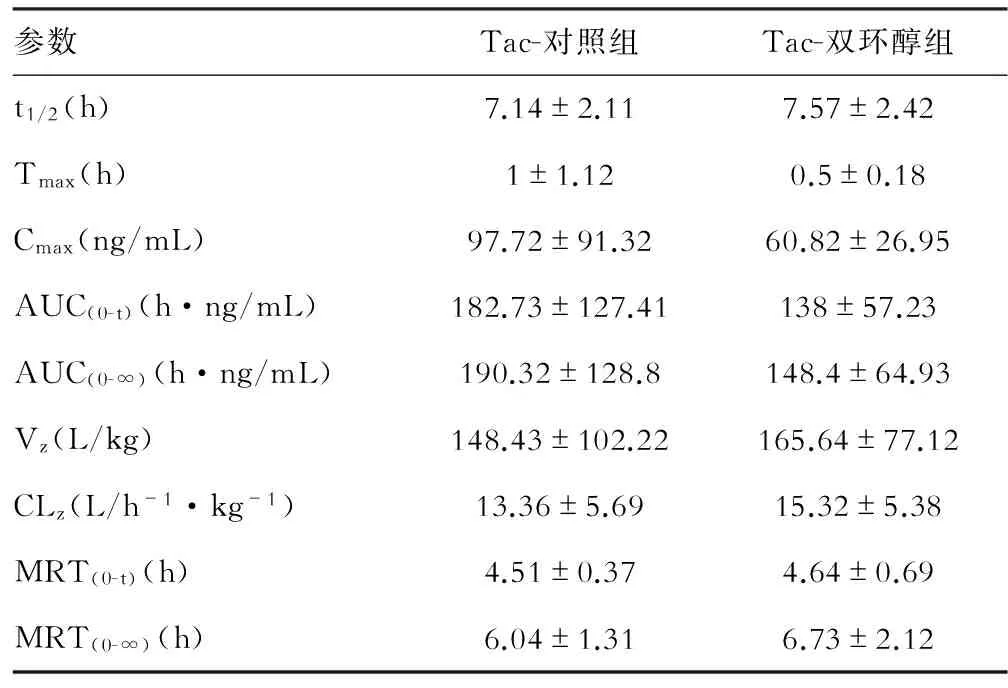
参数Tac-对照组Tac-双环醇组t1/2(h)7.14±2.117.57±2.42Tmax(h)1±1.120.5±0.18Cmax(ng/mL)97.72±91.3260.82±26.95AUC(0-t)(h·ng/mL)182.73±127.41138±57.23AUC(0-∞)(h·ng/mL)190.32±128.8148.4±64.93Vz(L/kg)148.43±102.22165.64±77.12CLz(L/h-1·kg-1)13.36±5.6915.32±5.38MRT(0-t)(h)4.51±0.374.64±0.69MRT(0-∞)(h)6.04±1.316.73±2.12
二、双环醇多次给药大鼠口服阿托伐他汀后血药经时间变化
大鼠多次口服双环醇(200 mg·kg-1·d-1,7 d)后口服阿托伐他汀(10 mg/kg),空白对照组和双环醇给药组相比,两者的Cmax分别为302±157.43 ng/mL和256±111.27 ng/mL,AUC(0-∞)分别为341.63±174.35 h·ng/mL和311.03±38.68 h·ng/mL。虽然双环醇给药后的 Cmax降低15.2%,AUC(0-∞)降低8.96%,但两组差异均无统计学意义(P>0.05)。两组动物的血药浓度-时间曲线比较见图2,药代动力学参数见表3。

图2 空白对照组和双环醇给药组大鼠口服阿托伐他汀(10 mg/kg)后的血浆药时曲线(n=5例)

参数Ato-对照组Ato-双环醇组t1/2(h)1.54±0.132.14±0.24Tmax(h)0.32±0.250.17±0Cmax(ng/mL)302±157.43256±111.27AUC(0-t)(h·ng/mL)340.42±173.52305.33±38.83AUC(0-∞)(h·ng/mL)341.63±174.35311.03±38.68Vz(l/kg)78.10±33.77100.90±20.04Clz(l/h/kg)35.47±15.5932.57±4.18MRT(0-t)(h)1.46±0.312.15±0.39MRT(0-∞)(h)1.5±0.312.39±0.49
讨 论
他克莫司是一种强效免疫抑制剂,作用强度约为CsA的10~100倍,且安全性较CsA好,已逐渐成为器官移植术后首选的免疫抑制剂。阿托伐他汀是3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,通过竞争性抑制胆固醇合成限速酶HMG-CoA降低胆固醇和脂蛋白水平,是目前最常用的他汀类降脂药。上述两药在长期临床应用中,可出现不同程度的肝损伤等不良反应。因此在免疫治疗和降脂过程常使用保肝药进行保肝治疗。
双环醇作为治疗肝脏炎症的1.1类化学新药,可通过抑制肝损伤后炎性调控因子的表达和活性,抑制氧自由基和一氧化氮的生成,提高体内抗氧化物如谷胱甘肽的水平,减轻炎症和氧化及硝化损伤,抑制肝细胞凋亡[4-5],从而稳定肝细胞膜、改善线粒体功能及保护肝细胞核DNA的结构和功能[6],达到抗炎保肝的作用。目前双环醇也越来越多的用于药源性肝损伤的联合治疗,如双环醇片可预防60岁以上肿瘤患者的化疗药物性肝损伤[7],在常规保肝基础上加用双环醇可明显减轻抗结核药所致DILI的发生率及肝损伤程度[8]等。
临床联合用药时,由于药物间的代谢性相互作用可能引起药物的血药浓度改变,从而影响疗效和毒性。既往体外实验结果显示[9],双环醇体外对二甲双胍、非诺贝特、环孢素A和他克莫司在大鼠和人肝微粒体中的代谢无明显影响,一定程度地反映了双环醇与上述合用药物的相互作用情况。双环醇主要经大鼠和人肝微粒体CYP3A代谢, 对CYP3A仅有微弱的诱导作用,不诱导其自身代谢。已知药物代谢过程中,当两种或多种药物经同一代谢酶代谢时,药物间则可能由于对药酶的竞争而发生相互作用,致使血药浓度发生改变。阿托伐他汀、他克莫司都是通过CYP3A4代谢[10]的临床药物,因此,本研究探讨双环醇对他克莫司、阿托伐他汀体内血药浓度的影响以及潜在的药物相互作用具有显著的临床意义。
研究结果表明,双环醇给药组大鼠给予他克莫司(2 mg/kg)后,与空白对照组相比,他克莫司的Cmax降低37.8%,AUC(0-∞)降低22.0%,但两组动物的Cmax和AUC(0-∞)差异均无明显统计学意义;双环醇连续给药7天后给予阿托伐他汀(10 mg/kg),与空白对照组相比,阿托伐他汀的Cmax降低15.2%,AUC(0-∞)降低8.96%,但两组动物的Cmax和AUC(0-∞)差异均无统计学意义。上述结果提示,双环醇多次给药未明显影响他克莫司和阿托伐他汀在大鼠体内的血药浓度,提示双环醇与上述药物合用时发生代谢性药物相互作用的可能性较小。
综上所述,大鼠多次口服双环醇后对他克莫司和阿托伐他汀体内血药浓度无明显影响,此结果可为临床联合用药的有效性和安全性提供一定的参考依据。
[ 1 ] 黄宇星,刘二伟. 联合用药的药物相互作用及研究方法.药物评价与研究,2014,37:276-279.
[ 2 ] 孙雨平,史国兵,樊蓉,等.他克莫司致不良反应67例文献分析.医药导报,2014,33:1535-1537.
[ 3 ] 王艳飞,石红娟,尹博英,等.双环醇预防他汀类药物肝损害的临床疗效观察.实用心脑肺血管病杂志,2013, 21:132-133.
[ 4 ] Lou XE, Xu N, Yao HP, et al. Bicyclol attenuates pro-inflammatory cytokine and chemokine productions in CpG-DNA-stimulated L02 hepatocytes by inhibiting p65-NF-kappa B and p38-MAPK activation. Pharmazie,2010,65: 206-212.
[ 5 ] Yu YN, Chen H, Li Y. Effect of bicyclol on cisplatin-induced hepatotoxicity in the hepatocarcinoma 22 tumour-bearing mice. Basic Clin Pharmacol Toxicol,2009,104:300-305.
[ 6 ] Liu GT, Li Y, Wei HL, et al. Mechanism of protective action of bicyclol against CCl-induced liver injury in mice. Liver Int,2005,25: 872-879.
[ 7 ] Li X, Zhou J, Chen S, et al. Role of bicyclol in preventing chemotherapeutic agent-induced liver injury in patients over 60 years of age with cancer. J Int Med Res,2014,42:906-914.
[ 8 ] Chu NH, Li L, Zhang X, et al. Role of bicyclol in preventing drug-induced liver injury in tuberculosis patients with liver disease.Int J Tuberc Lung Dis,2015,19:475-480.
[ 9 ] 杨树,赵曼曼,扈金萍,等.双环醇对二甲双胍、非诺贝特、环孢素A、他克莫司药物体外代谢的影响.胃肠病学和肝病学杂志,2015,24:1500-1504.
[10] de Jonge H, de Loor H,Verbeke K, et al. Impact of CYP3A5 genotype on tacrolimus versus midazolam clearance in renal transplant recipients: new insights in CYP3A5-mediated drug metabolism. Pharmacogenomics,2013,14:1467-1480.
(本文编辑:易玲)
100050 北京 中国医学科学院药物研究所,创新药物非临床药物代谢及药代/药效研究北京市重点实验室
扈金萍,Email:hujp@imm.ac.cn
2016-04-27)
