慢性乙型肝炎患者外周血小板参数与肝脏组织病理的相关性分析
2016-12-12欧宏杰潘业刘家俊吴晓鹭
欧宏杰 潘业 刘家俊 吴晓鹭
·论 著·
慢性乙型肝炎患者外周血小板参数与肝脏组织病理的相关性分析
欧宏杰 潘业 刘家俊 吴晓鹭
目的 探讨外周血小板参数在CHB患者肝脏组织病理无创性评估中的价值。方法 前瞻性对787例CHB患者进行血常规检查,记录血小板的相关参数,同时进行肝组织病理学检查。计数资料采用卡方检验;正态分布计量资料采用t检验。两组计量资料之间的相关性分析采用Spearman相关分析,多因素分析采用Logistic逐步回归。结果 不同肝脏组织炎症活动度和纤维化程度组在样本量及性别分布上差异均有统计学意义(均P<0.01);在年龄差异上也有统计学意义(P=0.037、0.01)。不同炎症活动度和纤维化程度组在PLT、MPV、PDW的差异均有统计学意义(t分别为-5.993、3.208、-3.344和-6.955、5.812、-6.503,均P<0.05)。肝组织炎症活动度与PLT、PCT、PDW呈负相关(r=-0.37、-0.16、-0.25,均P<0.01),与MPV呈正相关(r=0.22,P<0.01);肝纤维化程度与PLT、PCT、PDW呈负相关(r=-0.37、-0.15、-0.17,均P<0.01),与MPV呈正相关(r=0.22,P<0.01)。Logistic多元回归分析显示PLT(OR:0.987,P=0.008)、PDW(OR:0.833,P=0.01)为影响肝脏炎症活动度的独立预测因素;年龄(OR:1.017,P=0.049)、PLT(OR:0.989,P<0.01)、PDW(OR:0.801,P<0.01)为影响肝脏纤维化程度的独立预测因素。结论 外周血小板参数与CHB患者的肝脏组织炎症、纤维化程度存在一定的相关性,为临床评估肝脏组织炎症、纤维化情况、创建肝脏组织病理评估的无创模型提供了一项简便、有用的观测指标。
肝炎,乙型;血小板;病理学;相关因素;分析
目前CHB治疗的总体目标是:最大限度地长期抑制HBV,减轻肝细胞炎症坏死及肝纤维化,延缓和减少肝功能衰竭、肝硬化、肝细胞癌及其并发症的发生[1]。因此,及时、准确地评估肝脏组织的炎症、纤维化情况对于决定HBV感染者的治疗时机、评价治疗效果以及判断预后具有重大的意义。目前肝脏活组织检查被认为是评估肝脏炎症、纤维化情况的“金标准”。但肝脏活组织检查是有创操作,其并发症发生率接近0.5%,死亡率约0.05%[2],因此受所在医院硬件条件、操作医师技术水平以及患者依从性的影响,肝脏活组织检查有时难以广泛开展。同时,由于从肝脏活组织检查得到的肝脏组织较小,可能由于肝脏本身病变分布的不均匀导致取样误差而出现漏诊的情况[3]。因此,创建无创性评估肝脏组织炎症、纤维化的方法成为近来CHB研究的热点之一。由于外周血小板检测方便易行,有学者指出是否能用外周血小板参数来评估肝脏组织炎症、纤维化情况[4]。本研究通过分析外周血小板各参数与肝脏组织炎症、纤维化的关系,探讨外周血小板参数在CHB患者肝脏组织病理无创性评估中的价值。
资料和方法
一、研究对象
前瞻性研究2013年7月至2016年5月期间就诊于厦门大学附属第一医院感染性疾病科的CHB患者787例。其中男性598例,女性189例。平均年龄为(32.9±9.4)岁。所有病例HBsAg阳性持续时间均超过6个月,符合我国《慢性乙型肝炎防治指南(2010年版)》[5]的诊断标准。同时排除以下情况:①合并HAV、HCV、HDV、HEV或HIV感染;②酒精性肝病、自身免疫性肝病等;③合并与肝纤维化相关的疾病如结缔组织病、慢性阻塞性肺病、慢性肾功能衰竭、糖尿病及肿瘤等;④合并有血液系统疾病,特别是血小板疾病,如:再生障碍性贫血、血小板减少性紫癜、原发性血小板增多症等;⑤近3个月内使用过影响血小板的药物或进行过影响血小板的治疗。所有病例均在完全知情的条件下签署知情同意书。
二、血小板检测
外周血小板检测的参数包括:血小板计数(PLT)、血小板比率(PCT)、血小板分布宽度(PDW)、血小板平均容积(MPV)。由于正常人血小板存在6%~10%的波动[6],为避免单次采样的误差,在患者肝脏活组织检查前24 h内及检查后48 h内各进行一次血常规检测,取各参数的平均值记录为该病例的血小板参数。标本使用美国贝克曼库尔特有限公司生产的LHX750自动血常规分析仪,由厦门大学附属第一医院检验科统一检测。血小板各参数正常值如下,PLT:125~350×109/L、PCT:0.11~0.27、PDW:9%~17%、MPV:7.66~13.26 fl。
三、肝组织病理检查
使用美国巴德公司生产的Magnum Instrument活检装置搭配Magnum MN1610一次性活检针进行快枪活检。穿刺肝组织长度1.5~2.0 cm,直径0.1 cm,镜下至少包含10个汇管区。肝脏组织标本由厦门大学附属第一医院病理科统一行病理学检查。标本进行HE染色及嗜银染色,由两位病理医师进行阅片。按2000年病毒性肝炎防治方案的标准[7]将肝脏炎症活动度分为G0~G4,纤维化分期分为S0~S4。根据《慢性乙型肝炎防治指南》[1]所推荐的抗病毒治疗指证,本研究将G≥2和S≥2定义为有显著病理学改变。
使用SPSS 19.0统计软件进行数据分析,计数资料以例(百分比)表示,采用卡方检验;正态分布计量资料以均数±标准差表示,采用t检验。两组计量资料之间的相关性分析采Spearman相关分析,多因素分析采用Logistic逐步回归。所有检验均为双侧检验,P<0.05为差异有统计学意义。
结 果
一、入组患者人口学及临床数据
肝穿结果显示,无至肝脏组织轻度炎症活动度(0≤G<2)者59例,中至重度炎症活动度(2≤G≤4)者728例;无至轻度肝纤维化程度(0≤S<2)者574例,中至重度肝纤维化程度(2≤S≤4)者213例。统计结果显示,不同肝脏组织炎症活动度和纤维化程度组在样本量及性别、年龄分布上差异均有统计学意义。不同炎症活动度和纤维化程度组在PLT、MPV、PDW的差异均有统计学意义;但不同炎症活动和纤维化程度组PCT的差异均无统计学意义。见表1。
二、血小板参数与肝脏组织炎症活动度、纤维化程度的相关性分析
将肝组织炎症活动度与PLT、PCT、MPV、PDW进行Spearman相关分析,结果显示肝组织炎症活动度与PLT、PCT、PDW呈负相关(r=-0.37、-0.16、-0.25,均P<0.01),与MPV呈正相关(r=0.22,P<0.01),如图1所示。
将肝纤维化程度与PLT、PCT、MPV、PDW进行Spearman相关分析,结果同样显示肝纤维化程度与PLT、PCT、PDW呈负相关(r=-0.37、-0.15、-0.17,均P<0.01),与MPV呈正相关(r=0.22,P<0.01),如图2所示。
三、影响肝组织炎症活动度与纤维化程度的独立危险因素分析
影响CHB患者肝组织炎症活动度的单元相关分析提示,年龄、PLT、PCT、MPV、PDW与炎症程度相关。但Logistic多元回归分析显示,仅PLT、PDW为影响肝脏炎症活动度的独立预测因素。当PLT越小(OR:0.987,P=0.008)、PDW越小(OR:0.833,P=0.01)时,提示患者肝组织炎症活动度越严重。见表2。
这首《年轻的朋友来相会》,用欢快的旋律,唱出的是1980年代的青春宣言。歌曲或许不再流行,但那种青春心态、奋斗精神永不过时。
影响患者肝纤维化程度的单元相关分析提示,性别、年龄、PLT、PCT、MPV、PDW均与纤维化程度相关。但Logistic多元回归分析显示,年龄、PLT、PDW为影响肝脏纤维化程度的独立预测因素。当年龄越大(OR:1.017,P=0.049),PLT越小(OR:0.989,P<0.01),PDW越小(OR:0.801,P<0.01),提示患者的肝组织纤维化程度越剧烈,见表3。

表1 入组患者人口学、肝脏组织病理、血小板参数情况
注:PLT为血小板计数;PCT为血小板比率;PDW为血小板分布宽度;MPV为血小板平均容积

注:PLT为血小板计数;PCT为血小板比率;PDW为血小板分布宽度;MPV为血小板平均容积
图1 肝组织炎症活动度与血小板相关指标关系
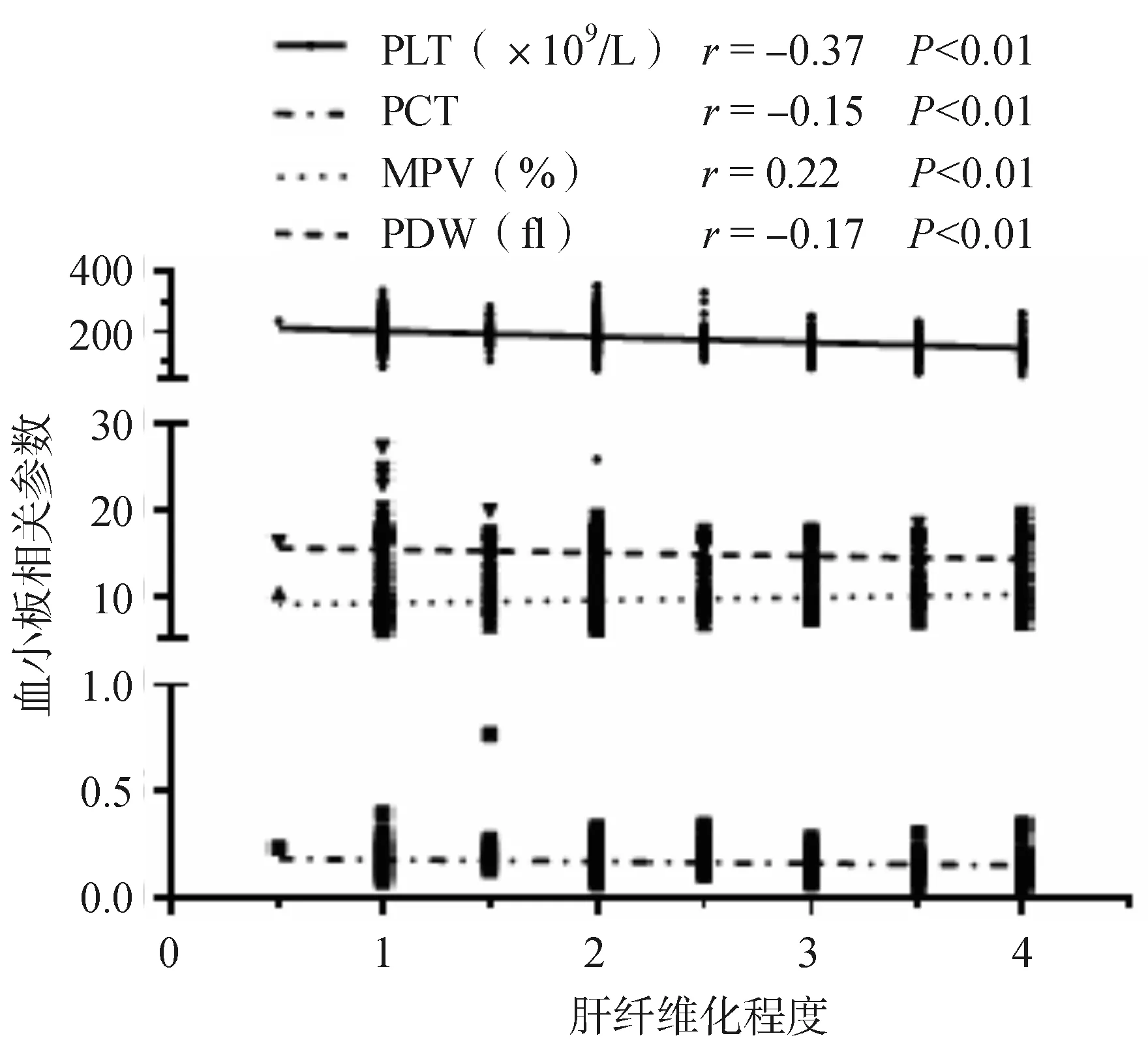
注:PLT为血小板计数;PCT为血小板比率;PDW为血小板分布宽度;MPV为血小板平均容积
表2 中至重度肝组织炎症的单元及多元相关分析
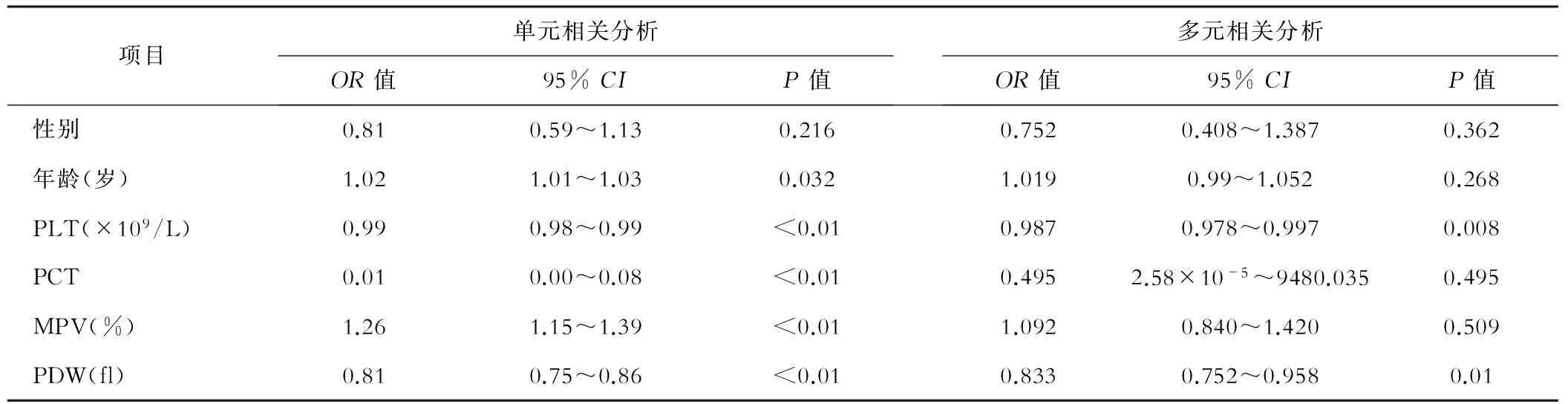
项目单元相关分析OR值95%CIP值多元相关分析OR值95%CIP值性别0.810.59~1.130.2160.7520.408~1.3870.362年龄(岁)1.021.01~1.030.0321.0190.99~1.0520.268PLT(×109/L)0.990.98~0.99<0.010.9870.978~0.9970.008PCT0.010.00~0.08<0.010.4952.58×10-5~9480.0350.495MPV(%)1.261.15~1.39<0.011.0920.840~1.4200.509PDW(fl)0.810.75~0.86<0.010.8330.752~0.9580.01
注:PLT为血小板计数;PCT为血小板比率;PDW为血小板分布宽度;MPV为血小板平均容积;OR为比值比;95%CI为95%可信区间

表3 中至重度肝纤维化程度的单元及多元相关分析
注:PLT为血小板计数;PCT为血小板比率;PDW为血小板分布宽度;MPV为血小板平均容积;OR为比值比;95%CI为95%可信区间
讨 论
调节性T淋巴细胞(regulatory T cell,Treg细胞)具有独特的免疫抑制调节作用,是一种专职抑制细胞[8]。CHB患者外周血中Treg细胞水平明显升高,与HBV DNA载量呈正相关[9-10],当CHB患者进入免疫清除期或进行了抗病毒治疗后Treg细胞水平下降[11-12]。CD4+CD25+Treg细胞通过细胞间接触和(或)细胞因子介导的途径调节HBV特异性CD8+效应T细胞的增殖、影响其功能发挥而引起免疫抑制效应,使机体抗病毒免疫低下,导致HBV感染慢性化;另外CD4+CD25+Treg细胞也通过抑制自身反应性T细胞和多种免疫细胞的功能,诱导和维持机体免疫耐受,使HBV难以完全清除[13-14]。因此特异性细胞免疫反应异常是引起HBV感染慢性化的重要原因。同时,Treg细胞水平在风湿性疾病发生时有下降的现象[15]。对自身免疫性血小板减少性紫癜的研究显示,Treg细胞水平与血小板计数呈正相关[16-17],Treg细胞水平下降使得机体对CD4+、CD8+T淋巴细胞的抑制作用减弱,过强的免疫反应导致血小板的破坏增加。HBV感染者在免疫耐受期,Treg细胞的水平较高,由于免疫抑制,机体对HBV的免疫反应较弱,肝组织无明显异常或轻度炎症坏死,无或仅有缓慢肝纤维化的进展,此时较高的Treg细胞水平同时抑制了针对血小板的免疫反应,血小板计数处于较高水平;HBV感染者在进入免疫清除期后,由于Treg细胞的水平下降,机体对HBV的免疫反应开始增强,免疫应答导致肝组织学出现中度或严重炎症坏死,肝纤维化可迅速进展,同时由于Treg细胞对免疫细胞的抑制功能减弱,血小板计数可能因相关的免疫反应而降低。因此外周血小板参数可以在一定程度上反映肝脏组织的炎症活动度情况。
肝纤维化程度与血小板参数的关系的研究已取得了一些成果,在APRI[18]、Forns index[19]、FibroTest[20]、FibroIndex[21]等预测肝纤维化程度的无创模型中,血小板均是重要的参数,可见血小板在评估肝纤维化中的价值。这些无创模型均显示肝纤维化程度与血小板计数存在负相关性。引起肝纤维化、肝硬化患者血小板降低的原因较多,目前已被基本证实的原因主要有:①患者出现肝纤维化、肝硬化后门静脉压力升高、脾大、脾功能亢进,脾脏一方面吞噬血小板,另一方面也产生血小板抗体,使抗血小板免疫球蛋白升高[22];②肝硬化患者体内出现血小板储存池,导致外周血小板衰竭[23]。研究显示血小板计数随着肝纤维化程度的加重而降低,故血小板参数可以作为评价肝脏组织纤维化情况的指标之一。
本研究显示外周血小板的四个参数与肝脏组织组织炎症活动度分级和纤维化分期存在相关性,结果与之前的研究相符合。Logistic回归分析进一步显示PLT、PDW可作为肝脏组织显著病理学改变的独立预测因素,PLT、PDW越小提示肝脏组织炎症活动度、纤维化程度越高。本研究选取的病例多数为转氨酶升高的肝功能代偿期患者,对于转氨酶正常的HBV携带者,由于其肝功能正常,肝脏组织活检的意愿不高;而严重肝功能失代偿的患者,由于肝脏活组织检查存在禁忌,无法获得准确的肝组织病理检查结果,这两部分病例外周血小板参数与肝脏组织病理的关系是否与转氨酶升高的肝功能代偿期患者相似仍需进一步研究。
综上所述,血小板这一临床常规检测项目在肝脏组织病理无创性评估方面有一定的价值,为临床评估肝脏组织炎症、纤维化情况、创建肝脏组织病理评估的无创模型提供了一项简便、有用的观测指标。进一步综合其他检测指标可以对肝脏组织的病理情况进行预测,其虽然不能完全替代肝活组织检查,但可以作为肝脏组织病理学检查的补充方法对肝脏组织炎症、纤维化情况进行评估。
[ 1 ] 中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2015更新版).肝脏,2015,20:915-932.
[ 2 ] Lok AS, McMahon BJ. Chronic hepatitis B: update 2009.Hepatology, 2009, 50: 661-662.
[ 3 ] Colloredo G,Guido M,Sonzogni A,et al.Impact of liver biopsy size on histological evaluation of chronic viral hepatitis:the smaller the sample,the milder the disease .J Hepatol,2003,39:239-244.
[ 4 ] Ceylan B,Fincanci M,Yardimci C,et al. Can mean platelet volume determine the severity of liver fibrosis or inflammation in patients with chronic hepatitis B .Eur J Gastroenterol Hepatol,2013, 25: 606-612.
[ 5 ] 中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版).肝脏,2011,16:2-16.
[ 6 ] 朱大年,王庭槐. 生理学. 第8版.北京:人民卫生出版社,2013:68-71.
[ 7 ] 中华医学会传染病与寄生虫病学分会,中华医学会肝病学分会.病毒性肝炎防治方案.中华传染病杂志,2001,19:56-62.
[ 8 ] Sakaguchi S,Sakaguchi N,Asano M,et al.Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains(CD25).Breaddown of a single mechanism of self-tolerancecauses various autoimmune diseases.J Immunol,1995,155: 1151-1164.
[ 9 ] Fu JL,Xu DP,Zhang P,et al.The characterization of regulatory T cells in peripheral blood of HBV-infected patients.Zhonghua Yi Xue Za Zhi,2006,86: 1522-1525.
[10] 庄鹏,王湘郴,罗国辉,等.慢性乙型肝炎患者外周血CD4+CD25+Fox P3+Treg及HBV抗原特异性CTLs检测的分析.中国病理生理杂志, 2011,27:1786-1789.
[11] Franzese O, Kennedy PT, Gehring AJ, et al. Modulation of the CD8+-T-cell response by CD4+CD25+regulatory T cells in patients with hepatitis B virus infection. J Virol, 2005, 79: 3322-3328.
[12] 邓茜,肖影群,邹正宇,等.慢性乙型肝炎患者抗病毒治疗前后CD4+CD25+Fox P3+调节性T细胞的变化.广东医学,2012,33:2592-2595.
[13] Franzese O,Kenmedy DT,Gehring AJ,et al.Modulation of CD8+T-cell response by CD4+CD25+regulatory T cells in patients with hepatitis B virus infection.J Virol,2005, 79: 3322-3328.
[14] Sakaguchi S.Naturally arising CD4+regulatory T cells for immunologic self-tolerance and negative control of immune responses.Annu Rev Immunol,2004,22:531-562.
[15] 莫莉,许礼发.调节性T细胞与风湿性疾病.中华临床医师杂志(电子版),2011,5:3277-3280.
[16] 贾瑞萍,赵雪芸.自身免疫性血小板减少性紫癜患者外周血中CD4+CD25+调节性T细胞、sFas和sFasL的表达及临床意义.中国实验血液学杂志,2011,19:1264-1267.
[17] Fahin NM,Monir E.Functional role of CD4+CD25+regulatory T cells and transforming growth factor-betal in childhood immune thrombocytopenic purpura.Egypt J Immunol,2006,13:173-187.
[18] Wai CT,Greenson JK,Fontana RJ,et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patient with chronic hepatitis C.Hepatology,2003, 38: 518-526.
[19] Forns X,Ampurdanes S,Llovet J M,et al.Identification of chronic hepatitis C patients without hepatic fibrosis by a simple predictive modle.Hepatology,2002, 36(4 Pt 1): 986-992.
[20] Imbert BF,Ratziv V,Pieroni L,et al. Biochemical markers of liver fibrosis in patientas with hepatitis C virus infection: a prosoective study.Lancet,2001,357: 1069-1075.
[21] Koda M,Matunaga Y,Kawakami M,et al. FibroIndex: a parctical index for predicting significant fibrosis in patients with chronic hepatitis C.Hepatology,2007,45: 297-306.
[22] Lee C M,Leung T K,Wang H J,et al.Evaluation of the effect of partial splentic embolization on platelet values for liver cirrhosis patients with thrombocytopenia.World J Gastroenterol,2007,13: 619-622.
[23] Laffi G,Mana F,Gresele P,et al.Evidence for a storage pool defect in platelets from cirrhotic patients with defective aggregation.Gastroenterology,1992,103: 641-646.
(本文编辑:钱燕)
Correlation analysis between parameter of platelet in peripheral blood and liver pathological of patients with chronic hepatitis B
OUHong-jie,PANYe,LIUJia-jun,WUXiao-lu.
DepartmentofInfectiousDiseases,theFirstAffiliatedHospitalofXiamenUniversity,Xiamen361003,China
Correspondingauthor:WUXiao-lu,,Email: 13606025483@139.com
Objective To explore the value of platelet parameters in peripheral blood during the noninvasive assessment of liver pathology in patients with CHB. Methods A total of 787 patients with CHB were enrolled in the study. All the patients were undergone blood routine test examination and liver biopsy. The platelet parameters in peripheral blood were recorded at the same time. Apply SPSS 19.0 statistical software for data analysis. Categorical data were analyzed by Chi-square test.Normal distribution measurement data were analyzed by t-test. The relationship between the platelet parameters and the degree of liver pathology was calculated by Spearman correlation analysis and Logistic regression analysis. Results There were significant differences between different genders concerning the degree of liver pathology inflammation and fibrosis (P<0.01); similar difference existed among patients with different age groups (P=0.037, 0.01). Platelet parameters including PLT, MPV, PDW were significantly different among patients with different degree of liver pathology(t=-5.993,3.208,-3.344and-6.955,5.812,-6.503,P<0.05). PLT, PCT, PDW were negatively related to(r=-0.37, -0.16, -0.25,P<0.01),and MPV was positively related to(r=0.22,P<0.01) the degree of liver inflammation; PLT, PCT, PDW were negatively related to the degree of liver fibrosis (r=-0.37, -0.15, -0.17,P<0.01),while MPV was positively related to it(r=0.22,P<0.01). Logistic multivariate regression analysis indicated that PLT(OR:0.987,P=0.008), PDW(OR:0.833,P=0.01)were independent predictors for the degree of liver inflammation; age (OR:1.017,P=0.049)、PLT(OR:0.989,P<0.01)、PDW(OR:0.801,P<0.01) were independent predictors for the degree of liver fibrosis. Conclusion There is a certain correlation between platelet parameters in peripheral blood and the liver pathology in patients with CHB including the degree of inflammation and fibrosis. They can be applied as an easy and useful method to assess the degree of liver pathology.
Hepatitis B;Platelet;Pathology;Correlation factor;Analysis
361003 厦门大学附属第一医院感染性疾病科
吴晓鹭,Email:13606025483@139.com
2016-07-31)
