精氨酸剥夺治疗在肝细胞癌中的研究进展
2016-12-12陈洁曾庆磊李晶晶胡秋月余炎余祖江
陈洁 曾庆磊 李晶晶 胡秋月 余炎 余祖江
·综 述·
精氨酸剥夺治疗在肝细胞癌中的研究进展
陈洁 曾庆磊 李晶晶 胡秋月 余炎 余祖江
肝细胞癌是全球第六常见的恶性肿瘤,占恶性肿瘤死因的第三位[1]。据统计:中国每年新患肝癌人数为46.61万,每年死亡人数为42.21万[2]。肝癌的主要病因有病毒性肝炎、肝硬化、黄曲霉素、化学致癌物和环境因素等[1]。治疗方法主要是肝切除术、经导管动脉化疗栓塞、射频消融术(transcatheter arterial chemoembolization,TACE)和肝移植。索拉非尼是晚期肝癌患者全身化疗的一线用药,只能延长患者生存时间3个月左右。
随着肿瘤分子生物学研究的深入,发现肿瘤有其特殊的生理学特性。譬如,精氨酸是半必需氨基酸,正常细胞可摄取外源性精氨酸,也可从头合成精氨酸。一些肿瘤,特别是肝细胞癌,精氨酸琥珀酸合成酶(ASS1)是缺陷的,使得精氨酸代谢障碍,而完全依赖于外源性精氨酸来支持必需的生物过程,即精氨酸营养缺陷型。研究发现精氨酸剥夺治疗在肝癌中有一定效果,本文就精氨酸剥夺治疗在肝细胞癌中的研究进展进行如下综述。
一、精氨酸的生物化学及在肿瘤中的作用
精氨酸是尿素循环中鸟氨酸的上游产物。经鸟氨酸氨甲酰氨基转移酶(OTC)催化,鸟氨酸转化为瓜氨酸。瓜氨酸由ASS1和精氨酸琥珀酸裂解酶(ASL)催化而生成精氨酸。精氨酸酶水解精氨酸为鸟氨酸和尿素,鸟氨酸再次进入尿素循环。精氨酸也可在一氧化氮合酶催化下产生一氧化氮(NO)和瓜氨酸,还可由鸟氨酸生成多胺类(图1)。
精氨酸参与多种细胞代谢过程,可促进伤口愈合,促进多种激素释放,并有免疫调节活性等。1930年,ESM1R等发现了精氨酸促进肿瘤生长的作用。无论对于原发还是种植产生肿瘤的小鼠,精氨酸喂养都促进其肿瘤生长[3]。同时,精氨酸是多胺类的前体,这被证明促进了肿瘤的生长、转移、侵袭[4]。另外,精氨酸是NO的唯一底物,NO可通过血管内皮生长因子促进肿瘤血管生成,并可调控肿瘤细胞DNA的破坏及修复,还可通过caveolin-1来调控肿瘤细胞侵袭行为等[5]。
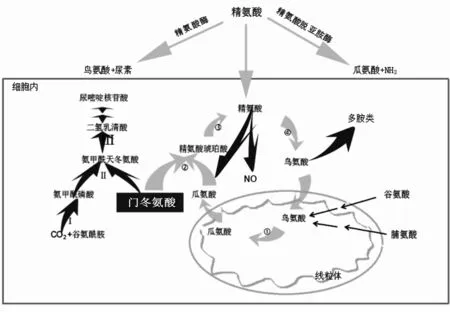
注:①OTC;②ASS1;③ASL;④精氨酸酶。Ⅰ氨基甲酰磷酸合成酶2;Ⅱ门冬氨酸氨基甲酰转移酶;Ⅲ二氢乳清酸酶。

图1 尿素循环和嘧啶从头合成的关系及精氨酸剥夺治疗途径
注:[1]未提供,[2]阳性相关,[3]阴性不相关
二、ASS1在肿瘤中的重要作用
肝癌中缺乏ASS1[6](表1)。ASS1缺失由ASS1基因启动子甲基化造成,并被认为促进了肿瘤增殖、侵袭、迁移[11][15]。例如检测149位乳腺癌患者肿瘤组织中ASS1表达情况时发现,ASS1阴性占63.8%(95/149)[16]。用shASS1敲除ASS1基因则促进了乳腺癌细胞增殖和侵袭[16]。体外实验重新引入ASS1抑制了肿瘤血管生成、肿瘤增殖和迁移,表明ASS1可能是一种新型的肿瘤抑制因子[22]。
三、精氨酸剥夺抑制肝癌细胞生长的机制
机制尚不明确。研究发现精氨酸剥夺抑制多种肿瘤细胞生长,可能机制总结如下:(1)直接影响蛋白质合成,特别是富精氨酸核组蛋白合成。(2)诱导细胞凋亡。精氨酸剥夺通过调节Cyclin和CDK导致了肝癌细胞G2/M期停滞和caspase依赖的凋亡[23]。(3)诱导细胞自噬。精氨酸剥夺可通过溶酶体氨基酸转运体SLC38A9抑制mTORC1途径而诱导自噬[24]。前列腺癌中精氨酸剥夺抑制mTOR信号通路,说明它也可能诱导自噬。(4)抑制血管生成。ADI在体外实验中抑制人脐静脉内皮细胞增殖、迁移,体内实验中抑制肾癌肿瘤血管生成[17],这可能与ADI调控细胞外精氨酸水平来抑制NO合酶而导致NO下调有关(图2)。
四、精氨酸剥夺的途径
基于上述机制,精氨酸剥夺治疗肝癌取得一定成果,并处于研究活跃领域(表2、3)。实际上,早在1953年BACH等就发现精氨酸酶通过破坏精氨酸而抑制Jensen肉瘤细胞的有丝分裂[25]。由于Km值、适宜pH要求和底物特异性等限制,精氨酸脱亚胺酶(ADI)和精氨酸酶现为精氨酸剥夺最常用的酶(图2)。
(一)ADI 聚乙二醇修饰的精氨酸脱亚胺酶(ADI-PEG20)抗原性减弱,半衰期增加至7天,可将精氨酸浓度从130 μmol/L降至可检测水平 (2 μmol/L)以下[23, 26]。
在转移性肝细胞癌的Ⅰ/Ⅱ期临床试验中,患者每周肌肉注射ADI-PEG20 160 IU/m2。47%(9/19)的患者显示出临床应答,其中2人为完全应答。所有患者的中位生存期延长到至少410 d,其中4人存活至680 d[23]。在另一个临床Ⅱ期试验中,76位转移性肝细胞癌患者随机接受80或160 IU/m2每周的ADI-PEG 20治疗共6个月,所有患者的中位生存期大于15.8个月[27]。试验中,患者耐受良好。另有一个全球的临床Ⅲ期实验正在进行中,以进一步确定ADI-PEG在肝癌中的有效性(表2)。
(二)精氨酸酶 经修饰的聚乙二醇重组人精氨酸酶(Peg-rhArg)延长半衰期至6 d,降低对精氨酸的Km值至2.9 mM[28]。
Peg-rhArg的临床Ⅰ期试验在晚期肝癌中进行。试验中单次静脉注射剂量从 500 U/kg 到 2500 U/kg,在1 600~2 500 U/kg时可实现充分的精氨酸耗竭(血清精氨酸水平<8 uM)。在2 500 U/kg时1位患者出现了剂量限制性毒性。试验中最好的应答仅是病情稳定(>8周),占26.7%(4/15),且有7位患者因疾病进展太快未纳入结果评估,如纳入,病情稳定率将更低[29]。

图2 精氨酸剥夺的机制及耐药机制
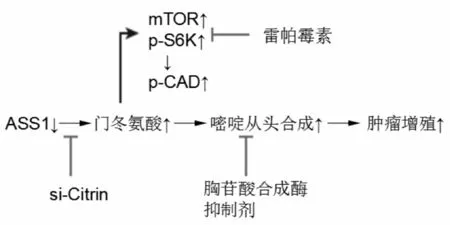
图3 干预肝癌细胞中嘧啶从头合成
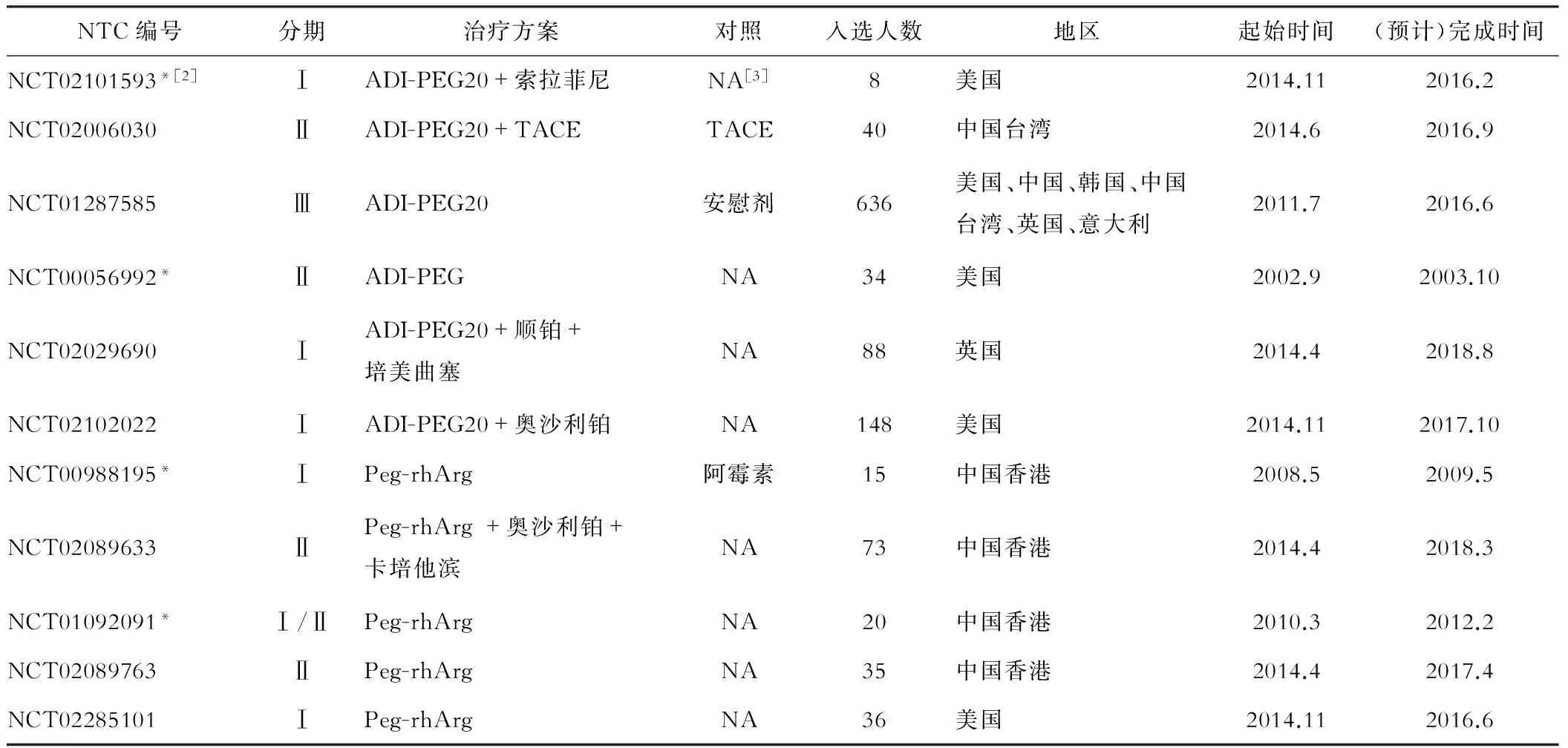
NTC编号分期治疗方案对照入选人数地区起始时间(预计)完成时间NCT02101593*[2]ⅠADI-PEG20+索拉菲尼NA[3]8美国2014.112016.2NCT02006030ⅡADI-PEG20+TACETACE40中国台湾2014.62016.9NCT01287585ⅢADI-PEG20安慰剂636美国、中国、韩国、中国台湾、英国、意大利2011.72016.6NCT00056992*ⅡADI-PEGNA34美国2002.92003.10NCT02029690ⅠADI-PEG20+顺铂+培美曲塞NA88英国2014.42018.8NCT02102022ⅠADI-PEG20+奥沙利铂NA148美国2014.112017.10NCT00988195*ⅠPeg-rhArg阿霉素15中国香港2008.52009.5NCT02089633ⅡPeg-rhArg+奥沙利铂+卡培他滨NA73中国香港2014.42018.3NCT01092091*Ⅰ/ⅡPeg-rhArgNA20中国香港2010.32012.2NCT02089763ⅡPeg-rhArgNA35中国香港2014.42017.4NCT02285101ⅠPeg-rhArgNA36美国2014.112016.6
注:[1]来自https://clinicaltrials.gov/,[2]*表示临床试验已完成,[3]未提供
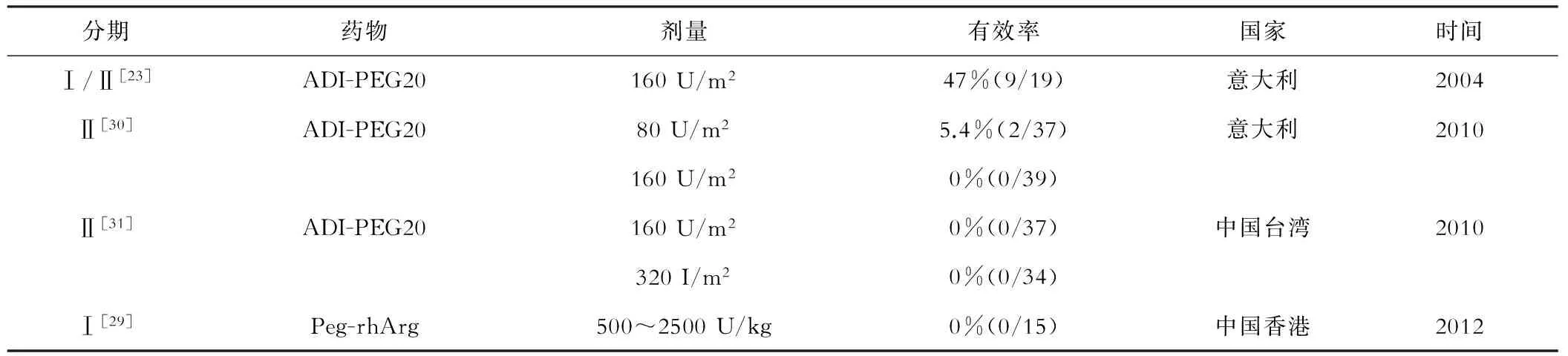
表3 精氨酸剥夺治疗肝细胞癌临床试验的结果汇总
五、精氨酸剥夺治疗肝细胞癌的局限性
精氨酸剥夺在治疗肝细胞癌中取得了一定成效,但仍有一定局限性。(一)有效率低(表3)。原因可能如下:(1)ASS1阴性可能存在精氨酸非依赖的其他效应;(2)循环来自ADI的瓜氨酸需要ASS1和ASL,而循环来自精氨酸酶的鸟氨酸除了ASS1和ASL外还需要OTC(图1)。OTC缺陷的肝癌细胞对ADI天然耐受。故应根据病人基因表达不同而选择ADI-PEG20和Peg-rhArg[28]。(3)病人选择、剂量和用药频率影响了精氨酸剥夺治疗的有效性。(二)耐药。通过研究耐ADI的黑素瘤变异株,发现其产生了一些变化[32],这可能与耐药相关。(1)ASS1再表达。33%(7/21)ASS1阴性的黑素瘤细胞在ADI治疗后,重新表达ASS1而对ADI耐受。ADI激活Ras/PI3K/ERK信号通路,c-Myc持续稳定表达,结合到ASS1启动子上而增加了ASS1表达。(2)耐药变异体显示出增强的AKT信号通路和减弱的mTOR信号通路,而对PI3K/AKT抑制剂敏感和对mTOR抑制剂耐受。(3)ADI耐药细胞葡萄糖转运体1、乳酸脱氢酶A、谷氨酸脱氢酶、谷氨酰胺酶表达增加,同时丙酮酸脱氢酶表达下降,说明糖酵解增强。(4)耐药变异体谷氨酰胺脱氢酶和谷氨酰胺酶表达增加,对谷氨酰胺抑制剂敏感。另外,抗ADI抗体出现。治疗肝癌的2期临床试验中,应用 ADI-PEG20后肝癌细胞中发现了抗ADI抗体,且精氨酸水平出现反弹[30],抗ADI抗体可能会促进抵抗精氨酸剥夺。(三)精氨酸和NO都有免疫调节作用,精氨酸耗竭方案存在争议。 Rodríguez等[33]发现Peg-rhArg可间接抑制T细胞应答而促进肿瘤生长。Peg-rhArg诱导髓源性抑制细胞增加而抑制小鼠T细胞增殖,并促进了髓源性抑制细胞数量增多的小鼠中肿瘤的生长。Rodríguez等指出精氨酸剥夺治疗有风险。
六、总结与展望
近来,Robinovich等[34]将尿素循环与嘧啶从头合成相联系,发现了ASS1缺乏的精氨酸非依赖效应。细胞质中门冬氨酸是ASS1和嘧啶从头合成中CAD(氨基甲酰磷酸合成酶Ⅱ,门冬氨酸氨基甲酰转移酶和二氢乳清酸酶的总称)的共同底物(图1)。肝癌等细胞缺乏ASS1,细胞质内门冬氨酸水平增高,这使得CAD活性因底物可利用度和mTOR途径的S6K1磷酸化而增高,促进了嘧啶从头合成,从而促进了癌细胞增殖。
结合上述发现,干预嘧啶合成可用于治疗肝细胞癌。一是抑制citrin,减少嘧啶合成原料,抑制肿瘤增殖。citrin是将线粒体内门冬氨酸运至细胞质的转运体,对于为嘧啶合成提供底物十分重要。二是降低CAD活性。应用mTOR抑制剂雷帕霉素或胸苷酸合成酶抑制剂5-氟尿嘧啶治疗后,细胞增殖受到抑制(图3)。综上,精氨酸剥夺在治疗肝细胞癌上很有前景,但也有一定局限性。干扰嘧啶从头合成与精氨酸剥夺治疗有共通之处,为攻克肝癌提供了新思路。
[ 1 ] Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma. Lancet, 2012, 9822: 1245-1255.
[ 2 ] Chen WQ,Zheng QS,Baade PD, et al. Cancer statistics in China, 2015. CA Cancer J Clin, 2016, 2: 115-132.
[ 3 ] Gilroy E. The influence of arginine upon the growth rate of a transplantable tumour in the mouse. Biochem J, 1930, 3: 589-595.
[ 4 ] Gerner EW, Meyskens FL Jr. Polyamines and cancer: old molecules, new understanding. Nat Rev Cancer, 2004. 10: 781-792.
[ 5 ] Wada S, Matsushita Y, Tazawa H, et al. Loss of p53 in stromal fibroblasts enhances tumor cell proliferation through nitric-oxide-mediated cyclooxygenase 2 activation. Free Radic Res, 2015, 3: 269-278.
[ 6 ] Dillon BJ, Prieto VG, Curley SA, et al. Incidence and distribution of argininosuccinate synthetase deficiency in human cancers: a method for identifying comcers sensitive to arginine deprivation. Cancer, 2004, 4: 826-833.
[ 7 ] Feun LG, Marini A, Walker G, et al. Negative argininosuccinate synthetase expression in melanoma tumours may predict clinical benefit from arginine-depleting therapy with pegylated arginine deiminase. Br J Cancer, 2012, 9: 1481-1485.
[ 8 ] Szlosarek PW, Klabatsa A, Pallaska A, et al. In vivo loss of expression of argininosuccinate synthetase in malignant pleural mesothelioma is a biomarker for susceptibility to arginine depletion. Clin Cancer Res, 2006, 23: 7126-7131.
[ 9 ] Szlosarek PW, Fennell DA, Rudd RM, et al. 221 A randomized phase II trial of pegylated arginine deaminase (ADI-PEG 20) in patients with malignant pleural mesothelioma. Lung Cancer, 2006: S54.
[10] Delage B, Luong P, Maharaj L, et al. Promoter methylation of argininosuccinate synthetase-1 sensitises lymphomas to arginine deiminase treatment, autophagy and caspase-dependent apoptosis. Cell Death Dis, 2012,7: e342.
[11] Lan J, Tai HC, Lee SW, et al. Deficiency in expression and epigenetic DNA Methylation of ASS1 gene in nasopharyngeal carcinoma: negative prognostic impact and therapeutic relevance. Tumor Biol, 2014, 1: 161-169.
[12] Kim RH, Coates JM, Bowles TL, et al. Arginine deiminase as a novel therapy for prostate cancer induces autophagy and caspase-independent apoptosis. Cancer Res, 2009, 2: 700-708.
[13] Syed N, Langer J, Janczar K, et al. Epigenetic status of argininosuccinate synthetase and argininosuccinate lyase modulates autophagy and cell death in glioblastoma. Cell Death Dis, 2013,1: e458.
[14] Nicholson LJ, Smith PR, Hiller L, et al. Epigenetic silencing of argininosuccinate synthetase confers resistance to platinum‐induced cell death but collateral sensitivity to arginine auxotrophy in ovarian cancer. Int J Cancer, 2009, 6: 1454-1463.
[15] Allen MD, Luong P, Hudson C, et al. Prognostic and therapeutic impact of argininosuccinate synthetase 1 control in bladder cancer as monitored longitudinally by PET imaging. Cancer Res, 2014, 3: 896-907.
[16] Qiu F, Chen YR, Liu X, et al. Arginine starvation impairs mitochondrial respiratory function in ASS1-deficient breast cancer cells. Sci Signal, 2014, 319: ra31.
[17] Yoon CY, Shim YJ, Kim EH, et al. Renal cell carcinoma does not express argininosuccinate synthetase and is highly sensitive to arginine deprivation via arginine deiminase. Int J Cancer, 2007, 4: 897-905.
[18] Lagarde SM, Ver Loren van Themaat PE, Moerland PD, et al. Analysis of gene expression identifies differentially expressed genes and pathways associated with lymphatic dissemination in patients with adenocarcinoma of the esophagus. Ann Surg Oncol, 2008, 12: 3459-3470.
[19] Tsai WB, Aiba I, Lee S, et al. Resistance to arginine deiminase treatment in melanoma cells is associated with induced argininosuccinate synthetase expression involving c-Myc/HIF-1α/Sp4. Mol Cancer Ther, 2009, 12: 3223-3233.
[20] Kelly MP, Jungbluth AA, Wu BW, et al. Arginine deiminase PEG20 inhibits growth of small cell lung cancers lacking expression of argininosuccinate synthetase. Br j Cancer, 2012, 2: 324-332.
[21] Bowles TL, Kim R, Galante J, et al. Pancreatic cancer cell lines deficient in argininosuccinate synthetase are sensitive to arginine deprivation by arginine deiminase. Int J Cancer, 2008, 8: 1950-1955.
[22] Huang HY, Wu WR, Wang YH, et al. ASS1 as a novel tumor suppressor gene in myxofibrosarcomas: aberrant loss via epigenetic DNA methylation confers aggressive phenotypes, negative prognostic impact, and therapeutic relevance. Clin Cancer Res, 2013, 11: 2861-2872.
[23] Izzo F, Marra P, Beneduce G, et al. Pegylated arginine deiminase treatment of patients with unresectable hepatocellular carcinoma: results from phase I/II studies. J Clin Oncol, 2004,10:1815-1822.
[24] Wang S, Tsun ZY, Wolfson RL, et al. Lysosomal amino acid transporter SLC38A9 signals arginine sufficiency to mTORC1. Science, 2015, 6218: 188-194.
[25] Bach SJ, Simon-Reuss I. Arginase, an antimitotic agent in tissue culture. Biochim Biophys Acta, 1953, 953: 396-402.
[26] Holtsberg FW, Ensor CM, Steiner MR, et al. Poly (ethylene glycol)(PEG) conjugated arginine deiminase: effects of PEG formulations on its pharmacological properties. J Control Release, 2002, 1: 259-271.
[27] Lam TL, Wong GK, Chong HC, et al. Recombinant human arginase inhibits proliferation of human hepatocellular carcinoma by inducing cell cycle arrest. Cancer Lett, 2009, 1: 91-100.
[28] Cheng PN, Lam TL, Lam WM, et al. Pegylated recombinant human arginase (rhArg-peg5, 000mw) inhibits the in vitro and in vivo proliferation of human hepatocellular carcinoma through arginine depletion. Cancer Res, 2007, 1: 309-317.
[29] Yau T, Cheng PN, Chan P, et al. A phase 1 dose-escalating study of pegylated recombinant human arginase 1 (Peg-rhArg1) in patients with advanced hepatocellular carcinoma. Invest New Drugs, 2013, 1: 99-107.
[30] Glazer ES, Piccirillo M, Albino V, et al. Phase II study of pegylated arginine deiminase for nonresectable and metastatic hepatocellular carcinoma. J Clin Oncol, 2010, 13: 2220-2226.
[31] Yang TS, Lu SN, Chao Y, et al. A randomised phase II study of pegylated arginine deiminase (ADI-PEG 20) in Asian advanced hepatocellular carcinoma patients. Br j Cancer, 2010, 7: 954-960.
[32] Long Y, Tsai WB, Wangpaichitr M, et al. Arginine deiminase resistance in melanoma cells is associated with metabolic reprogramming, glucose dependence, and glutamine addiction. Mol Cancer Ther, 2013, 11: 2581-2590.
[33] Rodríguez PC, Ochoa AC. Arginine regulation by myeloid derived suppressor cells and tolerance in cancer: mechanisms and therapeutic perspectives. Immunol Rev, 2008, 1: 180-191.
[34] Rabinovich S, Adler L, Yizhak K, et al. Diversion of aspartate in ASS1-deficient tumours fosters de novo pyrimidine synthesis. Nature, 2015, 7578: 379-383.
(本文编辑:张苗)
国家自然科学基金(81302593);河南省高等学校重点科研项目(15A320083)
450000 河南 郑州大学第一附属医院感染病科(陈洁,曾庆磊,胡秋月,余炎,余祖江),重点实验室(李晶晶)
余祖江,Email: johnyuem@zzu.edu.cn
2016-09-03)
