自身免疫性肝炎患者肝组织程序性细胞死亡因子1及其配体1的表达及其与临床的相关性
2016-12-12柯坤宇魏大海陈丽芳孔金峰孙芳熊克宫
柯坤宇 魏大海 陈丽芳 孔金峰 孙芳 熊克宫
·论 著·
自身免疫性肝炎患者肝组织程序性细胞死亡因子1及其配体1的表达及其与临床的相关性
柯坤宇 魏大海 陈丽芳 孔金峰 孙芳 熊克宫
目的 通过检测程序性细胞死亡因子1(PD-1)及其配体1(PD-L1)在自身免疫性肝炎(AIH))患者不同分期肝组织中的表达情况,探讨其在AIH发病机制中的作用。方法 收集43例AIH患者(包括活动期31例和缓解期12例)肝组织,并选择9例健康者为对照组。应用免疫组织化学方法结合图像定量分析系统检测肝组织内PD-1及PD-L1的表达情况,并比较不同病情分期PD-1及PD-L1表达的差异。结果 AIH患者肝组织PD-1为(10.12±5.31)%,高于对照组(1.74±0.37)%,(P<0.05),AIH活动期肝组织PD-1为(15.68±6.31)%,高于缓解期(6.24±3.25)%,(P<0.05)。AIH患者肝组织PD-L1为(7.45±4.29)%,高于对照组(1.48±0.32)%,(P<0.05);AIH活动期肝组织PD-L1为(9.47±4.67)%,高于缓解期(4.78±2.43)%(均P<0.05)。结论 PD-1及其配体PD-L1在AIH患者肝组织中高表达,提示其可能参与了AIH的发病机制。
AIH;PD-1;PD-L1;肝组织;免疫组织化学
自身免疫性肝炎(autoimmune hepatitis,AIH)是一种病因和发病机制尚未完全明确的慢性进行性肝脏炎性疾病。多项证据表明,遗传易感性、分子模型学说、自身反应性T细胞、调节性T细胞缺陷参与了自身免疫性肝损伤[1]。程序性细胞死亡因子1 (programmed cell death-l,PD-1)是CD28家族中新发现的传导抑制信号的共刺激分子,与其配体(主要是PD-L1)具有负性免疫调节作用,主要功能是调节T细胞的活化及分化[2]。PD-1/PD-L1通路可以诱导和维持外周组织的免疫耐受,对防止组织的过度炎性反应以及自身免疫性疾病的发生具有积极作用,但其在AIH中的研究少有报道,且多局限于外周血PD-1及PD-L1,而肝脏是AIH免疫反应的靶器官,因此,本研究通过检测AIH患者肝组织中PD-1及PD-L1表达情况,探讨其在AIH发生、发展中的作用,为AIH的免疫损伤及发病机制研究提供新的理论依据。
资料和方法
一、一般资料
选取2013年1月至2015年8月在福州市传染病医院就诊的AIH患者43例,男4例,女39例,其中12例在免疫抑制剂治疗后达到缓解,其余31例处于发病期未行免疫抑制剂治疗。入选病例均经肝脏活组织检查并经临床确诊。诊断标准参考2008年国际免疫性肝炎小组(IAIHG)提出的AIH 简化诊断积分系统及2010年美国肝病学会(AASLD)更新的有关AIH的诊断和治疗指南[3-4]。排除肝炎病毒感染、药物性、酒精性和遗传代谢性肝病等。激素治疗前评分≥15分明确诊断AIH。缓解是指症状消失,血清转氨酶、胆红素、IgG正常,肝组织正常或无活动性肝硬化[5]。对照组取材来自手术切除肝血管瘤病灶附带的正常周围肝组织,均取得患者同意并签署知情同意书。3组性别、年龄比较差异无统计学意义(P>0.05)。
二、标本收集及实验方法
(一)肝组织标本采集和处理 患者均于入院病情稳定后在超声引导下,采用巴德BARD一次性全自动活检枪(购自美国巴德公司,型号MN1620)。肝组织标本长度2.0 cm左右,汇管区数≥8个,4%甲醛固定,常规脱水、石蜡包埋、切片,HE染色。光学显微镜多视野观察。肝组织均由两名有经验的病理科医生独立阅片。PD-1及表达水平检测采用免疫组织化学卵白素-生物素-酶复合物染色法(ABC),PD-l抗体(购自美国R&D公司),为山羊抗人多克隆抗体;PD-L1抗体(购自美国life spanbiosciences公司),为兔抗人多克隆抗体,按试剂盒说明书进行。免疫组织化学试剂盒、二氨基联苯胺(DAB)显色试剂盒购自福州迈新生物技术开发有限公司。
(二)肝组织PD-1/PD-L1表达的检测和判定 采用ABC法检测PD-1及PD-L1,表达的工作浓度为1∶200,切片厚度4 μm,3%H2O2作用5 min去除内源性过氧化物酶,分别加入兔抗人PD-1多克隆抗体,4 ℃过夜,次晨分别加二抗,DAB显色,苏木精复染。PBS代替一抗作为阴性对照。结果判定:阳性结果呈棕黄色颗粒,位于肝细胞胞膜(或)及胞质,胞核呈浅蓝色。
(三)图像分析及定量方法 每张切片随机选取5个高倍镜视野(×400),应用HPIAS 1000图像分析仪,检测肝组织PD-1/PD-L1蛋白表达的平均吸光度值(MOD)与积分吸光度值(IOD),以每例5个视野的平均值作为测量值。
三、统计学处理
计量资料以均数±标准差表示,正态分布的两组组间比较采用t检验;非正态分布的两组组间比较采用秩和检验;方差齐则对多样本资料采用单因素方差分析及LSD-t检验比较组间差异,方差不齐则采用Mann-WhitneyU检验比较组间差异,P<0.05为差异有统计学意义。
结 果
一、研究对象的一般情况
43例AIH患者,其中31例为活动期患者,男性3例,女性28例,平均年龄(47.2±12.4) 岁;12例为免疫抑制剂治疗后缓解期患者,男1例、女11例,平均年龄(48.6±11.8) 岁。活动期患者表现为肝功能不同程度异常、IgG水平增高,外周血出现多种自身抗体阳性,缓解期AIH患者肝功能及IgG水平均恢复正常,但外周血中自身抗体阳性比例与活动期相似,且滴度较活动期无明显变化(见表1、表2)。
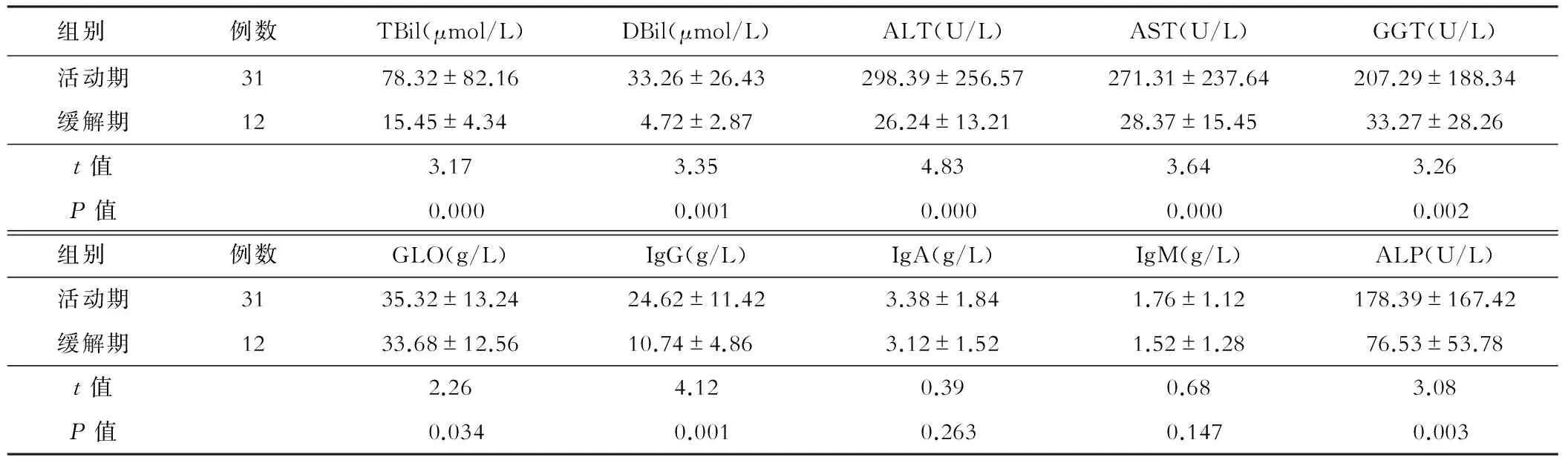
表1 AIH患者肝功能及免疫球蛋白检测结果
TBil:总胆红素;DBil:直接胆红素;ALT:丙氨酸转氨酶;AST:天冬氨酸转氨酶;GGT:谷氨酰转肽酶;ALP:碱性磷酸酶;GLO:球蛋白;IgG:免疫球蛋白G;IgA:免疫球蛋白A;IgM:免疫球蛋白M
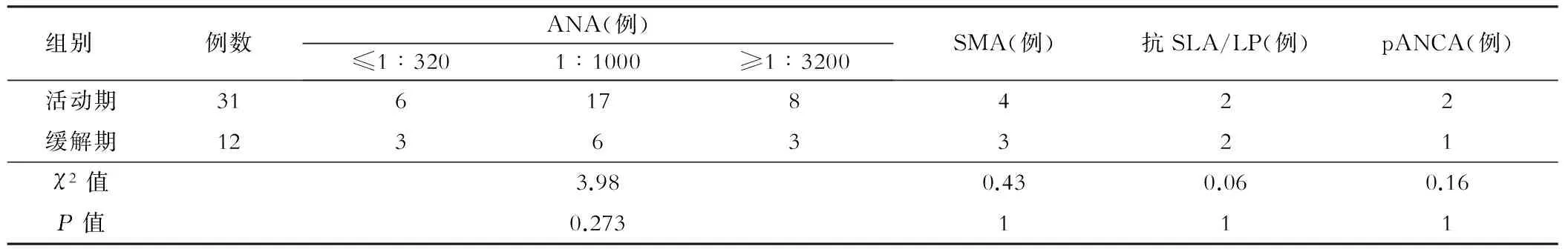
表2 AIH患者自身免疫抗体检测结果
ANA:抗核抗体;AMA:抗线粒体抗体;SMA:抗平滑肌抗体;抗SLA/LP:抗可溶肝抗原/肝胰抗体
二、AIH患者肝脏组织病理学改变
AIH以肝实质损伤为主要表现,31例活动期AIH患者以界面性肝炎和汇管区淋巴细胞、浆细胞及单核细胞等炎性细胞浸润为主,且大部分肝小叶内可见点状或碎屑样坏死,多数不累及胆管。界面性肝炎29例(93.5% ),淋巴、浆细胞浸润27例(87.1% ),胆管破坏性炎症2例(6.45% )(见图1)。12例缓解期患者汇管区及小叶间隔周围肝细胞均无明显坏死,无或仅有少量淋巴细胞浸润,无界面性炎,亦未见桥接坏死。此外,几乎所有AIH都存在不同程度的纤维化,严重病例可出现肝硬化。
三、PD-1在肝组织中的表达情况
肝组织切片中PD-1主要表达于淋巴细胞(包括T细胞、少量浆细胞)及一些库普弗细胞的胞质内,不同炎症及纤维化程度的肝组织中PD-1阳性表达细胞的分布较一致,主要分布在炎性细胞浸润的汇管区及坏死区,以汇管区淋巴细胞浸润较多处较为显著,肝细胞中未见表达。PD-1在对照组中无表达或极弱阳性表达(见图2~4)。定量图像分析结果显示AIH患者肝组织PD-1为(10.12±5.31)%,高于对照组(1.74±0.37)%(P<0.05);AIH活动期肝组织PD-1为(15.68±6.31)%,高于缓解期(6.24±3.25)%,(P<0.05)。
四、PD-L1在肝组织中的表达情况
所有43例AIH患者的PD-L1在肝组织炎性细胞浸润较明显的区域部分肝细胞胞膜及胞质均有着色。AIH活动期患者在肝组织汇管区、小叶肝窦内沿肝细胞窦侧及炎性坏死区可见到较明显PD-L1表达,常伴有淋巴细胞包绕及密切接触,并沿肝板在肝窦壁、坏死灶呈放射状分布,炎性细胞浸润较明显的区域部分肝细胞胞质亦有着色,阳性细胞数明显增加;治疗后缓解组肝组织可见少量PD-L1表达,阳性细胞散在分布,可表达于汇管区,同时在小叶肝窦内沿肝细胞窦侧及炎性坏死区有少量表达。PD-L1在对照组中无表达或极弱阳性表达(见图5~7)。定量图像分析结果显示AIH患者肝组织PD-L1为(7.45±4.29)%,高于对照组(1.48±0.32)%,(P<0.05);AIH活动期肝组织PD-L1为(9.47±4.67)%,高于缓解期(4.78±2.43)%(均P<0.05)。
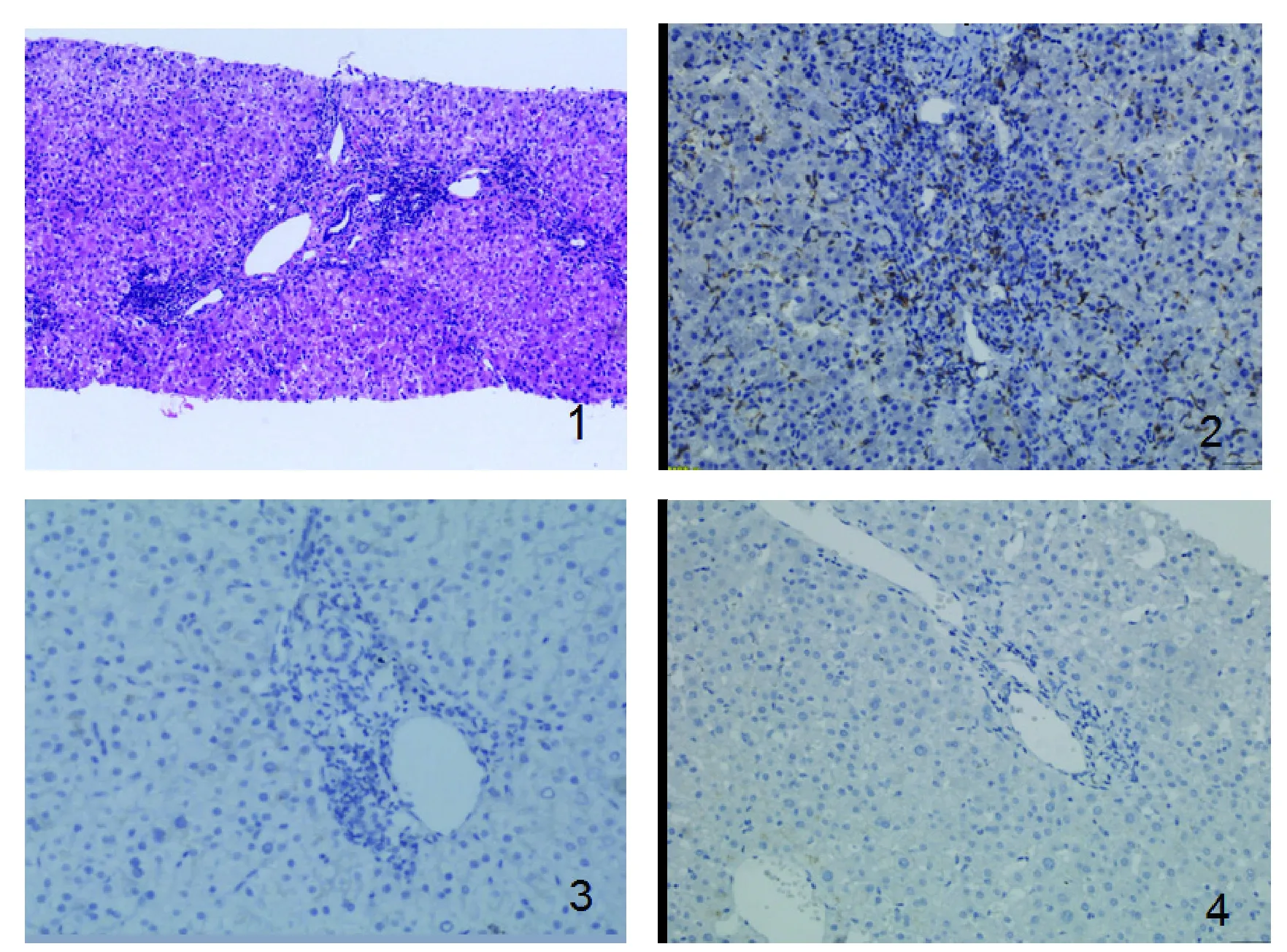
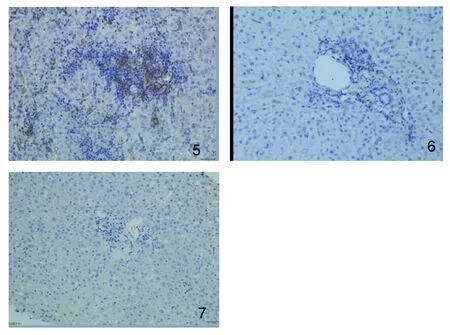
注:图1为HE染色,×100;图2~7均为ABC法,×400。图1 活动期AIH患者肝组织,图2 PD-1在活动期AIH患者肝组织中的表达,图3 PD-1在静止期AIH患者肝组织中的表达,图4 PD-1在对照组肝组织中的表达,图5 PD-L1在活动期AIH患者肝组织中的表达,图6 PD-L1在静止期AIH患者肝组织中的表达,图7 PD-L1在对照组肝组织中的表达
讨 论
AIH是一种免疫介导的肝损伤,以肝组织内T细胞浸润、高γ球蛋白血症、血清自身抗体阳性、具有人类白细胞抗原遗传背景、常伴发其他自身免疫性疾病和对免疫抑制治疗有效为特征[6]。目前尽管AIH的发病机制尚未完全阐明,但已明确自身免疫异常是AIH发病的主要原因。自身免疫异常通常指正常的免疫系统由于某种原因而出现免疫功能紊乱,会导致T细胞介导的包括AIH在内的多种自身免疫异常疾病。
PD-1作为CD28家族分子之一,属于免疫细胞的抑制性共刺激分子,在免疫反应特别是T细胞免疫反应中具有重要作用。PD-1与其配体PD-L1结合后,通过其胞质尾部的免疫受体酪氨酸抑制基序(ITIM基序)传入抑制信号,在免疫应答中发挥负性调控作用[7]。PD-1/PD-L1通路抑制了免疫应答的初始与效应阶段,维持机体的免疫自稳,否则过强的免疫应答将导致自身免疫性疾病的发生[9]。在许多自身免疫病动物模型如实验性自身免疫性脑脊髓炎、自身免疫性糖尿病等动物,阻断PD-1/PD-L1通路则加速疾病的严重程度及进展。PD-1基因敲除的小鼠出生3 d后给予切除胸腺,小鼠可发展为自身免疫性肝炎[8-9],且在自身免疫性肝炎动物模型中,肝组织内PD-1的mRNA与蛋白含量表达增高[10-11]。在肝组织内PD-L1可表达于肝细胞、窦上皮细胞及库普弗细胞上,对活化T细胞的增殖和分裂有抑制作用,在活化的T细胞或者在病毒感染期,PD-L1的表达能力升高,表达于肝细胞上的PD-L1与表达于T细胞上的PD-1结合能诱导T细胞的凋亡[12]。PD-L1基因敲除小鼠的CD8+T细胞大量聚集在肝内,活化T细胞在肝内的清除率下降,AIH的发病率上升[13]。
本研究证实,AIH患者肝组织病理学特征为肝实质破坏的界面性肝炎,提示存在针对汇管区肝界板及周围肝细胞的特异性免疫攻击。本研究还发现AIH患者肝组织内的所有汇管区均有明显淋巴细胞浸润,进一步验证了AIH患者肝组织发生主要由T淋巴细胞介导的免疫反应,从而导致了持续的肝细胞炎性损伤[14]。同时,本研究表明PD-1在活动期AIH患者表达增高,间接反映了肝内浸润性T淋巴细胞已被激活,发挥生物学功能。此外,在活动期AIH患者PD-L1的表达水平亦升高,表明其与PD-1结合可抑制T细胞的活化,调控肝脏浸润效应性T细胞的功能,阻止过度的免疫反应,从而部分程度上避免了自身反应性T细胞对肝脏的破坏作用。研究还发现PD-1/PD-L1的相互作用虽然可以起到自身免疫反馈抑制作用,但由于表达PD-L1的肝组织细胞数量较少,PD-L1的升高并不与PD-1平行。由此推测,PD-1/PD-L1通路并不能有效控制活化T细胞增殖分化的速度与强度,肝脏中PD-1/PD-L1通路调控失常,最终导致了AIH的发展。如果有药物或其他细胞、分子等物质上调PD-L1的表达,促进PD-1与PD-L1的相互作用,达到一定程度后,可能会加速活化的T细胞凋亡,从而起到治疗AIH的作用。因此,对PD-1/PD-L1通路的干预可能为治疗自身免疫性肝炎提供一种新的思路。
[ 1 ] Liberal R, Longhi MS, Mieli-Vergani G, et al. Pathogenesis of autoimmune hepatitis. Best Pract Res Clin Gastroenterol, 2011, 25: 653-664.
[ 2 ] Zhang X, Schwartz JC, Guo X, et al. Structural and functional analysis of the costimulatory receptor programmed death-1. Immunity, 2004, 20: 337-347.
[ 3 ] Hermes EM, Zeniya M, Czaja AJ, et al. Simplified criteria for the diagnosis of autoimmune hepatitis. Hepatology, 2008, 48: 169-176.
[ 4 ] Manns MP, Czaja AJ, Gorham JD, et al. Diagnosis and management of autoimmune hepatitis. Hepatology, 2010, 51: 2193-2213.
[ 5 ] Kamijo A, Yoshizawa K, Joshita S, et al. Cytokine profiles affecting the pathogenesis of autoimmune hepatitis in Japanese patients. Hepatol Res, 2011, 41: 350-357.
[ 6 ] Mieli-Vergani G, Vergani D. Autoimmune hepatitis. Nat Rev Gastroenterol Hepatol, 2011, 8: 320-329.
[ 7 ] Wang Q, Chen Y, Xie F, et al. Development of a sandwich ELISA for evaluating soluble OX40L(CD252) in human sera of different ages or with Graves’ disease. Cytokine, 2006, 36: 23-28.
[ 8 ] lwamoto S, Kido M, Aoki N, et al. TNF-α is essential in the induction of fatal autoimmune hepatitis in mice through upregulation of hepatic CCL20 expression. Clin Immunol, 2013, 146: 15-25.
[ 9 ] Aoki N, Kido M, lwamoto S, et al. Dysregulated generation of follicular helper T cells in the spleen triggers fatal autoimmune hepatitis in mice. Gastroenterology. 2011, 140, 1322-1333.
[10] Oikawa T, Takahashi H, Ishikawa T, et al. Intrahepatic expression of the co-stimulatory molecules programmed death-1, and its ligands in autoimmune liver disease. Pathol Int, 2007, 57 485-492.
[11] Mataki N, Kikuchi K, Kawai T, et al. Expression of PD-1, PD-L1, and PD-L2 in the liver in autoimmune liver diseases. Am J Gastroenterol, 2007, 102: 302-312.
[12] Muhlbauer M, Fleck M, Schtitz C, et al. PD-L1 is induced in hepatocytes by viral infection and by interferon-alpha and -gamma and mediates T cell apoptosis. J Hepatol, 2006, 45: 520-528.
[13] Dong H, Zhu G, Tamada K, et al. B7-H1 determines accumulation and deletion of intrahepatic CD8(+) T lymphocytes. Immunity, 2004, 20: 327-336.
[14] Liberal R, Grant CR, Mieli-Vergani G, et al. Autoimmune hepatitis: A comprehensive review, J Autoimmun, 2013, 41: 126-139.
(本文编辑:钱燕)
Expressions of PD and PD-L 1 in liver tissues of patients with autoimmune hepatitis and their clinic correlation
KEKun-yu,WEIDa-hai,CHENLi-fang,KONGJin-feng,SUNFang,XIONGKe-gong.
Departmentofliver,TheinfectiousdiseasehospitalofFujianmedicaluniversity,Fuzhou350012,China
Correspondingauthor:XIONGKe-gong,Emal: 510768115@qq.com
Objective To investigate the expressions of programmed death 1 (PD-1) and programmed death ligand 1 (PD-L1) in hepatic tissues of patients with autoimmune hepatitis (AIH), and to explore their roles in the pathogenesis of AIH. Methods The expressions of PD-1 and PD-L1 in hepatic tissues from 43 AIH patients and 9 healthy controls were detected by immunohistochemistry combined with computer image quantitative analysis. Results The PD-1 and PD-L1 expressions in hepatic tissues of AIH patients were 10.12±5.31% and 7.45±4.29%, respectively, which were significantly higher than those in controls (1.74±0.37% and 1.48±0.32%, respectively). The expressions of PD-1 and PD-L1 in hepatic tissues of AIH patients at active stage were 15.68±6.31% and 7.45±4.29%, respectively, which were higher than those in AIH patients in remission (6.24±3.25% and 4.78±2.43%, respectively) and healthy controls (1.74±0.37% and 1.48±0.32%, respectively). Conclusion PD-1 and PD-L1 are overexpressed in hepatic tissues of AIH patients, which reveals that PD-1 and its ligand might play an important role in the pathogenesis of AIH.
AIH; PD-1; PD-L1; Liver tissues; Immunohistochemistry
福州市卫生系统科技计划项目(2014-S-w21)
350025 福州 福州市传染病医院(福建医科大学附属传染病医院)肝病区
熊克宫,Email:510768115@qq.com
2016-06-28)
