内源抗坏血酸对水稻叶片抗氧化胁迫的影响
2016-12-12张启雷彭长连
张启雷, 高 辉, 彭长连
(广东省植物发育生物工程重点实验室, 华南师范大学生命科学学院,广州 510631)
内源抗坏血酸对水稻叶片抗氧化胁迫的影响
张启雷, 高 辉, 彭长连*
(广东省植物发育生物工程重点实验室, 华南师范大学生命科学学院,广州 510631)
以野生型水稻(Oryzasativa)品种‘中花11’(WT)、抗坏血酸合成关键酶GLDH基因的上调(超表达)株系GO-2及下调(干涉)株系GI-2的离体叶片为实验材料,用甲基紫精(MV)高光诱导的光氧化胁迫处理,研究内源抗坏血酸对水稻叶片抗光氧化能力的影响. MV高光处理后,超表达型水稻叶片的超氧阴离子和过氧化氢含量明显低于野生型和干涉型. 水稻叶片的膜脂过氧化加剧,可溶性蛋白发生了降解,其中干涉型受到的影响最大. 叶绿素荧光相关参数的变化体现了超表达的优势. 结果显示抗坏血酸含量高的超表达株系具有更强的抗氧化胁迫能力,而干涉型株系的抗氧化胁迫能力最差,从而说明了内源抗坏血酸能明显增强水稻抗氧化能力.
水稻; 抗坏血酸;GLDH基因; 氧化胁迫

抗坏血酸(Ascorbic Acid,AsA)又名维生素C(Vitamin C),是植物体内的一种重要抗氧化剂,直接或间接清除体内的活性氧[8],植物中的抗坏血酸含量与抗逆性呈正相关[9]. 有研究表明,L-半乳糖酸-1,4-内酯脱氢酶(GLDH)是植物合成抗坏血酸的限速酶[10],使GLDH基因超表达能够提高植物中的抗坏血酸含量[11],在水稻中也有同样的结果,且超表达株系和干涉型株系已经成功构建[12]. 本研究用MV高光处理3种株系水稻离体剑叶,分析不同株系水稻对MV高光介导的氧化胁迫的响应,探讨内源抗坏血酸对水稻抗光氧化胁迫的影响.
1 材料和方法
1.1 植物材料
水稻粳稻品种中花11(WT)和在中花11的遗传背景下构建的GLDH基因超表达株系GO-2和干涉株系GI-2,水稻种子由华南农业大学彭新湘教授实验室提供. 水稻种植于华南师范大学生物系试验田,常规水肥管理和病虫害防治. 剪取扬花期水稻剑叶,实验组用质量浓度为200 μmol/L的MV、光强为1 600 μmol/(m2·s)的高光进行处理,对照组用蒸馏水、光强为1 600 μmol/(m2·s)的光进行处理.
1.2 抗坏血酸含量的测定
参照文献[13]的方法, 取约0.1 g水稻叶片,用1 mL预冷的体积分数为6%的三氯乙酸在冰上充分研磨,4 ℃、13 000 r/m 离心10 min,取上清液加入2 mL反应体系中,37 ℃水浴1 h,用分光光度计检测525 nm的吸光值,每次测定重复3次.
1.3 叶绿素荧光参数的测定
剪取水稻叶片用湿纱布包好放在黑暗处暗适应30 min,暗适应后用便携式荧光测定仪(PAM-2100,Germany),设定光化光强度为150 μmol/(m2·s)测定叶绿素荧光参数(最大光化学效率Fv/Fm,电子流速率ETR,激发压1-qP,热耗散NPQ),计算方法参照文献[14].
1.4 电解质渗透率的测定
用超纯水把水稻叶片冲洗干净,再吸干叶片表面多余的水分,用打孔器取5片直径为0.6 cm的叶圆片,放在50 mL的试管中加入20 mL超纯水,抽真空使叶片完全浸泡在水中,室温放置3 h. 用DDS-11A型电导仪测定电导率,记为R1,煮沸30 min,冷却后再测定其电导率,记为R2. 以相对电导率表示细胞膜的渗透率,计算方式:相对电导率=(R1/R2)×100%.
1.5 超氧阴离子的检测
超氧阴离子检测方法参照文献[7],剪取MV高光处理的水稻叶片约2 cm,放在试管中,加入质量浓度为1 g/L的25 mmol/L Hepes buffer(pH=7.6)的硝基蓝四氮唑蓝(Nitroblue Tetrazolium,NBT)15 mL,抽真空,黑暗室温放置8 h. 取出叶片用超纯水冲洗后放入80%的乙醇溶液中,80 ℃脱色直至叶片无绿色,然后拍照.
1.6 过氧化氢的检测
过氧化氢检测方法参照文献[7],剪取MV高光处理的水稻叶片约2 cm,放在试管中,加入质量浓度为1 g/L的50 mmol/L Hepes 缓冲液(pH=3.8)的二氨基联苯胺(diaminobenzidine, DAB)15 mL,抽真空,黑暗室温放置6 h. 取出叶片用超纯水冲洗后放入95%的乙醇溶液中,室温脱色直至叶片无绿色,然后拍照.
1.7 可溶性蛋白的测定
可溶性蛋白参照文献[15]的方法进行测定. 称取去除叶脉水稻剑叶叶片0.1 g,剪碎后放入预冷研钵加入蛋白研磨缓冲液,在冰上充分研磨后,13 000 r/m离心10 min, 取上清液稀释50倍,向稀释后的上清液加入等体积的 Bradford工作液,反应5 min,用分光光度计检测595 nm的吸光值.
1.8 基因表达
取扬花期水稻剑叶进行基因表达量的测定,GLDH基因引物序列为GLDH-F:5’-CGGCGGCATCATTCAGGTT-3’,GLDH-R:5’-AAGCCCACAGCGAGCAAGATA-3’,内参引物序列为OsUBQ-F:5’-CCAGGACAAGATGATCTGCC-3’,OsUBQ-R:5’-AAGAAGCT-GAAGCATCCAGC-3’. 采用7500 Real Time PCR System进行PCR,分析方法来源文献[16].
1.9 数据统计分析
数据使用Microsofe Excel 2010 进行整理,用SPSS 12.0 One Way ANOVA 对数据进行统计分析和LSD检验,Sigma Plot 12.5绘图.
2 结果
2.1 不同转基因水稻植株GLDH表达量及抗坏血酸含量
3种株系水稻叶片的GLDH基因的表达量存在显著差异(图1),与野生型相比,超表达型的GLDH表达量高20倍,而干涉型低10倍,3种水稻叶片的抗坏血酸含量也都存在显著差异,且超表达型最高,干涉型最低,野生型居中.
2.2 MV高光处理后3种基因型植株超氧阴离子和H2O2的积累
在植物体内,超氧阴离子和H2O2能够分别与NBT和DAB反应,生成不溶于水的蓝色颗粒和黄褐色沉淀于叶片表面[17]. 分别用NBT和DAB对经过MV高光处理后的3种水稻剑叶进行染色,结果显示3种水稻都被染色,其中超表达株系的染色最浅,野生型和干涉型株系染色较深(图2).
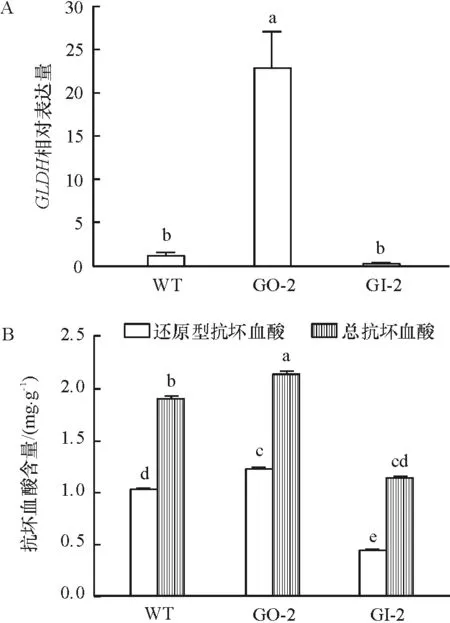
图1 GLDH相对表达量和抗坏血酸含量
Figure 1 Relative expression ofGLDHgene and ascorbic acid content in leaf
注:不同字母表示差异具有统计学意义(P<0.05)(下图同).

图2 MV光氧化后DAB和NBT染色
2.3 MV高光对3种基因型植株可溶性蛋白及电解质渗透率的影响
MV高光处理后水稻叶片的可溶性蛋白含量均有所降低,其中干涉型下降的最大幅度为31.9%,而超表达型和野生型分别降低了27.7%和23.8%(图3). 电导率的大小可以反映膜脂完整性,MV高光处理加剧了水稻叶片的膜脂过氧化程度(图3). 其中干涉型的膜脂受光氧化最严重,电解质渗透率增加了57%,而超表达型和野生型分别增加了40.5%和24.7%. MV高光处理后干涉型的电解质渗透率显著高于超表达型和野生型.
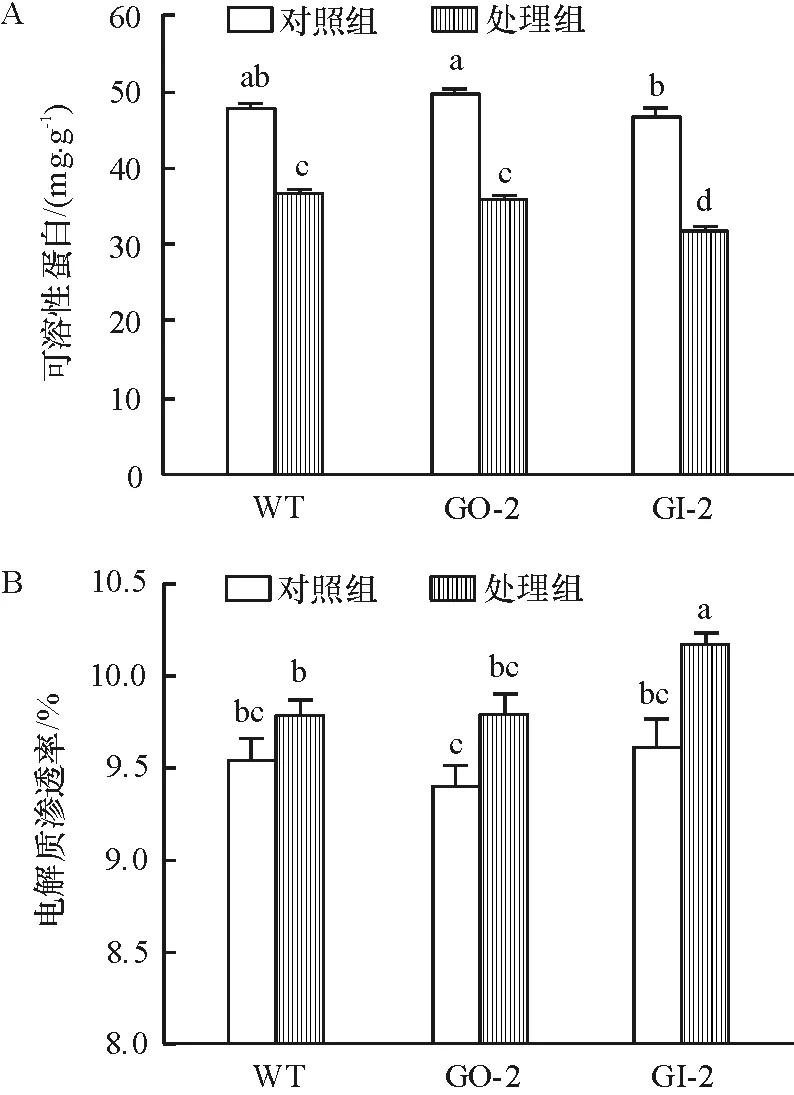
图3 可溶性蛋白和电解质渗透率的变化
Figure 3 Changes of soluble protein and ion leakage rate
2.4 MV高光对3种基因型植株叶绿素荧光的影响
MV高光对3种水稻叶片叶绿素荧光参数的影响趋势一致,在MV高光处理前Fv/Fm、1-qP、NPQ和ETR的值相近,MV高光处理后均发生了显著变化. 其中Fv/Fm、NPQ和ETR都处于下降趋势,1-qP则是上升的. 超表达型植株叶片的Fv/Fm和NPQ下降的程度显著低于野生型和干涉型,而1-qP上升程度显著低于野生型和干涉型(图4).
3 讨论
光和氧是光合作用进行的必要条件,也是MV毒性所表达的必须条件,它可接受光合电子传递链中PS Ⅰ的电子成为水溶性的阳离子自由基MV2+,随后迅速与氧反应形成超氧阴离子[18],也可通过Winterbourn的反应或Fenton反应形成高毒性的·OH[19],造成植物的强氧化胁迫,进而诱导或加剧植物的光氧化损伤. 文献[20]表明AsA可以清除植物体内因氧代谢及环境胁迫等产生的活性氧,进而保护机体免于氧化胁迫造成的伤害. HUANG等[21]以突变体vtc-1为材料,其AsA的含量只有野生型的30%,发现在盐胁迫下H2O2的积累明显高于野生型.

图4 叶绿素荧光参数的变化
本文结果显示超表达的GLDH的相对表达量高于野生型,是野生型的20倍,而干涉型的GLDH相对表达量低于野生型,是野生型的0.1倍(图1A). 相较于野生型,超表达的抗坏血酸含量增加了18.7%,干涉型的抗坏血酸含量减少57.9%(图1B). 由此可看出超表达或干涉GLDH的表达量确实可以改变水稻的内源AsA含量,说明GLDH的表达量同AsA的含量呈正相关. 这也与前人的研究发现GLDH与抗坏血酸的含量有密切关系是相符的[22]. 在MV介导的光氧化处理下,在短时间介导的光氧化下,3个株系的可溶性蛋白都呈下降趋势,其中干涉型的下降最快,较处理组下降了31.9%(图3A),而电解质渗透率都呈升高趋势,且干涉型的增加最快,较处理前增加了5.7%(图3B). 随着光氧化处理时间的延长,Fv/Fm和ETR都呈下降趋势,且都是干涉型的下降速度最快(图4A、B);1-qP在初期并没有显著变化,后期却迅速上升,且超表达的上升最慢而干涉型的最快(图4C);NPQ的计算可看出在此期间其先上升后下降且超表达的上升最快(图4D). 而活性氧定位分析显示,在光氧化处理后,干涉型的活性氧积累最多最明显(图2). 而BRATT等[23]研究紫黄质去环氧酶通过消耗AsA催化紫黄质生成玉米黄质,从而将过剩的光能以NPQ的叶绿素荧光释放,保护光合器官. 因此可以推断超表达GLDH水稻株系的耐光氧化是通过增加内源AsA的含量,减少了活性氧的产生,进而增加NPQ将过剩光以热形式耗散,从而减缓水稻剑叶膜脂损伤,减慢PSⅡ活性的丧失.
[1] 屠曾平,林秀珍,黄秋妹,等. 水稻中的光抑制现象及其品种间差异[J]. 中国水稻科学,1988,2(1):8-16.
TU Z P,LIN X Z,HUANG Q M,et al. Photoinhibition in rice and adaptability of varieties from different regions to light yintensity[J]. Chinese Journal of Rice Science,1988,2(1):8-16.
[2] OGREN E,EVANS J R. Photoinhibition of photosynthesisinsituin six species ofeucalyptus[J]. Functional Plant Biology,1992,19(1):223-232.
[3] 季本华,焦德茂. 光抑制条件下不同水稻品种叶片的PSⅡ光化学效率和CO交换特性的差异[J]. 中国水稻科学,1998,12(2):109-114.
JI B H,JIAO D M. Varietal differences in photochemical efficiency of PSⅡand features of CO2exchange in rice leaves under photoinhibitiory conditons[J]. Chinese Journal of Rice Science,1998,12(2):109-114.
[4] 林植芳,彭长连,林桂珠. 不同光合途径植物叶圆片对光氧化作用响应的比较[J]. 植物学报,1998,40(8):721-728.
LIN Z F,PENG C L,LIN G Z. Comparative study of the photooxidative response in leaf discs from plants with different photosynthetic pathways[J].Chinese Bulletin of Botany,1998,40(8):721-728.
[5] FUERST E P,VAUGHN K C. Mechanisms of paraquat resistance[J]. Weed Technology,1990,4(1):150-156.
[6] 彭长连,林植芳,林桂珠. 光氧化胁迫下几种植物叶片的超氧自由基产生速率和光合特性[J]. 植物生理学报,2000,26(2):81-87.
PENG C L,LIN Z F,LIN G Z. Superoxide production rate and photosynthetic feature in leaves of some plant species under photooxidation[J]. Plant Physiology Journal,2000,26(2):81-87.
[7] 张传玉,张执金,黄荣峰,等. 水稻品种中VC含量及抗氧化性的比较分析[J]. 中国农业科技导报,2011,13(6):6-11.
ZHANG C Y,ZHANG Z J,HUANG R F,et al. Comparative analysis of vitamin C contents and anti-oxidization in rice varieties[J]. Journal of Agricultural Science and Technology,2011,13(6):6-11.
[8] 余春梅,李斌,李世民,等. 拟南芥和作物中维生素C生物合成与代谢研究进展[J]. 植物学报,2009,44(6):643.
YU C M,LI B,LI S M,et al. Recent advances in research into vitamin C biosynthesis and metabolism inArabidopsisthalianaand crop species[J]. Chinese Bulletin of Botany,2009,44(6):643.
[9] GALLIE D R. The role of L-ascorbic acid recycling in responding to environmental stress and in promoting plant growth[J]. Journal of Experimental Botany,2013,64(2):438.
[10]WHEELER G L,JONES M A,SMIRNOFF N. The biosynthetic pathway of vitamin C in higher plants[J]. Nature,1998,393(6683):336.
[11]TOKUNAGA T,MIYAHARA K,TABATA K,et al. Gene-ration and properties of ascorbic acid-overproducing transgenic tobacco cells expressing sense RNA for l-galactono-1,4-lactone dehydrogenase[J]. Planta,2005,220(6):857.[12]俞乐,刘拥海,彭新湘. 水稻L-半乳糖内酯脱氢酶基因的克隆和原核表达及抗体的制备[J]. 湖南农业大学学报:自然科学版,2010,36(4):381-384;429.
YU L,LIU Y H,PENG X X. Cloning,prokaryotic expression of rice L-galactono-1,4-lactone dehydrogenase gene and preparation of anti-GLDH antibodies[J]. Journal of Hunan Agricultural University:Natural Sciences,2010,36(4):381-384;429.
[13]GILLESPIE K M,AINSWORTH E A. Measurement of reduced,oxidized and total ascorbate content in plants[J]. Nature Protocol,2007,2(4):872.
[14]SCHREIBER U,SCHLIWA U,BILGER W. Continuous recording of photochemical and non-photochemical chlorophyll fluorescence quenching with a new type of modulation fluorometer[J]. Photosynthesis Research,1986,10(1):56.
[15]BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1/2):249.
[16]LIVAK K J,SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods,2001,25(4):405.
[17]VANDENABEELE S,VANDERAUWERA S,VUYLSTEKE M,et al. Catalase deficiency drastically affects gene expression induced by high light inArabidopsisthaliana[J]. Plant Journal,2004,39(1):47.[18]CHIA L S,THOMPSON J E,DUMBROFF E B. Simulation of the effects of leaf senescence on membranes by treatment with paraquat[J]. Plant Physiology,1981,67(3):471.
[19]BABBS C F,PHAM J A,COOLBAUGH R C. Lethal hydroxyl radical production in paraquat-treated plants[J]. Plant Physiology,1989,90(4):1269.
[20]BLOKHINA O,VIROLAINEN E,FAGERSTEDT K V. Antioxidants,oxidative damage and oxygen deprivation stress:a review [J]. Annals of Botany,2003,91(2):184.
[21]HUANG C,HE W,GUO J,et al. Increased sensitivity to salt stress in an ascorbate-deficientArabidopsismutant [J]. Journal of Experimental Botany,2005,56(422):3044.
[22]TAMAOKI M,MUKAI F,ASAI N,et al. Light-controlled expression of a gene encoding l-galactono-γ-lactone dehydrogenase which affects ascorbate pool size inArabidopsisthaliana[J]. Plant Science,2003,164(6):1111-1117.
[23]BRATT C E,ARVIDSSON P O,CARLSSON M,et al. Regulation of violaxanthin de-epoxidase activity by pH and ascorbate concentration[J]. Photosynthesis Research,1995,45(2):171.
【中文责编:庄晓琼 英文责编:李海航】
Effects of Endogenous Ascorbic Acid on Resisting Oxidative Stress of Rice
ZHANG Qilei, GAO Hui, PENG Changlian*
(Guangdong Provincial Key Laboratory of Biotechnology for Plant Development, School of Life Science,South China Normal University, Guangzhou 510631, China)
The homozygote transgenic lines GO-2 with the up-regulatedGLDH( the key enzyme that catalyzes the final step of Asc biosynthesis in plants) gene and GI-2 with the down-regulatedGLDHgene had been established from the cultivar ‘Zhong Hua11’ (WT). Treatment three rice cultivars with methyl viologen(MV) and the effect of changes of endogenous ascorbic acid on resistance to oxidative stress of rice (Oryzasativa) were investigated among three rice cultivars of WT, GO-2 and GI-2. After treatment with MV photo-oxidation, superoxide anion and H2O2were lower in GO-2 than in WT or GI-2. GI-2 was the weakest in membrane lipid oxidation and soluble protein degradation in the three rice cultivars. Changes of chlorophyll fluorescence quenching in three rice cultivars in GO-2 were greater than in the WT or GI-2. The results showed that GO-2 had stronger resistance to oxidative stress which proved that ascorbic acid is important for rice resistance to oxidative stress.
Oryzasativa; ascorbic acid;GLDHgene; oxidative stress
2016-07-03 《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
国家自然科学基金项目(31270287,31570398);广东省自然科学基金项目(2015A030311023)
Q945.3
A
1000-5463(2016)06-0025-05
*通讯作者:彭长连,研究员,Email:pengchl@scib.ac.cn.
