家蚕BmFKBP45基因的表达和功能分析
2016-12-12陈郁蕙黄金花冯启理邓惠敏
陈郁蕙, 黄金花, 冯启理, 邓惠敏
(广州市昆虫发育调控与应用重点实验室, 华南师范大学生命科学学院, 广州 510631)
家蚕BmFKBP45基因的表达和功能分析
陈郁蕙, 黄金花, 冯启理*, 邓惠敏*
(广州市昆虫发育调控与应用重点实验室, 华南师范大学生命科学学院, 广州 510631)
以家蚕(Bombyxmori)为研究对象,对果蝇DmFKBP39的同源蛋白BmFKBP45进行了表达和初步的功能分析. 对DmFKBP39和BmFKBP45进行氨基酸序列比对分析发现,它们都含有酸性氨基酸区域、碱性氨基酸区域、核定位信号及FKBP结构域. 将BmFKBP45的第2个碱性区域与核蛋白HMG2的DNA结合位点进行比对,相似性达到21%,推测BmFKBP45可通过其第2个碱性区域与DNA结合,但EMSA的结果显示重组BmFKBP45不与果蝇的JHRE1元件结合. RT-PCR和Western blot结果显示,BmFKBP45在各个发育时期的家蚕翅原基中都有表达,在蛹期的表达量逐渐下降. 激素处理实验结果显示,BmFKBP45的表达并不受20E和JH的影响. 利用Pull-down、Far-western blot和Co-IP实验鉴定出一个与BmFKBP45相互作用的蛋白Bm6G1. 这些研究结果为进一步探究BmFKBP45的功能提供了线索.
家蚕; BmFKBP45; 亲免蛋白; 蜕皮激素; 保幼激素; 30K蛋白
在生物体内,免疫抑制剂通过结合相应的受体蛋白而发挥作用,人们将这些受体蛋白命名为亲免蛋白(Immunophilin). 根据结合不同的免疫抑制剂,这类蛋白可分为两大类型:能与环孢素A特异性结合的蛋白质命名为亲环蛋白(Cyclophilin,CyP);能与FK506和雷帕霉素结合的蛋白质命名为FK506结合蛋白(FK506-binding protein,FKBP)[1],并将与免疫抑制剂结合的位点称为FKBP结构域. FKBPs蛋白具有肽基脯氨酰顺反异构酶(Peptidyl Prolyl cis/trans Isomerase,PPIase)催化活性,能催化蛋白质或多肽中脯氨酸肽键的顺反转变,并且它们的PPIase活性可以被免疫抑制剂抑制. 部分亲免蛋白也具备分子伴侣的特性. FKBP38位于线粒体膜上,用RNAi抑制FKBP38的表达会导致抗凋亡因子Bcl-2的结构异常. FKBP38可能发挥了一个分子伴侣的作用,通过稳定Bcl-2的构象而参与细胞凋亡的调控过程[2]. 亲免蛋白是免疫抑制剂的受体蛋白,最初研究亲免蛋白主要是围绕其在免疫抑制反应中的作用机理而展开. 最先发现的是FKBPs中最小的FKBP12蛋白,它通过结合FK506和雷帕霉素抑制T细胞的免疫作用,但是复合物FK506-FKBP12和雷帕霉素-FKBP12所起的调控机理有所不同. FK506-FKBP12作用的靶蛋白是钙调磷酸酶(Calcineurin,CaN)[3],而雷帕霉素-FKBP12作用的靶蛋白是雷帕霉素靶蛋白(Target of Rapamycin,TOR)[4].
昆虫的FKBPs可分为3种类型:第1类与人类的FKBP12和FKBP13具有同源性;第2类的FKBPs具有序列相似性,相对分子量是3.8×104~4.6×104之间;第3类是人类的FKBP52的同源物. 在鳞翅目昆虫草地贪夜蛾(Spodopterafrugiperda)中,首次发现了一个亲免蛋白(SfFKBP46),这个蛋白是根据其Mw(4.58×104)及FKBP结构域命名的. SfFKBP46含有一个C末端FKBP结构域和核定位信号序列(Nuclear Localization Signal,NLS),并且和FKBP25一样也具有结合DNA的能力[5]. 在脊椎动物中发现类固醇激素受体能结合热激蛋白和亲免蛋白[6],后来发现烟草天蛾(Manducasexta)的FKBP46也能与EcR/USP结合形成复合物,为研究FKBPs与细胞核激素受体的关系提供了一个理想的模式系统[7]. 通过基因芯片分析,LI等[8]在黑腹果蝇L57细胞系中发现了16个受JH诱导的基因,它们的启动区都含有JH反应元件DmJHRE1(JH response element),并鉴定出FK506结合蛋白(DmFKBP39)和Calponin-like蛋白(DmChd64)能结合到DmJHRE1上. 酵母双杂交和GST pull-down分析显示,这2个蛋白能与 DmEcR/DmUSP和DmMet结合,共同调控JH应答基因的表达[8]. 本文主要研究与果蝇DmFKBP39同源的BmFKBP45是否与DmFKBP39一样参与了激素的信号传导途径,从而为认识家蚕变态发育的激素调控机理提供实验的证据.
1 材料与方法
1.1 材料及主要试剂
所选用的家蚕为大造品系,蚕卵来自广东省蚕业研究所. 大肠杆菌BL21、Rosetta和pET-32a载体质粒,以及提取试剂盒HiPure Plasmid Micro Kit购自Invitrogen公司;DNA聚合酶、DNA限制性内切酶、T4连接酶、RT-PCR试剂盒和荧光定量PCR试剂盒均购自TaKaRa公司; DNA胶回收采用Axygen公司的试剂盒;免疫共沉淀所用的Protein A/G-Plus Beads购自上海悦克生物科技有限公司;蛋白纯化树脂His·Bind Resin购自美国Novagen公司;牛血清白蛋白组分、弗氏完全佐剂和弗氏不完全佐剂等购自北京鼎国昌盛生物技术有限责任公司;碱性磷酸酶标记山羊抗兔抗体购自武汉博士德生物工程有限公司.
1.2 方法
1.2.1BmFKBP45基因克隆及原核表达 以果蝇的DmFKBP39(GenBank accession number:NM_079640.3)为询问序列,利用NCBI的BLAST工具获得家蚕中与DmFKBP39同源的基因,即BmFKBP45(GenBank accession number:NM_001043891.1). 根据BmFKBP45的mRNA序列设计包含BamH I、XhoI酶切位点的特异引物(上游:GGATCCATGTTTTGGGGATTAATAAT;下游:CTCGAGTCACTTAACATTCTTCAATT). 以家蚕翅原基cDNA为模板,PCR扩增该基因的编码开放阅读框ORF. PCR反应条件为:94 ℃预变性3 min,94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸1 min(变性到延伸总34个循环),72 ℃补充延伸10 min. 将PCR产物与pMD18-T载体连接,转化到DH5α菌体中,提取质粒测序,然后通过BamH I、XhoI双酶切后回收目的片段,并将其插入经过同样酶切的pET-32a表达载体上,转化到BL21菌体中,加入最终浓度为1 mmol/L的IPTG进行诱导表达,SDS-PAGE检测表达情况.
1.2.2 重组蛋白的纯化及包涵体复性 根据蛋白纯化试剂盒His·Bind Kit(Norvagen)说明书进行重组蛋白的纯化. 重组蛋白若为包涵体,所用的结合缓冲液、洗涤缓冲液及洗脱液均要带有6 mol/L的尿素. 操作步骤如下:
样品制备:收集诱导菌体,12 000 r/min离心取沉淀,用预冷的结合缓冲液(不含尿素)重悬沉淀,在冰上超声波破碎直至细胞完全破裂(超声波破碎7 s,冰上静置7 s,交替进行). 于4 ℃、12 000 r/min离心10 min,取上清液并用孔径为0.45 μm的滤膜过滤待用. 若为包涵体,用少量的结合缓冲液(含2 mol/L尿素)重悬沉淀2次,沉淀再次溶于结合缓冲液(含6 mol/L尿素)里,于4 ℃下过夜,次日于4 ℃、12 000 r/min离心10 min,取上清液待用.
纯化:取100~400 μL His·Bind树脂至1.5 mL离心管中,1 000 r/min离心1 min,弃上清液. 按以下顺序平衡树脂:3倍体积(相对于His·Bind树脂的体积,下同)的Strip缓冲液洗3次(旧树脂采用);2倍体积的蒸馏水洗2次;2倍体积的Charge缓冲液洗3次;2倍体积的结合缓冲液洗2次. 每一步都充分混匀,平衡步骤之间1 000 r/min离心1 min,弃上清液. 将制备好的上清液样品加入已平衡的树脂中,室温结合30 min,于1 000 r/min离心1 min,弃上清液. 按以下顺序清洗已结合目的蛋白的树脂:3倍体积的结合缓冲液洗3次,3倍体积的洗涤缓冲液洗3次,期间于1 000 r/min离心1 min,弃上清液. 最后用2倍体积的洗脱液洗3次,于1 000 r/min离心1 min,收集上清液即为纯化的蛋白样品. 期间上下轻轻混匀管中的内容物.
透析复性:取纯化的包涵体蛋白样品于透析袋中,依次用含6、4、2 mol/L尿素的透析液在4 ℃下搅拌透析,各3 h,然后用不含尿素的透析液透析搅拌过夜. 次日将透析后的蛋白液从透析袋吸到离心管,于4 ℃、1 000 r/min离心10 min,上清液即为复性后的蛋白样品,置于-80 ℃保存备用. 1.2.3 多克隆抗体的制备 成年兔子免疫前禁食24 h,进行耳缘动脉取血作为检测抗体时的阴性对照. 首次免疫将纯化的抗原与等体积的Freund’s完全佐剂充分混合乳化,1 000 r/min离心1 min,至水相和油相不分层即可注射. 首次免疫的抗原量为1 mg,第2、3次为0.5 mg. 每次免疫间隔7~10 d. 第3次重复免疫注射后,第7天进行耳缘动脉取血,血液于37 ℃下放置 2 h,然后置于4 ℃过夜,第2天早上于4 ℃、10 000 r/min离心10 min. 取上清液分装到1.5 mL离心管中,加入最终质量分数为0.02%的防腐剂叠氮化钠,-80 ℃保存备用. 1.2.4 Pull-down分析 按照蛋白纯化方法制备样品及处理His·Bind 树脂柱子. 分别取200 μL His·Bind 树脂至3个标记为A、B、C的1.5 mL离心管,将制备好的上清液样品等量加到A、B离心管中,向C管加入1 mL(0.5~1.0 g/L)翅原基蛋白裂解液(作为阴性对照),于摇床上低温孵育3 h. 将与C管等量的蛋白提取液加入B管,继续在摇床上低温结合3 h. 3管于800 r/min离心1 min,弃上清液. 用2倍体积的预冷的Tris-HCl缓冲液冲洗His·Bind树脂,800 r/min离心1 min后弃上清液,重复6次. 用适量的洗脱液洗脱1 h,800 r/min离心1 min后收集上清液. 1.2.5 Far-western blot分析 根据WU等[9]的方法进行了改进,具体方法如下:SDS-PAGE电泳分离蛋白(如Bm6G1纯化蛋白),于4 ℃恒流300 mA把蛋白转移至硝酸纤维膜. 用不同浓度的盐酸胍变性复性缓冲液对膜上的蛋白进行变性及复性处理. 如表1配比,配制出5种不同浓度的盐酸胍变性复性缓冲液,每种浓度缓冲液的总体积均为25 mL. 依次用6、3、1 mol/L的盐酸胍变性复性缓冲液在室温下对膜上的蛋白进行变性及复性处理30 min. 接着用0.1 mol/L的盐酸胍变性复性缓冲液在4 ℃条件下对膜上蛋白处理30 min,最后用0 mol/L的盐酸胍变性复性缓冲液在4 ℃下处理膜上蛋白过夜.
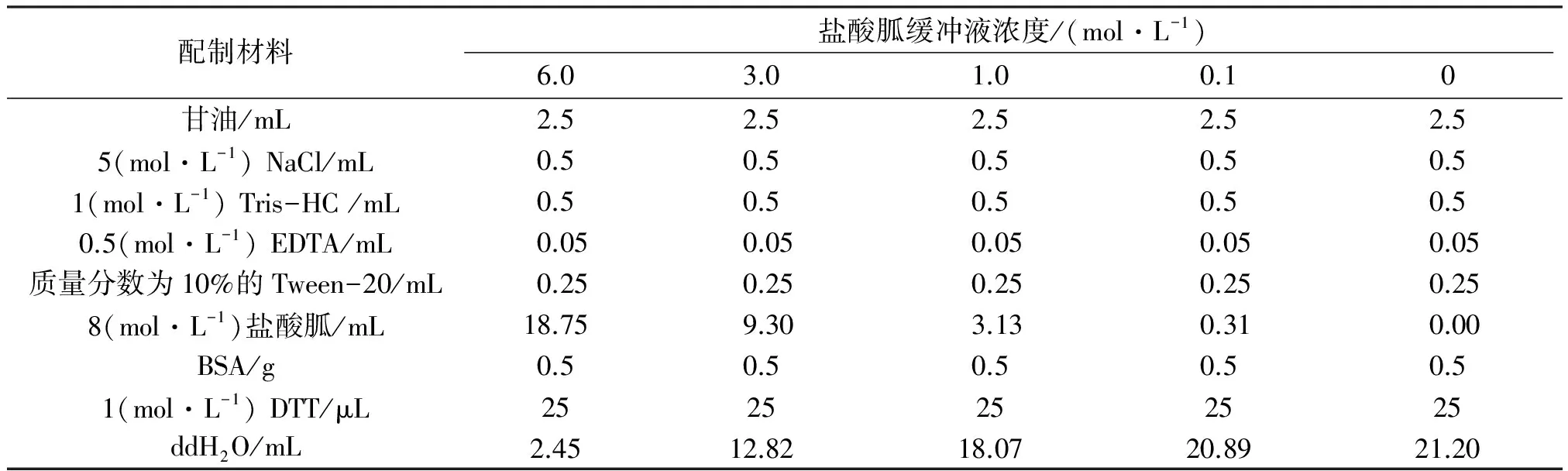
表1 不同浓度的盐酸胍变性复性缓冲液的配制材料
用含有质量分数为3%的BSA的TBST封闭,37 ℃温育1 h. TBST洗膜3次以去除封闭液,每次10 min. 加入重组并经His-tag纯化的蛋白液(如BmFKBP45,10 μg,1 mg/L),4 ℃孵育过夜. 第2天用TBST洗膜3次,每次10 min. 加入一抗BmFKBP45抗体(以质量分数为1%的BSA-TBST稀释,1∶5 000),室温孵育1 h. TBST洗膜3次,每次10 min. 加入碱性磷酸酶标记的羊抗兔二抗(以质量分数为1%的BSA-TBST稀释,1∶10 000),室温孵育1 h. TBST洗膜1次,再用TBS洗膜3次,每次10 min. 用NBT/BCIP显色液进行显色反应.
1.2.6 免疫共沉淀 将1 000 μL翅原基组织蛋白裂解液(0.5~1.0 g/L)与30 μL质量分数为50% 的Protein A/G-Plus Beads悬浮液在摇床上于4 ℃下缓慢摇动1 h. 然后于4 ℃下2 500 r/min离心1 min,取沉淀作实验的阴性对照. 各取500 μL上清液到2个新的离心管中,按1∶50比例加入目的蛋白抗体及免疫前血清,4 ℃缓慢摇动3 h. 添加质量分数为50% 的Protein A/G-Plus Beads 30 μL继续孵育1 h. 2 500 r/min、4 ℃离心1 min,弃上清液,用洗涤缓冲液上下颠倒洗涤沉淀,2 500 r/min、4 ℃离心1 min,重复4次. 最后一次洗涤后,收集洗出液作为对照. 加入20 μL 2×SDS-PAGE 电泳上样缓冲液,重悬沉淀,瞬时高速离心. 100 ℃加热变性5 min,取部分或全部样品进行Western blot 分析.
2 结果与分析
2.1 BmFKBP45的生物信息学分析
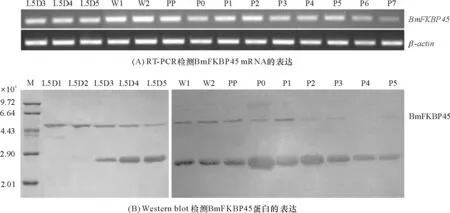
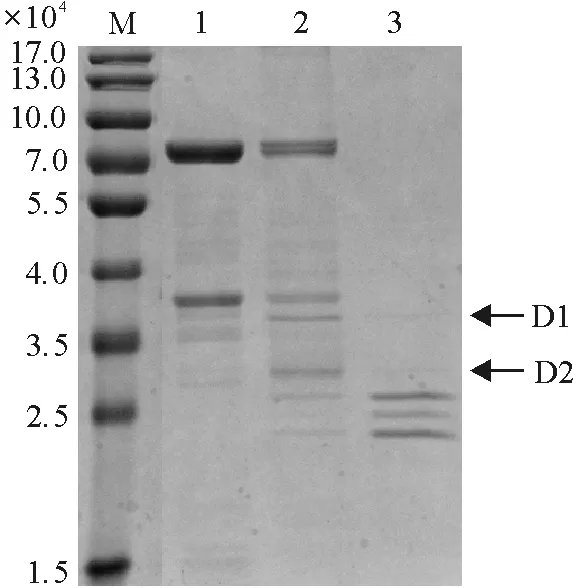
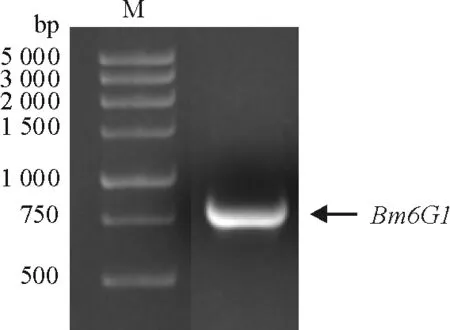
2.1.1 BmFKBP45与DmFKBP39蛋白序列比较分析 以果蝇DmFKBP39为询问序列,在家蚕数据库[10]中以 E-value 对BmFKBP45与DmFKBP39的序列进一步分析发现,DmFKBP39的酸性氨基酸紧密排在一起形成2个酸性区域(acidic domain),分别为Asp89-Asp99和Glu119-Gln184区域;碱性氨基酸紧密排在一起形成一个Pro185-Gln239碱性区域(basic domain);C末端Gly251-His357是一个肽基脯氨酰顺反异构酶结构域(FKBP domain). BmFKBP45的2个酸性氨基酸区域分别位于Asp91-Glu111和Ala146-Glu215,2个碱性氨基酸区域分别位于Lys119-Thr144和Thr217-Ser295,C末端Gly296-Lys402区域是一个肽基脯氨酰顺反异构酶结构域,其核定位信号序列(NLS)存在于这2个蛋白的碱性区域内. BmFKBP45的Asp91-Glu111和Ala146-Glu215酸性区域分别比DmFKBP39的Asp89-Asp99和Glu119-Gln184酸性区域多了10个和4个氨基酸. BmFKBP45不仅比DmFKBP39多了1个碱性区域Lys119-Thr144(26个氨基酸),而且BmFKBP45的Thr217-Ser295碱性区域比DmFKBP39的Pro185-Gln239碱性区域多了24个氨基酸(图1). BmFKBP45与DmFKBP39的氨基酸数目出现的差异,是由这2个蛋白在进化上出现的碱性区域的缺失或增加及区域中氨基酸的增减造成的. 上述结果表明,家蚕中并不存在FKBP39,但BmFKBP45与DmFKBP39具有明显的相似性. 这2个蛋白除了氨基酸数目不一样外,整体上它们的结构是很相似的. 因此家蚕中的BmFKBP45可能是果蝇中的DmFKBP39的同源物,推测它们具有类似的功能. 本研究以果蝇中的DmFKBP39为参照蛋白研究家蚕的BmFKBP45的生物学功能. 图1 BmFKBP45 与DmFKBP39蛋白氨基酸序列比较分析 2.1.2 BmFKBP45结合DNA分析 DmFKBP39是一个具有结合DNA能力的核蛋白[11],那么BmFKBP45是否也是一个DNA结合蛋白?有文献[5]报道,草地贪夜蛾SfFKBP46是个DNA结合蛋白,因为它与HMG2的DNA结合区域的相似性达到26%,并且预测能形成α-螺旋(图2A). 其中HMG2属于高迁移率族蛋白的一种,是结合DNA的核蛋白. 将BmFKBP45的第2个碱性区域(Thr217-Ser295)与HMG2进行比对,相似性达到21%(图2B). 另外,通过在线软件PSIPRED[12]分析BmFKBP45的二级结构,发现其第2个碱性区域中存在2个螺旋结构,分别为Lys241-Ala251和Lys269-Glu280,它们通过无规则卷曲结构连接(图2C). 这些序列比对及二级结构分析结果表明,BmFKBP45可能具有DNA结合能力,并且可能通过其碱性氨基酸区域(Thr217-Ser295)结合DNA. 图2 BmFKBP45 的DNA结合结构域分析 2.2 BmFKBP45 cDNA的克隆及原核表达 2.2.1BmFKBP45 cDNA的克隆 本实验以前期构建好的BmFKBP45/pMD18-T为模板,重新设计引物(FKBP45E-F2、FKBP45E-R2)进行克隆并获得了该基因ORF的cDNA.BmFKBP45的ORF的cDNA预测大小为1 209 bp. 经PCR扩增在1 000~1 500 bp处出现一条条带(图3),与BmFKBP45的大小一致,经测序确定此序列确为BmFKBP45.BmFKBP45编码一个含402个氨基酸的蛋白质,预测相对分子量大小为4.5×104. 将克隆出来的BmFKBP45经过BamH I和XhoI双酶切后,连接到蛋白表达载体pET-32a上,双酶切证明重组质粒构建成功(图4). 图3 BmFKBP45 ORF cDNA的PCR扩增 图4 BmFKBP45/pET-32a重组质粒双酶切 Figure 4 Double enzyme digestion of the recombinant plasmid ofBmFKBP45/pET-32a 2.2.2BmFKBP45基因的原核表达 将BmFKBP45/pET-32a重组质粒转化到BL21(DE3)大肠杆菌中,在30 ℃的培养条件下,加入IPTG诱导蛋白表达. 以诱导的空载体pET-32a及不做诱导的重组质粒作为对照. BmFKBP45预测相对分子量为4.5×104,加上载体上一个相对分子量为1.83×104的His-tag标签,其相对分子量预测为6.33×104. SDS-PAGE结果显示,BmFKBP45/pET-32a重组质粒和对照相比,在6.64×104处出现了一条明显的蛋白条带,其大小与BmFKBP45预测相对分子量相近. 将菌体经过超声波破碎后,发现重组蛋白是以可溶的形式存在(图5). 利用His-tag纯化了BmFKBP45重组蛋白. 除了目的蛋白BmFKBP45外,在2.90×104~4.43×104处还出现了一条较明显的蛋白条带. 在经IPTG诱导的空质粒菌体(第1泳道)和未经IPTG诱导的菌体重组蛋白(第2泳道)的2组对照中,出现一条很弱的与上述蛋白条带处于同一位置的蛋白条带,但在经IPTG诱导的菌体重组蛋白的实验组中(第 3泳道),此处的蛋白条带变粗,说明这个被诱导大量表达的蛋白并不属于pET-32a质粒和菌体的. 这个在纯化蛋白中(第7泳道)出现的相对分子量偏小的蛋白可能是BmFKBP45在菌体内被降解后而成的产物. 1:经IPTG诱导的pET-32a菌体蛋白;2:未经IPTG诱导的菌体重组蛋白;3:经IPTG诱导的菌体重组蛋白(未破碎);4:经IPTG诱导的菌体重组蛋白(破碎);5:诱导的菌体重组蛋白上清;6:诱导的菌体重组蛋白沉淀;7:纯化蛋白 图5 BmFKBP4重组蛋白表达的SDS-PAGE分析 Figure 5 SDS-PAGE analysis of expression of BmFKBP4 recombinant protein 2.3 BmFKBP45在翅原基中的表达谱 为了检查BmFKBP45在家蚕翅原基中的mRNA及蛋白质的表达情况,提取了5龄幼虫及蛹期的家蚕翅原基的总RNA及蛋白质,并用RT-PCR和Western blot 技术检测了BmFKBP45在不同发育时期的翅原基中的表达情况(图6). RT-PCR结果显示,BmFKBP45在翅原基的各时期都有表达,进入蛹期后其表达水平呈下降的趋势(图6A). Western blot结果显示,在5.50×104处出现了BmFKBP45蛋白条带(箭头所指),可能是由于体内的BmFKBP45发生了蛋白修饰而导致表观分子量的变化. 整体上看,BmFKBP45在蛋白水平的表达情况与mRNA水平的变化一致(图6B). L5Dy (y=1,2,…,5)表示幼虫5龄y天;Wx (x=1,2)表示熟蚕x天;PP表示预蛹期;Pm (m=0,1,2…,7)表示蛹期m天. 在图6B中还有一条大小约为2.90×104的蛋白条带,推测可能是由于BmFKBP45发生了剪接而造成的. 由于FKBPs家族的同源性较高,此蛋白条带也可能是这个家族中的其他成员. 在Western blot中所用的抗体是BmFKBP45多克隆抗体,这也可能是出现非特异条带的原因之一. 2.4 BmFKBP45对激素20E和JH的响应情况 研究表明,保幼激素JH III对果蝇DmFKBP39的表达具有诱导作用[11],为了研究激素对家蚕BmFKBP45的表达是否具有影响,对L5D3家蚕幼虫注射2 μg蜕皮激素(20E)或JH类似物甲氧普烯(methoprene),在处理1、2、4、8、16、32 h后提取翅原基RNA,利用qRT-PCR检测BmFKBP45对激素的响应情况. 结果显示,与二甲基亚砜(DMSO)对照比较,注射20E及甲氧普烯对BmFKBP45的表达并没有显著的影响(图7). 图7 qRT-PCR检测20E和methoprene对翅原基BmFKBP45 mRNA表达的影响 Figure 7 qRT-PCR analysis of mRNA expression ofBmFKBP45 in response to 20E and methoprene treatments 2.5 Pull-down检测与BmFKBP45互作的蛋白 BmFKBP45是亲免蛋白家族的成员. 目前对FKBP12、FKBP52等亲免蛋白研究较多,但对BmFKBP45的功能研究尚缺乏. 本研究通过Pull-down技术鉴定家蚕中与BmFKBP45相互作用的未知蛋白,从而为阐明BmFKBP45的功能提供线索. 把带有His标签的BmFKBP45固定到His·Beads上,然后将提取的翅原基细胞蛋白通过栓层析分离,洗涤除去不能结合的蛋白后进行SDS-PAGE分析(图8),第1泳道是将体外表达BmFKBP45的菌体总蛋白过柱子后洗脱下来的样品,第2泳道是把BmFKBP45固定到His·Beads上,再将翅原基细胞蛋白过亲和柱,经过洗脱留下的样品,第3泳道是只将翅原基蛋白过亲和柱的洗脱样品. 与第1和第3泳道对比,在第2泳道的3.50×104~4.0×104及2.50×104~3.50×104处各出现了一条差异条带(箭头所指),分别命名为D1和D2. 1:BmFKBP45纯化蛋白(对照);2:BmFKBP45的 Pull-down产物;3:翅原基蛋白(对照) 图8 Pull-down检测与BmFKBP45互作的蛋白 Figure 8 Pull-down analysis of the interactive proteins with BmFKBP45 提取D1和D2蛋白进行MALDI-TOF/TOF质谱分析,然后将检测到的蛋白肽与NCBI蛋白数据库进行序列比对,共鉴定到20个蛋白质. 其中D1蛋白条带包括逆转录酶、细胞骨架蛋白、能量转换蛋白及与激素信号转导途径相关的蛋白质(表2). D2蛋白条带主要包括表皮几丁质结合蛋白和30K蛋白. 根据保守的基序, 表皮蛋白分为R&R、Tweedle、CPF 及CPFL等家族. D2蛋白条带中的表皮几丁质结合蛋白属于R&R家族,具有结合几丁质的能力. 家蚕30K蛋白的相对分子量约为3.0×104,是一群核苷酸和氨基酸序列高度相似的低分子量脂蛋白. 有些30K蛋白的合成受激素调控. 30K蛋白是末龄幼虫和蛹期血液中含量最大的一群蛋白,能抑制蜕皮激素诱导的细胞程序性死亡. 此外,30K蛋白可以与葡萄糖和葡聚糖结合,在昆虫的自我防御中起作用. 在D2蛋白条带中鉴定出2个30K蛋白,其GenBank登录号、蛋白分值分别是:gi|126415,182;gi|225905552,175. 经过对这2个蛋白的氨基酸序列进行比对后发现,它们的氨基酸数目一致,但存在一个氨基酸的差异,这可能是由测序误差或核苷酸多态性造成的,因此这2个蛋白可能是同一种蛋白,即Bm6G1蛋白. 有研究表明,Bm6G1通过结合BmEcR从而抑制20E的信号传导[13]. 当体内存在高滴度的JH时,DmFKBP39大量表达,并通过结合DmEcR来抑制20E的信号传导[8]. Bm6G1和DmFKBP39都可以与EcR结合,说明30K蛋白、FKBPs蛋白和EcR有可能形成30K/FKBPs/EcR复合物从而发挥作用. 因此,本研究进一步分析Bm6G1蛋白与BmFKBP45的相互作用及功能. 表2 D1蛋白条带MALDI-TOF/TOF质谱鉴定结果 2.6 Bm6G1的克隆及表达 2.6.1Bm6G1的克隆 利用翅原基cDNA作为模板克隆得到了Bm6G1(GenBank Accession number:NM_001044021)的ORF(图9).Bm6G1编码256个氨基酸,预测相对分子量大小为3.0×104,等电点为6.25. 将克隆出来的Bm6G1经过BamH I和HindIII双酶切后,连接到蛋白表达载体pET-32a上,用酶切验证重组质粒(图10). 2.6.2 体外诱导Bm6G1蛋白的表达 将Bm6G1/pET-32a重组质粒转化到Rosetta(DE3)大肠杆菌中,在37 ℃的培养条件下,用IPTG诱导蛋白表达. 以空载体pET-32a作为对照. Bm6G1的预测相对分子量为3.0×104,加上载体上相对分子量为1.83×104的His-tag标签,其预测大小为4.83×104. SDS-PAGE结果显示(图11),Bm6G1/pET-32a重组质粒(第2泳道)和对照组(第1泳道)相比,表达出了一个大小与预测相对分子量一致的蛋白. 该重组蛋白主要以包涵体的形式存在的(第4泳道). 利用His-tag柱将已经变性的Bm6G1重组蛋白进行了纯化(第5泳道). 图9 Bm6G1 ORF的PCR扩增 图10 Bm6G1/pET-32a重组质粒双酶切分析 Figure 10 Double enzyme digestion of the recombinant plasmid of Bm6G1/pET-32a 1:经IPTG诱导的空载体菌体蛋白(对照);2:经IPTG诱导的菌体重组蛋白;3:诱导的菌体重组蛋白上清;4:诱导的菌体重组蛋白沉淀;5:纯化的蛋白 图11 SDS-PAGE 检测Bm6G1重组蛋白的表达 Figure 11 SDS-PAGE detection of expression of Bm6G1 recombinant protein 2.7 BmFKBP45与Bm6G1的相互作用 2.7.1 Far-western blot验证BmFKBP45与Bm6G1的相互作用 在Pull-down的蛋白中,发现了Bm6G1能与 BmFKBP45发生结合. 利用Far-western blot进一步验证这2个蛋白质是否存在相互作用. 将纯化的Bm6G1进行SDS-PAGE分离后转移到硝酸纤维膜上,用重组纯化的BmFKBP45蛋白与之孵育后用BmFKBP45抗体检测. 结果表明,与未用BmFKBP45蛋白进行孵育的对照相比(图12C),用BmFKBP45蛋白进行孵育后在Bm6G1处出现了条带(第4泳道),而负对照组(用BSA孵育)没有出现该蛋白条带(第3泳道),这表明在膜上的Bm6G1蛋白能与重组的BmFKBP45蛋白发生特异结合,结合后的蛋白复合物可被BmFKBP45蛋白抗体识别(图12B). 反过来,将纯化的BmFKBP45进行SDS-PAGE分离后转移到硝酸纤维膜上,用重组纯化后的Bm6G1与之孵育后用Bm6G1抗体检测. 结果表明,与未用Bm6G1蛋白进行孵育的对照相比(图13C),用Bm6G1蛋白进行孵育后在BmFKBP45处出现了条带(第4泳道),而负对照组(用BSA孵育)没有出现蛋白条带(第3泳道),这表明在膜上的BmFKBP45蛋白能与重组纯化的Bm6G1蛋白发生特异结合,结合后的蛋白复合物可被Bm6G1蛋白抗体识别(图13B). 1、3:BSA;2、4、5:Bm6G1纯化蛋白 图12 利用BmFKBP45抗体进行Far-western blot检测BmFKBP45与Bm6G1的相互作用 Figure 12 Far-western blot analysis of the interaction between BmFKBP45 and Bm6G1 by BmFKBP45 antibody 1、3:BSA;2、4、5:BmFKBP45纯化蛋白 图13 利用Bm6G1蛋白抗体进行Far-western blot检测BmFKBP45与Bm6G1的相互作用 Figure 13 Far-western blot analysis of the interaction between BmFKBP45 and Bm6G1 by using Bm6G1 antibody 2.7.2 Co-IP检测BmFKBP45与Bm6G1的相互作用 Far-western blot是在体外进行的蛋白结合实验,为了检测这2个蛋白在家蚕体内是否也会发生相互作用,提取刚进入蛹期(P0)的家蚕翅原基组织蛋白,用BmFKBP45多克隆抗体进行免疫共沉淀,所得的蛋白复合物进行SDS-PAGE分离后用Bm6G1多克隆抗体进行Western blot检测. 在图14中,当加入BmFKBP45蛋白抗体、翅原基组织蛋白及Protein A/G-Plus Beads进行孵育并洗涤时,在约3.0×104处出现了一条蛋白条带(第1泳道),而第4次洗涤后的洗出液在3.0×104处没有出现该蛋白条带(第4泳道),说明洗涤效果较好. 当加入翅原基组织蛋白及Protein A/G-Plus Beads进行孵育(第2泳道),或加入免疫前血清、翅原基组织蛋白及Protein A/G-Plus Beads进行孵育(第3泳道)时,在约3.0×104处均没有出现蛋白条带,表明在实验组第1泳道的约3.0×104处的蛋白不与Protein A/G-Plus Beads和免疫前血清发生结合,而是与BmFKBP45蛋白发生特异结合而被沉淀下来的蛋白. 3.0×104处的蛋白条带大小与Bm6G1(3.0×104)的大小相近,因此,可以认为该3.0×104蛋白是Bm6G1蛋白. 综上所述,BmFKBP45蛋白与Bm6G1蛋白在体内也是可以发生特异结合的. 图14 Co-IP检测翅原基中BmFKBP45与Bm6G1的相互作用 Figure 14 Co-IP detection of the interaction between BmFKBP45 and Bm6G1 in the wing discs WU等[9]在果蝇中发现了一个亲免蛋白家族成员DmFKBP39参与了JH的调控通路. 本研究的主要目的是探究在家蚕中与DmFKBP39同源的BmFKBP45的可能功能. 以DmFKBP39蛋白序列为参考序列,在家蚕数据库中SilkDB中进行Blast后并没有找到完全对应的BmFKBP39,但鉴定到了3个同源蛋白BmFKBP45、BmFKBP12和BmFKBP59. 其中BmFKBP45与DmFKBP39相似性为43.7%. 对这2个蛋白的序列结构进一步分析发现(图1),它们都含有酸性氨基酸区域和碱性氨基酸区域,碱性区域内都含有核定位信号(NLS). 除此之外,它们都具有一个肽基脯氨酰顺反异构酶结构域. BmFKBP45酸性区域的氨基酸数目比DmFKBP39多,并且BmFKBP45比DmFKBP39多了一个碱性区域. 综上所述,BmFKBP45和DmFKBP39这2个蛋白除了氨基酸数目有差异外,整体上它们的结构是很相似的,推测家蚕BmFKBP45可能是果蝇中的DmFKBP39的同源蛋白,它们可能具有类似的功能. 研究表明,分子伴侣蛋白复合物主要包括肽基脯氨酰顺反异构酶(FKBP51、FKBP52和Cyp40)、分子伴侣(Hsp90和Hsc70)及分子伴侣相互作用蛋白(Hop、Hip和p23)等蛋白组分,具有辅助蛋白发生正确折叠或稳定蛋白复合体的作用[6,14-15]. BmFKBP45应该是一个肽基脯氨酰顺反异构酶. 但同时通过对BmFKBP45的序列分析发现,BmFKBP45具有一个位于C末端的PPIase结构域、核定位信号及潜在的DNA结合结构域(图1),这表明BmFKBP45在家蚕体内既可能是一个分子伴侣,还可能是一个调控基因转录的DNA结合蛋白. 通过对BmFKBP45基因进行RT-PCR检测和对BmFKBP45蛋白进行Western blot分析,这2个实验的结果显示BmFKBP45的表达在mRNA及蛋白质水平的变化情况一致,即在幼虫期高表达、蛹期低表达(图6),并且家蚕microarray分析也显示其在各个组织都有高水平的表达. BmFKBP45的表达没有明显的时期及组织特异性,与这个家族蛋白的广泛分布和组成型表达的特性一致. 但相对蛹期来说,其在家蚕幼虫期处于一个比较高的表达水平,这与ZHANG等[16]利用鸟枪法蛋白质分析并结合MS测序对家蚕翅原基组织的蛋白组分的分析结果相似. 幼虫期是家蚕向外界吸收营养(进食桑叶)的发育阶段,此时更容易受到外界病原体的入侵. 亲免蛋白BmFKBP45在幼虫期上调表达,可能与亲免蛋白家族蛋白的免疫调节功能有关[15]. 另外,家蚕幼虫处于生长比较旺盛的时期,体内大量合成蛋白质,需要分子伴侣蛋白复合物稳定或折叠大量合成的蛋白及其复合体. 随着家蚕翅原基的不断发育,特别是在蛹期后期,翅原基细胞增殖能力降低,细胞内合成蛋白质减少,所以对一些分子伴侣或核蛋白如BmFKBP45的需求逐渐降低. 这可能是BmFKBP45在幼虫期上调表达而在蛹后期下调表达的原因. 激素处理结果显示,BmFKBP45在体内的表达并没有受到这2种激素明显的诱导或者抑制(图7). 这说明BmFKBP45与DmFKBP39不一样,它的表达不受到激素的直接调控. 另一方面,对BmFKBP45的启动子进行分析发现,它含有5个热激因子(Heat Shock Factor,HSF)转录因子结合位点[17]. 当生物细胞受到热胁迫时,活化的热激因子HSF会识别并结合到热激蛋白Hsp基因的启动子区域的热激元件上,从而起始Hsp基因的转录. 有研究表明,当古生菌和细菌受到热胁迫时,FKBPs会迅速且大量地合成[18-20]. 因此,推测热胁迫促使HSF与BmFKBP45上的热激元件结合,从而激活BmFKBP45的转录. Bm6G1属于30K蛋白家族成员,目前研究表明这个蛋白家族主要在免疫防御、细胞凋亡及胚胎发育等过程中起着重要的作用. 在家蚕中,30K蛋白Bm6G1和Bm19G1能结合葡萄糖、葡聚糖及昆布二糖等糖分子,可能在启动家蚕免疫防御系统,抵抗外界真菌的侵染时发挥了关键的作用[21-22]. 将不含30K蛋白的家蚕血清及含30K蛋白的家蚕血清加入昆虫细胞培养液中,发现含30K蛋白的家蚕血清抑制细胞凋亡的能力更强[23]. 纯化的家蚕30K BmLPl重组蛋白也可以抑制昆虫或哺乳动物细胞发生凋亡. Bm6G1蛋白能与USP竞争结合EcR-B1,从而抑制了20E通过USP/ EcR-B1复合体所诱发的细胞凋亡[13]. 在家蚕胚胎的卵黄蛋白中,约35%是30K蛋白[11]. 随着胚胎的不断发育,胚胎中的30K蛋白质逐渐减少[24]. 而有研究表明30K蛋白可以被刚孵化的蚁蚕提取物中的30kP蛋白酶A降解[25],推测在家蚕胚胎发育的过程中,30K蛋白可能被30kP蛋白酶A降解成氨基酸小分子,为合成其他功能蛋白提供氨基酸来源[26],从而帮助胚胎的发育. 目前,对家蚕BmFKBP45的研究很少. SOMARELLI等[17]首次发现BmFKBP45可以与U1 snRNA结合,推测它参与前体mRNA的剪接加工. BmFKBP45含有谷氨酸/天冬氨酸片段及赖氨酸/精氨酸片段,它们交替出现,这种结构在核蛋白、FKBP25和FKBP46中起着介导蛋白质相互作用或者赋予蛋白结合核酸的功能[5,17,27]. 许多FKBPs蛋白是免疫抑制剂FK506和雷帕霉素的胞内受体,这些抑制剂通过结合FKBP12分别作用于钙调磷酸酶/NF-AT信号通路和雷帕霉素靶蛋白信号通路,抑制机体发生免疫反应[3-4]. FKBP38被RNAi后,导致抗凋亡因子Bcl-2的结构异常,推测FKBP38发挥了一个分子伴侣的作用,通过稳定Bcl-2的构象而参与细胞凋亡的调控过程[2]. 在果蝇中,DmFKBP39通过与DmChd64、DmEcR、DmUSP和DmMet等蛋白互作形成复合物,结合到DmJHRE1上从而调控JH应答基因的表达[8]. BmFKBP45与Bm6G1的相互作用尚未见报道,是本研究的新发现. 虽然尚不清楚两者相互作用的具体机理及功能. 对家蚕翅原基组织的蛋白组分分析及MS测序,发现BmFKBP45在家蚕幼虫期大量表达[24],这与本研究的结果一致(图 6). 幼虫期是家蚕向外界吸收营养(进食桑叶)的发育阶段,此时更容易受到外界病原体的入侵. 亲免蛋白BmFKBP45在幼虫期上调表达,可能与亲免蛋白家族的免疫调节功能有关[15]. Bm6G1作为家蚕的先天免疫系统中的模式识别受体,通过识别并结合葡聚糖等病原体模式分子激活家蚕体内的免疫应答[21]. 因此,我们推测BmFKBP45与Bm6G1结合后,可能共同参与免疫反应过程;另外,BmFKBP45含有NLS及能结合核酸的谷氨酸/天冬氨酸片段及赖氨酸/精氨酸片段[17],暗示其可能具有进核和结合核酸的能力. BmFKBP45与Bm6G1结合后,可能调节BmFKBP45结合DNA靶标元件的活性,或是阻止BmFKBP45迁移到核内,这些假设还有待实验证明. 第三,MsFKBP46能与MsEcR/MsUSP结合形成复合物[7];DmFKBP39也能与DmEcR/DmUSP结合,抑制了20E的信号传导途径[8];Bm6G1通过结合BmEcR从而抑制20E的信号传导途径[13]. MsFKBP46、DmFKBP39和Bm6G1都可以与EcR结合并参与激素的调控过程,说明30K蛋白、FKBPs蛋白和EcR有可能形成30K/FKBPs/EcR复合物从而在激素调控中发挥作用. 本研究已经证明了BmFKBP45与Bm6G1的相互作用,而它们能否与BmEcR结合及在激素调控中发挥作用还有待研究. BmFKBP45的表达不受到激素的影响,而Bm6G1的表达受到JH的抑制[28],说明这2个蛋白的相互作用可能会受到体内JH的抑制. [1] KAY J. Structure-function relationships in the FK506-binding protein (FKBP) family of peptidylprolyl cis-trans isomerases [J]. Biochemical,1996,314:361-385. [2] KANG C B,FENG L,CHIA J,et al. Molecular characterization of FK-506 binding protein 38 and its potential regulatory role on the anti-apoptotic protein Bcl-2 [J]. Biochemical and Biophysical Research Communications,2005,337:30-38. [3] KISSINGER C R,PARGE H E,KNIGHTON D R,et al. Crystal structures of human calcineurin and the human FKBP12-FK506-calcineurin complex [J]. Nature,1995,378:641-644. [4] FERRARESSO M,KAHAN B. Immunopharmacology of rapamycin [J]. EOS-Rivista Di Immunologia Ed Immuno-farmacologia,1992,12:252-255.[5] ALNEMRI E S,FERNANDES-ALNEMRI T,POMERENKE K,et al. FKBP46,a novel Sf9 insect cell nuclear immunophilin that forms a protein-kinase complex [J]. The Journal of Biological Chemistry,1994,269:30828-30834. [6] PRATT W B,TOFT D O. Steroid receptor interactions with heat shock protein and immunophilin chaperones[J]. Endocrine Reviews,1997,18:306-360. [7] SONG Q,ALNEMRI E S,LITWACK G,et al. An immunophilin is a component of the insect ecdysone receptor (EcR) complex [J]. Insect Biochemistry and Molecular Biology,1998,27:973-982. [8] LI Y,ZHANG Z,ROBINSON G E,et al. Identification and characterization of a juvenile hormone response element and its binding proteins [J]. Journal of Biological Chemistry,2007,282:37605-37617. [9] WU Y L,LI Q,CHEN X Z. Detecting protein-protein interactions by far western blotting [J]. Nature Protocols,2007,2(12): 3278-3284. [10]XIA Q Y. Silkworm genome database[DB/OL]. (2004-12-10)[2016-09-01]. http://silkworm.genomics.org.cn/. [11]ZHU J,INDRASITH L S,YAMASHITA O. Characterization of vitellin,egg-specific protein and 30 kDa protein fromBombyxeggs,and their fates during oogenesis and embryogenesis [J]. Biochimica et Biophysica Acta (BBA)-General Subjects,1986,882:427-436. [12]LOBLEY A,WARD S,MCGUFFIN L J. The PSIPRED protein sequence analysis workbench[CP/OL]. [2016-09-01]. http://bioinf.cs.ucl.ac.uk/psipred/. [13]KIM M Y,SONG H Y,KIM J H,et al. Silkworm 30K protein inhibits ecdysone-induced apoptosis by blocking the binding of ultraspiracle to ecdysone receptor-B1 in cultured Bm5 cells [J]. Archives of Insect Biochemistry & Physiology,2012,81(3):136-147. [14]HARDING M W,GALAT A,UEHLING D E,et al. A receptor for the immuno-suppressant FK506 is acis-transpeptidyl-prolyl isomerase [J]. Nature,1989,341:758-760. [15]HARRAR Y,BELLINI C,FAURE J D. FKBPs:at the crossroads of folding and transduction [J]. Trends in Plant Science,2001,6(9):426-431. [16]ZHANG Y L,XUE R Y,CAO G L,et al. Shotgun proteomic analysis of wing discs from the domesticated silkworm (Bombyxmori) during metamorphosis [J]. Amino Acids,2013,45:1231-1241. [17]SOMARELLI J,COLL J,VELANDIA A,et al. Characterization of immunophilins in the silkmothBombyxmori[J].Archives of Insect Biochemistry and Physiology,2007,65:195-209. [18]IDENO A,YOSHIDA T,FURUTANI M,et al. The 28.3 kDa FK506 binding protein from a thermophilic archaeum,Methanobacteriumthermoautotrophicum,protects the denaturation of proteinsinvitro[J]. European Journal of Biochemistry,2000,267:3139-3149. [19]IDENO A,YOSHIDA T,IIDA T,et al. FK506-binding protein of the hyperthermophilic archaeum,Thermococcussp. KS-1,a cold-shock-inducible peptidyl-prolylcis-transisomerase with activities to trap and refold denatured proteins [J]. Biochemical,2001,357:465-471. [20]SUZUKI R,NAGATA K,YUMOTO F,et al. Three-dimensional solution structure of an archaeal FKBP with a dual function of peptidyl prolylcis-transisomerase and chaperone-like actiities [J]. Journal of Molecular Biology,2003,328:1149-1160. [21]UJITA M,KIMURA A,NISHINO D,et al. Specific binding of silkwormBombyxmori30-kDa lipoproteins to carbohydrates containing glucose [J]. Bioscience,Biotechnology and Biochemistry,2002,66:2264-2266. [22]UJITA M,KATSUNO Y,KAWACHI I,et al. Glucan-binding activity of silkworm 30-kDa apolipoprotein and its involvement in defense against fungal infection [J]. Bioscience,Biotechnology and Biochemistry,2005,69: 1178-1185. [23]KIM E J,RHEE W J,PARK T H. Isolation and characteri-zation of an apoptosis-inhibiting component from the hemolymph ofBombyxmori[J]. Biochemical and Biophysical Research Communications,2001,285:224-228.[24]ZHONG B X,LI J K,LIN J R,et al. Possible effect of 30K proteins in embryonic development of silkwormBombyxmori[J]. Acta Biochimica et Biophysica Sinica,2005,37:355-361. [25]MAKI N,YAMASHITA O. Purification and characterization of a protease degrading 30kDa yolk proteins of the silkworm,Bombyxmori[J]. Insect biochemistry and molecular biology,1997,27:721-728. [26] 钟伯雄. 家蚕胚胎发育时期的蛋白质变化及构造分析[J]. 遗传学报,1999,26(6):627-633. ZHONG B X. Characterization and stage-specific change of proteins during the embryonic development of silkwormBombyxmori[J]. Journal of Genetics and Genomics,1999,26(6):627-633. [27]JIN Y J,BURAKOFF S J. The 25-kDa FK506-binding protein is localized in the nucleus and associates with casein kinase II and nucleolin [J]. Proceedings of the National Academy of Sciences,1993,90:7769-7773. [28]OGAWA N,KISHIMOTO A,ASANO T,et al. The homeo-domain protein PBX participates in JH-related suppressive regulation on the expression of major plasma protein genes in the silkworm,Bombyxmori[J]. Insect Biochemistry & Molecular Biology,2005,35(3):217-229. 【中文责编:庄晓琼 英文责编:李海航】 Expression and Functional Analysis of BmFKBP45 in the Silkworm, Bombyx mori CHEN Yuhui, HUANG Jinhua, FENG Qili*, DENG Huimin* (Guangzhou Key Laboratory of Development Regulation and Application Research of Insects, School of Life Sciences, South China Normal University, Guangzhou 510631, China) The expression and function of theDrosophilaDmFKBP39 homolog in the silkworm, BmFKBP45, were analyzed in this study. By comparing the amino acid sequences of DmFKBP39 and BmFKBP45, it is found that both of them contained an acidic amino acid region, a basic amino acid region, a nuclear localization signal and a FKBP domain. Alignment for the DNA binding domain of HMG2 with the second basic region of BmFKBP45 shows a similarity of 21%, suggesting that BmFKBP45 may be capable of DNA binding through the second basic amino acid region. However, EMSA experiment showed that BmFKBP45 did not bind to DmJHRE1. The RT-PCR and western blot results indicated that BmFKBP45 expressed at different developmental stages in the silkworm wing disc and its expression decreased gradually during the pupal period. The hormone treatment assays demonstrated that the expression of BmFKBP45 was not changed by either ecdysone (20E) or juvenile hormone (JH). The pull-down, far-western blot and Co-IP experiments indicated an interaction between BmFKBP45 and Bm6G1, which provides a new perspective for further exploring the function of BmFKBP45. Bombyxmori; BmFKBP45; immunophilin; ecdysone; juvenile hormone; 30K protein 2016-09-21 《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n 国家重点基础研究发展计划项目(“973计划”,2012CB114602);国家自然科学基金项目(31330071,31301918) Q986 A 1000-5463(2016)06-0001-12 *通讯作者:冯启理,教授,Email:qlfeng@scnu.edu.cn;邓惠敏,讲师,Email:denghuiminmin@163.com.











3 讨论
