(1,3)-β-D-葡聚糖检测对侵袭性真菌感染临床价值的再评价
2016-12-12夏吉荣牛司强曹炬
夏吉荣 牛司强 曹炬
(重庆医科大学附属第一医院检验科,重庆 400016)
·论著·
(1,3)-β-D-葡聚糖检测对侵袭性真菌感染临床价值的再评价
夏吉荣 牛司强 曹炬
(重庆医科大学附属第一医院检验科,重庆 400016)
目的 探讨 (1,3)-β-D-葡聚糖检测 (G试验)在侵袭性真菌病诊断中的价值。方法 回顾性研究重庆医科大学附属第一医院2014年1~6月间临床G试验的住院患者结果,分析G试验诊断真菌感染的敏感性、特异性、符合率、阳性预测值、阴性预测值、约登指数等能力指标。结果 真菌感染组G试验检测值228.4±250.1 pg/mL,非真菌感染组G试验检测值32.6±13.6 pg/mL,两组间有显著统计学差异 (P<0.001);G试验对真菌感染的敏感性、特异性、符合率、阳性预测值 、阴性预测值、约登指数分别为83%、92%、88%、89%、87%、0.75。结论 G试验是真菌感染的重要早期实验室指标之一,对其合理应用可有效提高真菌感染的诊治水平,特别是阴性结果对排除真菌感染的意义更大。
(1,3)-β-D-葡聚糖;G试验;侵袭性真菌病
[Chin J Mycol,2016,11(5):269-271]
近年来,(1,3)-β-D-葡聚糖检测 (G试验)作为侵袭性真菌病 (IFD)的实验室指标已在临床广泛应用[1-7],然而临床医生在G试验应用中,又常存在疑惑,如何才能将G试验检测结果有效应用于临床,是实验室和临床共同面临的问题。从目前的研究报道[1-7]来看,G试验对侵袭性真菌病诊断的灵敏性和特异性分别在30.4%~95.3%和50%~98%之间,各家报道的灵敏度和特异性差异较大,说明G试验受干扰因素较多;同时不同研究者对研究对象的选择及研究病例的数量差异也较大,病例多在30~400例之间。为进一步探讨G试验在IFD诊断中的临床价值,本文对我院2014年1~6月间临床疑为IFD的住院患者的G试验结果及相关临床资料进行了回顾性分析,发现G试验的阴性符合率很高,G试验阴性结果用于临床排出真菌感染的价值大于阳性结果价值,现将结果报道如下。
1 材料和方法
1.1 研究对象
回顾性研究重庆医科大学附属第一医院2014年1~6月间临床疑为IFD做G试验,并同时送检了真菌病原学检查的住院患者402例,其中男性268例,女性134例,平均年龄54.3岁,病例来自呼吸科、血液科、重症监护病房、神经内科,神经外科ICU,老年科、肾内科、感染科、肿瘤科、干细胞移植中心等。根据中国侵袭性真菌感染工作组2013年“血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则 (第四次修订版)”标准[8]:临床通过患者病史、患者危险因素、可能感染的临床特征、影像学检查、真菌培养和 (或)镜检、抗真菌药物治疗的有效性等,将病例分为两组:(1)真菌感染组 (IFD组),即确诊和临床诊断为侵袭性真菌病组,共183例,其中男125例,女58例,平均年龄55.2岁。(2)非真菌感染组 (非IFD组),即经临床最后排除非侵袭性真菌病219例,其中男142例,女77例,平均年龄52.9岁。若同一患者有多个G试验结果,选择与临床诊断时间点最接近的测试结果分析。
1.2 仪器与试剂
MB-80微生物动态快速检测系统,Tol智能恒温仪,GKT-10MSet动态真菌检测试剂盒和相应质控品,均由北京金山川科技发展公司提供。
1.3 检测方法
检测标本 用一次性无菌、无热原真空采集管采取静脉血3 mL,进行3 000 r/min离心10~15 min,分离血清,2 h内完成检测。不能及时检测的标本放置2~8℃冷藏,但不超过24 h。
标本前处理 取离心血清0.1 mL,加入装有0.9 mL样品处理液中,混匀后70℃孵育10 min,取出立刻放入冷却槽冷却5 min,为待测血清样品。
标本检测 用无热原的吸头取待测血清样品0.1 mL,加入至9 mm×65 mm无热平底试管中,再加入0.1 mL反应主剂溶液,混匀后插入MB-80微生物快速动态检测系统中进行反应,反应结束后检测系统自动计算出待测血清中 (1,3)-β-D-葡聚糖含量。
1.4 真菌病原学检查
本文筛选的病例为临床疑似真菌感染的402例患者,同时进行了G试验和真菌病原学检查。真菌培养或真菌涂片检查,标本包括血液、痰液、尿液、大便、胸腔积液、腹腔积液等,真菌培养及涂片的操作均按《全国临床操作规程 (第3版)》[9]进行。
1.5 统计分析
2 结 果
经确诊和临床诊断为侵袭性真菌病的183例中,无菌体液真菌培养结果阳性的37例;真菌培养为阳性,同时涂片发现有菌丝及孢子的痰液、尿液、大便等标本114例。经上述微生物确认的151例病例中,白念珠菌97例,热带念珠菌23例,光滑念珠菌12例,曲霉菌17例,其他真菌2例 (未鉴定)。经临床最后排除为非侵袭性真菌病的219例中,其中白念珠菌9例,热带念珠菌5例,光滑念珠菌3例。研究对象包括的主要临床疾病为:肺部感染、白血病、多发性骨髓瘤、非霍奇金淋巴瘤、肺恶性肿瘤、呼吸衰竭、脑梗死、蛛网膜下腔出血等。统计学分析表明,非真菌感染组和真菌感染组 (1,3)-β-D-葡聚糖检测结果水平有显著统计学意义,见表1。
以试剂盒说明书 (1,3)-β-D-葡聚糖<60 pg/mL为临床判断时,G试验诊断真菌感染的符合率见表2。
G试验对真菌感染诊断的能力分析:当以试剂盒说明书 (1,3)-β-D-葡聚糖<60 pg/mL为临床判断真菌感染时,G试验诊断的灵敏度为83%,特异性为92%,符合率为88%,阳性预测值为89%,阴性预测值为87%,约登指数为0.75。
表1 非真菌感染组和真菌感染组(1,3)-β-D-葡聚糖检测结果水平
Tab.1 The distribution of (1,3)-β-D-glucan test results in the non fungal infection and fungal infection
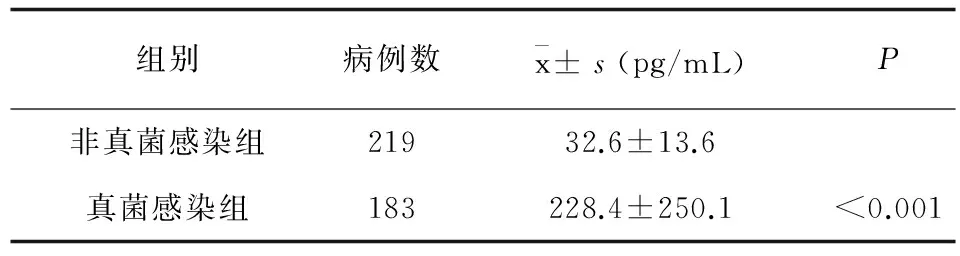
组别病例数x±s(pg/mL)P非真菌感染组21932.6±13.6真菌感染组183228.4±250.1<0.001
表2 (1,3)-β-D-葡聚糖对临床诊断真菌感染的符合率
Tab.2 The compliance rates of (1,3)-β-D-glucan on the clinical diagnosis of fungal infections
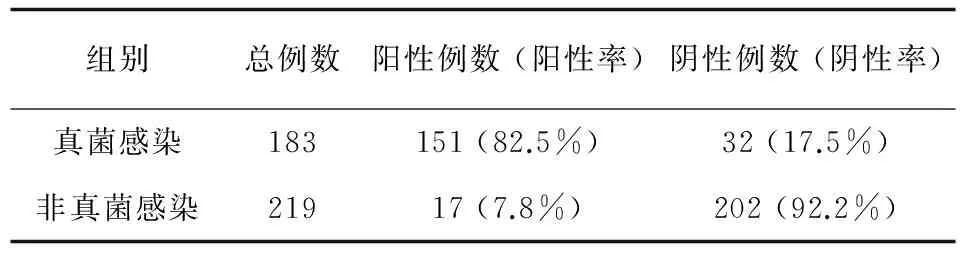
组别总例数阳性例数(阳性率)阴性例数(阴性率)真菌感染183151(82.5%)32(17.5%)非真菌感染21917(7.8%)202(92.2%)
3 讨 论
G试验作为真菌感染的早期实验室指标报道较多[1-7],本文表1显示,真菌感染组与非真菌感染组G试验结果有显著统计学意义 (P<0.001),G试验结果的合理应用能提高真菌感染的诊治水平;但G试验检测结果干扰因素又较多,易出现假阳性和假阴性,常给临床应用带来困惑。(1)检测方法本身的局限性影响检测结果的准确性:目前国内G试验检测的仪器试剂不够完善,检测结果的重复性较差,变异系数多大于10%,甚至有的达30%~50%。(2)检测血清中较多干扰物质可引起假阳性,如:使用纤维素膜进行血透,标本或患者暴露于纱布或其他含有葡聚糖的材料;静脉输注免疫球蛋白、白蛋白、凝血因子或血液制品;抗肿瘤药物;链球菌血症;操作者标本处理时污染等[10-13];部分细菌的干扰 (如葡萄球菌属细菌、铜绿假单胞菌和大肠埃希菌也可导致G试验假阳性的发生[14])。分析本文17例假阳性中,检测前使用过多种抗菌药物 (头孢菌素类、碳青霉烯类)或抗肿瘤药物,其中有8例患者使用过血液制品 (其中3例同时检出细菌);17例假阳性中检出有金黄色葡萄球菌3例,肺炎链球菌1例,铜绿假单胞菌5例,大肠埃希菌2例,未检出细菌的6例中,有3例在连续检测后G试验为阴性,可能与操作过程污染或实验方法不稳定有关。(3)G试验除假阳性外,假阴性也是临床应注意的问题,如G试验不能检测隐球菌和接合菌,使用某些抗真菌药物 (如卡泊芬净),标本放置时间过长等都可致假阴性;本文32例假阴性中有2例为隐球菌感染,做G试验前有16例使用了抗真菌药物治疗,假阴性可能与抗真菌药物本身干扰和治疗后真菌感染减轻致血清中 (1,3)-β-D-葡聚糖水平降低所致。对于这类病例临床医生可结合患者临床情况和微生物结果,通过抗真菌药物治疗效果加以真菌感染的判断。从本文G试验能力结果分析显示,G试验的特异性高达92%,说明G试验检测结果阴性意义明显高于G试验阳性检测结果,即G试验检测结果为阴性时可拟排除真菌感染;如G试验检测结果阳性,则应注意结合患者临床情况、真菌病原学结果和影像学结果等综合分析才可判断真菌感染;但当临床高度怀疑有真菌感染时,除连续检测G试验外,可对患者试用抗真菌药物后观察患者临床病情的变化,以此提高临床诊断的准确性,防止IFI的误诊误治。
要使G试验能在临床有效应用,实验室人员和临床医生需有效配合和沟通。实验结果显示,G试验的特异性很高,检测结果为阴性时可拟排除真菌感染;连续检测可降低真菌感染假阳性和假阴性,并以此监测疗效。
[1] 郑罡,余进,李雪迎,等.(1,3)-β-D-葡聚糖检测和半乳甘露聚糖抗原检测在侵袭性真菌病诊断中的价值探讨[J].中国真菌学杂志,2012,7(3):32-135.
[2] 廖红,李芳秋,张国勇.抗烯醇化酶抗体与 (1-3)-β-D-葡聚糖检测诊断侵袭性念珠菌病的临床比较[J].中国真菌学杂志,2014,9(5):272-274.
[3] Worasilchai N,Leelahavanichkul A,Kanjanabuch T,et al.(1→3)-β-D-glucan and galactomannan testing for the diagnosis of fungal peritonitis in peritoneal dialysis patients,a pilot study[J].Med Mycol,2015,53(4):338-346.
[4] Raggam RB,Fischbach LM,Prattes J,et al.Detection of (1,3)-β-D-glucan in same-day urine and serum samples obtained from patients with haematological malignancies[J].Mycoses,2015,58(7):394-398.
[5] 黄义泽,周东升,王谦.深部真菌感染的快速检测-G试验[J].中华医院感染学杂志,2014,24(1):255-257.
[6] AM Bal,GS Shankland,G Scott,et al.Antifungal step-down therapy based on hospital intravenous to oral switch policy and susceptibility testing in adult patients with candidaemia:a single centre experience[J].Int J Clin Pract,2014,68( 1):20-27.
[7] Ruta Petraitiene,Vidmantas Petraitis,John D.Bacher,et al.Effects of host response and antifungal therapy on serum and BAL levels of galactomannan and (1→3)-β-D-glucan in experimental invasive pulmonary aspergillosis[J].Med Mycol,2015,53(6),558-568.
[8] 中国侵袭性真菌感染工作组.血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则(第四次修订版)[J].中华内科杂志,2013,52(8):704-709.
[9] 叶应抚,王毓三,申子瑜.全国临床检验操作规程[M].第三版,人民卫生出版社,2007.
[10] Metan G,Agkus C,Nedret Koc A,et al.Does ampicillin-sulbactam cause false positivity of (1,3)-beta-D-glucan assay?A prospective evaluation of 15 patients without invasive fungal infections[J].Mycoses,2012,55( 4):366-371.[11] Duffner U,Abdel-Mageed A,Dahl K,et al.Serum (1,3)-β-D-glucan levels is not useful as a screeming test for recipients of an allogeneic HSCT while on immunoglobulin replacement[J].Bone marrow Transplant,2012,47 (1):151-152.
[12] Lo Cascio G,Koncan R,Stringari G,et al.Interference of confounding factors on the use of (1,3)-beta-D-glucan in the diagnosis of invasive candidiasis in the intensive care unit[J].Eur J Clin Microbiol Infect Dis,2015,34(2):357-365.
[13] Koo S,Bryar JM,Page JH,et al.Diagnostic performance of the(1,3)-beta-D-glucan assay for invasive fungal disease[J].Clin Infect Dis,2009,49 (11):1650-1659.
[14] 曹敏华.菌血症患者血浆(1,3)-β-D-葡聚糖检测意义探讨[J].国际检验医学杂志,2012,33(22):2802-2803.
[本文编辑] 卫凤莲
Re-evaluation of the clinical value of (1,3)-β-D-glucan detection in the invasive fungal infections
XIA Ji-rong,NIU Si-qiang,Cao Ju
(ThefirstaffiliatedhospitalofChongqingmedicaluniversity,Chongqing400016)
Objective To investigate the diagnostic value of (1,3)-β-D-glucan test (G test) in invasive fungal disease.Methods Retrospectively study the inpatient results of clinical G test from Jan.2014 to Jun.2014 at The First Affiliated Hospital of Chongqing Medical University and analyse the sensitivity,specificity,coincidence rate,positive predictive value,negative predictive value and Youden index of G test in fungal infection.Results The G test value of fungal infection group was 228.4±250.1 pg/mL,and the G test value of non-fungal infection group was 32.6±13.6 pg/mL.There were significant differences between the two groups (P<0.001).The sensitivity,specificity,coincidence rate,positive predictive value,negative predictive value and Youden index of G test in fungal infection were 83%,92%,88%,89%,87%,0.75,respectively.Conclusion G test is one of important early laboratory indexes in fungal infection,and the rational use of G test can effectively improve the diagnostic ability of fungal infection,especially for the negative exlusion.
(1,3)-β-D-glucan;G test;invasive fungal disease (IFD)
夏吉荣,男 (汉族),本科,副主任技师.E-mail:xjr196352@163.com
R 519
A
1673-3827(2016)11-0269-03
2015-11-28
