血浆蛋白可屏蔽人类循环中IgG抗体对凋亡细胞的反应活性
2016-12-12荣春书王伟刚郑宗宇高宝山
荣春书,连 鑫,王伟刚,郑宗宇,高宝山*
(1.长春中医药大学附属医院,吉林 长春130021;2.吉林大学第一医院,吉林 长春130021)
血浆蛋白可屏蔽人类循环中IgG抗体对凋亡细胞的反应活性
荣春书1,连 鑫2,王伟刚2,郑宗宇2,高宝山2*
(1.长春中医药大学附属医院,吉林 长春130021;2.吉林大学第一医院,吉林 长春130021)
目的 明确血浆蛋白影响循环中IgG抗体对凋亡细胞的反应性,并探索检测此类抗体活性的最佳条件。方法 分别检测纯化前及纯化后的IgG抗体对凋亡细胞的反应性。检测所用样本来源于:(1)10例发生移植肾抗体介导排异反应(AMR)患者的血浆样本;(2)从以上10例患者血浆中纯化的IgG抗体;(3)分泌IgG抗体的永生化B淋巴细胞克隆培养上清液;(4)从同一永生化B淋巴细胞克隆培养上清液中纯化的IgG抗体。结果 当IgG从血浆中纯化出来时,其对凋亡细胞的反应性显著增强。对于某些单克隆B细胞分泌的IgG抗体,只有将此抗体从细胞培养上清液中纯化,才能检测到其对凋亡细胞的反应性。而胎牛血清(FCS)可部分阻滞纯化IgG抗体对凋亡细胞的反应性。结论 当血浆蛋白存在时,循环中IgG抗体对凋亡细胞的反应性可被屏蔽。在检测此类抗体的活性时,有必要将其从血浆中纯化出来以提高检测的准确性。
多反应性抗体;凋亡细胞;蛋白;肾脏移植
(ChinJLabDiagn,2016,20:1892)
健康人群中具有凋亡细胞反应性的自然抗体以IgM为主,但此类抗体也可以IgG类型存在[1-4]。自然抗体的IgM类型具有重要的免疫调节特性,但通过类型转换产生的IgG的功能尚不清楚。在前期研究中,我们发现在肾移植患者中,与移植肾功能正常的患者相比较,经历抗体介导的移植肾排异反应(Antibody mediated rejection,AMR)的患者血浆IgG对凋亡细胞的反应性明显升高[5]。功能检测发现,此类IgG抗体可以激活补体途径,导致C4d沉积于凋亡细胞的表面。我们的研究结果提示,在生理条件下分泌自然抗体IgM的B淋巴细胞在AMR进程中可通过类型转换分泌IgG。正因为此类IgG有补体激活的特性,因此可能在疾病的病理过程中具有潜在作用。
在平行研究中,我们从一位AMR患者的血细胞中成功永生化了一系列B细胞克隆,通过对克隆的鉴定,我们发现多反应性克隆分泌的抗体可以与诸如DNA、LPS等结构毫不相关的抗原发生反应。在研究中偶然发现,从血浆样本中将IgG纯化后,其对凋亡细胞的反应性显著升高。因此我们假设,血浆蛋白对自然IgG抗体的活性起到了屏蔽作用,可以部分影响其对凋亡细胞的反应性。本研究中,我们应用多克隆及单克隆的自然抗体IgG来验证此假设,并旨在探寻检测人类血浆标本中自然IgG抗体的最佳条件。
1 资料与方法
1.1 一般资料
本研究所用血浆样本来源于:肾移植术后出现移植肾AMR的患者10例;所用外周血细胞来源于一位经历移植肾AMR的患者及健康志愿者。
1.2 方法
1.2.1 B淋巴细胞的分离及体外永生化
将液氮冻存的肾移植患者及健康志愿者外周血细胞复苏,CD19+(BD公司)磁珠将B淋巴细胞从外周血细胞中分离。将免疫纯化后的B淋巴细胞进行有限稀释,在96 孔V 底细胞培养板的每孔中加入50 μl 由EBV 转染的狨猴B95-8 细胞株培养上清液(其内含EBV),含50000个经5Gy 射线照射的Jurkat细胞做为支持细胞,并向每孔中加入CpG 2006(InvivoGen公司),最终浓度为2.5 μg/ml。定期更换细胞培养基,待细胞集落扩增后,收集细胞培养上清液待检测。通过检测最终获得具有多反应性的IgG抗体(克隆编号D8C6、D8H9、E17B2及E16F6),抗体浓度3-5 μg/ml。
1.2.2 血清IgG细胞培养上清液中IgG的纯化
将血浆与纯化缓冲液以1∶10混匀后加入预装有吸附胶体及滤膜的纯化容器(Thermo Scientific),6 000 rpm 离心2 min,通过滤膜落入Eppendorf试管中的即纯化后的IgG抗体。细胞培养上清液中的IgG抗体应用protein G 微球(NEB公司)纯化。1.2.3 血清及细胞培养上清液中IgG对凋亡细胞的反应性人类T淋巴细胞白血病Jurkat细胞株应用紫外线照射(240×10-3焦)并于37℃孵育箱内孵育20 h诱导凋亡,将分别从肾移植患者、健康志愿者血浆及细胞培养上清液中纯化的IgG抗体与1×106诱导凋亡后的Jurkat细胞株混匀,37℃孵育30 min,低温洗涤二次,分别向标本中加入FITC耦联的抗IgG的二抗(Invitrogen公司),40℃避光孵育30 min。低温洗涤二次,流式细胞仪(C6,BD)检测IgG对凋亡细胞的反应性。反应强度用平均荧光强度(MFI)表示。
1.2.4 统计学方法
数据统计采用GraphPad Prism 5.0统计软件,Student配对t检验用以比较纯化前IgG抗体及纯化后IgG抗体对凋亡细胞的反应性,P<0.05为差异具有统计学意义。
2 结果
2.1 纯化前后血浆IgG对凋亡细胞的反应性比较
我们检测了10位AMR肾移植患者纯化前血清及纯化后血清IgG对凋亡细胞的反应性。如图1所示,与纯化前血浆相比较,绝大部分血浆纯化后IgG对凋亡细胞的反应性显著升高(P=0.0321)。我们在实验中加入了胎牛血清(Fetal calf serum,FCS)来进一步验证血浆蛋白对IgG反应性的屏蔽作用。结果显示,以Pt.8为例,FCS对纯化IgG反应活性的屏蔽作用为剂量依赖性的(图2A)。当AMR患者纯化IgG中加入10%浓度的FCS后,大多数患者血浆IgG对凋亡细胞的反应性显著降低(P=0.0055)(图2B)。

图1 AMR患者血浆IgG及纯化后IgG对凋亡细胞的反应性
2.2 纯化前后细胞培养上清液IgG抗体对凋亡细胞的反应性比较
为进一步验证上述发现在单克隆细胞及抗体水平是否适用,我们首先检测了细胞培养上清液中纯化的IgG对凋亡细胞的反应性,如图3A所示,将自然抗体IgG从含有FCS的培养上清液中纯化后,其对凋亡细胞的反应性均有升高,而作为没有凋亡细胞反应性的对照克隆E16F6,抗体纯化后对凋亡细胞的反应性无明显变化。而且在单克隆的反应体系中加入FCS也能不同程度的屏蔽IgG对凋亡细胞的反应性(P=0.0674)(图3B)。
3 讨论
在既往研究中,我们报道了发生AMR的肾移植患者循环中多反应性IgG抗体可对多种抗原及凋亡细胞发生反应[5]。本研究中我们发现,当将IgG抗体从血浆中纯化后,其对凋亡细胞的反应性显著升高(P=0.0321),而将纯化的IgG抗体中再次加入FCS后,其对凋亡细胞的反应性则显著降低(P=0.0055)。因此我们根据实验结果推测,作为多反应性抗体可以识别的某些蛋白诸如牛血清蛋白,可能屏蔽多反应IgG对凋亡细胞的反应活性。
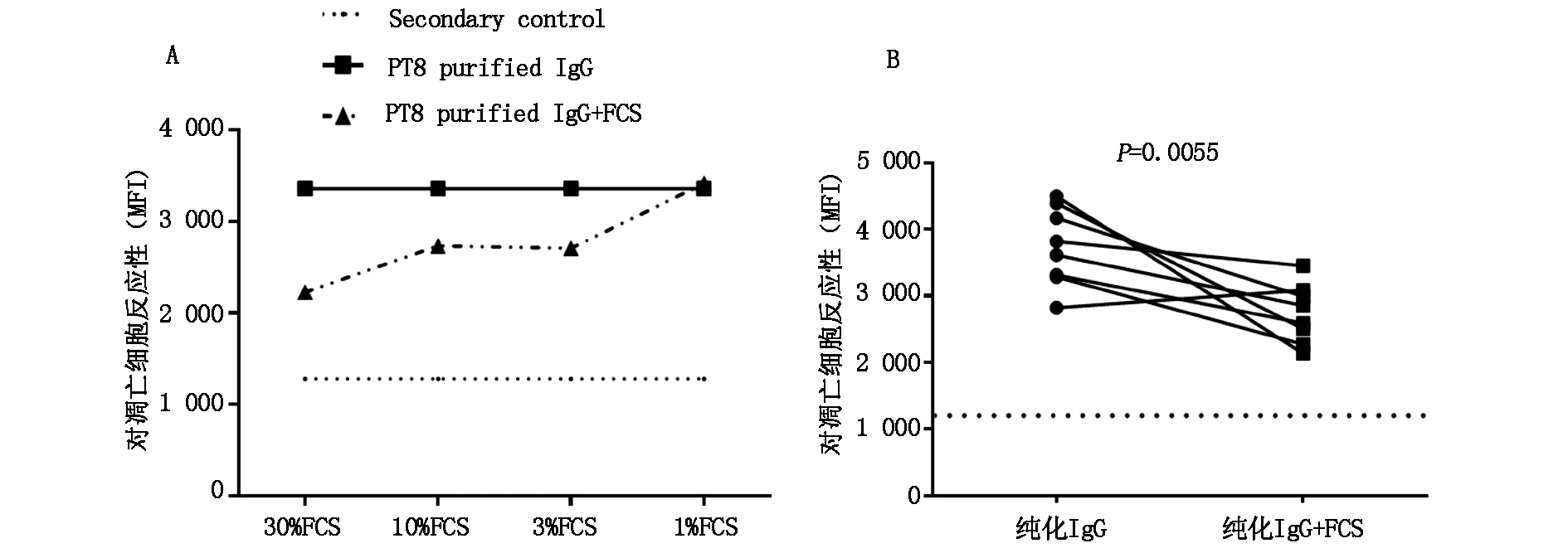
图2 (A)不同浓度FCS对Pt.8纯化IgG凋亡细胞反应性的影响;(B)AMR患者血浆纯化IgG及加入FCS后分别对凋亡细胞的反应性

图3 (A) B淋巴细胞培养上清液IgG纯化前及纯化后对凋亡细胞的反应性(B)B淋巴细胞培养上清液纯化IgG及加入FCS后分别对凋亡细胞的反应性
类似的发现曾被Spalter等学者报道[6],通过检测多反应IgG 对ABO抗原的反应性发现,未纯化血清中的IgG抗体对自身A或B抗原的反应性相对较低,而将IgG从同一份血清中纯化后,其对自身A或B抗原的反应性则显著升高。以往人们认为,健康个体血清中所包含的抗体仅对非表达于红细胞表面的血型抗原发生反应,而这个发现对此观点提出了挑战。Spalter及其他学者也通过研究发现,对血清IgG结合能力的调节取决于个体基因的差异[6-8],而自身反应性的IgM抗体可通过V区依赖的相互作用从而阻碍多反应性IgG与自身抗原的结合。
多反应性抗体普遍存在于健康人群的血清中,并主要以IgM形式存在。尽管多反应性IgM具有与自身抗原结合的能力,但此类抗体对健康个体并非有害。事实上,多反应性IgM可通过对凋亡细胞的结合及抑制炎症反应,从而可能在维持个体在稳定阶段的平衡起到至关重要的作用[9]。与此相反,在健康人群中很少能检测到多反应性IgG,此类抗体与诸如系统性红斑狼疮(Systemic lupus erythematosus,SLE)等自身免疫性疾病的病理过程密切相关,在这个病程中,凋亡细胞的清除过程可能受到干扰[10-12]。基于本研究的发现,由于人类血浆中多反应性IgG的活性可被部分血浆蛋白所屏蔽,因此所检测到的活性远远低于此类抗体的实际活性,故人类血浆中多反应性抗体IgG的活性可能被低估。我们建议在检测人类多反应性抗体IgG对凋亡细胞的结合能力及其功能时,有必要将此类抗体从血浆中纯化出来以提高对其检测的准确性。
[1]Peng Y,Kowalewski R,Kim S,et al.The role of IgM antibodies in the recognition and clearance of apoptotic cells[J].Mol Immunol,2005,42(7):781.
[2]Ehrenstein MR,Notley CA.The importance of natural IgM:scavenger,protector and regulator[J].Nat Rev Immuno,2010,10(11):778.
[3]Kaveri SV.Intravenous immunoglobulin:exploiting the potential of natural antibodies[J].Autoimmun Rev,2012,11(11):792.
[4]Kaveri SV,Silverman GJ,Bayry J.Natural IgM in immune equilibrium and harnessing their therapeutic potential[J].J Immunol,2012,188(3):939.
[5]Porcheray F,Fraser JW,Gao B,et al.Polyreactive Antibodies Developing Amidst Humoral Rejection of Human Kidney Grafts Bind Apoptotic Cells and Activate Complement[J].Am J Transplant,2013,13(10):2590.
[6]Spalter SH,Kaveri SV,Bonnin E,et al.Normal human serum contains natural antibodies reactive with autologous ABO blood group antigens[J].Blood,1999,93(12):4418.
[7]Adib M,Ragimbeau J,Avrameas S,et al.IgG autoantibody activity in normal mouse serum is controlled by IgM[J].J Immunol,1990,145(11):3807.
[8]Melero J,Tarrago D,Nunez-Roldan A,et al.Human polyreactive IgM monoclonal antibodies with blocking activity against self-reactive IgG[J].Scand J Immunol,1997,45(4):393.
[9]Chen Y,Park YB,Patel E,et al.IgM antibodies to apoptosis-associated determinants recruit C1q and enhance dendritic cell phagocytosis of apoptotic cells[J].J Immunol,2009,182(10):6031.
[10]Cabral AR,Alarcon-Segovia D.Autoantibodies in systemic lupus erythematosus[J].Curr Opin Rheumato,1998,10(5):409.
[11]Lee JY,Huerta PT,Zhang J,et al.Neurotoxic autoantibodies mediate congenital cortical impairment of offspring in maternal lupus[J].Nature Medic,2009,15(1):91.
[12]Zhang J,Jacobi AM,Mackay M,et al.Identification of DNA-reactive B cells in patients with systemic lupus erythematosus[J].J Immunol Methods,2008,338(1-2):79.
Circulating human IgG reactive to apoptotic cells are masked by plasma proteins
RONGChun-shu1,LIANXin2,WANGWei-gang,etal.
(1.TheAffiliatedHospitaltoChangchunUniversityofChineseMedicine,Changchun130021,China;2.TheFirstHospitalofJilinUniversity,Changchun130021,China)
Objective To confirm the influence of plasma proteins on the reactivity of circulating IgG to apoptotic cells and to develop an optimal methodology for studying these antibodies.Methods IgG reactivity to apoptotic cells was assessed before and after purification.The following sources of IgG were used:(1) Plasma specimens from 10 kidney transplant recipients with AMR;(2) purified IgG from the same 10 AMR patients;(3) supernatant from IgG-producing immortalized B cell clones;(4) purified IgG from the same B cell clone supernatants.Results Results Plasma IgG reactivity to apoptotic cells was dramatically increased following purification.We observed that reactivity to apoptotic cells could only be detected after purification for some monoclonal IgG produced by B cell clones.Fetal calf serum (FCS) partially reversed the apoptotic-binding potential of purified IgG.Conclusion The reactivity of circulating IgG to apoptotic cells is modified in the presence of plasma proteins.These antibodies must first be purified to remove plasma proteins in order to accurately assess their reactivity.
Polyreactive antibodies;Apoptotic cells;Protein;Kidney transplantation
吉林省科技发展计划资助项目(20160101100JC);吉林省卫生计生科研计划资助项目(2014Z042)
1007-4287(2016)11-1892-04
R392.4
A
2016-02-13)
*通讯作者
