外周血胃蛋白酶原在萎缩性胃炎与浅表性胃炎鉴别诊断中的临床价值
2016-12-12梁芬芬钟豪杰
袁 瑜,梁芬芬,钟豪杰
(广东药学院附属第一医院 消化内科,广东 广州510080)
外周血胃蛋白酶原在萎缩性胃炎与浅表性胃炎鉴别诊断中的临床价值
袁 瑜,梁芬芬,钟豪杰
(广东药学院附属第一医院 消化内科,广东 广州510080)
目的 明确胃蛋白酶原(PG)对慢性萎缩性胃炎及慢性浅表性胃炎鉴别诊断中的价值。 方法 2013年1月-2015年1月我院收治的慢性胃炎患者。依据胃炎种类的不同分为观察组(慢性萎缩性胃炎,58例)及对照组(慢性浅表性胃炎,54例)。检测两组患者外周血PG及相关炎症因子水平,并分析鉴别诊断价值。 结果 观察组患者外周血PG及INF-γ水平显著低于对照组(P<0.05),而IL-10水平显著高于对照组(P<0.05)。观察组患者外周血PG与INF-γ呈现显著正相关,而与IL-10呈现显著负相关(P<0.05)。ROC曲线分析显示,以92.14 μg/L为截点值,PG诊断慢性萎缩性胃炎的敏感性为93.10%,特异性为88.89%,曲线下面积为0.90,优于INF-γ及IL-10。 结论 PG在慢性浅表性胃炎及慢性萎缩性胃炎的鉴别诊断中具有一定价值。
慢性萎缩性胃炎;慢性浅表性胃炎;胃蛋白酶原;炎症因子;诊断
(ChinJLabDiagn,2016,20:1884)
慢性萎缩性胃炎的发病机制并不十分清楚,多数患者为慢性浅表性胃炎发展而来[1],而慢性萎缩性胃炎是胃癌的独立危险因素[2]。电子胃镜直视下取活检行病理学检查是鉴别这两种胃炎的可靠方法。但胃镜检查属于有创操作,有胃穿孔、出血等的风险。血胃蛋白酶原(PG)与慢性萎缩性胃炎关系密切[3]。本文分析PG在慢性萎缩性胃炎及慢性浅表性胃炎鉴别诊断中的价值。
1 资料与方法
1.1 研究对象
2013年1月-2015年1月我院收治的慢性胃炎患者。依据胃炎种类的不同分为观察组(慢性萎缩性胃炎,58例)及对照组(慢性浅表性胃炎,54例)。胃炎的诊断及分型依据电子纤维胃镜检查及病理学分析,诊断标准参考我国共识[4]。排除以下情况的患者:合并胃癌或其它组织起源的恶性肿瘤;合并胃部其它器质性病变;合并糖尿病等严重代谢性疾病;合并肝肾功能障碍。观察组男31例,女27例,平均年龄46.7±5.3岁,BMI平均22.7±1.5 kg/m2,其中有吸烟史者22例。对照组男32例,女22例,平均年龄45.9±4.9岁,BMI平均22.3±1.6 kg/m2,其中有吸烟史者24例。
1.2 方法
所以患者禁食12小时后抽取每位受试者外周血5 ml, PG、白介素-10(IL-10)、干扰素-γ(IFN-γ)、白介素-6(IL-6)及C-反应蛋白(CRP),均采用酶联免疫吸附法检测,试剂盒购置于R&D公司(USA),按试剂盒说明书操作。
1.3 统计学方法

2 结果
2.1 两组血液学指标的比较
如表1,观察组患者外周血PG及INF-γ水平显著低于对照组(P<0.05),而IL-10水平显著高于对照组(P<0.05)。
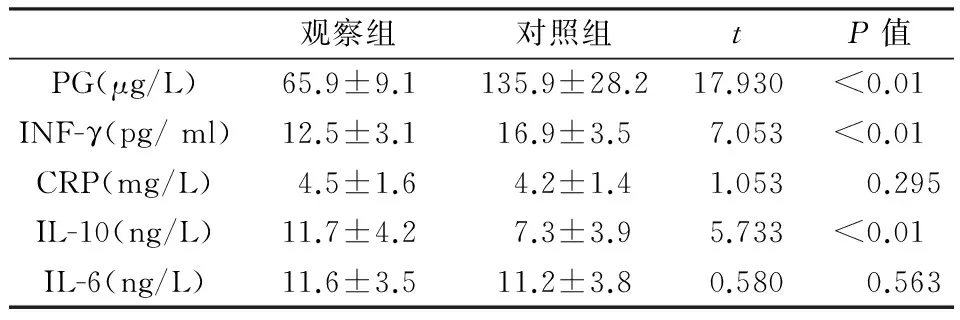
表1 两组血液学指标的比较
2.2 观察组PG与其它血液学指标间的相关性分析
如图1所示,观察组患者外周血PG与INF-γ呈现显著正相关,而与IL-10呈现显著负相关(P<0.05)。
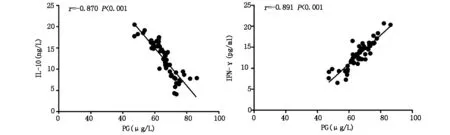
图1 观察组PG与其它血液学指标间的相关性分析
2.3 各项指标对胃炎的鉴别诊断价值分析
如表2及图2,ROC曲线分析显示,以92.14 μg/L为截点值,PG诊断慢性萎缩性胃炎的敏感性为93.10%,特异性为88.89%,曲线下面积为0.90,优于INF-γ及IL-10。
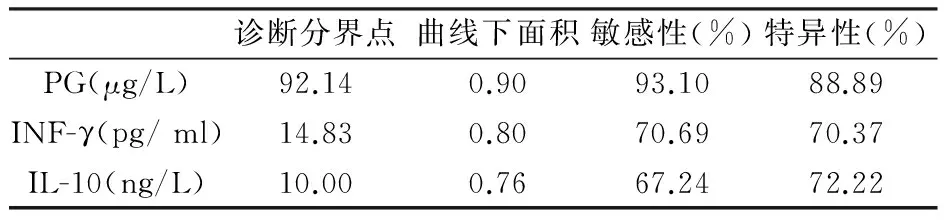
表2 各项指标对胃炎的鉴别诊断价值分析
3 讨论
慢性浅表性胃炎在我国的发病率较高,目前认为与幽门螺杆菌感染、不良饮食习惯及遗传易感等因素密切相关[5,6]。慢性萎缩性胃炎是在慢性浅表性胃炎的基础上发展而来[7]。胃镜检查对其诊断具有较高的准确性,但是胃镜检查具有创伤性,患者的接受程度较低,依从性差,难以作为疾病筛查及监测常用手段[3]。慢性萎缩性胃炎的病理改变及预后与普通胃炎相比具有较大的不同。患者胃黏膜在长期反复的损伤修复过程中表现出萎缩状态,可使黏膜下血管暴露,并伴有固有生理功能紊乱[8],及胃酸合成及分泌功能降低。PG是胃黏膜所分泌的蛋白类物质,大部分PG进入胃内用以辅助消化食物,但约有1%的PG进入血液[9,10]。因此外周血PG水平可反应胃黏膜分泌功能,可间接反应疾病进展情况。
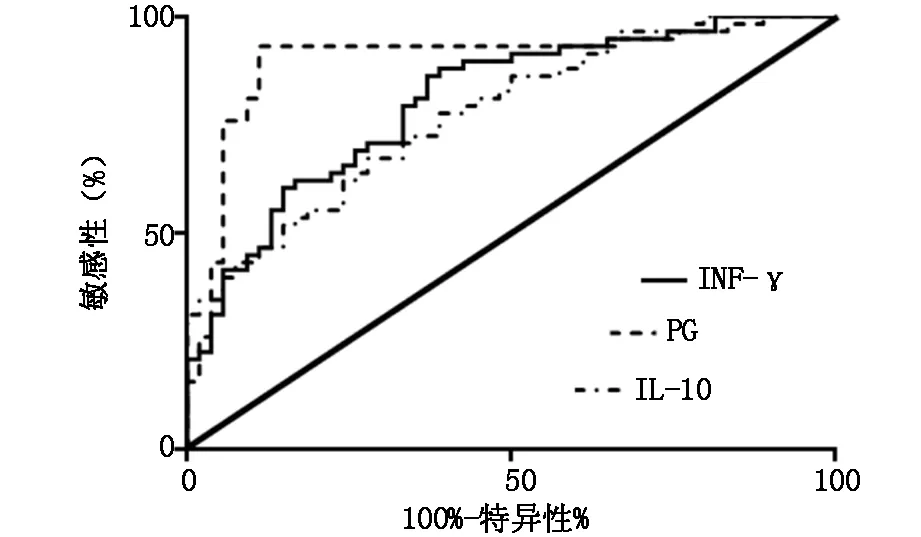
图2 各项指标对胃炎的鉴别诊断价值分析
本研究结果显示,观察组患者外周血PG水平显著降低,因为萎缩性胃炎主细胞和腺体数量的减少或伴有肠上皮化生是其主要病理改变,这可能是导致萎缩性胃炎PG分泌减少的主要因素之一[10]。同时我们发现观察组患者外周血INF-γ水平显著降低,而IL-10水平显著升高。INF-γ是由T淋巴细胞所分泌的一种具有免疫调节及抵抗病原微生物的细胞因子[11]。INF-γ水平的降低提示萎缩性胃炎患者可能存在局部或系统性的免疫功能缺陷。其原因可能来源于胃黏膜结构细胞的损伤或数量降低,而浅表性胃炎则因病灶局限于黏膜表层,其黏膜下实质细胞功能与结构相对完整。IL-10是一种抗炎细胞因子,主要由Th2淋巴细胞所分泌,而且IL-10能够抑制INF-γ等免疫因子的分泌[12]。同时我们还发现,观察组患者外周血PG水平与INF-γ呈现显著正相关,而与IL-10呈现显著负相关。既往研究均显示外周血PG水平降低是萎缩性胃炎的重要特征之一,且可一定程度代表疾病严重程度[10]。我们采用ROC曲线分析PG、INF-γ和IL-10对胃炎的鉴别诊断价值,结果显示PG以92.14μg/L为截点值,诊断慢性萎缩性胃炎的敏感性达到为93.10%,特异性为88.89%,曲线下面积为0.90,优于INF-γ及IL-10。说明外周血PG水平的检测对诊断慢性萎缩性胃炎的诊断具有较高的敏感性和特异性,对早期诊断慢性萎缩性胃炎诊断及预防干预具有重要意义。
[1]Vannella L,Lahner E,Annibale B.Risk for gastric neoplasias in patients with chronic atrophic gastritis:a critical reappraisal[J].World J Gastroenterol,2012,18(12):1279.
[2]Chung SH,Lee KJ,Kim JY,et al.Association of the Extent of Atrophic Gastritis With Specific Dyspeptic Symptoms[J].J Neurogastroenterol Motil,2015,21(4):528.
[3]Kim EH,Kang H,Park CH,et al.The optimal serum pepsinogen cut-off value for predicting histologically confirmed atrophic gastritis[J].Dig Liver Dis,2015,47(8):663.
[4]中华中医药学会脾胃病分会.慢性萎缩性胃炎中医诊疗共识意见(2009,深圳)[J].中国中西医结合消化杂志,2010,18(5):345.
[5]Pittman ME,Voltaggio L,Bhaijee F,et al.Autoimmune Metaplastic Atrophic Gastritis:Recognizing Precursor Lesions for Appropriate Patient Evaluation[J].Am J Surg Pathol,2015,39(12):1611.
[6]Chen P,Cui Y,Fu QY,et al.Positive relationship between p42.3 gene and inflammation in chronic non-atrophic gastritis[J].J Dig Dis,2015,16(10):568.
[7]Kuipers EJ.Pernicious Anemia,Atrophic Gastritis,and the Risk of Cancer[J].Clin Gastroenterol Hepatol,2015,13(13):2290.
[8]Jing JJ,Sun LP,Xu Q,et al.Effect of ERCC8 tagSNPs and their association with H.pylori infection,smoking,and alcohol consumption on gastric cancer and atrophic gastritis risk[J].Tumour Biol,2015,36(12):9525.
[9]Eun BS,Hoon LJ,Soo PY,et al.Decrease of serum total ghrelin in extensive atrophic gastritis:comparison with pepsinogens in histological reference[J].Scand J Gastroenterol,2016,51(2):137.
[10]Massarrat S,Haj-Sheykholeslami A.Increased Serum Pepsinogen II Level as a Marker of Pangastritis and Corpus-Predominant Gastritis in Gastric Cancer Prevention[J].Arch Iran Med,2016,19(2):137.
[11]Zhang W,Shen ZY,Song HL,et al.Protective effect of bone marrow mesenchymal stem cells in intestinal barrier permeability after heterotopic intestinal transplantation[J].World J Gastroenterol,2014,20(23):7442.
[12]Li J,Wang Z,Mao K,et al.Clinical significance of serum T helper 1/T helper 2 cytokine shift in patients with non-small cell lung cancer[J].Oncol Lett,2014,8(4):1682.
The differential diagnosis value of serum pepsinogen for chronic Gastritis
YUANYu,LIANGFen-fen,ZHONGHao-jie.
(DepartmentofGastroenterology,theFirstAffiliatedHospitalofGuangdongPharmaceuticalUniversity,Guangzhou510080,China)
Objective Our study was aimed to analyze the differential diagnosis value of serum pepsinogen (PG) for chronic gastritis.Methods Clinical data of patients with chronic gastritis received treatment at our hospital from 2013 to 2015 were analyzed.Patients were divided in to different types of gastritis,Group A:Chronic atrophic gastritis,Group B:Chronic superficial gastritis.Results A total of 112 cases were analyzed,Group A 58 cases,Group B 54 cases.Group A patients had higher level of IL-10 than that of Group B patients,the difference was statistically significant (P<0.05).Group A patients had lower levels of INF-γ and PG than these of Group B patients,the difference were statistically significant (P<0.05).Correlation analysis showed that,for Group A patients,the levels of PG had significant positive correlation with INF-γ but significant negative correlation with IL-10 (P<0.05).ROC analysis showed that the PG cut-off point value of 92.14 μg/L,as used for the diagnosis of chronic atrophic gastritis,provided a sensitivity of 93.10%,a specificity of 88.89%,better than these of IL-10 and INF-γ.Conclusion The level of PG decreased significantly in patients with chronic atrophic gastritis,which can be used as an auxiliary diagnosis marker for differential diagnosis with chronic superficial gastritis.
Chronic atrophic gastritis;Chronic superficial gastritis;Pepsinogen;Inflammatory factor;Diagnosis
1007-4287(2016)11-1884-03
R735.2
A
袁瑜(1972-),男,副主任医师,研究方向:消化道早期肿瘤的诊断和治疗。
2016-02-18)
