hTERT基因沉默对乳腺癌细胞生物学特性及COX-2表达的影响
2016-12-12于宏建赵世铭马洪奎
于宏建,赵 杨,赵世铭,马洪奎,李 光
(1.天津市津南区咸水沽医院 检验科,天津300350;2.天津医科大学基础医学院)
hTERT基因沉默对乳腺癌细胞生物学特性及COX-2表达的影响
于宏建1,赵 杨1,赵世铭1,马洪奎1,李 光2
(1.天津市津南区咸水沽医院 检验科,天津300350;2.天津医科大学基础医学院)
目的 本研究探讨hTERT基因沉默后对乳腺癌细胞生物学特性及环氧化酶-2(COX-2)的影响。方法 设计合成特异性针对hTERT mRNA的siRNA,电转染入乳腺癌细胞,以致目的基因沉默。应用RT-PCR及Western blot法检测沉默hTERT基因后乳腺癌MCF-7细胞的mRNA及蛋白的表达状况;应用流式细胞仪检测细胞周期;并通过CCK-8 增殖实验检测沉默hTERT基因后乳腺癌MCF-7细胞的增殖能力;经小室侵袭实验检测沉默hTERT基因后乳腺癌MCF-7细胞的侵袭能力。利用免疫组织化学法检测COX-2蛋白的表达。结果 hTERT基因沉默48 h后,hTERT转染组在沉默hTERT基因后乳腺癌MCF-7细胞的mRNA及蛋白表达呈现明显降低(P<0.05);细胞周期检测结果示乳腺癌MCF-7肿瘤干细胞停滞在G0/G1周期,S期的细胞数目减低,三组比较统计学差异明显(P<0.05);CCK-8 增殖实验结果表明乳腺癌MCF-7肿瘤干细胞在hTERT转染组的增殖得到显著抑制(P<0.05);小室侵袭实验结果表明,hTERT转染组穿过滤膜的细胞数量明显减少(P<0.05);免疫组织化学法检测结果显示,COX-2蛋白在hTERT转染组的表达明显降低,并与hTERT基因的表达相关联。结论 hTERT基因沉默后对乳腺癌细胞的增值和迁移能力均有影响,并能降低COX-2蛋白的表达,从而改善乳腺癌患者预后。
乳腺癌;hTERT基因;基因沉默;COX-2
(ChinJLabDiagn,2016,20:1817)
乳腺癌发病率位居女性恶性肿瘤的第一位,严重危害妇女同志健康[1-3]。研究发现hTERT基因与COX-2在乳腺癌的发病机制中发挥作用,hTERT表达量升高,能促使端粒酶活性增强,延长端粒、恢复端粒功能,进而使染色体稳定并免受末端降解酶的影响,促使细胞无限制的分裂、增殖,使乳腺癌得以发生发展[4-6]。COX-2可以在多种细胞因子的作用下呈高表达,正常组织细胞表达很少,在肿瘤或炎症等病理反应,大量存在。研究发现COX-2在多种人类恶性肿瘤及癌前病变有高表达,这为肿瘤的防治贡献了新思路[7-9]。本研究旨在观察将HTERT基因沉默电转染乳腺癌MCF-7细胞后,对乳腺癌细胞生物学特性及COX-2的影响。
1 材料与方法
1.1 材料
1.1.1 细胞株
人乳腺癌MCF-7细胞购自于中国医学科学院。将细胞株在37℃,5%CO2,常规培养于含10%灭活的新生小牛血清中(100 u/ml青霉素、100 U/llll链霉素的RIPMl640培养液中)。
1.1.2 主要试剂与仪器
见表1。
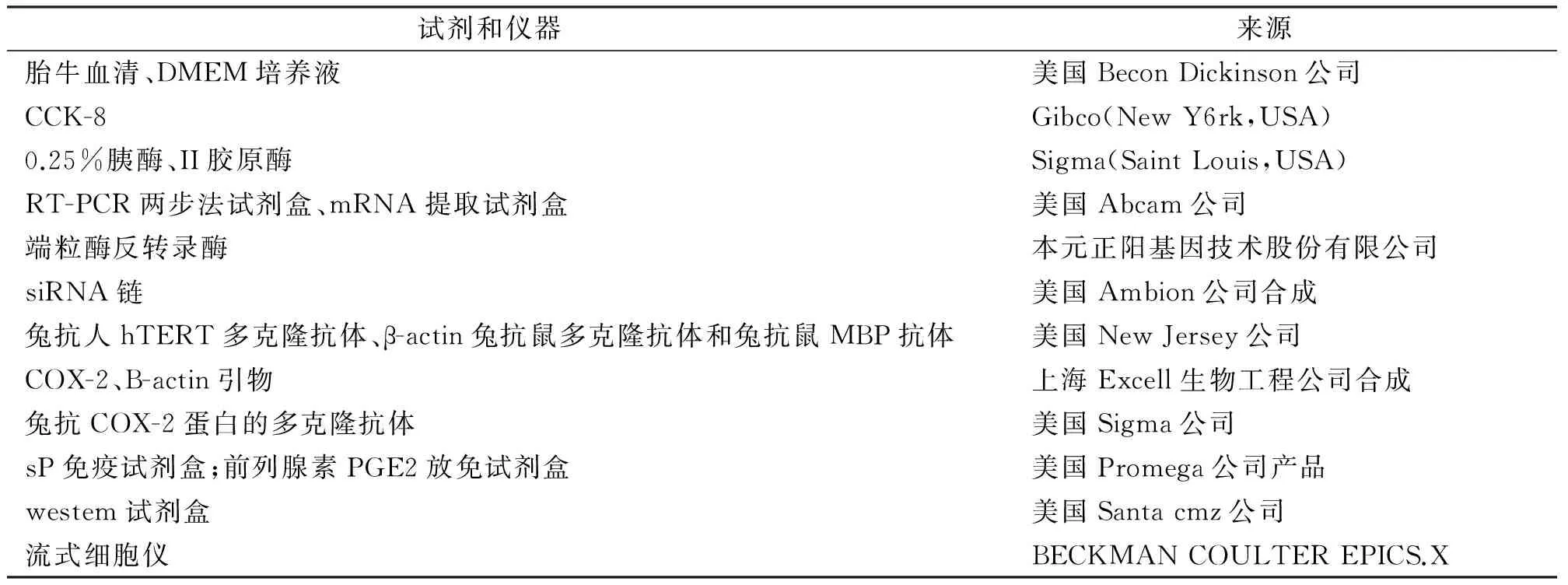
表1 主要试剂和仪器
1.2 方法
1.2.1 siRNA设计、合成及MCF-7细胞的电转染
设计合成特异性针对hTERT mRNA的siRNA,由美国Ambion公司设计合三对siRNA:siRNA正义链为:5’-GGAACACCAAGAAGUUCAU-TT-3 7(1521-1539);反义链为:5 7-AUGAACUUCUUGGUGUUCC-TT-37,将其克隆入pGenesil-1.1质粒中,重组成hTERT mRNA-siRNA的表达载体,产生RNA干扰作用,以致目的基因沉默。
电转染乳腺癌MCF-7细胞:将处于对数生长期的细胞,制成单细胞悬液,利用PBS清洗并经胰酶消化,离心后重悬于电转液中。 将转染后的hTERT- MCF-7细胞,放置于室温30 min,细胞移入DMEM培养基,含10%小牛血清,1%双抗的培养皿中,37℃、5%CO2孵箱内培育。于转染后48h将培养板于荧光显微镜下观察转染效率,并进行RNA干扰效应的检测。
1.2.2 细胞实验分组
hTERT基因沉默后,乳腺癌MCF-7细胞转染时分为3组:hTERT转染组(转染pGenesil-1.1-hTERT-siRNA载体者);空载质粒组(转染pGenesil-1.1组);未转染组(MCF-7组);于转染后48 h行RNA干扰效应的检测。
1.2.3 RealTime RT-PCR检测转染MCF-7细胞hTERT mRNA的表达
采用TRIzol法提取总RNA后参考文献[9],以0.8%的琼脂糖凝胶进行电泳并观察RNA的完整性。根据cDNA合成试剂盒说明书逆转录合成cDNA,设计引物序列为:上游引物:5-CTGAAGTGTCACAGCCTGTTT-3,下游引物:5-CACACATGCGTGAAACCTGTA-3,产物大小:111 bp;内参β-actin上游引物:5-TATCGGACGCCTGGTTAC-3,下游引物:5-CTCAGCCTTGACTGTGCC-3,产物大小:151 bp。PCR扩增产物取5 ml进行电泳,电泳后应用Image-Pro Plus8.0软件分析hTERT的条带与β-actin条带的相对灰度比值。
1.2.4 Westem blot检测转染MCF-7细胞hTERT蛋白的表达
提取总蛋白经BCA法测定蛋白质浓度,吸取50 μg总蛋白,去离子水补至20 μl,入等体积2×上样缓冲液调整蛋白浓度至1 mg/ml,99 ℃ 变性10 min,离心30 s;同时加入蛋白质分子量标准品进行电泳;电转移印迹到PVDF膜上,观察膜上有蛋白分子量标准条带,标记正反面;封闭液中孵育1 h。加入1∶1000稀释的HTERT一抗4℃过夜。TBST洗膜5 min,共3次。加入1∶5000 HRP标记的二抗及GAPDH,37℃孵育2 h。PBS洗涤3次,每次10min,用辣根过氧化物酶染色,避光静置1 min,暗室曝光X 光片,将膜置入仪器中成像,分析结果。
1.2.5 流式细胞仪检测细胞周期
于转染48 h后收集各组MCF-7细胞,4℃预冷,调整细胞浓度为1×106/L,置入含50 μg/ml RNA 酶的Tris-HCL缓冲液(pH7.4)中共同孵育30 min。用流式细胞仪检测,并采用其附带软件对MCF-7细胞的DNA含量分布进行分析,并计算出各个周期细胞的百分率,实验重复进行3次。
1.2.6 CCK-8实验检测MCF-7的增殖能力
收集对数生长期MCF-7细胞,以1×103个/每孔接种细胞于96孔板中,并设6个复孔在每组,培育24 h后,于转染后1-4 d天,每天各取一96孔板经CCK-8试剂室温融化,加入CCK-820 μl置于每孔里,行CCK-8法检测细胞增殖情况。并进行数据处理分析。绘制对细胞生长影响的各组曲线图,并计算出细胞的生长抑制率。
1.2.7 小室侵袭实验检测MCF-7侵袭能力
以50 μg/孔在聚碳酸酯微孔滤膜上铺Matrigel,加入10%的胎牛血清在聚合好的小室下室中作为条件培养液,将上述3组处理过的G666-1细胞悬液100 μl(3×105/L)加入上室中,经培育箱中培育24小时,利用棉签轻轻刮除滤膜上室面未穿过的G666-1细胞,再采用95%乙醇固定5 min,采取PBS清洗小室,等待其自然凉干后,封片;干燥后光镜下记数5个视野的侵袭细胞数,并计算出其平均值。
1.2.8 免疫组化法检测COX-2蛋白的表达
利用免疫组化S-P 法检测COX-2蛋白的表达:实验步骤严格按照试剂盒说明操作。石蜡切片脱蜡,用75%酒精室温下浸泡 5 min,清水反复冲洗2 min,再用PBS 洗涤3 min,已清除内源性过氧化物酶。经抗原修复后放置于室温下培育15 min经PBS洗涤后弃掉PBS 液,滴加三抗于每张切片上,室温下培育20 min。于显微镜下观察细胞核的显色。结果应用双评分半定量法进行评分。
1.2.9 统计学处理
2 结果
2.1 RT-PCR检测HTERT siRNA抑制hTERT mRNA的表达
hTERT因沉默48h后,与空载质粒组及未转染组相比较,hTERT转染组HTERT基因沉默后的乳腺癌MCF-7细胞的mRNA的条带明显变窄,表明mRNA的表达明显降低,统计学差异明显(P<0.05)。hTERT转染组与空载质粒组比较,hTERT转染组与未转染组(MCF-7组)比较,差异均有统计学意义,见图1。
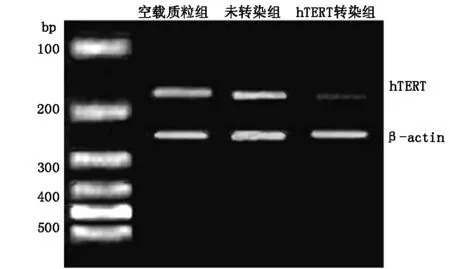
图1 RT-PCR检测MCF-7细胞中HTERT mRNA的表达
2.2 Westem blot检测siRNA 抑制 HTERT 蛋白的表达
HTERT因沉默48 h后,与空载质粒组及未转染组相比较,hTERT转染组HTERT基因沉默后的乳腺癌MCF-7细胞的HTERT蛋白条带明显变窄,表明HTERT蛋白的表达有明显降低,统计学差异明显(P<0.05)。hTERT转染组与空载质粒组比较,hTERT转染组与未转染组(MCF-7组)比较,差异均有统计学意义,见图2。
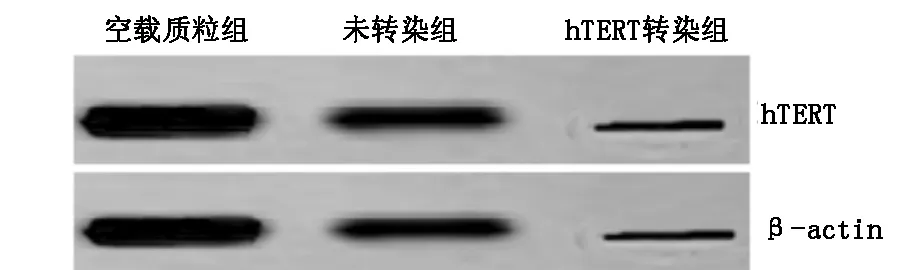
图2 Western blot检测MCF-7细胞中HTERT protein的表达
2.3 流式细胞仪检测细胞周期
流式细胞仪检测结果显示,乳腺癌MCF-7肿瘤干细胞在G0/G1周期略有增加,S期的细胞数目减低,M期细胞无明显变化,hTERT转染组与空载质粒组比较,hTERT转染组与未转染组(MCF-7组)比较,差异均有统计学意义。说明MCF-7细胞有明显的S期阻滞(表2)。

表2 乳腺癌MCF-7肿瘤干细胞周期的变化
和未转染组、空载质粒组比较,aP<0.05
2.4 CCK-8增殖实验检测结果
通过CCK-8法分别测得各组MCF-7细胞的A450(OD)值。结果表明乳腺癌MCF-7细胞在hTERT转染组的增殖得到显著抑制,与空载质粒组及未转染组比较,统计学差异明显(P<0.05);见表3。

表3 各组乳腺癌MCF-7细胞的A450(OD)
和未转染组、空载质粒组比较,aP<0.05
2.5 小室侵袭实验检测结果
小室侵袭实验结果示,与空载质粒组、未转染组穿过滤膜的细胞数量比较,(46.12±1.20)和(45.17±2.02);hTERT转染组穿过滤膜的细胞数量明显减少(26.14±0.34),统计学差异明显(P<0.05)。见图3。
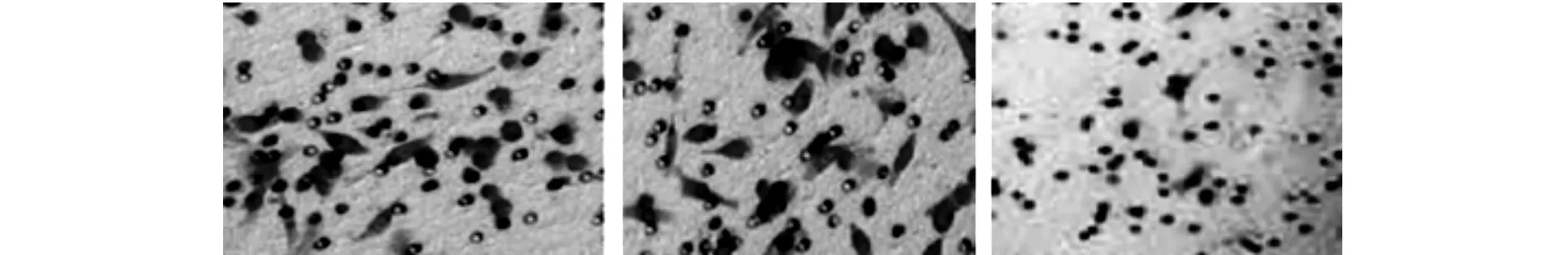
图3 hTERT转染组穿过滤膜的细胞数量较空载质粒组和未转染组明显减少(P<0.05).
2.6 免疫组化法检测COX-2蛋白表达
免疫组化S-P 法检测COX-2蛋白的表达结果显示,未转染组COX-2呈现强表达;空载质粒组呈现强表达;hTERT转染组呈弱表达,见图4。

图4 COX-2基因阳性表达率
3 讨论
乳腺癌的复发率及转移率在全世界范围内均较高,它的发生、发展是一个多因素的复杂过程。目前的研究认为乳腺癌的发生、发展是环境与遗传因素共同作用的结果[10-12]。现阶段的研究发现,乳腺癌肿瘤起始的源泉就是肿瘤干细胞,肿瘤干细胞在维持肿瘤的生长、转移及促进血管生成中发挥了决定性作用,肿瘤干细胞可以在化疗后继续存留,且不受外界影响进行恶性增殖和多向分化,最终发展为新的肿瘤进而致使癌症复发。另有研究发现,乳腺癌干细胞的迁移性增强是导致乳腺癌转移的重要原因。因此抑制乳腺癌细胞的增值及迁移是治疗乳腺癌的关键步骤。
端粒酶是一种维持端粒长度的反转录酶,hTERT是端粒酶的催化亚单位,是能以RNA为模板反转录合成端粒酶,具有多重生物学效应。 正常组织hTERT表达是被抑制的,但在肿瘤、癌细胞系中却呈现高表达。研究发现hTERT基因经电转染可以取得有效而持久的作用。有实验研究发现,用电穿孔法转染基因,发现目的基因瞬时表达率高于脂质体转染方法,因此电转染法可作为一个简单可行、有效的方法[13,14]。本研究通过设计合成特异性针对hTERT mRNA的siRNA,沉默HTERT基因后,经改良的电转染法,转染乳腺癌MCF-7细胞,检测结果中观察到HTERT mRNA和蛋白的表达量均下降,提示HTERT基因沉默可以改善乳腺癌预后。
环氧化酶(COX-2)是前列腺素合成过程的一个主要限速酶,正常组织细胞中较少发现,当受各种因素刺激时可表达增强,COX-2参与肿瘤的发生和发展。在静息细胞内检测不到,只有当细胞接受相应的刺激才开始合成。本实验采用免疫组化sP法检测乳腺COX-2的阳性表达,结果显示:未转染组及空载质粒组呈现强表达而hTERT转染组呈弱表达,与文献报道基本一致[15]。结果表明COX-2蛋白表达与乳腺癌的发生、发展有关。等人的研究结果证明了COX-2高表达患者的预后均较差。
本研究采用沉默HTERT基因后,用设计、合成的特异性针对hTERT mRNA的siRNA对MCF-7细胞进行电转染,流式细胞仪检测结果显示,在hTERT转染组的乳腺癌MCF-7细胞周期在G0/G1期略有增加,S期的细胞数目减低,M期细胞无明显变化,提示MCF-7细胞出现明显的S期阻滞;通过CCK-8 增殖实验检测结果表明了乳腺癌MCF-7细胞在hTERT转染组的增殖得到显著抑制;小室侵袭实验结果示hTERT转染组的侵袭能力受到抑制。综上所述,通过HTERT siRNA可以明显抑制乳腺癌MCF-7细胞的增殖及侵袭能力,能使细胞的活力下降,转染后细胞生长被抑制。因此认为沉默HTERT基因与COX-2的弱表达可能有关,COX-2可能是乳腺癌端粒酶激活和调节的机制之一,这为乳腺癌的靶向治疗提供了新的思路。
[1]胡凡果,只向成,史玉荣,等.人端粒酶逆转录酶shRNA抑制乳腺癌T47D细胞增殖活性的研究[J].中华实验外科杂志,2013,30(4):667.
[2]Fokas E,Weiss C,R del C.The role of radiotherapy in the multimodal management of esophageal cancer[J].Dig Dis,2013,31(1):30.
[3]Hoesel B,Schmid J A.The complexity of NF-kappaB signaling in inflammation and cancer[J].Mol Cancer,2013,12(86.10):1186.
[4]张艳君,刘彩刚.乳腺癌教育项目对乳腺癌筛查知识及参加意愿的影响[J].中国实用护理杂志,2014,30(3):18.
[5]杨媛媛,王 燕.个案管理模式在乳腺癌患者中[J].中国实用护理杂志2014,30(10):71.
[6]TianY,Han X,Tian DL.The biological regulation of ABCE1[J].IUBMB Life,2012,64(10):795.
[7]杨 俊,辛云辉.临床护理路径在乳腺癌手术患者健康教育中的应用[J].中国实用护理杂志,2014,30(12):28.
[8]Kargi A,Uysal M,Bozcuk H,et al.The importance of COX-2 expression as prognostic factor in early breast cancer[J].Journal of the Balkan Union of Oncology,2013,18(3):579.
[9]沈 娜,何文山,赵 月,等.转化生长因子-β1及p21对乳腺癌干细胞的作用[J].中华实验外科杂志,2012,29(5):815.
[10]Chen X,Hu,Z,Wang,W.,etc.Identification of ten serulTl microRNAs from a genome-wide serum microRNA expression profile as novel noninvasive biomarkers for nonsmall cell lung cancer diagnosis[J].Int J Cancer,2012,130(7):1620.
[11]Wang X,Liang Y,Wang J,et al.Effect of NS-398,a cyclooxygenase-2 selective inhibitor,on the cytotoxicity of cytotoxic T lymphocytes to ovarian carcinoma cells[J].Tumor Biology,2013,34(3):1517.
[12]李莎莎,盛 俊,苑占娜,等.瘦素诱导乳腺癌细胞中端粒酶反转录酶表达的机制[J].中华医学杂志,2012,92(34):2386.
[13]霍慧霞,柳晓义,姜丹丹,等.乳腺癌与载脂蛋白B基因多态性关系[J].中华实验外科杂志,2012,29(5):812.
[14]沈小英.健康教育路径对提高乳腺癌患者围手术期安全性的效果评价[J].中国实用护理杂志,2012,28(12):40.
[15]Zhu,Q,Wang,Z,Hu,Y,et al.miR-21 promotes migration and invasion by the miR-2 1-PDCD4-AP-1 feedback loop in human hepatocellular carcinoma[J].Oncol Rep,2012,27(5):1660.
Effect of hTERT gene silencing on biological characteristics and COX-2 expression in breast cancer cells
YUHong-jian,ZHAOYang,ZHAOShi-ming,etal.
(XianshuiguHospitalofJinnanDistrict,Tianjin,Laboratory,Tianjin300350,China)
Objective This study was to investigate the effect of hTERT gene silencing on the biological characteristics of breast cancer cells and to investigate the effect of hTERT gene silencing on the expression of cyclooxygenase-2 (COX-2) in breast cancer cells.Methods The siRNA targeting hTERT mRNA was synthesized and cloned into pGenesil-1.1 plasmid.The hTERT mRNA-siRNA expression vector was transfected into breast cancer cells by electroporation to produce RNA interference effect,so that the target gene was silenced.The mRNA and protein expression of breast cancer MCF-7 cells were detected by RT-PCR and Western blot.The cell cycle was detected by flow cytometry.MCF-7 cells,and the invasive ability of breast cancer MCF-7 cells after silencing hTERT gene was detected by cell invasion assay.The expression of COX-2 protein was detected by immunohisto chemistry.Results After hTERT gene silencing,the mRNA and protein expression of hTERT gene in breast cancer MCF-7 cells after hTERT transfection were significantly lower than those in untransfected plasmid group and untransfected group (P<(P<0.05).The results of CCK-8 proliferation test indicated that the breast cancer MCF-7 tumor stem cells stagnated in G0/G1 cycle and the number of cells in S phase was decreased,the difference was statistically significant (P<0.05) The proliferation of MCF-7 tumor stem cells in hTERT-transfected group was significantly inhibited (P<0.05).The invasion of MCF-7 cells in hTERT-transfected group was significantly lower than that in control group(P<0.05),and the difference was statistically significant (P<0.05).The expression of COX-2 protein in hTERT-transfected group was significantly lower than that in control group(P<0.05).The expression of COX-2 protein was correlated with the expression of hTERT gene.Conclusion The silencing of hTERT gene may affect the proliferation and migration of breast cancer cells and decrease the expression of COX-2 protein,so as to improve the prognosis of patients with breast cancer.
breast cancer;hTERT gene;gene silencing;COX-2
1007-4287(2016)11-1817-05
R737.9
A
于宏建,32岁,男,病原生物学硕士,主管检验师,研究方向:病原生物学。
2015-08-15)
