粪便中分离肺炎克雷伯菌的血清型与毒力基因检测
2016-12-12曹敬荣高世超陈典典段园园王培昌
曹敬荣,高世超,陈 静,2,陈典典,段园园,王培昌
(1 首都医科大学宣武医院,北京 100053; 2 江西卫生职业学院,江西 南昌 330201)
·论著·
粪便中分离肺炎克雷伯菌的血清型与毒力基因检测
曹敬荣1,高世超1,陈 静1,2,陈典典1,段园园1,王培昌1
(1 首都医科大学宣武医院,北京 100053; 2 江西卫生职业学院,江西 南昌 330201)
目的 了解粪便标本分离肺炎克雷伯菌(KPN)的血清型与毒力基因分布,为临床治疗提供依据。方法 收集2013年11月—2014年6月某院健康体检者及住院非腹泻患者粪便标本分离KPN,检测其黏液表型、 6种荚膜血清型(K1、K2、K3、K5、K54和K57)及6种毒力基因(rmpA、fimH、Aero、mrkA、wabG和ironB),分析不同黏液表型、不同人群来源菌株荚膜血清型与毒力基因分布情况。结果 收集粪便标本510份,其中健康体检者92份,住院非腹泻患者418份,分离KPN 107株(健康体检者19株,住院非腹泻患者88株),粪便标本KPN总分离率为20.98%,其中高黏液表型菌24株,非高黏液表型菌83株。分离的KPN中6种血清型和6种毒力基因均有检出,以K1、K2、K57、K54血清型为主(48.60%);毒力基因mrkA和wabG检出率最高(分别为90.65%、83.18%),rmpA+fimH+Aero+mrkA +wabG基因同时检出最常见(30.84%),主要分布于K1、K2、K57、K54血清型中。rmpA和Aero毒力基因主要在K1、K2、K57、K54血清型中检出。健康体检者KPN血清型以K1型为主(26.32%),未检测到K3和K57型;住院非腹泻患者6种血清型均有检出,以K1、K2、K57、K54为主。高黏液表型菌同时携带4种毒力基因以上者占83.33%(20/24),高于非高黏液表型菌的32.53%(27/83)(χ2=19.51,P<0.01)。高黏液表型菌中K1、K2、K57、K54血清型总检出率为91.67%(22/24),高于非高黏液表型菌的36.14%(30/83);rmpA、Aero毒力基因的检出率均为95.83%,均高于非高黏液表型菌组(分别为31.32%、30.12%)(均P<0.05)。结论 粪便中分离的KPN均检测到强毒力荚膜血清型和多种毒力基因,尤其在高黏液表型菌和住院患者分离菌中,应引起临床重视。
肺炎克雷伯菌; 肺炎; 毒力基因; 血清型; 流行病学
[Chin J Infect Control,2016,15(11):807-812]
肺炎克雷伯菌(Klebsiellapneumoniae,KPN)是呼吸道和消化道的定植菌,也是引起临床多种感染的常见条件致病菌,具有较强的毒力和致病性,且多重耐药严重。目前,国内外关于不同感染标本中KPN的分离鉴定、耐药情况[1-7]、相关危险因素、血清型[2-5,8-13]、毒力基因及流行病学方面研究较多,而缺乏粪便KPN荚膜血清型和毒力基因方面的报道。笔者收集某院2013年11月—2014年6月不重复门诊健康体检者及非腹泻住院患者粪便标本,首次对粪便中KPN进行荚膜血清型和毒力基因检测,以了解粪便中KPN分离率、血清型分布及携带毒力因子情况,为KPN引起的感染性疾病的合理治疗提供依据。
1 材料与方法
1.1 标本采集及菌株收集 选择首都医科大学宣武医院2013年11月—2014年6月不重复门诊健康体检者粪便标本,入选标准:无肠道及其他明显感染性疾病,标本采集前1个月未使用抗菌药物,粪便常规检验正常。排除标准:有肠道感染性疾病、腹泻、粪便常规检验异常、近期使用抗菌药物的体检者,共92份;选取同期非腹泻住院患者粪便标本418份,入选标准:粪便性状、外观正常,镜下未见到红、白细胞及寄生虫等。粪便标本接种于中国蓝平板,按照《全国临床检验操作规程》操作,根据菌落形态特点初筛KPN,菌种保存于-80℃冰箱。
1.2 主要仪器与试剂 PCR仪(Veriti 9902,Applied Biosystems,USA),电泳仪(北京六一仪器厂,中国),凝胶成像仪(U-Genius,Gene Company, UK),离心机((Eppendorf AG22331, Hamburg,Germany),生物安全柜(Thermo scientific,China),-80℃低温冰箱(海尔)。PCR检测试剂Premix Taq(TaKaRa,Japan),DL2000 DNA Marker(TaKaRa,Japan),中国蓝平板和血平板(Oxoid)。
1.3 黏液丝试验 (string test,ST)筛选高黏液表型菌[9-12]将KPN受试菌接种于5%羊血琼脂平板,37℃孵育过夜,用细菌接种环向上挑起菌落,如不能挑起黏液丝或黏液丝长度<5 mm,判为黏液丝试验阴性;如挑起黏液丝长度≥5 mm,则判为黏液丝试验阳性。
1.4 菌株鉴定、血清型和毒力基因检测 将冻存于-80℃冰箱的菌种复苏,接种于哥伦比亚血平板,35℃培养18 h后挑取菌落,采用煮沸法提取模板DNA(200 μL),置于-20℃备用,PCR扩增khe基因鉴定KPN[8]。委托上海英潍捷基(上海)贸易有限公司合成khe基因和6种荚膜血清型(K1、K2、K3、K5、K54和K57)及6种毒力基因(rmpA、fimH、Aero、mrkA、wabG和ironB)的引物。引物序列见表1。PCR反应为25 μL的体系,包括Premix Taq 12.5 μL,上下游引物(10 μmol/L)各1.0 μL,DNA模板5 μL,双蒸水5.5 μL。反应条件为95℃预变性3 min,94℃变性40 s,48~58℃退火40 s,72℃延伸1 min,30个循环后72℃延伸10 min。取5 μL PCR产物进行1%琼脂糖凝胶电泳,紫外成像仪观察。
1.5 统计分析 应用SPSS 19.0统计软件对数据进行分析,采用χ2检验,P≤0.05为差异有统计学意义。
2 结果
2.1 粪便标本KPN分离情况 收集的510份粪便标本中,健康体检者92份,住院非腹泻患者418份,分离KPN 107株,其中男性65例,女性42例,年龄15~94岁,平均年龄(60±13)岁,60岁以上者占59.81%。粪便标本KPN总分离率为20.98%,健康体检者分离率为20.65%(19/92),住院非腹泻患者分离率为21.05%(88/418)。
2.2 KPN荚膜血清型分布和毒力基因检测结果 107株粪便分离菌中6种血清型和6种毒力基因均有检出,以K1、K2、K57、K54血清型为主(48.60%);毒力基因mrkA和wabG检出率最高(分别为90.65%、83.18%),ironB检出率最低(2.80%),且ironB仅存于其他型中。同时检测到2种、3种和4种以上毒力因子的菌株分别占13.08%、28.04%和43.93%; 组合rmpA+fimH+Aero+mrkA +wabG最常见(30.84%),主要分布于K1、K2、K57、K54血清型中。rmpA和Aero毒力基因主要在K1、K2、K57、K54血清型中检出。见表2。6种荚膜血清型及毒力因子PCR扩增结果见图1。

表2 107株KPN荚膜血清型和毒力基因检测结果

M:DNA Marker DL2000;1—6泳道分别为血清型K1、K2,K57、K54、K5和K3;7为阴性对照;8—13泳道分别为毒力基因rmpA、fimH、Aero、mrkA、wabG和ironB
图1 KPN血清型及毒力基因PCR扩增电泳图谱
Figure 1 PCR amplification results of KPN serotypes and virulence genes
2.3 不同人群分离KPN血清型与毒力基因分布 健康体检者KPN血清型以K1型为主(26.32%),未检测到K3和K57型。住院非腹泻患者6种血清型均有检出,以K1、K2、K57、K54为主,K5和K3分别仅占6.82%和1.13%;住院非腹泻患者毒力基因fimH、mrkA、wabG在6种血清型中均有检出。见表3。
2.4 不同黏液表型KPN的血清型与毒力基因分布 高黏液表型菌(即黏液丝试验阳性)24株(22.43%),高黏液表型菌仅检测到K1、K2、K57和K54血清型;非高黏液表型菌83株(77.57%),6种血清型均有检出。高黏液表型菌同时携带4种毒力因子以上者占83.33%(20/24),高于非高黏液表型菌的32.53%(27/83)(χ2=19.51,P<0.01)。高黏液表型菌中K1、K2、K57、K54血清型总检出率为91.67%(22/24),高于非高黏液表型菌的36.14%(30/83);rmpA、Aero毒力基因的检出率均为95.83%,均高于非高黏液组(分别为31.32%、30.12%)(χ2值分别为19.52、31.21、32.50,均P<0.05)。见表4。

表3 不同人群粪便标本分离KPN的血清型与毒力基因分布

表4 不同黏液表型KPN的荚膜血清型与毒力基因分布
3 讨论
粪便中携带细菌可移位引起其他部位感染,监测粪便中的分离菌对感染病原菌的溯源和有效防治有重要价值。本组粪便KPN总分离率为20.98%,接近于张嵘等[4]报道的22.6%;其中住院非腹泻患者粪便KPN分离率为21.05%,是引起医院感染的一个潜在威胁;而携带KPN的60岁以上的老年患者占59.81%,由于高龄患者器官及免疫功能减退、营养状态不良等因素,极易发生KPN感染[14],因此,临床和微生物实验室应注意对住院患者,尤其老年患者粪便携带细菌和其他感染部位分离菌进行监控,以发现感染来源。
KPN具有较强的毒力和致病性,与其产生的毒力因子密不可分,如荚膜多糖(K抗原)、黏附因子(I、III型菌毛)[15]、铁摄入系统等。目前,公认的77种荚膜血清型中以K1、K2、K54、K57毒力最强、最常见[1-12]。本组6种血清型均有检出,以强毒力血清型K1、K2、K57、K54为主,占6种检测血清型的86.67%(52/60),与以往报道[8-12]一致。黏液表型是强毒力血清型KPN特征之一[8-10],本组高黏液表型菌中K1、K2、K54、K57血清型所占比率(91.67%)高于非黏液表型菌(36.14%),可能K1、K2、K54、K57血清型与高黏液表型密切相关[8-10];K3和K5型仅存在于非高黏液表型菌中,提示其可能与高黏液表型菌强毒力关系不大,但由于检测数据量少,需增加标本量进一步验证。对不同人群粪便标本KPN检测发现,健康体检者血清型以K1型为主,未检测到K3和K57型,而住院非腹泻患者6种血清型均有检出,且以K1、K2、K57、K54为主,说明住院患者粪便携带更多高毒力KPN,具有引起侵袭性严重感染的潜在危险,应引起临床的高度关注。107株KPN血清型未分型者47株(43.93%),与已鉴定的6种血清型相比所占比例较大,主要存在于非高黏液组(95.74%,45/47),这些血清型可能为低毒力型,需对其进行其他血清型的分型鉴定,以明确血清型未分型KPN的分布和流行趋势。
本组6种毒力基因中mrkA、wabG和fimH检出率最高,ironB检出率最低,与以往报道[5]相似。fimH和mrkA分别为I型和III型菌毛的黏附蛋白,与KPN与上皮细胞的黏附相关,而wabG主要作用为分泌细胞黏附式荚膜多糖,三者均是KPN的主要致病因子。本组mrkA、wabG和fimH基因在高毒力血清型中检出率高,提示高毒力KPN具有更强的黏附及侵袭力。rmpA 基因是黏液型调节因子,可增加荚膜多糖合成基因的表达和荚膜的产生,增强其毒性和侵袭力。本组rmpA和Aero基因总检出率分别为45.79%和44.86%,但在高黏液表型菌中二者的检出率均>95%,说明rmpA和Aero基因可能与高黏液性相关;但非黏液组中亦有31.32%的KPN检测到rmpA 基因,可能与其他毒力因子存在抑制了黏液表型有关,具体原因有待进一步研究。本组KPN中K3和K5血清型未检测到rmpA和Aero基因)。高黏液表型菌中同时携带≥4种毒力因子者所占比例高于非高黏液表型菌,与以往研究[8-10]结果一致,高黏液性KPN中毒力基因携带率高。住院非腹泻患者毒力因子fimH在6种血清型中均有检出。
本组结合黏液性状、荚膜分型和毒力基因,判断粪便中分离KPN的特性,发现KPN携带多种强毒力血清型和毒力因子,是医院感染的重要潜在感染源,临床应及早关注KPN致病因子的检测。但本组未进行药敏数据的相关分析,在今后的研究中,我们将进一步探讨血清型、毒力基因与抗菌药物相关的机制,为临床更好地防治KPN引起的感染提供依据。
[1] 谷秀梅,刘文恩,简子娟,等.携带产新型碳青霉烯酶基因blaIMP-38肺炎克雷伯菌致病性分析[J].临床检验杂志,2013,31(9):698-701,704.
[2] 马荣,刘科芳,聂大平,等.肺炎克雷伯菌中K1、K2 血清型菌株的分布及其耐药性分析[J].中国感染与化疗杂志,2015,15(3):204-208.
[3] 魏丹丹,刘洋,万腊根,等.高毒力肺炎克雷伯菌新型变种感染病例分析及耐药机制研究[J].中华检验医学杂志,2015,38(6):392-396.
[4] 张嵘,王选,吕建新.碳青霉烯类抗生素耐药K1型肺炎克雷伯菌一株的分离及耐药机制分析[J].中华医学杂志,2014,94(46):3666-3670.
[5] 李莹莹,明亮,刘红春,等.2型糖尿病并发颌面部感染来源的肺炎克雷伯菌的分子分型、耐药性及毒力研究[J].中华检验医学杂志,2014,37(2):136-139.
[6] 罗甫花,姜维,蒋晓军,等.黏液型肺炎克雷伯菌耐药性[J].中国感染控制杂志,2015,14 (5): 314-316.
[7] 谢宁,郭斌,蔡燕,等.肠杆菌科细菌KPC型碳青霉烯酶的研究[J].中国感染控制杂志,2012,11(4): 266-269.
[8] 和晋渝,邱景富,刘梦颖,等.PCR鉴定肺炎克雷伯菌的强毒性血清型[J].生物技术通讯,2012,23(4): 554-557.
[9] Wang J, Yan Y, Xue X, et al. Comparison of pyogenic liver abscesses caused by hypermucoviscousKlebsiellapneumoniaeand non-Klebsiellapneumoniaepathogens in Beijing: a retrospective analysis[J].J Int Med Res, 2013, 41(4):1088-1097.
[10] Shen DX, Wang J, Li DD.Klebsiellapneumoniaeliver abscesses[J]. Lancet Infect Dis, 2013, 13(5):390-391.
[11] Liao CH, Hung YT, Chang CY, et al. Capsular serotypes and multilocus sequence types of bacteremicKlebsiellapneumoniaeisolates associated with different types of infections[J].Eur J Clin Microbiol Infect Dis, 2014, 33(3):365-369.
[12] 沈定霞,李东冬,郭玲,等.高黏液表型肺炎克雷伯菌的荚膜分型与毒力基因的检测[J].中华检验医学杂志,2014,37(5):379-382.
[13] Shon AS,Bajwa RP,Russo TA. Hypervirulent (hypermucoviscous)Klebsiellapneumoniae:a new and dangerous breed[J].Virulence, 2013, 4(2):107-118.
[14] 陈键,陈世昌.老年患者肺炎克雷伯菌感染分布及耐药性变迁研究[J].国际检验医学杂志,2015,36(10):1330-1332.
[15] 方立超,程平,贺娟,等.重庆两家三甲医院肺炎克雷伯菌菌毛变化分析[J].重庆医学,2010,39(5):551-552,554.
(本文编辑:左双燕)
Detection of serotypes and virulence genes of Klebsiella pneumoniae from feces
CAO Jing-rong1,GAO Shi-chao1,CHEN Jing1,2,CHEN Dian-dian1,DUAN Yuan-yuan1, WANG Pei-chang1
(1XuanwuHospitalofCapitalMedicalUniversity,Beijing100053,China; 2JiangxiHealthVocationalCollege,Nanchang330201,China)
Objective To understand the distribution of serotypes and virulence genes ofKlebsiellapneumoniae(KPN) isolated from feces specimens, and provide basis for clinical treatment. Methods KPN isolated from feces specimens of healthy physical examination people and hospitalized patients without diarrhea in a hospital between November 2013 and June 2014 were collected. Mucoid phenotype, 6 kinds of capsule serotypes(K1, K2, K3, K5, K54, and K57), and 6 kinds of virulence genes (rmpA,fimH,Aero,mrkA,wabG, andironB)were detected, distribution of capsule serotypes and virulence genes in KPN of different mucoid phenotypes and from different populations were analyzed. Results A total of 510 feces specimens were collected, 92 were from healthy physical examination people and 418 from hospitalized patients without diarrhea, 107 strains of KPN were isolated ( 19 from healthy physical examination people, and 88 from hospitalized patients without diarrhea),the total isolation rate of KPN from feces specimens was 20.98%, 24 isolates were hypermucoviscous phenotype KPN (HMVKP) stains, and 83 were non-HMVKP strains. 6 kinds of capsule serotypes and 6 kinds of virulence genes were all detected among KPN, the major were K1, K2, K57, and K54 serotypes(48.60%);the detection rates of virulence genesmrkA andwabG were the highest (90.65% and 83.18% respectively), simultaneous detection ofrmpA+fimH+Aero+mrkA +wabG gene was most common (30.84%), which mainly distributed in K1,K2,K57,and K54 serotypes.rmpA andAerovirulence genes were mainly detected in K1,K2,K57,and K54 serotypes. Among healthy physical examination people, the main serotype of KPN was K1 type(26.32%),while K3 and K57 types were not detected; 6 kinds of capsule serotypes were all detected from hospitalized patients without diarrhea, the major types were K1, K2, K57, and K54. HMVKP strains carrying 4 kinds of virulence genes was higher than non-HMVKP strains (83.33%[20/24] vs 32.53%[27/83],χ2=19.51,P<0.01). The total detection rate of K1, K2, K57, and K54 serotypes in HMVKP strains were higher than non-HMVKP strains (91.67%[22/24] vs 36.14%[30/83]); the detection rates ofrmpA andAerogenes were both 95.83%, which were higher than those in non-HMVKP strains (31.32% and 30.12% respectively)( bothP<0.05). Conclusion Hypervirulence capsular serotypes and multiple virulence genes are detected in KPN from feces, especially HMVKP strains and strains from hospitalized patients, which should be paid attention.
Klebsiellapneumoniae; pneumoniae; virulence gene; serotype; epidemiology
�因引物序列及来源参考文献Table 1
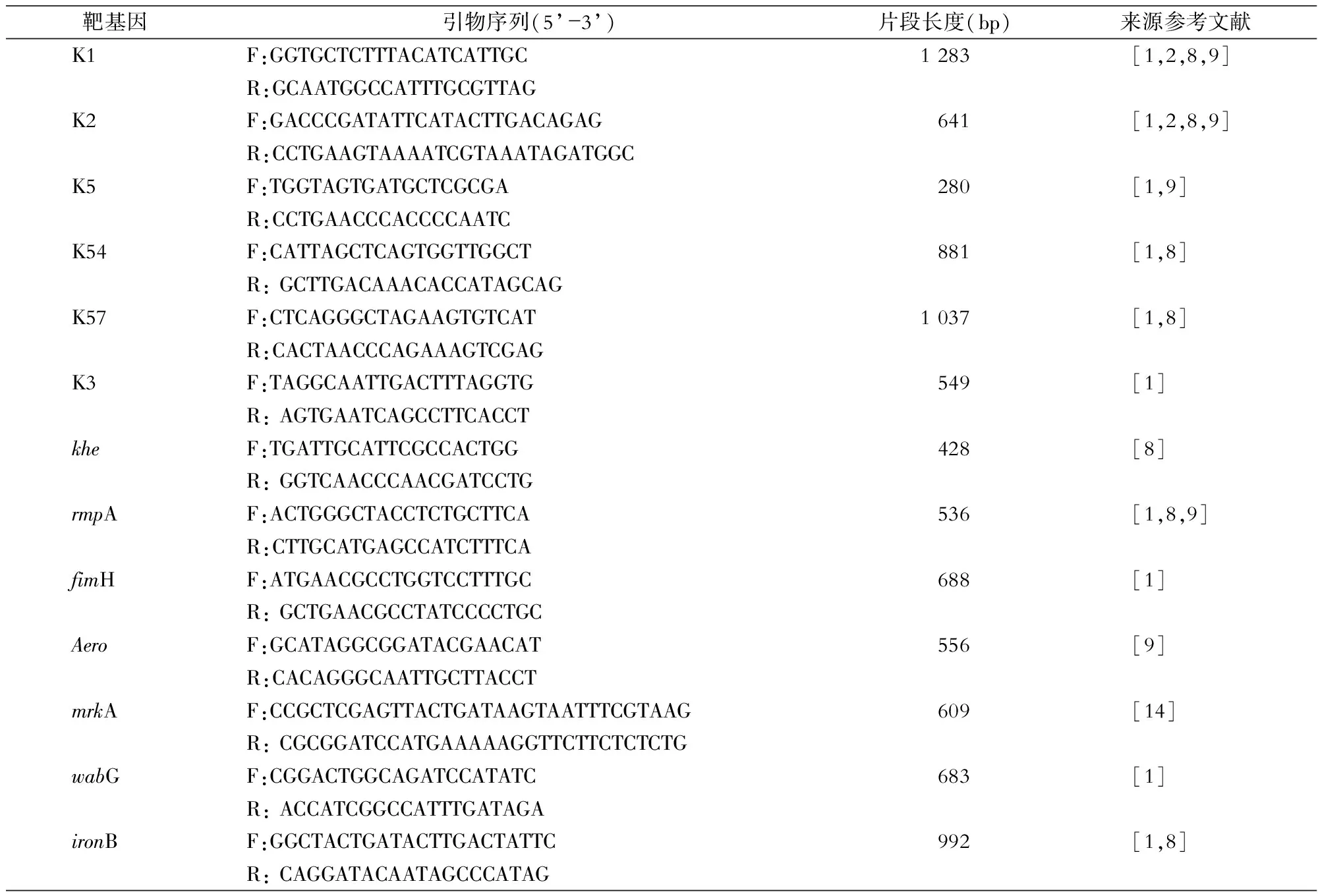
靶基因引物序列(5’-3’)片段长度(bp)来源参考文献K1F:GGTGCTCTTTACATCATTGC1283[1,2,8,9]R:GCAATGGCCATTTGCGTTAGK2F:GACCCGATATTCATACTTGACAGAG641[1,2,8,9]R:CCTGAAGTAAAATCGTAAATAGATGGCK5F:TGGTAGTGATGCTCGCGA280[1,9]R:CCTGAACCCACCCCAATCK54F:CATTAGCTCAGTGGTTGGCT881[1,8]R:GCTTGACAAACACCATAGCAGK57F:CTCAGGGCTAGAAGTGTCAT1037[1,8]R:CACTAACCCAGAAAGTCGAGK3F:TAGGCAATTGACTTTAGGTG549[1]R:AGTGAATCAGCCTTCACCTkheF:TGATTGCATTCGCCACTGG428[8]R:GGTCAACCCAACGATCCTGrmpAF:ACTGGGCTACCTCTGCTTCA536[1,8,9]R:CTTGCATGAGCCATCTTTCAfimHF:ATGAACGCCTGGTCCTTTGC688[1]R:GCTGAACGCCTATCCCCTGCAeroF:GCATAGGCGGATACGAACAT556[9]R:CACAGGGCAATTGCTTACCTmrkAF:CCGCTCGAGTTACTGATAAGTAATTTCGTAAG609[14]R:CGCGGATCCATGAAAAAGGTTCTTCTCTCTGwabGF:CGGACTGGCAGATCCATATC683[1]R:ACCATCGGCCATTTGATAGAironBF:GGCTACTGATACTTGACTATTC992[1,8]R:CAGGATACAATAGCCCATAG
2015-12-08
首都医科大学宣武医院院级基金(2014)
曹敬荣(1979-),女(汉族),河北省邢台市人,主治医师,主要从事临床微生物检验、细菌耐药性及分子流行病学研究。
王培昌 E-mail: pcw1905@126.com
10.3969/j.issn.1671-9638.2016.11.001
R181.3+2
A
1671-9638(2016)11-0807-06
