中风宁合剂质量标准研究
2016-12-09毕晓黎胥爱丽
毕晓黎 陈 雪 胥爱丽 陈 仪
(1 广东省中医药工程技术研究院中医药研究开发重点实验室,广州,510095; 2 广州中医药大学,广州,510405;3 中山大学新华学院,广州,510520)
中风宁合剂质量标准研究
毕晓黎1,2陈 雪2胥爱丽1陈 仪3
(1 广东省中医药工程技术研究院中医药研究开发重点实验室,广州,510095; 2 广州中医药大学,广州,510405;3 中山大学新华学院,广州,510520)
目的:建立中风宁合剂的质量标准。方法:采用薄层色谱(Thin-layer Chromatography,TLC)法对方中3味药进行定性鉴别;采用高效液相(High Performance Liquid Chromatography,HPLC)色谱法对方中赤芍所含芍药苷的含量进行测定,以Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 μm)为色谱柱,甲醇-0.05 mol/L的磷酸二氢钾溶液(28∶72)为流动相,检测波长230 nm。结果:在TLC中能检出赤芍、石菖蒲、何首乌的特征斑点,且阴性对照无干扰。芍药苷在0.185 2~0.926 0 μg范围内与色谱峰峰面积线性关系较好,相关系数r为0.999 9,加样回收率的平均值为98.55%,RSD%为1.16(n=9)。结论:所建立的方法简便准确,快速,专属性高,重现性好,结果可靠,可用于中风宁合剂的质量控制。
中风宁合剂;TLC;芍药苷;HPLC;质量标准
中风宁合剂是广东省第二中医院名老中医的经验方,经过一定的工艺制成合剂,具有活血散瘀,化痰通窍的功效,本方由赤芍、石菖蒲、制何首乌、当归等7味中药材组成,可用于治疗“反射性交感神经营养不良综合征”[1]以及中风引起的口眼歪斜,小便失禁,吞咽食物困难等后遗症[2],为了控制其内在质量,使临床用药更安全,有效,本项目对本品的质量标准展开了研究。
本处方中以凉血散瘀[3]的赤芍为君药,以醒神开窍的石菖蒲和养血滋阴的制何首乌为臣药,故本文采用TLC法对处方中的赤芍、石菖蒲、制何首乌进行了定性鉴别,同时以主药赤芍中的芍药苷为检测指标,采用高效液相色谱法(Agilent 1200高效液相色谱仪)对处方中所含的芍药苷进行了含量测定,为中风宁合剂的质量标准提供了实验依据。
本实验通过对中风宁合剂的质量标准进行研究,为该中药复方制剂的质量标准提供有效、可靠的评价参考依据,为中药合剂质量标准的建立提供有效的方法和参考。
1 材料
1.1 实验仪器 高效液相色谱仪型号为Agilent 1200(美国Agilent公司),DAD检测器,四元梯度泵,Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 μm)色谱柱;ATS4型自动点样仪(CAMAG瑞士);Reprostar 3型号的数码成像系统(瑞士CAMAG);梅特勒XS205Du型分析天平(瑞士);BQ-Ⅱ型薄层自动铺板器(重庆南岸实验电器厂);DHG-9203A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);MilliPore Advantage A10自动纯水机(美国);KQ52300DE型数控超声波辅助提取仪(昆山市超声仪器有限公司);SevenCompact pH计(上海梅特勒-托利多仪器有限公司);电热恒温水浴槽(上海)。
1.2 受试药物 赤芍对照药材(批号:121093-200402)、石菖蒲对照药材(批号:121098-201105)、制何首乌对照药材(批号:121454-200502);芍药苷对照品(批号:110736-201035),从中国食品药品检定研究院购买;中风宁合剂(批号分别为2015080101、2015080102、2015080103),为广东省第二中医院制剂室中式产品;甲醇为色谱纯(默克)、水为屈臣氏蒸馏水,其他的试剂为分析纯(广州化学试剂厂)。
2 试验方法
2.1 薄层色谱(TLC)的定性鉴别
2.1.1 赤芍薄层鉴别 取批号为2015080101、2015080102、2015080103的3批中风宁合剂各5 mL,通过D101大孔树脂柱,先用自来水洗脱,把大孔树脂柱洗至无色,洗脱液丢弃,再用20%的乙醇洗脱,用量为30 mL,丢弃洗脱液,然后用70 mL 20%乙醇洗脱[4~5],将洗脱液收集,于蒸发皿中置水浴锅上蒸干,用1 mL甲醇溶解,即得供试品溶液。另取0.5 g的赤芍对照药材,置于100 mL的广口瓶中,加50 mL饮用水,煎煮时间为30 min,放冷,过滤至蒸发皿中,浓缩滤液为5 mL,对照药材的溶液依据此方法制得。取缺赤芍药材的阴性样品,同上述方法制得赤芍阴性对照溶液。照薄层色谱法《中华人民共和国药典》(以下简称《中国药典》)2015年版四部通则0502试验,吸取15 μL的阴性对照溶液,3 μL的对照药材溶液,15 μL的上述3批供试品溶液,分别点于同一自制的硅胶G薄层板上,甲醇-乙酸乙酯-三氯甲烷-甲酸(10∶5∶40∶0.2)为展开剂,显色剂为5%香草醛硫酸溶液,显色之后,晾干,取出,将薄层板放于105 ℃烘箱至斑点显色清晰,放于白光下检视[6-7],在TLC薄层板上,供试品色谱与赤芍对照药材色谱有对应的斑点。且赤芍阴性对照无干扰,如图1。
2.1.2 石菖蒲薄层鉴别[6]取批号为2015080101、2015080102、2015080103的3批中风宁合剂各10 mL,用稀盐酸调pH值至2~3,将此溶液用20 mL乙醚液萃取两次,合并,蒸干,残渣用1 mL的甲醇溶解,即得供试品溶液。另取0.20 g的石菖蒲对照药材,置于250 mL的广口锥形瓶中加饮用水100 mL,煎煮时间为30 min,放冷,过滤,得滤液,滤液用稀盐酸调节pH值至2~3,用上述方法制得对照药材溶液[6]。取缺石菖蒲药材的阴性样品,同上述方法制得石菖蒲阴性对照溶液。照薄层色谱法《中国药典》四部通则0502试验,吸取3 μL的阴性对照溶液,5 μL的对照药材溶液,3 μL的供试品溶液,把样品点于同一自制的硅胶G薄层板上。展开剂为乙酸乙酯-二氯甲烷-环己烷-甲酸(1∶1∶4∶0.1),置室温下晾干。将薄层板在365 nm的紫外光灯下检视,在TLC薄层板上,供试品色谱与石菖蒲对照药材色谱有对应的斑点。且石菖蒲阴性对照无干扰,如图2。

图1 赤芍TLC色谱图
注:1赤芍阴性;2赤芍对照药材;3赤芍供试品2015080101;4赤芍供试品2015080102;5赤芍供试品2015080103。
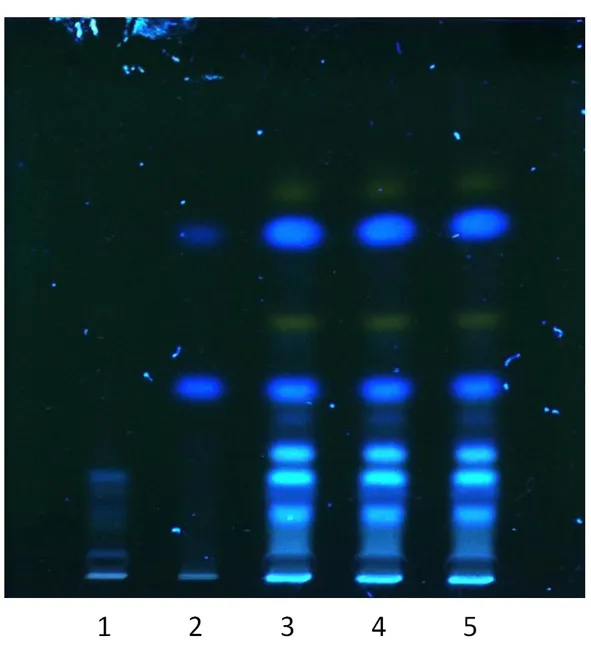
图2 石菖蒲TLC色谱图
注:1石菖蒲阴性;2石菖蒲对照药材;3 石菖蒲供试品2015080101;4石菖蒲供试品2015080102;5石菖蒲供试品2015080103。
2.1.3 制何首乌薄层鉴别[6]取批号为2015080101、2015080102、2015080103的3批中风宁合剂各10 mL,用稀盐酸调pH值至2~3,将此溶液用20 mL乙醚液萃取两次,合并,蒸干,溶解溶剂为1 mL的甲醇,即得供试品溶液。另取0.25 g的制何首乌对照药材于250 mL的广口锥形瓶中,加饮用水100 mL,煎煮30 min,过滤,滤液用稀盐酸调节pH值至2~3,同法处理作为对照药材溶液。取缺制何首乌药材的阴性对照药材,用相同的方法制备供试品溶液制成制何首乌阴性样品。照薄层色谱法(《中国药典》四部通则0502)试验,吸取5 μL的阴性对照溶液,1 μL的对照药材溶液,5 μL的供试品溶液,把样品点于同一自制的硅胶G薄层板上,展开剂为乙酸乙酯-二氯甲烷-环己烷-甲酸(1∶1∶4∶0.1),置室温下晾干。将薄层板在365 nm的紫外灯光下检视,在TLC薄层板上,供试品色谱与制何首乌对照药材色谱有对应的斑点。且制何首乌阴性对照无干扰,如图3。
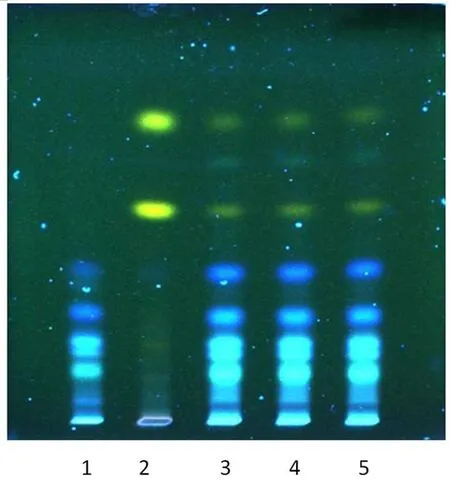
图3 制何首乌TLC色谱图
注:1制何首乌阴性;2制何首乌对照药材;3制何首乌供试品2015080101;4制何首乌供试品2015080102;5制何首乌供试品2015080103。
2.2 芍药苷的含量测定
2.2.1 色谱条件[6]色谱柱:Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 μm);流动相:甲醇-0.05 mol/L的磷酸二氢钾溶液(28∶72);流速:0.800 mL/min;柱温:25 ℃;测波长:230 nm;进样量:10 μL;按芍药苷峰计算理论塔板数应不低于3 000。
2.2.2 对照品溶液的制备[6]称得芍药苷4.63 mg精密称定,取出五氧化二磷减压干燥器中干燥36 h的芍药苷对照品,溶解溶剂为甲醇,制成芍药苷的浓度为0.463 mg/mL,作为芍药苷的对照品溶液,备用。
2.2.3 供试品溶液的制备[6]精密吸取中风宁合剂1 mL,99 ℃水浴锅上蒸至九成干,加硅藻土适量,与样品充分拌匀,移至锥形瓶中,精密加入10.00 mL甲醇,称重,浸泡4 h,超声波辅助提取20 min,放冷,补足失重,摇匀,过滤,取续滤液,通过0.45 μm微孔滤膜进行过滤,制得供试品溶液,备用。
2.2.4 阴性对照溶液制备[6]按照处方比例,取缺赤芍的处方药材,按照中风宁合剂的制备方法制成赤芍阴性样品,99 ℃水浴锅上蒸至九成干,同供试品处理方法制成赤芍阴性对照溶液,备用。
2.2.5 专属性考察[8-14]取中风宁合剂(批号:2015080101),依据“2.2.1”项下的色谱条件对赤芍的阴性对照溶液和芍药苷对照品溶液进行测定,HPLC色谱峰显示,在芍药苷色谱峰的位置上,阴性对照溶液没有吸收,该图谱表明,该方法的专属性较强,如图4。

图4 HPLC色谱图
2.6 线性考察[8-14]芍药苷对照品溶液(0.463 mg/mL)0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL用移液枪精密吸取,并分别置于5 mL的容量瓶中,用色谱纯甲醇定容,振匀,制成浓度分别为18.52 μg/mL,37.04 μg/mL,55.56 μg/mL,74.08 μg/mL,92.60 μg/mL的芍药苷对照品溶液,进样体积均为10 μL,按“2.2.1”项下色谱条件对峰面积进行测定。以芍药苷峰面积积分值(Y)为纵坐标,以进样量(X/μg)为横坐标,进行线性回归,可得线性回归方程:Y=2587.6X-130.38(相关系数r为0.999 9)。结果表明芍药苷具有良好的线性关系在0.185 2~0.926 0 μg范围内。
2.7 精密度试验[8-14]取中风宁合剂1.00 mL(批号:2015080101),按“2.2.3”项下的供试品制备方法制得供试品溶液,连续进样6次。测得其峰面积,经计算得芍药苷峰面积RSD%值为0.35%(n=6),结果表明此高效液相色谱仪的精密度良好。
2.8 稳定性试验[8-14]用移液枪分别吸取供试品溶液1.00 mL(批号:2015080101),分别于0、2、6、8、12、24 h时进样,按“2.2.1”项下确立的色谱条件进行测定。测得其峰面积,经计算得芍药苷峰面积RSD%值为0.69%(n=6),结果表明该中风宁合剂在24 h内稳定。
2.9 重复性试验[8-14]取中风宁合剂(批号:2015080101),分别精密吸取6份,把供试品溶液按“2.2.3”项下的制备方法处理即得,照“2.2.1”项下确立的色谱条件进行测定,即得其峰面积值,计算得芍药苷含量。结果显示芍药苷的平均含量为0.60 mg/mL,含量的RSD%值为0.60%(n=6),结果表明该方法的重复性良好。
2.10 加样回收率试验[8-14]用移液枪吸取9份已知芍药苷含量(0.60 mg/mL)的供试品溶液(批号:2015080101),将供试品溶液依据“2.2.3”项下制备方法处理,即得,按“2.2.1”项下确立的色谱条件进行测定,计算得回收率。见表1。

表1 芍药苷加样回收率试验结果

图5 当归尾TLC色谱图
注:1、2、3当归尾对照药材8 μL、10 μL、12 μL;4、5、6供试品8 μL、10 μL、12 μL。

图6 当归尾TLC色谱图
注:1当归尾阴性;2当归尾药材;3当归尾供试品2015080101;4当归尾供试品2015080102;5当归尾供试品2015080103。
2.11 供试品测定结果 取批号为2015080101、2015080102、2015080103的3批中风宁合剂各一定量,按“2.2.3”项下的方法处理,即得供试品溶液,按“2.2.1”项下的色谱条件进行测定,计算3批供试品中芍药苷的含量。见表2。

表2 样品中芍药苷含量测定结果(n=3)

图7 石菖蒲TLC色谱图
注:1、2、3石菖蒲对照药材1 μL、2 μL、5 μL;4、5、6供试品1 μL、2 μL、5 μL。
3 讨论
实验过程中曾尝试对方中所有药味的薄层鉴别方法进行摸索,结果除赤芍、石菖蒲、制何首乌外,其余药味均存在分离度不佳、背景干扰大或阴性干扰等问题,故未列入标准。在对当归尾进行薄层鉴别时,运用《中国药典》2015年版四部通则0502,供试品与对照药材没有对应的斑点,如图5,故尝试鉴别项下鉴别(3)中的方法,阴性有干扰,故未列入标准,但在供试品TLC色谱图中,如图6有一明显的黄色斑点,在365 nm检视下,此点前后无干扰。因黄色斑点对应的化合物必为方中某味药材的成分,经查阅资料,此点可能为制何首乌中的成分[15-16],故将此方法运用到制何首乌的TLC中。
在石菖蒲的TLC鉴别中,按照《中国药典》2010年版药材鉴别项下鉴别(2),365 nm下检视,对照药材对应位置没有斑点,供试品中斑点展开效果差,如图(7)。遂尝试用《中国药典》2015年版一部当归项下的薄层鉴别方法,对照药材与供试品有对应的蓝色斑点,且分离度良好,阴性无干扰。
本实验所建立的TLC鉴别方法和HPLC含量测定方法专属性强,阴性无干扰,且方法简单准确,故可用于中风宁合剂的质量分析与控制。
[1]马越,李澎.中风后肩手综合征临床研究进展[J].中华针灸电子杂志,2015(4):201-204.
[2]姜颖.中医治疗中风后遗症的临床观察[J].中国卫生标准管理,2015,6(18):148-149.
[3]陆小华,马骁,王建,等.赤芍的化学成分和药理作用研究进展[J].中草药,2015,46(4):595-602.
[4]陈立江,段洪云,张胜,等.赤芍中芍药苷的分离纯化与结构鉴定[J].中国现代应用药学,2011,28(7):634-637.
[5]张诚光,谭梅英,胥爱丽,等.中风复元口服液质量标准研究[J].江西中医药,2013,44(7):58-60.
[6]国家药典委员会.中华人民共和国药典[S].一部.北京:中国医药科技出版社,2010:85,124,147-148,164.
[7]水彩红,陈玉敏,姜春来,等.小儿止泻安颗粒质量标准的研究[J].解放军药学学报,2011,27(5):435-437.
[8]李丽娟,彭丽诗,李素梅,等.柴芍安神解郁颗粒质量标准研究[J].湖南中医杂志,2014,30(6):151-153.
[9]彭丽诗,毕晓黎,罗文汇,等.陈术口服液质量标准研究[J].辽宁中医药大学学报,2014,16(8):10-12.
[10]陈继英,吴谋,卢晓燕,等.芳香化浊液的质量标准研究[J].现代中药研究与实践,2015,29(3):63-65.
[11]韩琳,林红,史勤怡,等.小儿肺炎口服液的质量标准研究[J].儿科药学杂志,2015,21(6):49-53.
[12]申祥国.活血合剂质量标准研究[J].中国医药科学,2015,5(13):37-39.
[13]张红燕,王翠云.双黄连口服液的质量标准研究[J].黑龙江科技信息,2014(33):7.
[14]张丽君,江治武.升血颗粒质量标准研究[J].科技之窗,2015(2):153.
[15]颜世伦.制何首乌化学成分研究[D].天津:天津大学,2014.
[16]李林福.制何首乌化学成分及其质量标准研究[D].北京:中国中医科学院,2008.
(2015-11-25收稿 责任编辑:张文婷)
Research on Quality Standard for Zhong-feng-ning Mixture
Bi Xiaoli1,2,Chen Xue2,Xu Aili1,Chen Yi3
(1GuangdongProvincialKeyLaboratoryofTraditionalChineseMedicineResearchandDevelopment,GuangdongProvincialTCMScienceandTechnologyInstitute,Guangzhou510095,China; 2GuangzhouUniversityofChineseMedicine,Guangzhou510405,China; 3XinhuaCollegeofSunYat-senUniversity,Guangzhou510520,China)
Objective:To establish the quality standard of Zhong-feng-ning mixture.Methods:TLC was used for the qualitative identification of paeoniae radix rubar, acori tatarinowii rhizome and polygoni multiflori radix. The samples were separated on the Agilent ZORBAX SB C18column. The mobile phase was set as methanol-0.05% monopotassium phosphate(28∶72)and the detection wave length was set at 230 nm.Results:The TLC spots of paeoniae radix rubar, acori tatarinowii rhizoma, polygoni multiflori radix were clear and well-separated without interference of negative samples. The linear relationship of peaoniflorin was good in the range of 0.1852-0.9260 μg (r=0.999 9). The average recovery rate was 98.55%. (RSD=1.16).Conclusion:The method is simple, accurate and fast with great repeatability, high specificity and good repeatability, which can be used for the quality control of Zhong-feng-ning mixture.
Zhong-feng-ning mixture; TLC; Peaoniflorin; HPLC; Quality standard
广东省科技计划项目(编号:2013B040200040)
R284.1
A
10.3969/j.issn.1673-7202.2016.10.053
