寒地冬小麦冰结构蛋白的提取及抗冻活性的检测
2016-12-09陈凤莲刘羽佳孙兆国李凌俐
陈凤莲,鲍 欢,曲 敏,刘羽佳,孙兆国,李凌俐,赵 旭
(哈尔滨商业大学食品工程学院,黑龙江省高等学校食品科学与工程重点实验室,黑龙江哈尔滨 150076)
寒地冬小麦冰结构蛋白的提取及抗冻活性的检测
陈凤莲,鲍 欢,曲 敏,刘羽佳,孙兆国,李凌俐,赵 旭
(哈尔滨商业大学食品工程学院,黑龙江省高等学校食品科学与工程重点实验室,黑龙江哈尔滨 150076)
以东农冬麦1号寒地冬小麦面粉为原料,利用磷酸盐缓冲溶液结合冰提法提取寒地冬小麦冰结构蛋白,通过单因素和响应曲面实验,得到提取寒地冬小麦冰结构蛋白的最佳工艺为:料液比1∶15,磷酸盐缓冲溶液浓度为10 mol/mL,pH7.8,搅拌时间2 h,冰球用量10个,冰提时间2 min,冰提温度-10 ℃,在此条件下对寒地冬小麦冰结构蛋白溶液进行复提,复提三次得到寒地冬小麦冰结构蛋白,提取率为18.2%。将寒地冬小麦冰结构蛋白进行浓缩,制成冻干粉,复溶至5%,对其进行冰晶观察,检测寒地冬小麦冰结构蛋白的抗冻活性,结果显示,寒地冬小麦冰结构蛋白复溶液冰晶排列整齐,形态各异,具有很好的抗冻活性。将其应用到冷冻面团中,面团品质得到了较好的改善。
高寒冬小麦,冰提,冰结构蛋白,冰晶
冰结构蛋白(Ice Structuring Proteins,ISPs),又称为抗冻蛋白、不冻蛋白(Antifreeze Protein,AFP),广泛地分布于各类有机体中,如鱼类、昆虫、动物、植物、细菌和真菌等[1-5]。冰结构蛋白具有三大特性[6]:一是ISPs具有非依数性降低冰点的抗冻活性,主要表现在ISPs可以影响结冰过程,而不影响熔化过程;二是ISPs具有抑制冰晶生长的作用,而且该作用在冰晶的不同方向上强弱是不同的,冰晶形态检测的方法,适用于定性检测。张超等[7]发现冬小麦麸皮中存在ISPs,并进一步对冬小麦麸皮抗冻蛋白(TaISPs)进行分离纯化,研究其理化性质、一级结构、二级结构,并以一级结构为基础,探讨TaISPs与冰晶的结合方式,揭示其抗冻机理。本实验采用黑龙江省黑河地区种植的东农冬麦1号寒地冬小麦面粉为原料,利用ISPs可吸附在冰晶表面的性质,采用改进的冰结合磷酸盐缓冲溶液法提取寒地冬小麦ISPs,对其进行冰晶形态的观察,检测其是否具有抗冻活性。将寒地冬小麦ISPs添加到冷冻面团中,考察对冷冻面团质地的影响。我国冬小麦种植地区生态条件具有多样性,东农冬麦1号寒地冬小麦种植于在我国黑龙江省东北部(45度-47度),高产稳产,耐寒性极强。对寒地冬小麦冰结构蛋白的研究,旨在拓宽寒地冬小麦的开发利用,为我国小麦育种提供理论基础。
1 材料与方法
1.1 材料与仪器
东农冬麦1号寒地冬小麦面 粉由绿禾农产品种植合作社提供;考马斯亮蓝G250 美国Sigma公司;磷酸二氢钠 分析纯,天津市耀华化学试剂有限责任公司;磷酸氢二钠 分析纯,天津市致远化学试剂有限公司。
UV-5100B紫外-可见分光光度计 上海元析仪器有限公司;FDU-1200型冷冻干燥机 日本东京理化;Z366高速大容量台式离心机 德国哈默公司;DM750生物显微镜 瑞士莱卡显微系统有限公司;TA-XT2i型质构仪 英国SMS公司。
1.2 实验方法
1.2.1 寒地冬小麦蛋白质含量的测定 参照GB/T5511-2008测定寒地冬小麦蛋白质的含量。
1.2.2 冰提寒地冬小麦蛋白质含量的测定 采用考马斯亮蓝法。
1.2.2.1 标准曲线的制作 采用考马斯亮蓝比色法。配制牛血清白蛋白100 ug/mL,分别精确吸取牛血清蛋白标准溶液0、0.2、0.4、0.6、0.8、1.0 mL于试管中,分别加蒸馏水至1 mL,然后在各支试管中分别加入5.0 mL考马斯亮蓝G-250溶液、摇匀,在595 nm波长处测吸光度。后以标准蛋白浓度为横坐标,吸光度为纵坐标,绘制曲线。
1.2.2.2 冰提寒地冬小麦蛋白提取率的测定
式中:M1为冰提后寒地冬小麦蛋白质量;M2为磷酸盐缓冲溶液提取的寒地冬小麦蛋白质量。
1.2.3 寒地冬小麦ISPs的提取
1.2.3.1 冰球的制备 冰球为统一规格的玻璃珠放入冰格板中加水冰冻而成。冰球直径约为2 cm。
1.2.3.2 提取方法 称取5份3 g寒地冬小麦面粉,分别与不同浓度,不同pH,不同料液比的磷酸盐缓冲溶液混合搅拌,在室温条件下提取不同时间。然后用离心机以2000 r/min离心15 min,取离心后的上清液并记录溶液体积,取1 mL上清液用蒸馏水稀释100倍后加入5 mL考马斯亮蓝测其分光光度值。而后将剩余液体加入提前冻好的不同数量的冰球,放入-10 ℃的冰箱中,冰提2 min待冰球表面吸附的ISPs达到饱和,将冰球取出,置于室温下自然融化,测其分光光度值。
1.2.4 单因素实验设计
1.2.4.1 磷酸盐缓冲溶液料液比对冰提寒地冬小麦ISPs提取的影响 在磷酸盐缓冲溶液浓度为10 mol/mL,pH7.8,搅拌时间2 h,冰球用量10个,冰提时间2 min,冰提温度-10 ℃时,以不同的料液比:1∶10、1∶15、1∶20、1∶25、1∶30,按上述方法进行单因素实验,研究磷酸盐缓冲溶液料液比对寒地冬小麦ISPs提取的影响。
1.2.4.2 磷酸盐缓冲溶液浓度对寒地冬小麦ISPs提取的影响 在料液比1∶15,pH7.8,搅拌时间2 h,冰球用量10个,冰提时间2 min,冰提温度-10 ℃时,添加不同浓度的磷酸盐缓冲溶液:6、8、10、12、14 mol/mL,按上述方法进行单因素实验,研究磷酸盐缓冲溶液浓度对寒地冬小麦ISPs提取的影响
1.2.4.3 磷酸盐缓冲溶液pH对寒地冬小麦ISPs提取的影响 在料液比1∶15,磷酸盐缓冲溶液浓度为10 mol/mL,搅拌时间2 h,冰球用量10个,冰提时间2 min,冰提温度-10 ℃时,改变磷酸盐缓冲溶液的pH7.2、7.4,、7.6,、7.8,、8.0,按上述方法进行单因素实验,研究磷酸盐缓冲溶液pH对寒地冬小麦ISPs提取的影响。
1.2.4.4 搅拌时间对寒地冬小麦ISPs提取的影响 在料液比1∶15,磷酸盐缓冲溶液浓度为10 mol/mL,pH7.8,冰球用量10个,冰提时间2 min,冰提温度-10 ℃时,以不同的搅拌时间0.5、1.0、1.5、2.0、2.5、3.0 h,按上述方法进行单因素实验,研究搅拌时间对寒地冬小麦ISPs提取的影响。
1.2.4.5 冰球数量对寒地冬小麦ISPs提取的影响 在料液比1∶15,磷酸盐缓冲溶液浓度为10 mol/mL,pH7.8,搅拌时间2 h下进行提取后,向42 mL左右粗蛋白(磷酸盐缓冲溶液提取)溶液中分别加入规格相同的6、8、10、12、14个冰球,冰提时间2 min,冰提温度-10 ℃,按上述方法进行单因素实验,研究冰球数量对寒地冬小麦ISPs提取的影响。
1.2.5 响应面实验设计 根据Box-Behnken设计原理,以寒地冬小麦冰结构蛋白质提取率为响应值,在单因素实验结果的基础上,综合考虑选择磷酸盐缓冲溶液浓度、料液比、pH 3个因素进行响应面实验设计,见表1。
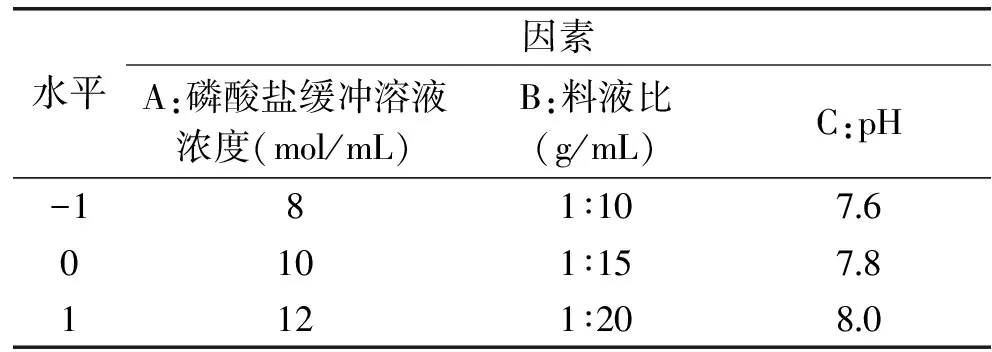
表1 响应面实验因素与水平
1.2.6 复提寒地冬小麦ISPs 根据单因素实验和响应曲面实验,确定寒地冬小麦ISPs提取的最佳实验工艺条件,在最佳工艺条件下,对寒地冬小麦冰结构蛋白进行复提(对磷酸盐缓冲溶液提取后的粗蛋白溶液重复三次冰提),计算寒地冬小麦ISPs提取率。
1.2.7 寒地冬小麦蛋白冰晶形态观察 在最佳工艺条件下,复提寒地冬小麦ISPs溶液,将其旋转蒸发浓缩后,冷冻干燥成冻干粉,将冻干粉用磷酸盐缓冲溶液进行复溶,复溶至浓度5%,在显微镜下,观察高寒ISPs溶液的冰晶形态。并以水、3%蔗糖溶液和3%复溶溶液进行对照。
1.2.8 添加寒地冬小麦ISPs对冷冻面团的影响 称取2份50 g普通高筋粉,加入等比例的水制作成面团,分别标为空白组,实验组。其中空白组为不添加寒地冬小麦冰结构蛋白的面团,实验组为以面粉为100%加入1%的寒地冬小麦冰结构蛋白冻干粉,冷冻48 h以上,利用Brabender物性仪对其进行检测,并进行三次平行实验。测定方式:T.P.A;探头:P/50;测试前速率:2.00 mm/s;测试中速率:1.00 mm/s;测试后速率:1.00 mm/s;压缩程度:50%;力度:100 g;停留间隔:5 s;数据采集速率:200 pps。从质构特性参数当中选取硬度、黏附性、弹性、内聚性和咀嚼性指标进行评价[8-10]。
1.3 数据处理
采用Design-Expert软件进行三因素三水平Box-Behnken实验设计和分析。
2 结果与分析
2.1 寒地冬小麦面粉的蛋白含量
寒地冬小麦面粉的蛋白含量为12.25%。
2.2 牛血清蛋白标准曲线的制作
标准曲线的回归方程:y=0.0098x+0.1244,R2=0.9955,标准曲线的相关性良好。将测量的吸光度值带入标准曲线中,计算蛋白质含量。
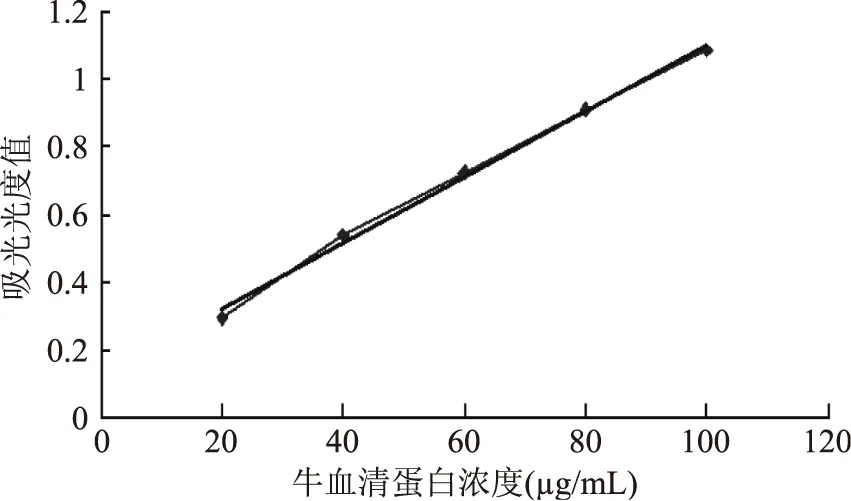
图1 牛血清蛋白溶液Fig.1 Bovine serum albumin standard curve
2.3 寒地冬小麦提取ISPs的单因素实验结果
2.3.1 磷酸盐缓冲溶液料液比对ISPs提取的影响 料液比1∶10时,寒地冬小麦ISPs不能被充分提取,提取率较低。料液比在1∶15时,寒地冬小麦ISPs被磷酸盐缓冲溶液充分提取,提取率最大,达到10.49%。料液比达到1∶20时,由于缓冲液过多,提取率逐渐下降。料液比的最佳范围为1∶10~1∶20。

图2 料液比对ISPs提取的影响Fig.2 Effect of solid/solvent ratio on antifreeze protein extraction
2.3.2 磷酸盐缓冲溶液浓度对ISPs提取的影响 缓冲液浓度在6 mol/mL时,由于缓冲液浓度较低,冰提寒地冬小麦ISPs不能被充分溶出。缓冲液浓度升高到10 mol/mL时,寒地冬小麦ISPs的提取率达到最高9.86%。之后,由于缓冲液浓度的升高,影响了寒地冬小麦ISPs的溶出,提取率随之下降。因此,磷酸盐缓冲液浓度的最佳范围8~12 mol/mL。
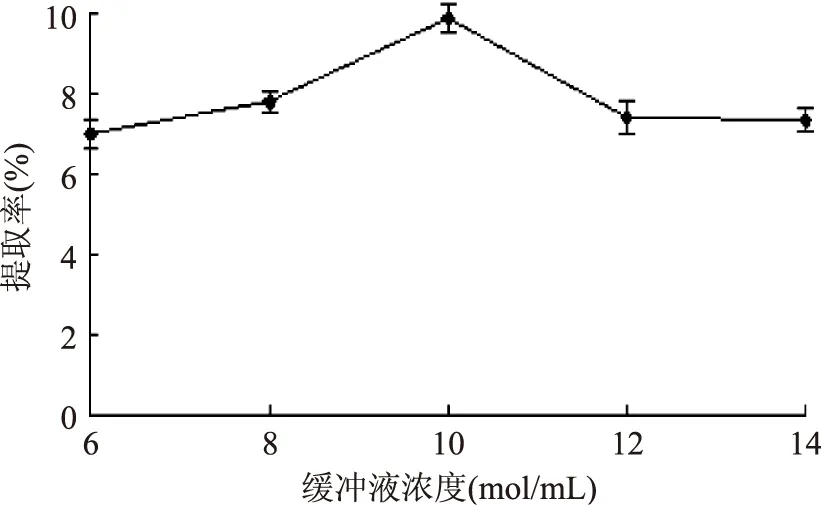
图3 缓冲液浓度对ISPs提取的影响Fig.3 Effect of buffer concentration on antifreeze protein extraction
2.3.3 磷酸盐缓冲溶液pH对ISPs提取的影响 缓冲液pH=7.2到7.8时,寒地冬小麦ISPs提取率逐渐升高,在pH=7.8时,ISPs提取率达到最大11.57%,但在pH达到8时,ISPs提取率明显下降。说明最佳提取pH范围为7.6~8。

图4 缓冲液pH对ISPs提取的影响Fig.4 Effect of pH on antifreeze protein extraction
2.3.4 搅拌时间对ISPs提取的影响 搅拌时间达到0.5 h后,随着搅拌时间的增加,寒地冬小麦ISPs的提取率逐渐升高。到达2 h时,ISPs提取率达到10.23%,之后,继续增加搅拌时间,ISPs的提取率趋于稳定,说明寒地冬小麦ISPs充分溶出。所以,最佳的搅拌时间为2 h。

图5 搅拌时间对ISPs提取的影响Fig.5 Effect of stirring time on antifreeze protein extraction
2.3.5 冰球数对ISPs提取的影响 随着冰球数量的增加,冰球吸附的ISPs越多,ISPs的提取率越高。冰球数量达到10个时,寒地冬小麦ISPs的提取率达到10.92%。之后,继续增加冰球数量,由于冰球不能完全被缓冲溶液提取的粗蛋白溶液覆盖,寒地冬小麦ISPs提取率逐渐下降。所以,10个冰球为最优条件。
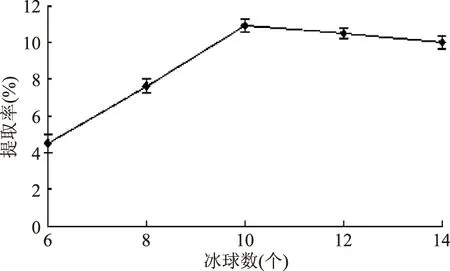
图6 冰球数量对ISPs提取的影响Fig.6 Effect of number of ice ball on antifreeze protein extraction
2.4 提取最佳工艺条件的确定
通过单因素方差分析,得到因素对寒地冬小麦ISPs提取率的影响程度大小顺序为:料液比>磷酸盐缓冲溶液浓度>pH>冰球数量>提取时间,故最佳提取工艺条件优化时,选择影响程度最大的3个因素。根据Box-Behnken的中心组合实验设计原理,选择料液比、磷酸盐缓冲溶液浓度、pH 3个因素,采用三因素三水平的响应分析方法求取优化的工艺参数,实验设计和结果见表2、表3。实验次数为17次,其中析因部分实验次数为12,中心点重复实验次数为5。利用 Design Expert 软件对表2的实验结果进行二次多元回归拟合,并进行方差分析,结果见表3。对响应值与各因素进行回归拟合后,得到的寒地冬小麦冰ISPs提取率(Y)对编码自变量的回归模型表达式。
Y=9.53+0.034A-0.17B+0.44C-0.063AB+1.28AC+0.15BC+0.64A2+0.12B2-0.36C2
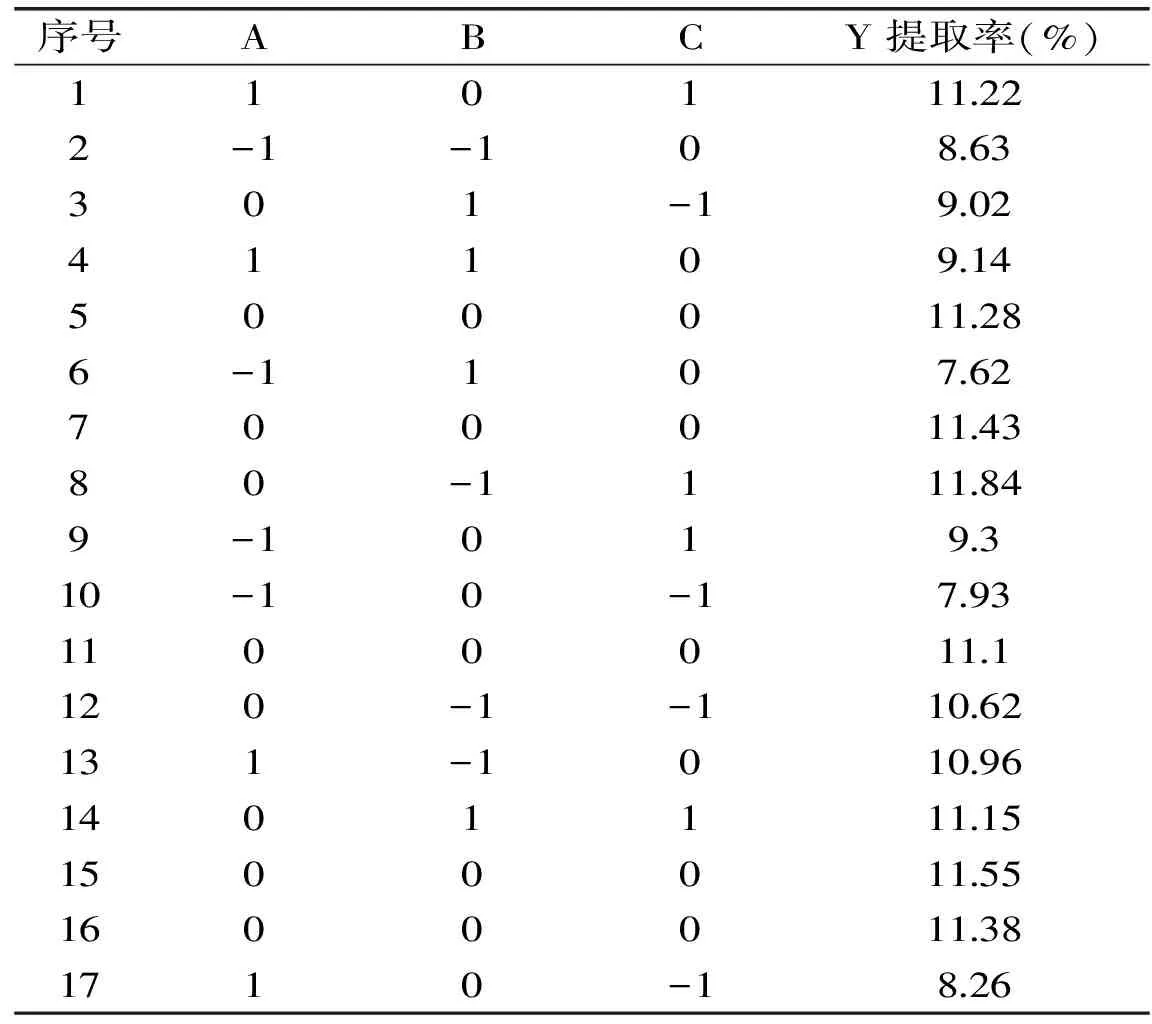
表2 响应面实验分析方案及结果
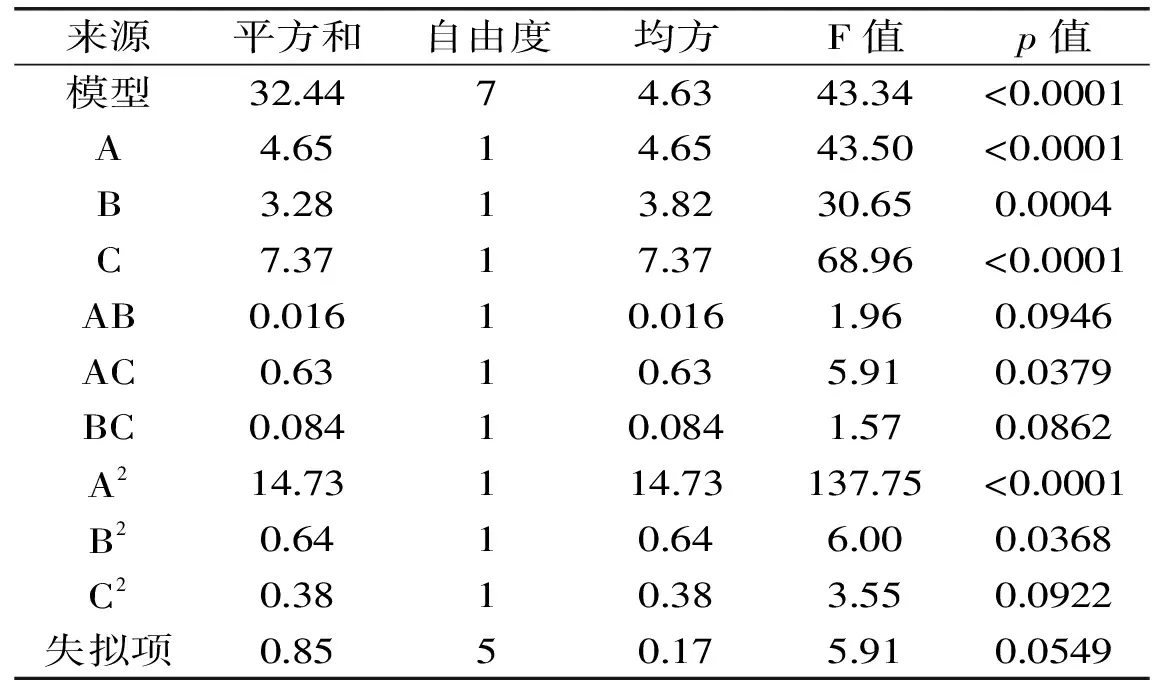
表3 回归模型的方差分析
从表3可知,此模型显著(p<0.01,A、B、C、AC、A2、B2对寒地冬小麦ISPs提取率有显著影响。模型失拟项(p=0.0549,不显著),说明该回归模型对实验结果拟合较好,回归方程整体模型极显著,并且失拟项不显著,表明该回归模型与实测值能较好地拟合。因此可利用该回归模型对实验结果进行分析,并确定寒地冬小麦ISPs的最优提取工艺。各因素的F值可以反映出各因素对实验指标的重要性,F值越大,表明对实验指标的影响越大。从方差分析结果可知:F(A)=43.50,F(B)=30.65,F(C)=68.96,即各因素对寒地冬小麦ISPs提取率的影响程度大小顺序为:pH>磷酸盐缓冲溶液浓度>料液比。
为了考察交互项对冬小麦ISPs提取率的影响,在其他因素条件固定不变的情况下,考察交互项对ISPs提取率的影响,对模型进行降维分析。经Design Expert7.0软件分析,得到随着因素的增大,响应值逐渐减小或不再增大。在交互项对蛋白提取率的影响中,磷酸盐缓冲液浓度和pH交互作用对提取率的影响显著,其次是pH和料液比交互作用,影响最小的是磷酸盐缓冲液浓度与料液比交互作用。经过软件分析,得到最优提取条件为料液比1∶15,磷酸盐缓冲液浓度为10.45 mol/mL,pH7.82。得到的蛋白提取率为11.84%。选取最佳工艺条件:料液比1∶15,磷酸盐缓冲液浓度为10 mol/mL,pH7.8,经过3次平行实验,得到的蛋白提取率为11.78%,稍低于实验的设计值,但接近于最优提取条件的预测值,实验值与预测值相符合。
2.5 复提寒地冬小麦蛋白质
在最佳提取工艺条件下,对缓冲溶液提取的寒地冬小麦粗蛋白溶液重复三次冰提,得到寒地冬小麦蛋白质提取率为18.2%。
2.6 寒地冬小麦ISPs的冰晶观察
ISPs具有抑制冰晶生长的作用,而且该作用在冰晶的不同方向上强弱是不同的,因而引起冰晶形态的改变。在电子显微镜下,放大40倍进行观察,纯水中,冰晶形状为大的圆形,由图7可以看出,寒地冬小麦ISPs溶液的冰晶形态大多呈水滴形和小圆形,分布均匀,也出现多边形,短棒形甚至线性,冰晶形态理想。由图8可以看出,水的冰晶呈大圆泡型,排列致密;蔗糖溶液的冰晶数量多,体积小,形态单一,呈小圆形,排列较紧密。可见,寒地冬小麦ISPs对冰晶生长的抑制及对冰晶的形态修饰作用显著。Yang等[11]认为冰结构蛋白的这种作用,可以在生物体内调节胞外冰晶的生长形态,避免冰晶对细胞膜造成机械损伤。由此,冰提法提取的寒地冬小麦蛋白具有较好的抗冻活性,为冰结构蛋白。

图7 5%高寒冬小麦ISPs溶液冰晶形态Fig.7 Ice crystal morphology of 5% alpine winter wheat ISPs注:A:水滴形和小圆形;B:水滴形和线形;C:多边形;D:小圆形和短棒形;E:线形。
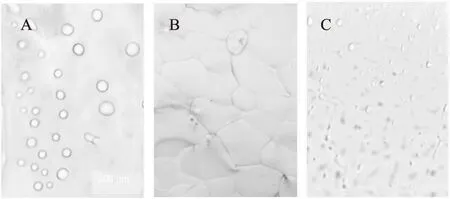
图8 高寒冬小麦ISPs溶液与蔗糖溶液、及水的冰晶形态对比Fig.8 Ice crystal morphology of alpinewinter wheat ISPs contrast to sugar solution and water注:A:3%蔗糖溶液;B:水; C:3%高寒冬小麦ISPs溶液。
2.7 添加寒地冬小麦ISPs对冷冻面团的影响
潘振兴[12]等通过采用质构分析仪、扫描电镜以及冷冻面团烘焙发酵实验法研究了ISPs对长期冻藏冷冻面团抗冻发酵特性与超微结构的影响。结果发现,ISP可以显著保护冷冻面团超微结构。Zhang[13]等研究了抗冻蛋白对冷冻面团质地特性的影响,结果发现,添加抗冻蛋白的实验组冷冻面团的硬度比空白组更加柔软和稳定。本实验从质构特性参数当中选取硬度、黏附性、弹性、内聚性和咀嚼性等指标对空白组和实验组进行比较,结果见图9,图10。
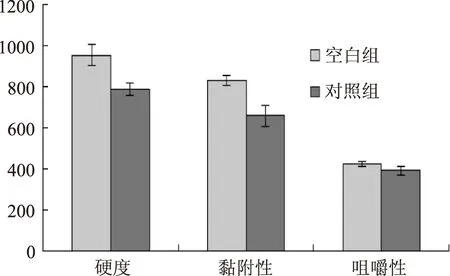
图9 硬度、黏附性、咀嚼性的变化Fig.9 The change of hardness,adhesion and chewiness
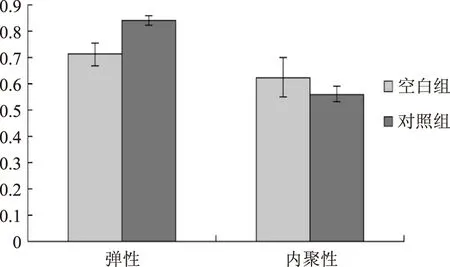
图10 弹性、内聚性的变化Fig.10 The change of elasticity and cohesion
未添加ISPs的面团由于经过冷冻过程,使面筋质量变差,内部组织变硬,所以面团硬度升高,咀嚼性和内聚性增加,弹性下降,经过缓冻后面团表面黏附性增加。而添加了寒地冬小麦ISPs的面团,由于其能够改变冰晶形态,影响面团中淀粉和蛋白质的凝胶性、持水性等,从而影响面团的质构特性。使面团的硬度、黏附性、咀嚼性和内聚性有所下降,弹性有所提高,面团的品质得到了明显改善。因此,寒地冬小麦抗冻蛋白能够提高冷冻面团的抗冻性。
3 结论
在最佳工艺条件:料液比1∶15,磷酸盐缓冲溶液浓度为10 mol/mL,pH7.8,搅拌时间2 h,冰球用量10个,冰提时间2 min,冰提温度-10 ℃,提取后复提,得到寒地冬小麦ISPs的提取率为18.2%。对寒地冬小麦ISPs进行冰晶形态的观察,得到小圆形,三角形,椭圆形,四边形,五边形和六边形的冰晶结构,并且冰晶分布均匀,可知寒地冬小麦ISPs具有抗冻活性。将寒地冬小麦ISPs加入到冷冻面团中,经物性仪检测,冷冻面团品质得到了改善。
[1]Graether S P,Kuiper M J,Gagn S M,et al. Helix structure and ice-binding properties of a hyperactive antifreeze protein from an insect[J]. Nature,2000,406:325-328.
[2]Atici O,Nalbantoglu B. Antifreeze proteins in higher plants[J]. Phytochemistry,2003,64(7):1187-1196.
[3]Zhong Q W,Fan T J. Advances in fish antifreeze protein research[J]. Acta Biochimica Et Biophysica Sinica,2002,34(2):124-130.
[4]Lu C F,Wang H,Jian L C,et al. Progress in study of plant antifreeze proteins[J]. Progress in Biochemistry and Biophysics,1998,25(3):210-216.
[5]Jia Z C,Davies P L. Antifreeze proteins:an unusual receptor-ligand interaction[J]. Trends in Biochemical Sciences.2002,27(2):101-106.
[6]Davies P L,BAARDSNES J,KUIPER M J,et al. Structure and function of antifreeze proteins[J]. Philosophical Transactions of the Royal Society B:Biological Sciences,2002,357:927-935.
[7]张超. 冬小麦麸皮抗冻蛋白结构及其抗冻机理的研究[D]. 江南大学硕士学位论文,2008.
[8]曲敏,董正婷等.苜蓿冰结构蛋白的提取及对冷冻面团的影响[J].食品科学,2014,35(24):57.
[9]任顺成,李绍虹,范永超等. 增稠剂对冷冻面团品质影响的研究[J]. 粮食加工,2010,35(3):46-50.
[10]汪少芸,赵珺,吴金鸿等. 抗冻蛋白的研究进展及其在食品工业中的应用[J]. 北京工商大学学报:自然科学版,2011,29(4):50-56.
[11]Yang D S C,Sax M,Chakrabartty A,et al.Crystal-structure of an antifreeze polypeptide and its mechanistic implications[J]. Nature,1988,333(6170):232-237.
[12]潘振兴,邹奇波,黄卫宁.冰结构蛋白对长期冻藏冷冻面团抗冻发酵特性与超微结构的影响[J].食品科学,2008,29(8):39-42.
[13]Zhang C,Zhang H,Wang L.Effect of carrot(Daucus carota)antifreeze proteins on texture properties of frozen dough and volatile compounds of crumb[J].LWT,2008,41:1029-1036.
Extraction of apine winter wheat antifreeze protein and detection of the antifreeze activity
CHEN Feng-lian,BAO Huan,QU Min,LIU Yu-jia,SUN Zhao-guo,LI Ling-li,ZHAO Xu
(Key Laboratory for Food Science and Engineering of HeiLongjiang Province,College of Food Engineering,Harbin University of Commerce,Harbin 150076,China)
Supposing alpine winter wheat as raw material,antifreeze protein extracted from alpine winter wheat by phosphate buffer solution and ice process. Though single factor and response surface test,we concluded that the best process conditions of alpine winter wheat antifreeze protein was:the material liquid ratio was 1∶15,concentration of phosphate buffer solution was 10 mol/mL,pH was 7.8,stirring time was 2 h,ice hockey was 10,ice time was 2 min,the ice temperature was-10 ℃. Under this condition the extraction yield of antifreeze protein from alpine winter wheat was 18.2%. After extraction of antifreeze protein from alpine winter wheat,producing into freeze drying,and redissolving into 5%,its ice crystals observed to detect the antifreeze activity of alpine winter wheat protein. According to the results,the ice crystals were in order forms,and have good antifreeze activity. Applying to the frozen dough,it could improve the quality of frozen dough.
alpine winter wheat;ice process;ice structure protein;ice crystal
2015-09-10
陈凤莲(1975-),女,博士,副教授,主要从事生物技术在粮食谷物精深加工方面的应用研究,E-mail:finesxm@163.com。
黑龙江省自然科学基金项目(C2011-24);黑龙江省教育厅科学技术研究项目(12511128);黑龙江省博士后科研启动基金项目(LBH-Q13098)。
TS255.3
A
1002-0306(2016)20-0000-00
10.13386/j.issn1002-0306.2016.20.000
