辛夷挥发油GC-MS分析及其抗氧化、抗菌活性
2016-12-07张婷婷,郭夏丽,黄学勇等
辛夷挥发油GC-MS分析及其抗氧化、抗菌活性
张婷婷,郭夏丽,黄学勇,罗丽萍*
(南昌大学生命科学学院,江西 南昌 330031)
采用水蒸气蒸馏(hydrodistillation,HD)法、同时蒸馏萃取(simultaneous distillation extraction,SDE)法、静态顶空(static headspace,SH)法3 种方法对辛夷挥发油进行提取,通过气相色谱结合标准品获得保留指数,气相色谱-质谱联用结合数据库检索进行定性,确定不同方法提取的挥发油的成分和相对含量,并采用1,1-二苯基-2-三硝基苯肼自由基清除法、普鲁士蓝法和新铜试剂法比较HD法和SDE法挥发油的抗氧化能力,以及滤纸片扩散法和96 孔板法测定抗菌活性。结果表明,3 种方法共鉴定出66 种化学成分,其中17 种共有成分。从HD法和SDE法挥发油中分别鉴定出47 种和43 种化合物,SH法对辛夷粉末分析检测到26 种化合物。其中,HD和SDE提取的化合物成分较接近,而SH法获得的挥发成分最少,三者相同成分的相对含量也存在较大差异。HD法和SDE法挥发油均表现出一定的抗氧化活性,对供试菌(金黄色葡萄球菌、单增李斯特氏菌、大肠杆菌、鼠伤寒沙门氏菌)均有抑制作用,对其中的革兰氏阴性菌的抑制效果较好。辛夷挥发油的抗氧化和抗菌研究显示其具有药学研究价值和作为食品天然抗菌剂和食品防腐剂的潜能。
辛夷;挥发油;气相色谱-质谱联用;静态顶空;同时蒸馏萃取;水蒸气蒸馏;抗氧化;抗菌
张婷婷, 郭夏丽, 黄学勇, 等. 辛夷挥发油GC-MS分析及其抗氧化、抗菌活性[J]. 食品科学, 2016, 37(10): 144-150. DOI:10.7506/spkx1002-6630-201610025. http://www.spkx.net.cn
ZHANG Tingting, GUO Xiali, HUANG Xueyong, et al. GC-MS analysis and antioxidant and antimicrobial properties of volatile oil from Flos Magnoliae[J]. Food Science, 2016, 37(10): 144-150. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201610025. http://www.spkx.net.cn
辛夷是木兰科(Magnoliaceae)落叶乔木植物紫玉兰(Magnolia liliiflora Desr.)或望春玉兰、玉兰(M. denudata Desr.)、武当玉兰(M. sprengeri Pamp.)的花蕾,也可以指其他木兰属植物的花蕾[1],产于中国河南、江苏、陕西等地[2]。辛夷性温,味辛微苦,归肺、胃经[3]。具有散风寒,通鼻窍之功效,常用于治疗风寒头痛、鼻塞、鼻渊、鼻流浊涕等症状,是重要的中药材[4]。辛夷主要成分有挥发性物质、生物碱、木脂素类、酚酸性化合物等,其中挥发性物质是其主要生物活性成分[5],且组成复杂,包括烃、酮、醇、酯、醛、酸、酚、醚类等化合物,且具有特殊的香气,因此辛夷也是重要的香精原料[6]。
辛夷挥发性物质的化学成分是其开发利用价值的重要评价指标[7]。目前,对挥发性物质的提取采用气相色谱法或气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)法鉴定已有多处报道。如李卫民等[8]从水蒸气蒸馏(hydrodistillation,HD)法提取的挥发油中鉴定出38 种化合物,主要有桉油精、金合欢醇等;赵欧等[9]从HD法所得辛夷挥发油中鉴定出34 种成分,主要成分是桉油精、樟脑等;魏鹏程等[10]用HD法所得挥发油有30 种成分,主要成分是桉油精、β-蒎烯,用同时蒸馏萃取(simultaneous distillation extraction,SDE)法研究辛夷成分,鉴定出30 种成分,主要是桉油精、β-蒎烯、α-松油醇等。但是用科瓦茨指数(Kovats index,KI)对辛夷挥发油进行准确定性及研究其体外生物活性的报道较少。为明确辛夷挥发油的不同提取制备方法对其产物化学组成的影响,本研究分别采用HD法、SDE法和静态顶空(static headspace,SH)法对辛夷挥发油进行提取,通过GC结合标准品获得各主要成分的KI,GC-MS结合数据库检索进行定性定量分析,从而对3 种方法提取物质的化学组成准确定性,并对其进行比较分析。以1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除法、普鲁士蓝法、新铜试剂法研究辛夷挥发油的抗氧化活性,并用滤纸片法和96 孔板法研究其体外抗菌活性。从而为辛夷在医药和食品工业中的应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
辛夷的干燥花蕾 江西省黄庆仁栈华氏大药房;阴干后用粉碎机粉碎过CB20号筛,收集粉末封袋保藏。
金黄色葡萄球菌(Staphylococcus aureus ACCC 01170)、单增李斯特菌(Listeria monocytogenes ACCC 0356)、大肠杆菌(Escherichia coli ACCC 0169)、鼠伤寒沙门氏菌(Salmonella typhimurium ACCC 530013)中国农业微生物菌种保藏中心;C10~C25正构烷烃混标美国O2si公司;DPPH、新亚铜 美国Sigma公司;芦丁标准品 中国医药上海化学试剂公司;铁氰化钾天津市福晨化学试剂厂;Na2HPO4•12H2O 西陇化工股份有限公司;NaH2PO4·2H2O 上海青析化工科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
6890/5973 GC-MS联用仪 美国Agilent公司;HD装置 上海满贤经贸有限公司;SDE装置 安徽天长优信电器设备有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;电热恒温干燥箱 上海跃进医疗器械厂;人工气候箱 宁波东南仪器有限公司;722E型可见分光光度计 上海光谱仪器有限公司;电子分析天平(精度0.001 g) 上海精密科技仪器有限公司。
1.3 方法
1.3.1 样品的制备
1.3.1.1 HD法
准确称量30 g辛夷粉末装入1 000 mL圆底烧瓶中,加300 mL去离子水,加热沸腾5 h,收集蒸馏液,无水乙醚萃取,加入适量无水硫酸钠干燥,收集,35 ℃旋转蒸发除去乙醚后获得淡黄色具有特殊香气的挥发油,平行实验2 次,平均得率为0.77%。取适量挥发油用正己烷溶解稀释,待GC-MS检测。
1.3.1.2 SDE法
准确称量30 g辛夷粉末置于1 000 mL圆底烧瓶中,加入350 mL去离子水,连接SDE装置的一端,使用电炉加热,另一端连接装有45 mL无水乙醚的250 mL烧瓶并进行50 ℃水浴加热,沸腾3.5 h,收集乙醚萃取液,加入适量无水硫酸钠干燥,除去硫酸钠用旋转蒸发仪在35 ℃浓缩,得到乳黄色芳香气味的挥发油,平行实验2 次,平均得率为1.05%。取适量挥发油用正己烷溶解稀释待GC-MS检测。
1.3.1.3 SH法
将1 g辛夷粉末加入10 mL的顶空瓶,置顶空进样器中进样,顶空瓶加热温度90 ℃,定量环温度95 ℃,平衡30 min,进样1 mL,进入GC-MS检测。
1.3.1.4 正构烷烃混标进样前处理
将1 mg/mL的C10~C25正构烷烃混标用正己烷稀释,待GC-MS检测。
1.3.2 GC条件
Agilent HP-1色谱柱(30 m×0.25 mm,0.25 μm);载气为He,载气流速1 mL/min;进样量1 μL;分流比20∶1;柱前压8.04 psi(55.44 kPa);进样口温度270 ℃;程序升温:起始柱温60 ℃,保持2 min,以10 ℃/min升至280 ℃,保持10 min,共用时34 min。
1.3.3 MS条件
电子电离源(70 eV);离子源温度230 ℃;接口温
度250 ℃;传输线温度280 ℃;质量扫描范围35~400 u;溶剂延迟时间3.00 min;四极杆温度150 ℃。
1.3.4 定性和定量分析
挥发油被GC分离的各成分按公式(1)计算其KI:

GC-MS数据采集得到的总离子流图中各质谱图运用NIST 02.L标准谱库检索,并与NIST数据库中相应标准文献的KI对比确定[12-19],即为b法;其他组分用质谱库检索匹配度最高的结果确定,即为a法。用峰面积归一化法进行定量分析。
1.3.5 辛夷挥发油的抗氧化活性测定
1.3.5.1 清除DPPH自由基活性[20]
将HD、SDE挥发油分别用甲醇稀释成5、6、7、8、9、10 mg/mL样液,阳性对照芦丁标准品稀释成0、0.04、0.05、0.06、0.07 mg/mL的样液。分别取各质量浓度样液0.1 mL,加入3.9 mL的0.075 mmol/L DPPH-甲醇溶液(现配现用),以0.1 mL甲醇作空白。室温黑暗条件下静置90 min后,于波长517 nm处测定其吸光度。按公式(2)计算自由基清除率:
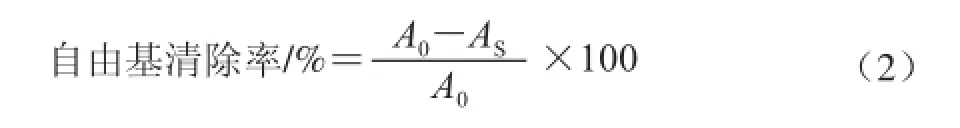
式中:A0为空白样液最终的吸光度;AS为挥发油和芦丁样液最终的吸光度。
计算结果用于制作自由基清除率-样品质量浓度的曲线。50%抑制浓度(half maximal inhibitory concentration,IC50)可通过自由基清除率-样品浓度的曲线的回归模型来求出,数值越大,抗氧化活性越小。由于IC50结果受DPPH质量浓度的影响,而目前很多文献中使用的DPPH浓度不一,因此无法与其他报道中的数据相比较,而抗氧化活性指数(antioxidant activity index,AAI)消除了DPPH质量浓度对测定结果的影响,因此选择AAI作为抗氧化活性的标准,按公式(3)计算:

式中:AAI为抗氧化活性指数;C[DPPH]e为DPPH终质量浓度/(μg/mL)。
1.3.5.2 普鲁士蓝法测抗氧化活性[21]
用甲醇将HD、SDE辛夷挥发油配制成0、1.4、1.8、2.8、3.2、3.6 mg/mL的样液,取各等级样液1 mL于试管中,加入2.5 mL磷酸缓冲液(0.2 mol/mL,pH 6.6)和2.5 mL 1%铁氰化钾溶液,放入50 ℃水浴锅中静置20 min,冷却后,加入2.5 mL 10%三氯乙酸溶液。从试管中取出1 mL溶液(即还剩7.5 mL),再加7.5 mL蒸馏水和1.5 mL 0.1%氯化铁溶液。静置10 min后,在波长700 nm处测吸光度,用甲醇组调零。
以芦丁标准品作对照,用甲醇将芦丁标准品配制成0.06、0.08、0.10、0.12、0.14 mg/mL的样液,按上述方法进行实验,记录其吸光度。
1.3.5.3 新铜试剂法测定抗氧化能力[22]
用甲醇配制10 mg/mL的HD、SDE辛夷挥发油,备用。取0.75 mL氯化铜溶液(0.01 mol/L)于试管中,再依次加入0.75 mL新亚铜-乙醇溶液(7.5×10-3mol/L)、0.75 mL醋酸铵缓冲液(1 mol/L)。分别向各个试管中加入0.03、0.04、0.05、0.06、0.07 mL的挥发油,以甲醇作空白。用蒸馏水定容至3 mL。将试管口塞好,在室温条件下放置30 min后,在波长450 nm处测吸光度。用甲醇组调零。
以芦丁标准品作对照,将芦丁配制成1 mg/mL溶液,按0、0.02、0.03、0.04、0.05、0.06的梯度进行上述实验,记录其吸光度。
1.3.6 辛夷挥发油抑菌活性测定
1.3.6.1 滤纸片扩散法测挥发油抑菌活性
将HD、SDE法提取的辛夷挥发油分别用无水甲醇稀释成8 个质量浓度梯度,分别为30、15、7.5、3.75、1.875、0.937 5、0.468 75、0.234 375 mg/mL。以无水甲醇做空白对照。在超净工作台上将倒入平板中的LB培养基凝固时,向培养基中加入已备好的106CFU/mL的金黄色葡萄球菌、单增李斯特氏菌、大肠杆菌、鼠伤寒沙门氏菌4 种菌悬液100 μL,注入圆形平板,涂布均匀。吸取样品溶液7 μL,滴在已灭菌的圆形滤纸片(直径为0.6 cm)上,待甲醇挥发后,分别固定在平板中指定的位置上,每个样品3 个平行,在37 ℃培养箱恒温培养24 h。记录抑菌圈的大小,取其平均值,以mm为单位。
1.3.6.2 96 孔板法测辛夷挥发油的最小抑菌浓度(minimum inhibition concentration,MIC)和最小杀菌浓度(minimal bacteriocidal concentration,MBC)
将96 孔培养板用体积分数75%乙醇溶液浸泡1 h后晾干,备用。配制106CFU/mL的4 种菌液,备用。用移液枪往孔中分别注入99 μL 4 种菌液,并精确加入1 μL的0.5、1、2、4、6、8、10、15(μL/μL)浓度梯度的HD、SDE挥发油,每个梯度重复3 次,以空白培养基为阴性对照,0.5 mg/mL氨苄青霉素为阳性对照。接种后,放于37 ℃摇床培养16 h后取出观察,肉眼看小孔内澄清即在小孔内完全抑制细菌生长的最低药物浓度为MIC。从完全无菌生长的孔内再移取50 μL的液体涂板,做3 个重复,然后将培养皿放入37 ℃的培养箱中培养24 h,涂布平板完全没有菌生长出的最低浓度为MBC[23]。
2 结果与分析
2.1 GC-MS检测结果

表1 3种方法提取的辛夷挥发油化学成分分析Table 1 Chemical components of the volatile oils extracted from Flos Magnoliae with three methods
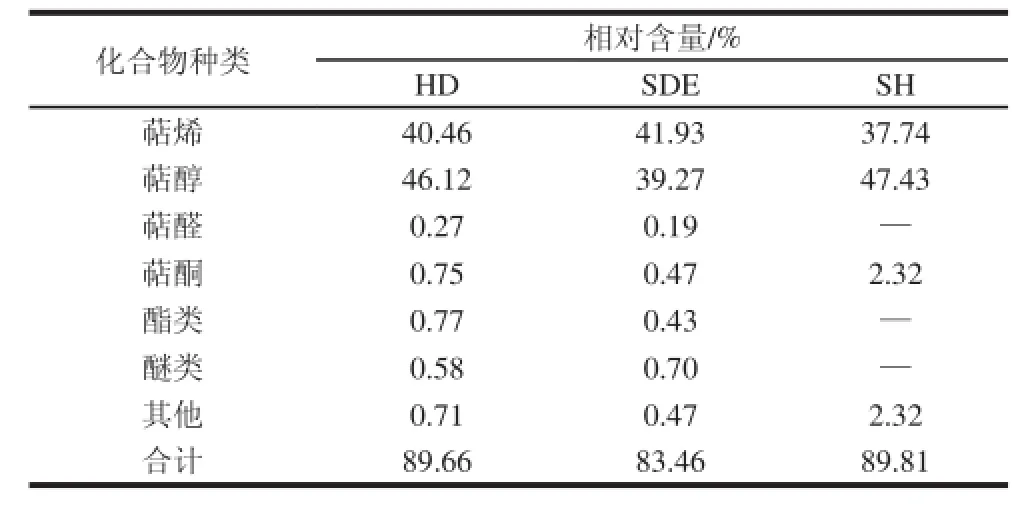
表2 3 种方法提取挥发油的组成分类和相对含量Table 2 Classifi cation and relative contents of volatiles extracted by three methods
GC-MS检测结果见表1、2。HD提取的挥发油中鉴定出了47 种化合物,占该方法提取挥发油总量的89.66%,主要有δ-杜松烯(14.18%)、α-金合欢醇(10.69%)、大根香叶烯D(7.43%)、α-杜松醇(7.14%)、τ-muurolol(7.00%)、α-衣兰油烯(4.88%)、石竹烯(4.74%)、桉叶油醇(4.66%)等。HD是提取挥发油的传统方法,提取时间长,所需温度较高,提取物含有很多沸点较高的物质[24],挥发油以萜醇类为主,其次是萜烯类。
从SDE所得样品中鉴定出了43 种化合物,占该方法提取挥发油总量的83.46%,主要有桉叶油醇(13.60%)、δ-杜松烯(9.57%)、α-金合欢醇(8.83%)、α-杜松醇(5.70%)、L-β-蒎烯(5.29%)、大根香叶烯D(5.12%)、芳樟醇(5.06%)、τ-muurolol(4.88%)、石竹烯(4.14%)等。SDE在提取挥发油同时用有机溶剂萃取,提取率高,用时相对较短,仪器结构简单操作方便[25],提取出的成分多为萜烯类,其次为萜醇类。
SH法鉴定出26 种化合物,占该方法检测到挥发性物质总量的89.81%,主要有桉叶油醇(19.06%)、R-香茅醇(9.89%)、芳樟醇(8.69%)、L-β-蒎烯(7.40%)、δ-杜松烯(6.86%)、石竹烯(3.49%)、大根香叶烯D(3.37%)、L-α-蒎烯(3.31%)等。SH快速便捷,样品消耗量少,提取温度较低,不需要有机溶剂,对色谱柱伤害少,但相对的只能得到中、低沸点的挥发油[26]。
2.2 GC-MS检测结果比较分析


图1 HD(a)、SDE(b)和SH(c)提取辛夷挥发油的GC-MS总离子流图Fig. 1 GC-MS total ion current chromatograms of volatile oils from Flos Magnoliae by HD (a), SDE (b) and SH (c)
从3 种方法的提取物中共鉴定出66 种化合物,HD和SDE、HD和HS、SDE和HS的共有成分分别为23、17 种和16 种。3 种方法的共有成分有:桉叶油醇、D-柠檬烯、L-β-蒎烯、δ-杜松烯、(+)-樟脑、R-香茅醇、古巴烯、石竹烯、反-β-金合欢烯、α-石竹烯、α-杜松醇、大根香叶烯D、α-衣兰油烯等17 种。由表2可知,辛夷挥发油的成分以萜烯类、萜醇类为主,并含有少量的萜醛、萜酮、酯类和醚类。不同方法所得提取物挥发性化学成分种类有明显的差异,导致GC-MS总离子流图也存在差异。从图1可以看出,HD和SDE 2 种方法提取的化合物成分较为接近,主要色谱峰均集中在6~18 min之间;SH获得的挥发成分较少,色谱峰集中在0~16 min之间,相同成分相对含量也存在较大差异,例如桉叶油醇在SH方法中相对含量高达19.06%,在HD中相对含量只有4.66%;SDE提取的R-香茅醇相对含量只有1.60%,而在SH法中R-香茅醇相对含量有9.89%。这主要是因为HD、SDE与SH的原理不同,前两者在蒸馏过程中会导致一定低沸点物质的损失,而后者适合分析挥发性较强,浓度比较高的物质。
2.3 辛夷挥发油的抗氧化活性测定
根据辛夷挥发油的化学组成分析,其萜烯类、萜醛类等成分均表现出一定的抗氧化活性,本研究比较SDE和HD法提取的辛夷挥发油的抗氧化能力,并以芦丁做阳性对照。
2.3.1 辛夷挥发油清除DPPH自由基活性
如表3所示,DPPH自由基清除率与样品质量浓度的回归模型为线性的回归方程,样品质量浓度与DPPH自由基清除率相关性良好。IC50和AAI结果均显示自由基的清除能力为HD挥发油<SDE挥发油<芦丁。可见辛夷挥发油清除DPPH自由基的能力较弱。

表3 辛夷挥发油清除DPPH自由基能力Table 3 DPPH radical scavenging activity of volatile oils extracted ffrroomm Flos Magnoliae by HD and SDE
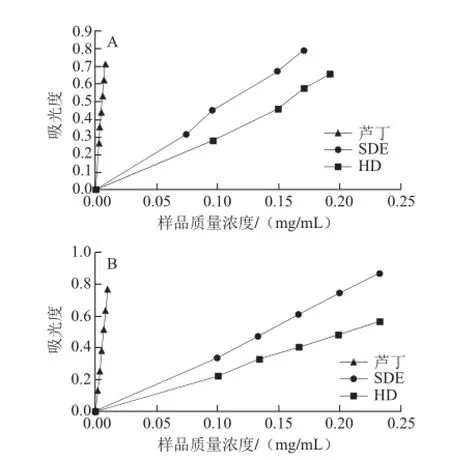
图2 普鲁士蓝法(A)和新铜试剂法(B)测定辛夷挥发油的抗氧化能力结果Fig. 2 Antioxidant capacities of volatile oils from Flos Magnoliae measured by Prussian blue method (A) and neocuproine method (B)
2.3.2 普鲁士蓝法和新铜试剂法检测结果如图2所示,随挥发油质量浓度增大其吸光度均有不同程度增大,但与芦丁标准品相比其斜率较小,说明辛夷挥发油具有一定的抗氧化活性,但活性较弱。2 种方法测定结果均显示SDE挥发油的抗氧化能力比HD挥发油强,这是由于采用不同的提取方法,其化学组分和相对含量不尽相同,HD法提取过程会对热不稳定物质等抗氧化成分造成一定的破坏,因此HD挥发油的抗氧化能力较弱。可见提取方法对其生物活性有显著影响。
2.4 辛夷挥发油的体外抑菌实验结果
2.4.1 滤纸片扩散法测定辛夷挥发油的抑菌活性


图3 SDE法(A)和HD法(B)提取的辛夷挥发油的抑菌圈结果Fig. 3 Antibacterial activity (inhibition zone diameter, mm) of Flos Magnoliae volatile oils extracted by SDE and HD
由图3可知,一定质量浓度的辛夷挥发油能有效抑制细菌的生长,随挥发油质量浓度升高其抑菌效果增强。SDE挥发油对4 种常见菌的抑制作用规律不明显,但不同质量浓度的挥发油对鼠伤寒沙门氏菌或大肠杆菌表现出最强的抑制作用,如图3A所示,HD挥发油对4 种常见菌的抑制作用除了在挥发油质量浓度为7.5 mg/mL时大肠杆菌表现出最强的抑菌活性,其余均为鼠伤寒沙门氏菌>大肠杆菌>金黄色葡萄球菌>单增李斯特氏菌,如图3B所示,辛夷挥发油对革兰氏阴性菌的抑制效果更佳。另外,由不同挥发油对4 种细菌的抑制效果的数据比较发现总体上SDE挥发油比HD挥发油的抑菌效果好。
2.4.2 96 孔板法测辛夷挥发油的MIC和MBC

表4 辛夷挥发油对细菌的MIC、MBC测定结果Table 4 MIC and MBC ofFlos Magnolliiaaee volatile oils against bacterial strains mL/mL
如表4所示,SDE挥发油对大肠杆菌的抑制效果最佳,MIC=0.01 mL/mL,MBC≤0.02 mL/mL,对鼠伤寒沙门氏菌和金黄色葡萄球菌的抑菌效果次之,MIC=0.02 mL/mL,MBC≤0.04 mL/mL,对单增李斯特氏菌的抑菌能力最弱,MIC=0.04 mL/mL,MBC≤0.06 mL/mL。HD挥发油对鼠伤寒沙门氏菌的抑制效果最佳,MIC=0.02 mL/mL,MBC≤0.04 mL/mL,对大肠杆菌的抑菌效果次之,MIC=0.04 mL/mL,MBC≤0.06 mL/mL,对金黄色葡萄球菌和单增李斯特氏菌的抑菌能力较弱,MIC分别为0.04、0.06 mL/mL,MBC分别为0.08、0.08 mL/mL。以上结果与抑菌圈检测结果基本相符。辛夷挥发油与氨苄青霉素的MIC和MBC结果相比较,可以更直观的体现辛夷挥发油的抑菌效果,数值越小表明效果越好。可见2 种挥发油对4 种食源性致病菌均有良好的抑制作用,尤其是一种比较有效的大肠杆菌抑制剂,可见辛夷挥发油有作为食品防腐剂的潜能。
3 结 论
本研究在统一变量的前提条件下,集中评价了辛夷挥发油的不同提取制备方法对检测结果的影响,并采用GC-MS与KI相结合的方法为质谱定性提供进一步佐证。SH提取出的挥发油化合物种类较少,以萜烯类、萜醇类为主。HD制备样品中组成复杂,辛夷挥发油中基本组成为萜类化合物及其含氧衍生物,其中萜醇类相对含量最高。SDE得到的化合物种类较多,并且物质还原性较高,能检测到L-α-蒎烯、δ-松油烯、桉叶油醇及芳樟醇等辛夷挥发油中的多种有效组分。SDE挥发油的主要成分桉叶油醇(13.60%)是一种有效的抗菌剂和杀虫剂[27],而HD挥发油中桉叶油醇相对含量为4.66%,因此桉叶油醇可能与SDE挥发油的抗菌活性较高有关。芳樟醇被报道对口腔龋齿相关细菌及革兰氏阳性菌和革兰氏阴性菌均具有良好的抗菌活性[28],R-香茅醇也是多种高抗菌活性挥发油的主要成分[29],可见其在抗菌活性检测中发挥一定作用。
辛夷挥发油中含有大量的萜烯、萜醇及一些醛类成分,具有一定的抗氧化和抗菌抑菌活性。SDE法和HD法挥发油对4 种食源性致病菌均有良好的抑制作用,且对大肠杆菌(G+)的抑制效果值得进一步研究开发。辛夷挥发油抗氧化和抑菌实验表明SDE挥发油效果相对更好,可见SDE法是一种较有效的提取方法。另外,辛夷挥发油的活性研究,表明辛夷挥发油有一定的药学研究价值和作为食品天然抗菌剂和食品防腐剂的潜能。
[1] 国家药典委员会. 中国药典:Ⅰ部[M]. 北京: 化学工业出版社, 2000: 1432144.
[2] 宋彦君, 杨磊, 李友群, 等. 辛夷挥发油提取分离技术与应用开发研究进展[J]. 浙江农业科学, 2010(4): 825-829. DOI:10.3969/ j.issn.0528-9017.2010.04.046.
[3] 李战, 吴敏. 辛夷和苍耳子的临床药理研究进展[J]. 上海第二医科大学学报, 2004, 24(5): 393-396. DOI:10.3969/ j.issn.1674-8115.2004.05.024.
[4] 王永慧, 叶方, 张秀华. 辛夷药理作用和临床应用研究进展[J]. 中国医药导报, 2012, 9(16): 12-14. DOI:10.3969/ j.issn.1673-7210.2012.16.005.
[5] 刘星, 单杨. 辛夷的提取, 应用及其品质评价研究进展[J].食品工业科技, 2011, 32(11): 506-510. DOI:10.13386/ j.issn1002-0306.2011.11.053.
[6] 于培明, 田智勇, 许启泰, 等. 辛夷研究的新进展[J]. 时珍国医国药, 2005(7): 652-653. DOI:10.3969/j.issn.1008-0805.2005.07.059.
[7] 傅大立, 赵东欣, 孙金花, 等. 10 种国产玉兰属植物挥发油成分及系统学意义[J]. 林业科学, 2005, 41(3): 68-74. DOI: 10.3321/j.issn:1001-7488.2005.03.012.
[8] 李卫民, 田恒康. 辛夷二氧化碳超临界萃取物的化学成分研究[J].中国民族医药杂志, 1999(增刊1): 137-138. DOI:10.16041/j.cnki. cn15-1175.1999.s1.126.
[9] 赵欧, 梁逸曾. 辛夷挥发油不同提取方法的研究[J]. 质谱学报, 2007, 28(2): 106-113. DOI:10.3969/j.issn.1004-2997.2007.02.009.
[10] 魏鹏程, 赵铭钦, 刘鹏飞, 等. 不同蒸馏方法提取辛夷挥发油的比较分析[J]. 现代食品科技, 2013, 29(2): 358-361. DOI:10.13982/ j.mfst.1673-9078.2013.02.007.
[11] 廖远熹, 王昊阳, 郭寅龙, 等. 中药柴胡挥发性成分的静态顶空-气相色谱-质谱分析[J]. 质谱学报, 2005, 26(3): 187-192. DOI:10.3969/ j.issn.1004-2997.2005.03.013.
[12] DEVARAJAN T, SREEYAPUREDDY A, THAMMINENI P, et al. Essential oil constituents and in vitro antimicrobial activity of Decalepis hamiltonii roots against foodborne pathogens[J]. Journal of Agricultural and Food Chemistry, 2002, 50(11): 3147-3149. DOI:10.1021/jf011541q.
[13] SHIOTA H. Volatile components of pawpaw fruit (Asimina triloba Dunal)[J]. Journal of Agricultural and Food Chemistry, 1991, 39(9): 1631-1635. DOI:10.1021/jf00009a019.
[14] STIVASTAVA A K, SRIVASTAVA S K, SYAMSUNDAR K V. Volatile composition of Curcuma angustifolia Roxb. rhizome from central and southern India[J]. Flavour and Fragrance Journal, 2006, 21(3): 423-426. DOI:10.1002/ffj.1680.
[15] RAJESWARA R B R, KAUL P N, SYAMASUNDAR K V, et al. Comparative composition of decanted and recovered essential oils of Eucalyptus citriodora Hook[J]. Flavour and Fragrance Journal, 2003, 18(2): 133-135. DOI:10.1002/ffj.1157.
[16] GHASEMPOUR H R, SHIRINPOUR E, HEYDARI H. The constituents of essential oils of Ferulago angulata (Schlecht.) Boiss at two different habitats, Nevakoh and Shahoo, Zagross mountain, western Iran[J]. Iranian Journal of Science and Technology Transaction A-Science, 2007, 31: 309-312.
[17] MECCIA G, ROSQUETE C, ROJAS L B, et al. New labdane derivative from the essential oil of Acalypha plicata Müll. Arg[J]. Flavour and Fragrance Journal, 2006, 21(3): 559-561. DOI:10.1002/ ffj.1679.
[18] MEVY J P, BESSIERE J M, RABIER J, et al. Composition and antimicrobial activities of the essential oil of Triumfetta rhomboidea Jacq.[J]. Flavour and Fragrance Journal, 2006, 21(1): 80-83. DOI:10.1002/ffj.1511.
[19] SAMRESH D, KHAN M, SRIVASTAVA S K, et al. Essential oil composition of different accessions of Mentha × piperita L. grown on the northern plains of India[J]. Flavour and Fragrance Journal, 2004, 19(5): 437-440. DOI:10.1002/ffj.1333.
[20] SCHERER R, GODOY H T. Antioxidant activity index (AAI) by the 2,2-diphenyl-1-picrylhydrazyl method[J]. Food Chemistry, 2009, 112(3): 654-658. DOI:10.1016/j.foodchem.2008.06.026.
[21] 丽艳. 中国不同地区蜂胶醇提物化学组成及抗氧化活性[D]. 南昌:南昌大学, 2008. DOI:10.7666/d.y1540006.
[22] ÖZTURK M, AYDOGMUS-ÖZTURK F, DURU M E, et al. Antioxidant activity of stem and root extracts of Rhubarb (Rheum ribes): an edible medicinal plant[J]. Food Chemistry, 2007, 103(2): 623-630. DOI:10.1016/j.foodchem.2006.09.005.
[23] 张超, 魏琴, 杜永华. 脱油油樟叶提取物的体外抑菌活性研究[J]. 广西植物, 2011, 31(5): 690-694. DOI:10.3969/ j.issn.1000-3142.2011.05.023.
[24] 张鑫, 姚光明. 超临界CO2流萃取及与水蒸气蒸馏萃取辛夷挥发油的化学组分分析[J]. 精细化工, 1999, 16(6): 10-12. DOI:10.3321/ j.issn:1003-5214.1999.06.004.
[25] 李晓, 邬亚萍. 辛夷挥发油化学组分的GC/MS分析及在卷烟加香中的应用[J]. 烟草科技, 2002(4): 6-8. DOI:10.3969/ j.issn.1002-0861.2002.04.002.
[26] 刘文涵, 何晶晶, 滕渊洁. 顶空液液萃取-气相色谱-质谱法用于白术挥发性成分的分析[J]. 分析化学, 2015, 41(8): 1226-1231. DOI: 10.3724/SP.J.1096.2013.30111.
[27] DJABOU N, LORENZI V, GUINOISEAU E, et al. Phytochemical composition of Corsican Teucrium essential oils and antibacterial activity against foodborne or toxi-infectious pathogens[J]. Food Control, 2013, 30(1): 354-363. DOI:10.1016/j.foodcont.2012.06.025.
[28] 胡小刚, 陈剑鸿, 夏培元, 等. 芳樟醇R-和S-对映异构单体的体外抗菌活性研究[J]. 第三军医大学学报, 2013, 35(19): 2077-2080. DOI:10.16016/j.1000-5404.2013.19.035.
[29] BOUKHATEM M N, KAMELI A, SAIDI F. Essential oil of Algerian rose-scented geranium (Pelargonium graveolens): chemical composition and antimicrobial activity against food spoilage pathogens[J]. Food Control, 2013, 34(1): 208-213. DOI:10.1016/ j.foodcont.2013.03.045
GC-MS Analysis and Antioxidant and Antimicrobial Properties of Volatile Oil from Flos Magnoliae
ZHANG Tingting, GUO Xiali, HUANG Xueyong, LUO Liping*
(School of Life Sciences, Nanchang University, Nanchang 330031, China)
The volatile oil of Flos Magnoliae was extracted by simultaneous distillation extraction (SDE) method, hydrodistillation (HD) method and static headspace (SH) method, respectively. Quantitative analyses of volatile oils were carried out by retention index using gas chromatography-mass spectrometry (GC-MS) combined with database searching. To compare the volatile oils extracted with the HD and SDE methods, we used Prussian blue method and the Neocuproine method to examine their antioxidant activities, used 1,1-diphenyl-2-picrylhydrazyl (DPPH) to determine their free radical scavenging abilities, and used the fi lter paper method and the 96-well plate method to measure their antibacterial activities. The results showed that a total of 66 chemical compounds were identifi ed in the volatile oils extracted with the above three methods, 17 compounds of which were common to the three oils, showing signifi cant differences in the relative amount of each of them. A total of 47, 43 and 26 volatile compounds were identifi ed in the oils extracted with HD, SDE and SH, respectively. The composition of volatile compounds extracted with HD and SDE was similar, while SH extracted the smallest number of compounds. The Flos Magnoliae volatile oils extracted by HD and SDE showed an obvious antioxidant activity, as well as the ability to inhibit Staphylococcus aureus, Listeria monocytogenes, Escherichia coli and Salmonella typhimurium, especially Gram-negative bacteria. The antioxidant activity and antibacterial activity showed the potential usage of Flos Magnoliae volatile oils as natural food preservatives in the pharmaceutical and food industries.
Flos Magnoliae (Xinyi); volatiles; gas chromatography-mass spectrometry (GC-MS); static headspace; simultaneous distillation extraction; hydrodistillation; antioxidant; antimicrobial
10.7506/spkx1002-6630-201610025
Q94
A
2015-09-17
江西省主要学科学术和技术带头人培养对象资助项目(20123BCB22004);江西省高等学校科技落地计划项目(KJLD12051)
张婷婷(1990—),女,硕士研究生,主要从事植物化学研究。E-mail:1178621647@qq.com
*通信作者:罗丽萍(1972—),女,教授,博士,主要从事植物代谢产物研究。E-mail:lluo2@126.com
