响应面试验优化纤维素酶辅助提取莲子钻芯粉中甲基莲心碱工艺
2016-12-07夏延斌王亮亮
任 美,夏延斌,*,王亮亮
(1.湖南农业大学食品科技学院,湖南 长沙 410128;2.湖南省食品质量监督检验研究院,湖南 长沙 410111)
响应面试验优化纤维素酶辅助提取莲子钻芯粉中甲基莲心碱工艺
任 美1,夏延斌1,*,王亮亮2
(1.湖南农业大学食品科技学院,湖南 长沙 410128;2.湖南省食品质量监督检验研究院,湖南 长沙 410111)
以莲子钻芯粉为原料,采用纤维素酶辅助提取莲子钻芯粉中的甲基莲心碱,在单因素试验的基础上,选择加酶量、酶解温度、酶解时间、酶解pH值为自变量,以甲基莲心碱提取量为响应值,通过Box-Behnken响应面设计优选最佳工艺条件。结果表明:采用纤维素酶辅助提取莲子钻芯粉中甲基莲心碱,最佳提取工艺条件为加酶量3.1%(质量分数)、酶解时间1.7 h、酶解pH 4.8、酶解温度50 ℃。该工艺条件下得到的甲基莲心碱提取量为(7.02±0.22)mg/g,高于传统乙醇法(4.03±0.17)mg/g,提取量提高了71.9%。采用纤维素酶辅助提取法操作简单,条件温和,有效地提高了莲子钻芯粉的利用率。
莲子钻芯粉;甲基莲心碱;纤维素酶;响应面
任美, 夏延斌, 王亮亮. 响应面试验优化纤维素酶辅助提取莲子钻芯粉中甲基莲心碱工艺[J]. 食品科学, 2016, 37(10): 105-110. DOI:10.7506/spkx1002-6630-201610018. http://www.spkx.net.cn
REN Mei, XIA Yanbin, WANG Liangliang. Applying response surface methodology to optimize the extraction of neferine from lotus seed core powder using cellulase[J]. Food Science, 2016, 37(10): 105-110. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201610018. http://www.spkx.net.cn
莲子钻芯粉是机械钻头从莲子的果蒂到果尖钻孔取芯形成的粉末,主要由莲子皮、莲子心和莲子肉组成,其中莲子心是睡莲科植物莲成熟种子中间的绿色胚根,含有莲心碱、甲基莲心碱和异莲心碱等生物碱类物质。甲基莲心碱在三大生物碱中含量最高,具有多种生物学活性,如扩充血管[1]、抗心律失常[2]、降压作用[3]、清除活性氧自由基[4]、抑制脂质过氧化作用[5]、抗心肌缺血[6],在医学上常用来治疗高血压、
心律失常[7]、血栓、有机磷中毒等慢性疾病,应用前景广阔。
目前,莲子钻芯粉的利用率较低,一般作为动物饲料低值利用。因此,从莲子钻芯粉中提取甲基莲心碱等功效成分,不仅有利于节约植物资源,而且还能延长莲子心加工产业链。国内外对于莲芯生物碱的提取方法的研究主要包括:水提法[8]、有机溶剂提取法[9]、超声辅助提取法、超声-微波协同萃取法[10]、另外还有酸液渗漉法[11]等,对于酶法提取这一工艺少有涉及。酶法提取相对于其他方法而言具有处理条件温和、有效成分浸出率高、专一性强等优点。中药材中常采用纤维素酶或果胶酶对有效成分进行提取,它能在一定程度上溶解和软化细胞壁,破坏组成细胞壁中纤维素主要成分的β-1,4-糖苷键,改变细胞壁的通透性,细胞疏松后,使得植物细胞中的有效成分更多的溶解出来,从而提高莲心生物碱的提取率。由于莲子钻芯粉中的甲基莲心碱主要是被细胞壁中的纤维素所包裹,因此,采用纤维素酶对其进行酶解处理有利于提高甲基莲心碱的提取率。
本研究以甲基莲心碱提取量为指标,采用纤维素酶-乙醇法从莲子钻芯粉中提取甲基莲心碱,在单因素试验的基础上,通过Box-Behnken响应面试验对条件进行优化,以期提高甲基莲心碱的提取量,为莲子钻芯粉副产物的研究与利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
莲子钻芯粉于2014年6月加工于湘潭宏兴隆公司,贮藏于-10 ℃冰箱冷冻室中。
甲基莲心碱标准品(纯度≥98%) 成都曼斯特生物科技有限公司;纤维素酶(酶活力400 000 U/g) 上海瑞永生物科技有限公司;无水乙醇、醋酸钠、甲醇(均为色谱纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
B-260型恒温水浴锅 上海亚荣生化仪器厂;PHS-3C型pH计 上海奥豪斯仪器有限公司;AP-01P型真空抽滤机 天津奥特赛恩斯仪器有限公司;TGL-16C低速离心机 湖南星科科学仪器有限公司;LC-20A型高效液相色谱仪 日本岛津公司。
1.3 方法
1.3.1 甲基莲心碱的测定
1.3.1.1 色谱条件
色谱柱:Agilent ZORBAX SB-C18柱(4.6 mm×150 mm,5 μm);流动相:甲醇-0.1%三乙胺溶液配比64∶36(V/V);检测波长:282 nm,流速:1.0 mL/min,柱温:25 ℃,进样量:10 μL;配可变波长检测器。
1.3.1.2 标准曲线的绘制
精密称取甲基莲心碱标准品5.0 mg置于25 mL容量瓶中,加入适量甲醇进行溶解并定容至刻度,配制成200 μg/mL甲基莲心碱标准品母液。精密量取标准品母液0、1、2、4、6、8 mL于10 mL容量瓶中,用甲醇稀释并定容至刻度,配制成质量浓度分别为0、10、20、40、80、120、160 μg/mL系列梯度的标准品子液,将子液超声10 min后,用甲醇补足质量,用0.2 μm微孔过膜,备用。以甲基莲心碱做标准品,得到线性关系式:y=3 634.95x+0.28(y为甲基莲心碱标准品峰面积;x为甲基莲心碱质量浓度/(μg/mL))。
1.3.2 莲子钻芯粉中甲基莲心碱提取工艺

取莲子钻芯粉2 g,于100 mL锥形瓶中,加入一定量的纤维素酶,用醋酸钠缓冲溶液调节溶液pH值,混合均匀,于水浴锅中酶解一段时间后,3 500 r/min离心15 min,取上清液。滤渣按料液比1∶20加入体积分数70%乙醇溶液,于70 ℃水浴回流提取90 min后,3 500 r/min离心15 min,合并上清液。取40 mL上清液用70%乙醇溶液定容至50 mL,高效液相色谱检测其甲基莲心碱含量。
1.3.3 样品中甲基莲心碱提取量的测定
取定容后的莲子钻芯粉样液,使用0.2 μm微孔滤膜过滤后入高效液相色谱仪进行测定,根据甲基莲心碱标准曲线测定提取液中甲基莲心碱的含量,并按下式计算提取量:

式中:C为甲基莲心碱质量浓度/(μg/mL);V为溶液体积/mL;m为莲子钻芯粉样品质量/g。
1.3.4 单因素试验设计
莲子钻芯粉中甲基莲心碱的提取量主要受纤维素酶活性的影响,因此在单因素试验中,主要考察加酶量(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%、4.5%)、料液比(1∶10、1∶15、1∶20、1∶25、1∶30)、酶解pH值(4.0、4.5、5.0、5.5、6.0、6.5)、酶解时间(0.5、1.0、1.5、2.0、2.5、3.0 h)及酶解温度(30、40、50、60、70、80 ℃)对物料中甲基莲心碱提取量的影响。
1.3.5 响应面试验设计
在单因素试验结果的基础上,将纤维素酶加酶量、酶解时间、酶解温度、酶解pH值作为考察因素,以甲基莲心碱提取量作为试验指标,设计四因素三水平的Box-Behnken响应面试验,因素与水平见表1。

表1 响应面试验因素与水平Table 1 Factors and levels used in response surface experiments
2 结果与分析
2.1 单因素试验结果
2.1.1 加酶量对甲基莲心碱提取量的影响
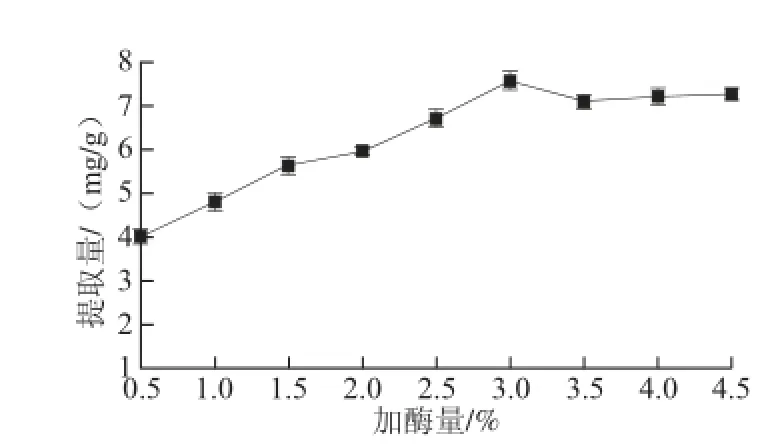
图1 加酶量对甲基莲心碱提取量的影响Fig. 1 Effect of cellulase dosage on the extraction yield of neferine
图1 显示,加酶量对甲基莲心碱提取量的影响基本呈现正相关,在0.5%~3%的范围内,随着加酶量的增加,甲基莲心碱提取量逐渐上升,且在3%加酶量时提取量达到最高(7.58 mg/g),当加酶量大于3%时,莲子钻芯粉中甲基莲心碱提取量有略微下降并趋于平稳。原因可能是:在底物质量浓度有限[12]的情况下,加酶量少,无法将甲基莲心碱从细胞壁中释放出来[13],其反应不彻底,导致当加酶量小于1.5%时,甲基莲心碱提取量较低;继续增加酶量,反应体系中细胞壁的通透性增强[14],阻碍有效成分溶出的阻力减小,甲基莲心碱提取量增加迅速;而当加酶量过大时,由于酶分子之间的竞争,使得底物与酶接触减少,甲基莲心碱提取量呈现平稳的趋势[15]。因此,出于酶量节约考虑,纤维素酶加酶量确定为3%。
2.1.2 料液比对甲基莲心碱提取量的影响

图2 料液比对甲基莲心碱提取量的影响Fig. 2 Effect of solid-to-liquid ratio on the extraction yield of neferine
图2 表明,料液比在1∶10~1∶15范围内,甲基莲心碱提取量逐渐增加,由6.542 mg/g增加到7.548 mg/g;当料液比在1∶15之后时,莲子钻芯粉中的甲基莲心碱提取量随着体系中溶剂用量的增加而缓慢下降,料液比为1∶30时,其提取量仅为4.665 mg/g。原因是:加酶量一定,体系中的溶剂用量逐渐增大时,参与反应的酶与底物接触面积增大,反应速率加快,甲基莲心碱提取量增加。溶剂用量继续增加时,降低了酶的质量浓度,导致单位体积内底物量偏低[16],因此,本试验中选择料液比1∶15比较理想。
2.1.3 酶解pH值对甲基莲心碱提取量的影响

图3 酶解pH值对甲基莲心碱提取量的影响Fig. 3 Effect of hydrolysis pH on the extraction yield of neferine
每一种酶都有其发挥最大酶解作用的是最适pH值,纤维素酶的最适pH值为4.0~6.0,低于或高于此范围都不利于有效成分的提取。由图3可知,pH值在4.0~5.0之间时,甲基莲心碱提取量随溶液体系pH值升高而上升,在pH 5.0时,提取量达到最高6.936 mg/g,当再升高溶液的pH值时,甲基莲心碱提取量开始逐渐下降。这是因为:溶液体系的pH值会在一定程度上影响酶的活性中心,产生不同的解离状态[17],当pH 5.0时,酶活力最大,当溶液体系偏离最佳pH值时,酶活力会有不同程度的减弱,导致甲基莲心碱提取量下降。因此,酶解pH值应选择5.0。
2.1.4 酶解温度对甲基莲心碱提取量的影响

图4 酶解温度对甲基莲心碱提取量的影响Fig. 4 Effect of hydrolysis temperature on the extraction yield of neferine
由图4可知,甲基莲心碱提取量随着酶解温度的升高呈现先上升后逐渐下降的趋势,30~50 ℃的酶解温度范围内,甲基莲心碱提取量增加较快,在50 ℃时达到最高,为6.915 mg/g,其后,随着温度的进一步升高,提取量降低。这是因为:在较低温度(30 ℃)时,底物分子具有的能量较低,不足以使得酶发生作用,温度升高,物料的分子运动加快,同时酶破坏细胞壁的速率加快,莲子钻芯粉中的甲基莲心碱加速溶解到溶液中。但温度进一步升高时,由于纤维素酶的蛋白质特性,在高温条件下,酶变性失活[18],甲基莲心碱提取量降低。因此,酶解温度选择50 ℃为宜。
2.1.5 酶解时间对甲基莲心碱提取量的影响

图5 酶解时间对甲基莲心碱提取量的影响Fig. 5 Effect of hydrolysis time on the extraction yield of neferine
如图5所示,随着酶解时间的延长,在0.5~2 h内,莲子钻芯粉中甲基莲心碱提取量呈现上升的趋势,并在2 h时达到最高提取量,6.464 mg/g,随后提取量开始逐渐减少。在酶解初期,纤维素酶对粉末细胞中的细胞壁进行破碎和溶解,细胞间隙间的有效成分流入到溶液体系中,且在一定范围内,时间越长,细胞壁被破坏的程度越大,甲基莲心碱提取量越高。超过2 h后,纤维素酶对底物进行分解产生的产物如纤维二糖、寡糖、葡萄糖[19]等对甲基莲心碱的提取溶出有抑制作用,使得其提取量有所降低,因此,酶解时间选择2 h为宜。
2.2 响应面试验结果
2.2.1 Box-Behnken试验设计及结果
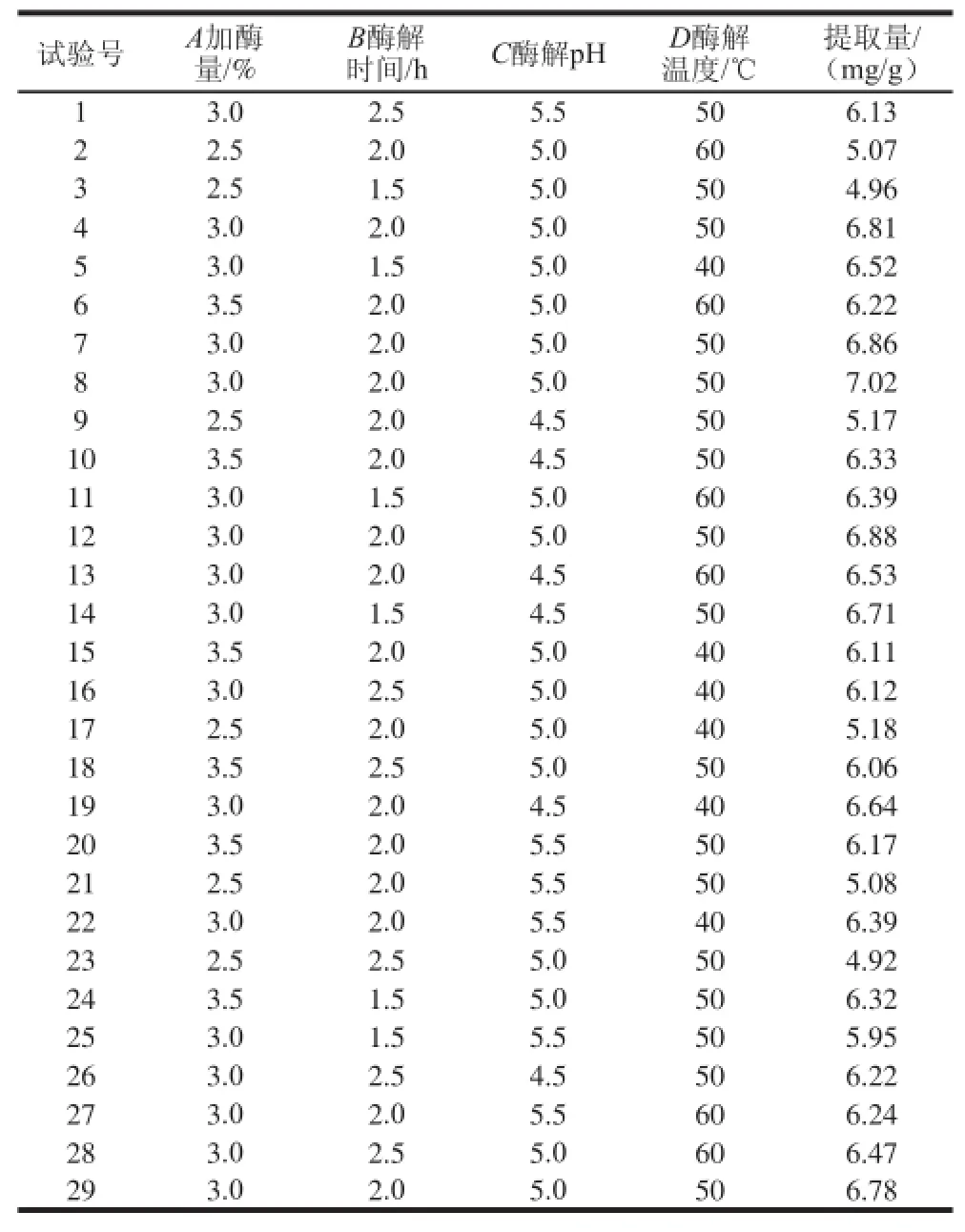
表2 Box-Behnken试验设计及结果Table 2 Box-Behnken design matrix with experimental results for neferine yiieelldd
本研究采用纤维素酶法提取莲子钻芯粉中甲基莲心碱,在单因素试验的基础上,以加酶量、酶解时间、酶解温度和酶解pH值作为响应面试验的影响因素,固定醇提条件和料液比,并以甲基莲心碱提取量为考察指标,进行四因素三水平的Box-Behnken试验,选出最优试验条件。响应面试验设计及结果见表2。
2.2.2 回归模型显著性检验及方差分析
通过Design-Expert 8.05b软件对表2数据进行分析并进行回归拟合,得到试验实际值的二次回归模型方程:Y=-56.159 17+24.948 33A+1.308 33B+8.13C+ 0.124 5D-0.22AB-0.07AC+0.011AD+0.67BC+ 0.024BD-0.002CD-3.928 33A2-1.338 33B2-0.943 33C2-0.001 958D2。对回归方程进行显著性检验及方差分析,结果见表3。

表3 回归模型显著性检验及方差分析Table 3 Signifi cance test and analysis of variance for the regression model describing enzymatic extraction of neferine
由表3可知,试验模型的P<0.000 1,说明此模型极显著,模型失拟项表示模型预测值与实际值不拟合的概率[20],此模型失拟项P=0.383 1>0.05,表明模型不显著,拟合的概率高,运用到试验中误差小。由表3可知,加酶量(A)及其二次项(A2)、酶解pH值(C)、酶解时间二次项(B2)、酶解pH值二次项(C2)、酶解时间与酶解pH值的交互项(BC)、酶解温度的二次项(D2)对甲基莲心碱提取量的影响极显著(P<0.01),酶解时间(B)、酶解时间与酶解温度的交互项(BD)对甲基莲心碱提取量影响显著(P<0.05),说明上述因素对甲
基莲心碱提取量影响大,改变这些因素的水平会对响应值产生较显著的影响。
根据表中F值大小,可以得出对甲基莲心碱提取量影响程度主次为:加酶量>酶解pH值>酶解时间>酶解温度,其中加酶量对甲基莲心碱提取量的影响最大。回归模型结果表明,该模型相关系数R2=0.985 4,且模型调整确定系数R2Adj=0.970 9,说明此模型能用于97.09%的试验结果解释,仅仅只有2.91%的试验结果不能用此模型解释。本试验中的离散系数较小,为1.74%,表明此模型反映的试验结果可靠性强,数据真实。
2.2.3 响应面分析
响应面等高线图可以直观反映各因素对响应值的影响,以便找出最佳工艺参数以及各因素之间的交互作用[21-22]。响应面图中3D图的陡峭程度代表两个交互作用的强弱,3D图坡度越陡,因素影响越大,交互作用越明显。等高线曲线沿一个因素轴方向越密集[23],并成椭圆状,其交互作用越强。固定因素取0水平对应的值,研究各因素交互作用,响应面如图6所示。
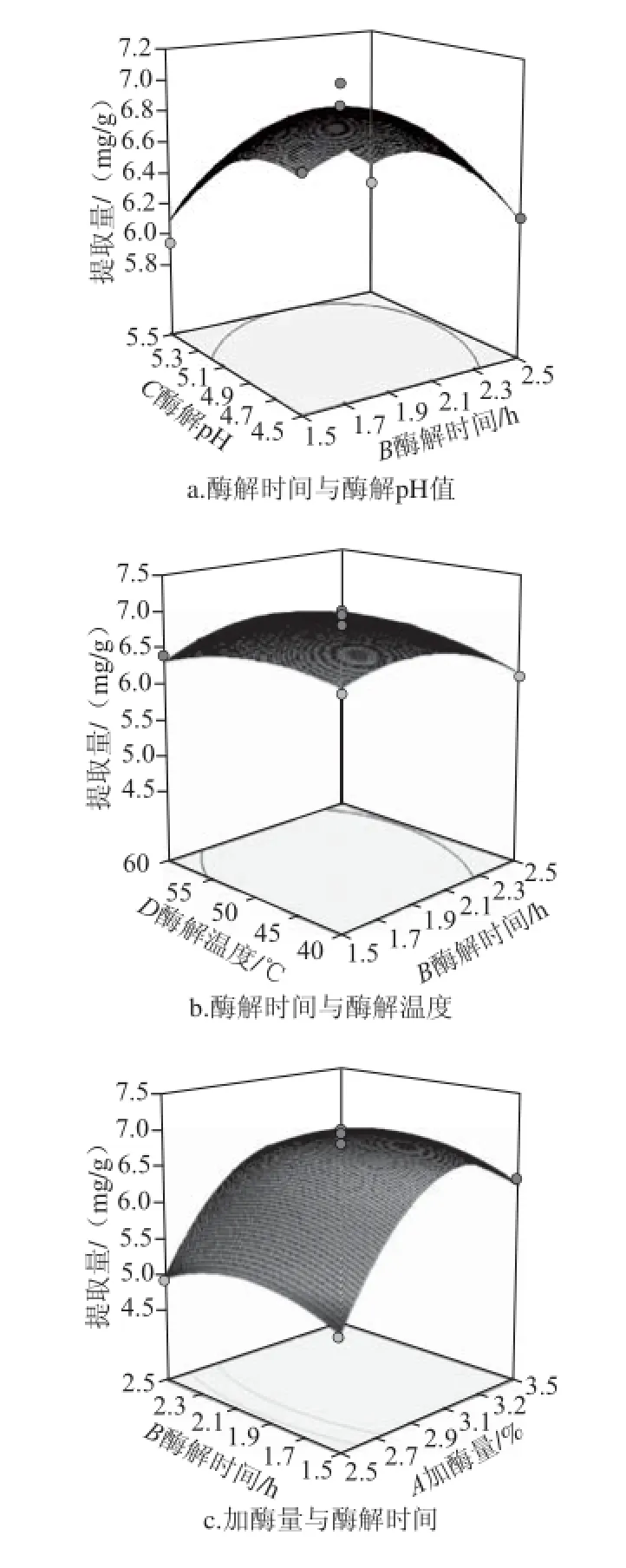
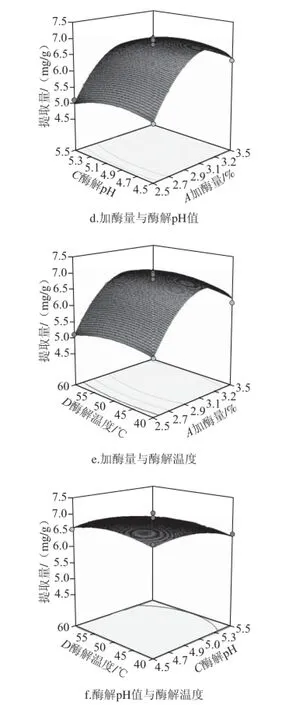
图6 各因素交互作用对甲基莲心碱提取量的影响Fig. 6 Interactive effects of hydrolysis time, pH, temperature and cellulase dosage on the yield of neferine
图6a、b响应面图在酶解时间、酶解温度、酶解pH值方向坡面陡峭,向上凸出,甲基莲心碱提取量有最高值。等高线呈现椭圆状,交互作用明显。当加酶量与酶解温度一定时,随着酶解时间与酶解pH值的延长和升高,甲基莲心碱提取量逐渐升高,并在2.1 h、pH 5.1附近达到最高值,之后两因素水平逐渐增加时,提取量有所下降。由图6b可知,当加酶量与酶解pH值一定时,随着酶解时间与酶解pH值的延长和升高,甲基莲心碱提取量也呈现先上升后下降的趋势,并在2.1 h、50 ℃附近,提取量最高。
图6c、d、e、f响应面图开口向下,坡面陡峭,其提取量有最高值,加酶量方向的坡面更为陡峭,即加酶量的增加使得甲基莲心碱提取量的变化更加显著,随着加酶量的增加,甲基莲心碱提取量呈现先增加后减少的趋势。而随着酶解时间、酶解pH值和酶解温度的改变,甲
基莲心碱提取量的增加趋势不明显,表现在响应面图上为坡面平缓。因此,AB、AC、AD、CD之间的交互作用不明显,与表3中的数据一致。
2.3 验证实验
通过Design-Expert 8.05b软件分析得知,最佳酶解条件为加酶量3.15%、酶解时间1.88 h、酶解pH 4.81、酶解温度49.68 ℃,在此最优条件下甲基莲心碱提取量为6.99 mg/g,结合实际操作,将最佳提取条件调整为加酶量3.1%、酶解时间1.7 h、酶解pH 4.8、酶解温度50 ℃,并对其进行3 次验证实验,得到甲基莲心碱提取量平均值为(7.02±0.22)mg/g,最优值与实际值的相对标准偏差为3.57%。说明运用响应面进行分析的数据可靠性强,能用于生产实际。
3 结 论
本研究在单因素试验的基础上,通过Design-Expert 8.05b软件和Box-Behnken试验设计方法优化了纤维素酶辅助提取莲子钻芯粉中甲基莲心碱的工艺,并结合实际操作,确定纤维素酶辅助提取甲基莲心碱最佳工艺条件为加酶量3.1%、酶解时间1.7 h、酶解pH 4.8、酶解温度50℃,在此条件下得到甲基莲心碱平均提取量(7.02±0.22)mg/g,高于传统乙醇法的提取量(4.03±0.17)mg/g,提取量提高了71.9%。表明采用纤维素酶辅助提取法提高了莲子钻芯粉中甲基莲心碱提取量,有助于提高副产物的利用率,为莲子钻芯粉的深加工提供了理论依据,具有一定的指导意义。
[1] 唐小卿, 曹建国. 甲基莲心碱的药理作用[J]. 中国药理学通报, 2004, 20(1): 8-10. DOI:10.3321/j.issn:1001-1978.2004.01.004.
[2] 廖立, 舒展, 李笑然, 等. 莲类药材的化学成分及药理作用研究进展[J].上海中医药杂志, 2010, 44(12): 82-84.
[3] 胡文淑, 郭莲军, 冯秀玲, 等. 甲基莲心碱的降压作用[J]. 中国药理学与毒理学杂志, 1999, 4(2): 107-110. DOI:10.3321/ j.issn:1000-3002.1990.02.008.
[4] WU Yongjie, LI Wengguang, ZHANG Zhenming, et al. Antioxldatire activity of 4-oxy-and-4-hydroxy-nitmxides in tissues and erythrocytes from rats[J]. Acta Pharmacologica Sinica, 1997, 18(2): 150.
[5] 吴远明, 胡本荣, 贾菊芳. 甲基莲心碱对电解性氧自由基损伤离体大鼠心脏的保护作用[J]. 中国药理学通报, 1996, 12(4): 325-328. DOI:10.3321/j.issn:1001-1978.1996.04.014.
[6] 李秋菊, 曾贵云, 潘竞先, 等. 莲心总碱的心血管药理及有效成分的研究[J]. 北京医科大学学报, 1992, 24(1): 61-62 .
[7] 袁小红. 莲子心4 种提取方法的比较研究[J]. 中国药房, 2006, 17(8):637-638. DOI:10.3969/j.issn.1001-0408.2006.08.035.
[8] GUO Z B, LI Q, CAO H Y, et al. Antiarrhythmic effi cacy of neferine assessed by programmed electrical stimulation in a canine model of elect ropharmacology[J]. Chinese Pharmaceutical Sciences, 2002, 11(2): 35-42.
[9] 王嘉陵, 胡学民. 莲子心中生物碱成分的研究[J]. 中药材, 1991, 14(6): 36-38.
[10] 张勋. 3 种提取莲子心总生物碱的方法比较[J]. 福建中医药大学学报, 2013, 23(3): 40-41.
[11] 黄先菊, 罗顺德, 杨健. 酸液渗漉法提取分离莲心碱[J] . 湖北省卫生职工医学院学报, 2002, 15(3): 51- 52.
[12] 李永生. 酶促乌头生物碱提取工艺的影响研究[D]. 北京: 北京化工大学, 2009.
[13] 孙磊磊, 康健. 响应面优化酶法辅助提取葡萄叶白藜芦醇工艺[J].食品科技, 2015, 40(2): 276-281.
[14] 陈小举, 吴学凤, 姜邵通, 等. 响应面法优化半纤维素酶提取梨渣中可溶性膳食纤维工艺[J]. 食品科学, 2015, 36(6): 18-23. DOI:10.7506/spkx1002-6630-201506004.
[15] 戴媛媛, 潘丽军, 吴学凤, 等. 中心组合设计优化芋头浆糖化工艺[J].食品科学, 2015, 36(6): 86-90. DOI:10.7506/spkx1002-6630-201506016.
[16] 张慢, 潘丽军, 姜邵通, 等. 响应面法优化酶-超声波辅助同步提取紫薯花青素工艺[J]. 食品科学, 2014, 35(10): 23-28. DOI:10.7506/ spkx1002-6630-201410005.
[17] 刘晓飞, 刘宁, 张娜, 等. 超声波辅助酶法提取甜玉米穗轴黄酮及抑菌性检测[J]. 食品科学, 2014, 35(20): 79-82. DOI:10.7506/spkx1002-6630-201420016.
[18] 施瑛, 裴斐, 周玲玉, 等. 响应面法优化复合酶法提取紫菜藻红蛋白工艺[J]. 食品科学, 2015, 36(6): 51-57. DOI:10.7506/spkx1002-6630-201506010.
[19] 张卫红. 复合酶解法提取茶叶中有效成分的过程研究[D]. 西安: 西北大学, 2005.
[20] 卢可, 娄永江, 周湘池. 响应面优化杨梅果醋发酵工艺参数研究[J]. 中国调味品, 2011, 36(2): 57-60. DOI:10.3969/ j.issn.1000-9973.2011.02.016.
[21] LIU Yong, GONG Guili, ZHANG Jiao, et al. Response surface optimization of ultrasound-assisted enzymatic extraction polysaccharides from Lycium barbarum[J]. Carbohydrate Polymers, 2014, 110: 278-284. DOI:10.1016/j.carbpol.2014.03.040.
[22] IMEN E, WAFA H, MANEL B T, et al. Development and optimization of a non conventional extraction process of natural dye from olive solid waste using response surface methodology (RSM)[J]. Food Chemistry, 2014, 161: 345-352.
[23] BUCKOW R, KASTELL A, TEREFE N S, et al. Pressure and temperature effects on degration kinetics and storage stability of total anthocyanins in blueberry juice[J]. Journal of Agriculture and Food Chemistry, 2010, 58(18): 10076-10084.
Applying Response Surface Methodology to Optimize the Extraction of Neferine from Lotus Seed Core Powder Using Cellulase
REN Mei1, XIA Yanbin1,*, WANG Liangliang2
(1. College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China; 2. Hunan Institute of Food Quality Supervision Inspection and Research, Changsha 410111, China)
The cellulase-assisted extraction of neferine from lotus seed core powder was optimized using single-factor experiments and response surface methodology based on Box-Behnken design. The independent variables were cellulase dosage, hydrolysis pH, temperature and time. Neferine yield was used as the response. The extraction conditions were optimized as follows: cellulase dosage, 3.1% (m/m); pH, 4.8; hydrolysis time, 1.7 h min; and hydrolysis temperature, 50 ℃. Under the optimized conditions, the yield of neferine was (7.02 ± 0.22) mg/g, which was 71.9% higher than that ((4.03 ± 0.17) mg/g) obtained with the traditional ethanol extraction method. The cellulase-assisted extraction process was accomplished under simple and mild conditions, which could effectively improve the utilization of lotus seed core powder.
lotus seed core powder; neferine; cellulas; response surface methodology
10.7506/spkx1002-6630-201610018
TS201.1
A
2015-09-24
湘莲加工技术集成产业化示范项目(2013GA770001)
任美(1990—),女,硕士研究生,研究方向为食品化学与营养。E-mail:531480212@qq.com
*通信作者:夏延斌(1952—),男,教授,博士,研究方向为食品化学与营养。E-mail:xy520523@aliyun.com
