鸡蛋清卵白蛋白酶解工艺优化及其结构性质
2016-12-07刘丽莉尹光俊康怀彬
刘丽莉,王 焕,李 丹,尹光俊,康怀彬
(河南科技大学食品与生物工程学院,河南 洛阳 471003)
鸡蛋清卵白蛋白酶解工艺优化及其结构性质
刘丽莉,王 焕,李 丹,尹光俊,康怀彬
(河南科技大学食品与生物工程学院,河南 洛阳 471003)
研究鸡蛋清卵白蛋白的酶解工艺及其结构性质,以水解度为指标,确定最佳酶源为碱性蛋白酶,其水解度为26.55%,显著优于其他蛋白酶(P<0.05)。以碱性蛋白酶酶解鸡蛋清卵白蛋白,采用单因素和五元二次正交旋转试验研究酶解工艺;针对酶解前后卵白蛋白的功能特性进行分析,并采用紫外扫描、傅里叶红外变换光谱、差示扫描量热针对卵白蛋白及其酶解产物进行结构表征。结果发现,碱性蛋白酶酶解鸡蛋清卵白蛋白最佳工艺条件为反应温度52.5 ℃、反应时间5 h、pH 8.25、酶用量5 500 U/g、底物添加量5%,此条件下水解度为27.88%。酶解后产物表面巯基含量降低了3.6 mol/(L·g),溶解度大幅度提高,起泡性降低了18.18%,泡沫稳定性降低了20.24%,乳化活性指数升高了13.56 m2/g,乳化稳定性提高了10.46%。同时,酶解后的卵白蛋白肽链发生了裂解,有序的二级结构被破坏,暴露出更多氨基酸残基,α-螺旋略有减少,β-转角相应增加,亲水基团也相应的增加。
鸡蛋清卵白蛋白;酶解物;结构表征;功能特性
卵白蛋白是一种含糖蛋白质,大约含有3%的糖基,其中乙酰葡萄糖胺占1.3%,甘露糖为1.7%。卵白蛋白由385 个氨基酸组成,等电点为4.5,每一个分子有一根糖链,N-端和C-端的氨基酸分别为乙酰甘氨酸和脯氨酸,有1 个双硫键和4个巯基,分子质量约为45 kD[1]。卵白蛋白可以大批量获得,但分子不耐酶解,用链霉蛋白酶水解其晶体,可以生成5 个含天冬酞胺糖基的组分[2]。卵白蛋白电泳性质稍有不同的3 组分Al、A2和A3的混合物。A1含2 个磷酸基,A2含1 个磷酸基,A3不含磷酸基,它们之间的比例为85∶12∶3[3-4]。
蛋清粉黏度大、腥味重、受热易凝固、溶解性差,这些性质限制了它在食品加工中的应用。蛋白酶解技术可使蛋白质部分降解,从而使其溶解性提高、黏度和热凝固性降低,并可促使呈味氨基酸或小肽释放,改善其风味[5]。此外,蛋白质酶解后产生的小肽比大分子蛋白质更易吸收,并能产生具有一定功能特性的小分子肽[6]。因此,利用酶解技术对蛋清粉进行部分降解,可制备出既可满足食品加工业需求,又具有有益生理活性的蛋清蛋白肽。卵白蛋白的多肽链中含有一些特殊的肽,选择适宜的蛋白酶水解可以得到一些具有特异生理调节功能的活性肽[7]。Fujita等[8]分别用胃蛋白酶和胰凝乳蛋白酶酶解卵白蛋白,碱性蛋白酶解物用反相高效液相色谱分离出具有血管舒张活性的物质OA358.365,在胰凝乳蛋白酶酶解物中也分离出Ovokinin(2.7)和OA359.364,这二种肽对自发性高血压大鼠具有降压作用[9]。Xu Mingsheng等[10]的研究发现,卵白蛋白酶解物具有强抗氧化活性。
目前我国针对禽蛋高附加值的产品开发利用有限,尤其在专用蛋清粉的开发方面一直是疑难问题。蛋白质的理化性质和功能特性直接相关,改性就是基于结构决定功能的这一基本原理,用物理因素或生化因素使其氨基酸残基和多肽链发生变化,引起蛋白大分子空间结构和理化性质的改变,在不影响其营养价值的基础上,来获得较好的功能特性。在这种形式下,应用适当的方法对蛋清粉的特性进行改造开发出功能性的蛋清粉,研究酶解鸡蛋清卵白蛋白的最佳工艺,并对酶解前后的卵白蛋白结构性质进行研究。
1 材料与方法
1.1 材料与试剂
鸡蛋购买于河南省洛阳市南昌路丹尼斯超市。
木瓜蛋白酶(1.0×104U/g)、中性蛋白酶(5.0×104U/g)、碱性蛋白酶(1.0×105U/g)、风味蛋白酶(1.6×104U/g) 上海蓝季科技发展有限公司;甲醛、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)试剂 天津市德恩化学试剂有限公司;十二烷基磺酸钠(sodium dodecyl sulfate,SDS) 洛阳昊华化学试剂有限公司。
1.2 仪器与设备
Avanti J-E超速冷冻离心机 美国Beckman Coulter公司;Beta2.8LD型真空冷冻干燥机 德国Christ公司;UV1800紫外分光光度仪 美国Mapada公司;470FT-IR红外光谱仪 美国Nicolet公司;204F1差示扫描量热仪德国Netzsch公司。
1.3 方法
1.3.1 卵白蛋白的提取工艺流程
鲜鸡蛋→清洗→分离得到蛋清→双层纱布过滤→0.9%的生理盐水5 倍稀释→3 000 r/min离心15 min(去除卵黏蛋白)→取上清液盐析(pH 4.5)→4 500 r/min离心15 min→去除上清液→粗蛋白→透析法脱盐→卵白蛋白→真空冷冻干燥[11](卵白蛋白纯度为89.34%)
1.3.2 卵白蛋白的酶解工艺流程
配制5%卵白蛋白粉溶液作为底物溶液,按照试验设计调节底物溶液的pH值,在设定温度的水浴锅中温育10 min后,加入设定量的酶进行酶解,酶解时间为所设计时间。水解过程中水浴控温,每30 min振荡混匀1 次,酶解反应期间用pH计监测卵白蛋白溶液的pH值,并通过滴加NaOH溶液来调节pH值,使pH值保持在一定的值。
1.3.2.1 蛋白酶的筛选
针对碱性蛋白酶、中性蛋白酶、风味蛋白酶、木瓜蛋白酶进行初步筛选,通过单个酶解卵白蛋白实验,分析比较各酶的水解能力。
1.3.2.2 酶解工艺条件单因素试验
分别考察反应温度(30、35、40、45、50、55、60、65 ℃)、反应时间(1、2、3、4、5、6、7 h)、反应pH值(7.0、7.5、8.0、8.5、9.0、9.5)、酶用量(3 000、4 000、5 000、6000、7 000、8 000 U/g)、底物添加量(1%、2%、3%、4%、5%、6%、7%)对酶解反应水解度的影响。
1.3.2.3 酶解工艺条件优化正交旋转试验
在单因素试验基础上,利用DPS版软件进行五元二次正交旋转组合设计。以反应温度、反应时间、反应pH值、酶用量、底物添加量5 个因素为自变量,以水解度为响应值,设立了36 个处理组,试验因素与水平见表1。

表1 正交旋转试验因素与水平Table 1 Factors and their coded levels used in quadratic general rotary unitized desiiggnn
1.3.3 水解度的测定

水解后生成的—NH2的量由甲醛滴定法[12]测得,样品总含N量由凯氏定氮法测定[13]。
1.3.4 卵白蛋白功能特性的测定
1.3.4.1 巯基含量的测定
取4 mL 0.1 mol/L pH 8.5 Tris-甘氨酸缓冲液(含0.01 mol/L乙二胺四乙酸)加入到1 mL 5%卵白蛋白溶液中,40 ℃保温30 min,加入125 μL DTNB试剂(20 mg),再在25 ℃显色10 min,测定412 nm波长处的吸光度[14]。以半胱氨酸作为参比溶液。巯基含量按公式(2)计算:

式中:A412nm为样品在412 nm波长处的吸光度;ρ为蛋白质的质量浓度/(g/mL)。
1.3.4.2 溶解度的测定
蛋白质的溶解性采用蛋白质的溶解度来表示,即水溶性氮含量占样品中总氮含量的百分数。水溶性氢氧化钾溶解法[15],称取样品1 g于100 mL烧杯中,取50 mL 2%氢氧化钾溶液与之混合,磁力搅拌120 min,以2 700 r/min离心10 min,静置数分钟取上清液15 mL,用凯氏定氮法测定其中的氮含量,总氮含量同样采用凯氏定氮法测定。蛋白质溶解度按公式(3)计算:

1.3.4.3 起泡性及泡沫稳定性
采用搅打发泡法[16]测定起泡性:分别将酶解前后的卵白蛋白粉溶于pH 7.4 Tris-HCl缓冲液中,配成5%的卵白蛋白溶液。取40 mL蛋白溶液,记录起始高度H0。在高速分散机中,以13 000 r/min的转速搅打2 min,记录泡沫高度H1,按公式(4)计算卵白蛋白的起泡性:

蛋清蛋白泡沫稳定性的测定:静置30 min后,测定泡沫高度H2,按式(5)计算泡沫稳定性:
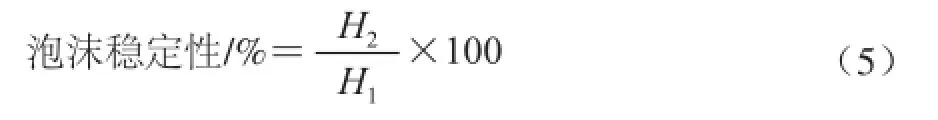
1.3.4.4 乳化特性及乳化稳定性
参照Pearce等[17]的方法,并进行改进。分别取酶解前后的2 种蛋白干燥样,用Tris-HCl缓冲溶液(pH 7.4)配制成1%的蛋白溶液,即谷蛋白和面筋蛋白悬浮液,取该悬浮液15 mL,加入5 mL植物油,用均质机10 000 r/min均质1 min,分别于均质后0、10 min取均质样的最底层乳化液0.1 mL加入到100 mL 0.1%的SDS溶液中,以0.1% SDS液为空白,于500 nm波长处测定其吸光度(A500nm)。乳化活性指数和乳化稳定性见式(6)、(7):

式中:C为蛋白质溶液质量浓度/(g/mL);Ø为油相所占分数/%;L为比色池光径/cm。

式中:Δt为乳化液放置时间/min;A0为0 min时样品在500 nm波长处的吸光度;∆A为10 min后吸光度A10与开始时吸光度A0差值。
1.3.5 卵白蛋白结构表征
1.3.5.1 酶解前后卵白蛋白的紫外光谱分析
分别将酶解前后的卵白蛋白溶于50 mmol/L、pH 7.4 Tris-HCl缓冲液中,配制成0.01 mg/mL蛋白溶液,样品分别在200~400 nm波长处用紫外分光光度计扫描[18]。
1.3.5.2 酶解前后卵白蛋白红外光谱分析
将一定量干燥后的 KBr和冷冻干燥后的卵白蛋白样品置于玛瑙研钵中,研磨均匀,尽量呈粉末状,装样,手动压片,取出样品小心轻放入样品室。采用傅里叶变换红外光谱仪对样品在400~4 000 cm-1区间扫描[18]。
1.3.5.3 差示扫描量热(differential scanning calorimeter,DSC)分析
称量10 mg左右的样品放入铝坩锅中,将蛋白分别从30 ℃加热升温至150 ℃,加热速率为10 ℃/min。同时做空白对照[19]。
1.4 数据分析
采用Origin Pro 8.5软件对单因素、巯基含量、溶解性数据进行处理;采用DPS V7.0专业版和设计专家Design-Expert 8.0程序进行分析,作响应曲面图和等高线图。
2 结果与分析
2.1 单酶的选择
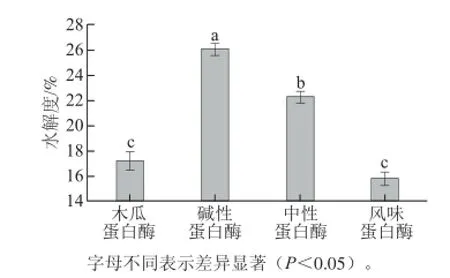
图1 不同蛋白酶的水解度的比较Fig. 1 Comparison of DH values among different proteases
由图1可知,碱性蛋白酶的水解度达到26.55%,水解能力显著优于其他3 种蛋白酶(P<0.05),原因可能是碱性蛋白酶的酶活力高于其他3 种蛋白酶,同时碱性蛋白的最适pH值是在8.5左右,而在碱性条件下又能使蛋白质自身裂解。因此选用碱性蛋白酶为后续实验的水解酶。
2.2 单因素试验结果
2.2.1 反应温度和时间的确定

图2 反应温度(a)和时间(b)对水解度的影响Fig. 2 Inf luence of reaction temperature and time on the hydrolysis degree
由图2a可知,开始时鸡蛋清卵白蛋白水解度随反应温度的升高而增大,在反应温度55 ℃左右卵白蛋白的水解度达到最大值,随后水解度开始下降。随着反应温度的升高,碱性蛋白酶失活,水解度降低,因此最佳酶解温度为55 ℃。
由图2b可知,随着反应时间的延长鸡蛋清卵白蛋白水解度增加,在反应5 h左右卵白蛋白的水解度达到最大值,随后水解度开始缓慢下降,6 h后基本保持不变。因此,碱性蛋白酶水解鸡蛋清卵白蛋白的最佳时间为5 h。
2.2.2 反应pH值、酶用量、底物添加量的确定
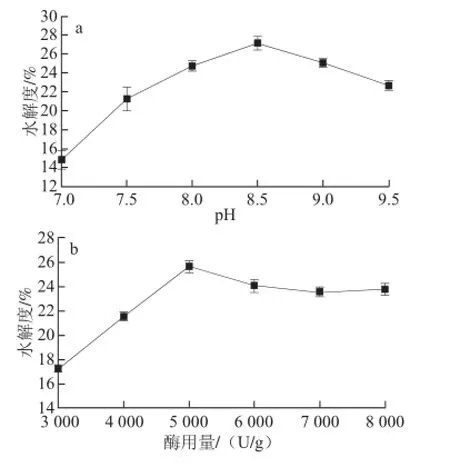

图3 反应pH值(a)、酶用量(b)、底物添加量(c)对水解度的影响Fig. 3 Infl uence of pH, enzyme concentration and substrate concentration on the hydrolysis degree
由图3a可知,在其他反应条件确定下,改变反应pH值,开始时鸡蛋清卵白蛋白水解度随反应pH值的升高而增大,在pH值达到8.5左右,卵白蛋白的水解度达到最大值,随后水解度开始下降。随着pH值升高,碱性蛋白酶失活,水解度降低,因此最佳酶解pH值为8.5。
由图3b可知,在其他反应条件确定下,改变酶用量,开始时鸡蛋清卵白蛋白水解度随着碱性蛋白酶用量的增加而增大,当酶用量达到5 000 U/g时,水解度达到最大值。随后,可能是因为随着酶用量的增加反应体系发生酶抑制反应,水解度开始缓慢下降,当酶用量达到6 000 U/g时,水解度基本趋于稳定。因此最佳酶用量为5 000 U/g。
由图3c可知,在其他反应条件确定下,改变底物添加量,开始时水解度随卵白蛋白添加量的增加而增大,当底物添加量达到5%时,水解度达到最大值。继续增大卵白蛋白的添加量,卵白蛋白的水解度随卵白蛋白添加量增大而减小。为此,选取底物添加量为5%进行酶解反应条件的研究。
2.3 二次回归正交旋转试验结果
在单因素试验的基础上,设计五元二次正交旋转试验,根据表1的因素和水平进行响应面试验设计,结果见表2。
采用DPS数据处理系统用二次回归旋转组合试验统计方法对试验数据进行拟合,得到的回归方程如下:
Y=26.43+0.364 2X1+2.086 7X2+1.059 1X3-0.432 5X4+0.475 0X5-1.008 7X12-0.835 0X22-1.575 0X32-0.046 3X42+0.233 8X52-1.525X1X2+ 0.226 3X1X3-0.385 0X1X4-0.141 3X1X5-0.531 3X2X3-0.482 5X2X4-0.063 8X2X5+0.078 8X3X4-0.01X3X5+ 0.311 3X4X5
由方差分析可知,回归方程的失拟性检验F1=10.77(F0.05(6,9)=4.06)不显著,可以认为所选用的二次回归模型是适当的。对回归系数检验可知方程的决定系数R2=0.898 5,说明该模型能解释89.85%的数据,表明该模型拟合结果好,试验误差小,能够正确反映各因素与水解度的数量关系,以此数学模型来模拟酶解反应的得率有效。

表2 五元二次正交旋转组合试验设计方案及结果(n==33)Table 2 Quadratic orthogonal rotary composite experimental design in terms of coded values of fi ve variables and corresponding experimental resulttss ((n = 3)
2.3.1 方差分析和显著性检验
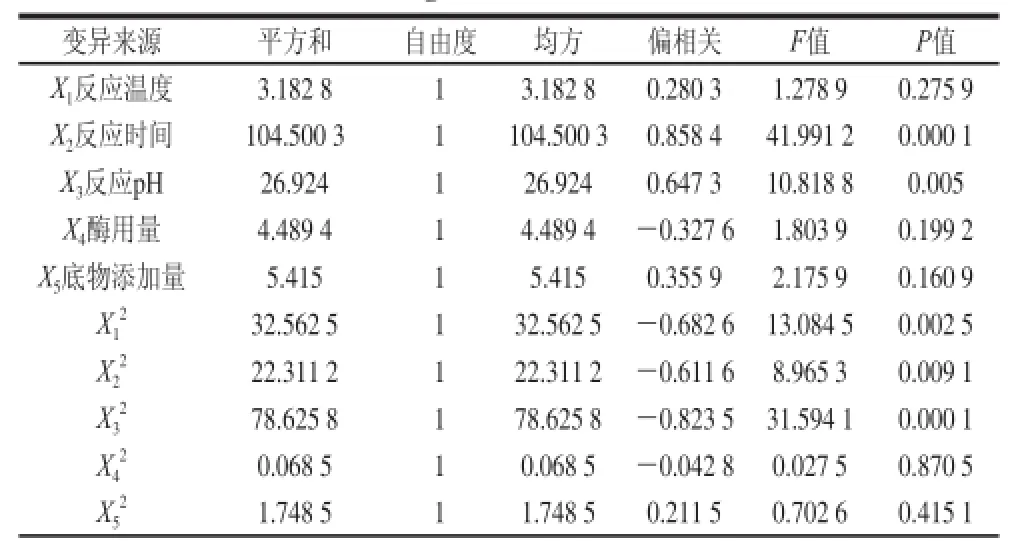
表3 二次响应面回归模型方差分析Table 3 Analysis of variance (ANOVA) of the response surface regression moddeell

续表3
2.3.2 双因素交互效应分析
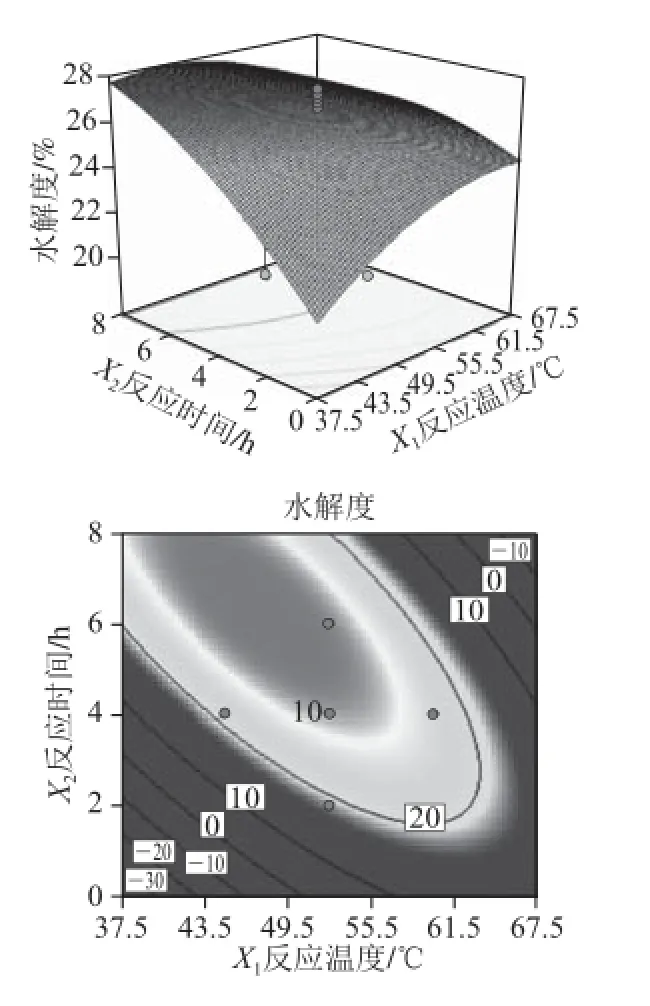
图4 反应温度与反应时间的交互影响水解度的响应面和等高线图Fig. 4 Response surface and contour plots showing the degree of hydrolysis as a function of hydrolysis temperature and time
由回归方程偏回归系数显著性检验可知,只有X1(反应温度)和X2(反应时间)两因素间存在着显著的交互作用,其他因素间的交互作用差异均不显著。由于二次项系数之间具有相关性,因此这些微弱的交互项不能删除,因此只分析X1和X2之间的交互作用。同样采用降维法[20],固定另外2 个因素取零水平。交互作用方程为:Y12=26.43+0.364 2X1+2.086 7X2-1.008 7X12-0.835 0X22-1.525 0X1X2
等高线的形状可以反映因素间交互作用的大小,圆形表示交互作用不显著,椭圆形表示交互作用显著[21]。由图4可知,反应温度与反应时间存在一定的交互作用。
当反应温度一定时,随着反应时间的延长,反应时间先升高后降低,水解度在编码值4~8 h达到最大值;当反应时间一定时,随着反应温度的升高,水解度也是先升高后降低,在编码值为40~55 ℃时达到最大值。由此可知,X1、X2在编码为0~1时交互作用最明显。
2.4 利用回归方程确定最佳作用参数和模型验证实验结果
采用DPS V7.5专业版和设计专家Design-Expert.8.0分析,得到各因素的最佳酶解条件组合为反应温度55 ℃、反应时间5 h、pH 8.25、酶用量5 500 U/g、底物添加量5%,最高水解度预测值为28.73%,通过验证实验所得水解度平均为(27.88±0.27)%,偏差绝对值小于1.0%,表明通过优化的水解条件可信。
2.5 酶解前后的鸡蛋清卵白蛋白功能特性的变化
2.5.1 巯基含量分析
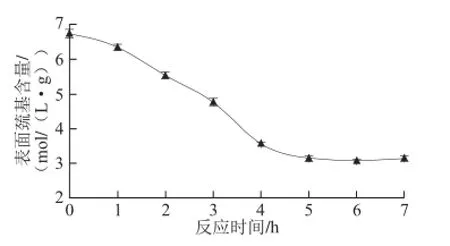
图5 不同反应时间表面巯基含量的变化Fig. 5 Changes surface hydrosulfuryl content at different reaction time
由图5可以看出,蛋白质分子表面巯基含量与反应时间呈负相关,即水解程度越大,巯基含量越少,蛋白的疏水性越弱。一方面因为酶诱导破坏了卵白蛋白质表面的疏水区域;另一方面在酶产物制备过程中一些疏水性多肽或片段在离心过程中被去除[22-23]。
2.5.2 溶解性分析
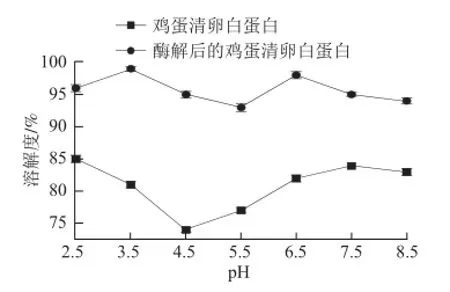
图6 鸡蛋清卵白蛋白及其水解物的溶解度比较Fig. 6 Protein solubility profi les of OVA and its hydrolysate
由图6可得出,在pH 2.5~8.5条件下酶解后的鸡蛋清卵白蛋白溶解度显著高于卵白蛋白(P<0.05),这是因为在酶解过程中使蛋白分子断裂,破坏了其巯基,暴露出更多的亲水基团,从而使其溶解度增加。酶解后卵白蛋白的等电点也发生了显著性的变化,卵白蛋白的在其等电点4.5的溶解度最小,而酶解后的卵白蛋白在pH 5.5时溶解度最低,说明水解改变了蛋白的等电点。
2.5.3 起泡性及泡沫稳定性分析

表4 鸡蛋清卵白蛋白及其水解物的起泡性、泡沫稳定性、乳化活性指数、乳化稳定性Table 4 Foaming capacity, foam stability, emulsifying capacity and emulsion stability of OVA and its hydrolysate
由表4可知,鸡蛋清卵白蛋白的起泡性和泡沫稳定性值分别为52.67%和60.63%。但酶解处理导致了起泡性和稳定性明显降低,且起泡性比稳定性下降趋势更为显著。由此表明,酶解导致了鸡蛋清卵白蛋白起泡性的下降,原因可能是:酶解使得分子间作用力降低,包围泡沫的黏弹性膜难以形成;另外酶解使得鸡蛋清卵白蛋白的亲水性增强疏水性减弱,在搅打和起泡过程中,鸡蛋清卵白蛋白分子在气液界面上的快速吸附能力降低。
2.5.4 乳化性及乳化稳定性分析
乳化性是指蛋白质溶液从油包水变成水包油的形成稳定乳化液的能力,乳化性越强,形成的乳化液越稳定,不易形成沉淀[24]。蛋白质的乳化性主要受蛋白的温度、浓度、pH值、离子强度影响,由表4可以看出,酶解后的卵白蛋白乳化活性指数提高了13.56 m2/g,乳化稳定性提高了10.46%,这表明酶解后的蛋清卵白蛋白亲水基团伸展到水相中,增加了亲水性,从而增加了蛋白质分子的亲水亲油平衡值,提高了乳化性和乳化稳定性。
2.6 酶解前后鸡蛋清卵白蛋白结构表征
2.6.1 酶解前后卵白蛋白紫外光谱分析

图7 鸡蛋清卵白蛋白及其水解物紫外扫描图Fig. 7 UV scanning spectra of OVA and its hydrolysate
由图7可看出,酶解前后的鸡蛋清卵白蛋白在波长280 nm附近都有强烈的吸收峰,这是由于卵白蛋白所特有的吸收峰一般在280 nm左右。因为色氨酸(Trp)、酪氨酸(Tyr)残基的侧链基团对光的优先吸收,其次是苯
丙氨酸(Phe)、组氨酸(His)、半胱氨酸(Cys)残基的侧链和肽键对光的吸收,其中Trp和Tyr在280 nm波长附近有一个吸收峰,因此蛋白质能够吸收一定波长范围的紫外光[25]。酶解后的卵白蛋白肽紫外吸收峰发生了蓝移,说明卵白蛋白Trp、Tyr残基的侧链基团分布发生了变化。且最大吸收峰在一定程度上增强了,酶解后的卵白蛋白分子的有序二级结构减少,具有紫外吸收的芳香氨基酸残基由分子暴露出来,使分子表面具有紫外吸收的氨基酸残基增多,从而导致紫外吸光度增加[26]。
2.6.2 酶解前后鸡蛋清卵白蛋白的傅里叶红外光谱分析
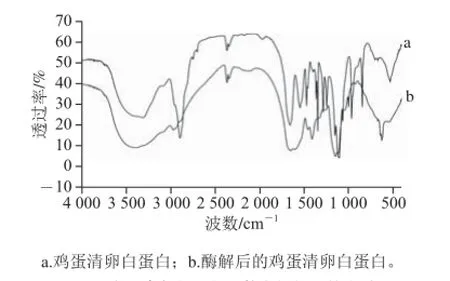
图8 鸡蛋清卵白蛋白及其水解物红外光谱图Fig. 8 FT-IR spectra of OVA and its hydrolysate
由图8可知,鸡蛋清卵白蛋白和酶解后的卵白蛋白红外图谱存在一定的差异,说明两者的微观结构有很大的不同,由此可以基本确定酶解作用使卵白蛋白肽链裂解,结构发生变化,因此其红外图谱呈现出很大的差异。蛋白质在红外区有若干特征吸收带,其中酰胺Ⅰ带(1 600~1 700 cm-1)和酰胺Ⅲ带(1 220~1 330 cm-1)对于研究二级结构最有价值。游离羟基在3 700~3 200 cm-1处有伸缩振动吸收,极性的C-O键伸缩振动在1 200~1 000 cm-1内有强吸收峰。由图8可知,Ⅰ和Ⅱ在1 220~1 245 cm-1都有蛋白质的特征吸收峰,但Ⅱ的吸收峰比Ⅰ明显较弱,说明酶解作用破坏卵白蛋白的二级结构,从而导致特征吸收峰减弱。α-螺旋特征吸收频率为1 330~1 290 cm-1,Ⅰ在1 330 cm-1出现了蛋白质的特征吸收峰,α-螺旋是肽链骨架上由n位氨基酸残基上的—C=O与n+4位残基上的—NH之间形成的氢键起着稳定的作用,因此这个吸收峰的形成是N—H键变形振动的结果,Ⅱ在此阶段并没明显的特征吸收峰,表明酶解作用破坏了其α-螺旋结构,使蛋白质裂解成小分子肽,更利于人体需要。1 265~1 290 cm-1为β-转角伸缩振动,β-转角的特定构象在一定程度上取决于它的氨基酸序列。Ⅱ在1270 cm-1出现了其特征吸收峰,说明卵白蛋白与酶发生反应破坏了其原来的肽链结构,暴露出更多的氨基酸的残基,而脯氨酸具有换装结构和固定角的作用,因此在一定程度上迫使β-转角形成。
2.6.3 酶解前后鸡蛋清卵白蛋白热收缩温度分析
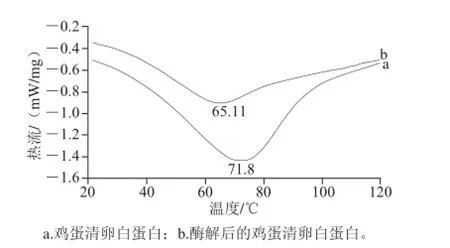
图9 鸡蛋清卵白蛋白及其水解物热收缩温度的分析Fig. 9 DSC of OVA and its hydrolysate
由图9可知,酶解前后鸡蛋清卵白蛋白的差示扫描量热曲线变化很明显。曲线出现了明显的吸热峰,这是蛋白质在加热处理时,其高级结构发生了异常变化,即发生变性所致。在天然状态下卵白蛋白成椭圆状,几乎所有的肽链都有二级结构构成,且疏水中心内部含有1 个二硫键、4 个自由巯基,与卵白蛋白分子的聚集行为息息相关[27-28]。而蛋白质的氨基酸组成影响蛋白质的热稳定性,含有高比例的疏水性氨基酸残基比亲水性较强的蛋白质一般更为稳定,酶解后的卵白蛋白溶解性增加暴露出的亲水基团增加,所以酶解后蛋白的热变形温度变低。
3 结 论
通过对鸡蛋清卵白蛋白的酶解工艺进行研究,确定了酶解蛋清蛋白的最佳酶源为碱性蛋白酶,最佳工艺条件为反应温度55 ℃、反应时间5 h、pH 8.25、酶用量5 500 U/g、底物添加量5%,在此条件下水解度可高达27.88%。
通对酶解前后鸡蛋清卵白蛋白的功能特性进行分析,得出酶解后产物巯基含量降低了3.6 mol/(L·g),溶解度大幅度提高,起泡性降低了18.18%,泡沫稳定性降低了20.24%,乳化活性指数升高了13.56 m2/g,乳化稳定性提高了10.46%。
通过采用紫外扫描、傅里叶红外光谱、差示扫描量热针对鸡蛋清卵白蛋白及其酶解产物进行结构表征,结果表明,酶解后的卵白蛋白肽链发生了裂解,有序的二级结构被破坏,暴露出更多氨基酸残基,α-螺旋略有减少,β-转角相应增加,亲水基团也相应的增加。
[1] NISBET A D, SAUNDRY R H, MOIR A J G, et al. The complete amino acid sequence of hen ovalbumin[J]. European Journal of Biochemistry, 1981, 115(2): 335-345. DOI:10.1111/j.1432-1033.1981. tb05243.x.
[2] HUANG C C, MONTGOMERY R. Enzymatic degradation of the components of asparaginyi-carbohydrate from chicken ovalbumin[J]. Biochemical and Biophysical Research Communications, 1969, 37(1): 94-98. DOI:10.1016/0006-291x(69)90884-5.
[3] KOVACS-NOLAN J, PHILLIPS M, MINE Y. Advances in the value of eggs and egg components for human health[J]. Journal of Agricultural and Food Chemistry, 2005, 53(22): 8421-8431. DOI:10.1021/jf050964f.
[4] PERLMANN G. Enzymatic dephosphorylaton of ovalbumin and plakalbumin[J]. Journal of General Physiology, 1950, 166: 870-871. DOI:10.1038/166870a0.
[5] VIOGUE J, SANCHEZ-VIOQUE R, CLEMENTE A. Partially hydrolyzed rapeseed protein isolates with improved functional properties[J]. Journal of the American Oil Chemists Society, 2000, 77(4): 447-450. DOI:10.1007/s11746-000-0072-y.
[6] 顾瑞霞. 乳与乳制品的生理功能特征[M]. 北京: 中国轻工业出版社, 2000: 50-60.
[7] 唐良艳, 于兰, 季金林. 生物活性肽-白蛋白多肽[J]. 食品工业科技, 2008, 29(5): 301-303.
[8] FUJITA H, USUI H, KURAHASHI K, et a1. Isolation and characterization of ovokinin, a bradykinin B1agonist peptide derived from ovalbumin[J]. Peptides, 1995, 16(5): 785-790. DOI:10.1016/0196-9781(95)00054-N.
[9] MATOBA N, USUI H, FUJITA H, et a1. A novel anti-hypertensive peptide derived from ovalbumin induces nitric oxide-mediated vasorelaxation in an isolated SHR mesenteric artery[J]. FEBS Letters, 1999, 452(3): 18l-184. DOI:10.1016/S0014-5793(99)00587-6.
[10] XU M, SHANGGUAN X, WANG W, et a1. Antioxidative activity of hen egg ovalbumin hydrolysates[J]. Asia Pacific Journal of Clinical Nutrition, 2007, 16(1): 178-182.
[11] 傅冰, 季秀玲, 俞汇颖, 等. 盐析法快速分离鸡蛋清卵白蛋白[J]. 江苏农业科学, 2013, 41(6): 229-230. DOI:10.3969/ j.issn.1002-1302.2013.06.084.
[12] 赵新淮, 冯志彪. 蛋白质水解物水解度的测定[J]. 食品科学, 1994, 15(11): 65-67. DOI:10.3321/j.issn:1002-6630.1994.11.023.
[13] 卫生部. GB 5009.5—2010 食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2010.
[14] OU S Y, KWOK K C, KANG Y J, et a1. An improved method to determine SH and-S-S-group content in soymilk protein[J]. Food Chemistry, 2004, 88(2): 317-320. DOI:10.1016/ j.foodchem.2004.05.001.
[15] WIRlYAUM P S, SOPONRONNARIT S, PRACHAYAWARAKORN S. Comparative study of heating processes for full-fat soybeans[J]. Journal of Food Engineering, 2004, 65(3): 371-382. DOI:10.1016/ j.jfoodeng.2004.01.036.
[16] 迟玉杰, 胥伟, 李鸿键. 酶法提高蛋清粉起泡功能及其机理的研究[J].中国家禽, 2011, 33(24): 16-19.
[17] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins: evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723. DOI:10.1021/jf60217a041.
[18] 钟朝辉, 李春美, 粱晋鄂, 等. 鱼鳞胶原蛋白提取工艺的优化[J]. 食品科学, 2006, 27(7): 162-165. DOI:10.3321/ j.issn:1002-6630.2006.07.035.
[19] 刘苏锐, 王坤余, 琚海燕. 猪皮Ⅰ型胶原蛋白的提取及其结构表征[J].中国皮革, 2007, 36(7): 43-46.
[20] 张富县, 王文文, 艾乃吐拉·马合木提, 等. 二次通用旋转组合设计优化杏皮渣醋酒精发酵阶段工艺[J]. 中国调味品, 2014, 39(2): 36-41. DOI:10.3969/j.issn.1000-9973.2014.02.009.
[21] 刘松, 李祝, 周礼红, 等. 响应面法优化黑曲霉产纤维素酶的发酵条件[J]. 食品科学, 2013, 34(7): 225-229.
[22] VISSCHERS R W, de JONGH H H J. Disulphide bond formation in food protein aggregation and gelation[J]. Biotechnology Advances, 2005, 23(1): 75-80. DOI:10.1016/j.biotechadv.2004.09.005.
[23] AWADE A C, EFSTATHIOU T. Comparison of three liquid chromatographic methods for egg-white protein analysis[J]. Journal of Chromatography, 1999, 723(1/2): 69-74. DOI:10.1016/S0378-4347(98)00538-6.
[24] 李玉珍, 肖怀秋. 大豆分离蛋白不同酶解方式水解度与乳化性和起泡性关系[J]. 食品与发酵科技, 2009, 45(4): 49-51.
[25] 吴丹, 徐桂英. 光谱法研究蛋白质与表面活性剂的相互作用[J]. 物理化学学报, 2006, 22(2): 254-260.
[26] 涂宗财, 王辉, 刘光宪, 等. 动态超高压微射流对卵清蛋白微观结构的影响[J]. 光谱学与光谱分析, 2010, 30(2): 495-498. DOI:10.3964/j. issn.1000-0593(2010)02-0495-04.
[27] 豆玉新. 动态超高压微射流均质对卵清蛋白改性机理的研究[D]. 南昌: 南昌大学, 2008.
[28] STEIN P E, LESLIE A G, FINCH J T, et al. Crystal structure of ovalbumin as a model for the reactive centre of serpins[J]. Nature, 1990, 347: 99-102. DOI:10.1038/347099a0.
Enzymatic Hydrolysis and Structural Properties of Egg White Ovalbumin
LIU Lili, WANG Huan, LI Dan, YIN Guangjun, KANG Huaibin
(College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471003, China)
The enzymatic hydrolysis of egg white albumin and changes in its structural properties were studied. As evaluated in terms of degree of hydrolysis (DH), alkaline protease was determined as the bes t enzyme to hydrolyze egg white albumin, which was signifi cantly superior to other proteases tested, providing a DH value of 26.55% (P < 0.05). The enzymatic hydrolysis process was studied through single factor and quadratic general rotary unitized design experiments. The structural properties of egg white albumin and its hydrolysate were characterized by ultraviolet (UV), Fourier transform infrared spectroscopy (FT-IR) and differential scanning calorimetry (DSC). The results showed that the optimum hydrolysis conditions were as follows: hydrolysis temperature, 52.5 ℃; hydrolysis time, 5 h; pH, 8.25; enzyme dosage, 5 500 U/g; and substrate concentration, 5%. Under these conditions, the maximum DH value of 27.88% was obtained. The resulting hydrosulfuryl content showed a decrease of 3.6 mol/(L·g) in surface hydrosulfuryl, a signifi cant increase in solubility, a decrease of 18.18% in foaming ability, and a reduction of 20.24% in foam stability as compared to egg white albumin. Moreover, the emulsifying index and emulsion stability of the hydrolysate increased by 13.56 m2/g and 10.46%, respectively. At the same time, the enzymatic hydrolysis led to peptide chain cleavage of egg albumin, damage to the ordered secondary structure, exposure of more amino acid residues, slight decrease in α-helix, and corresponding increases in β-turns and hydrophilic groups.
egg white ovalbumin (OVA); hydrolysate; structure characterization; functional property
10.7506/spkx1002-6630-201610010
TS253.1
A
1002-6630(2016)10-0054-08
刘丽莉, 王焕, 李丹, 等. 鸡蛋清卵白蛋白酶解工艺优化及其结构性质[J]. 食品科学, 2016, 37(10): 54-61. DOI:10.7506/ spkx1002-6630-201610010. http://www.spkx.net.cn
LIU Lili, WANG Huan, LI Dan, et al. Enzymatic hydrolysis and structural properties of egg white ovalbumin[J]. Food Science, 2016, 37(10): 54-61. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201610010. http://www.spkx.net.cn
2015-08-19
公益性行业(农业)科研专项(201303084);河南省重点攻关项目(152102110080);国家自然科学基金青年科学基金项目(31401622);河南科技大学高级别项目培育基金项目(2013ZCX012);河南省教育厅自然科学研究项目(13A550255)
刘丽莉(1974—),女,副教授,博士,研究方向为畜产品加工技术。E-mail:yangliuyilang@ 126.com
