川贝母分子鉴别方法的应用及改进
2016-12-07鲍方名薛满
鲍方名,薛满
(苏州市食品药品检验所,江苏 苏州 215104)
川贝母分子鉴别方法的应用及改进
鲍方名,薛满
(苏州市食品药品检验所,江苏 苏州 215104)
目的 改进《中国药典》2015版中川贝母分子鉴别方法,为《中国药典》的应用和标准修订提高提供参考。方法 优化聚合酶链式反应(PCR)模板与引物的比率,提高退火温度至61 ℃;采用乙醇沉淀法纯化PCR反应液。结果 原方法PCR出现明显非特异性条带,酶切结果模糊。方法改进后,非特异性条带得到明显抑制,同时目的条带量没有明显影响,酶切结果清晰,效果良好。结论 该方法专属性强、重现性好,可以满足川贝母的鉴别。
川贝母;分子鉴别;中药质量标准
中药川贝母为百合科植物川贝母、暗紫贝母、甘肃贝母、梭砂贝母、太白贝母或瓦布贝母的干燥鳞茎[1]。川贝母具有苦寒之性,有清热化痰之功。用治肺热咳嗽之证,常与知母相须为用,可以清气滋阴;兼有甘味微寒,尚能清润肺燥,长于润肺化痰止咳,多用于治阴虚燥咳,常与杏仁、麦门冬、紫苑等药同用;还可用治老嗽咳血,常与百部、天冬、沙参等药同用[2]。随着人们对川贝母的应用,在许多治疗急性气管炎、支气管炎、肺结核等的中成药制剂中都加入了川贝母:二母宁嗽丸、川贝雪梨膏、止嗽化痰丸、贝羚胶囊、牛黄蛇胆川贝液、甘露消毒丸、百合固金口服液、妙灵丸、金嗓清音丸、治咳川贝枇杷露、参茸保胎丸、复方川贝精片、川贝止咳露、养阴清肺丸、小儿止咳糖浆、小儿化毒散、小儿至宝丸、小儿金丹片、小儿咳喘颗粒、小儿清肺止咳片、蛇胆川贝胶囊、贝母瓜蒌散等[1,3]。
川贝母按照药材性状的不同常分为松贝、青贝、炉贝及栽培品[1]。川贝母的传统鉴别方法就是根据各种川贝母的性状的细微差别来鉴别混淆品与伪品[4]。随着自然科学技术的发展,分子生物学技术在中药鉴定中开始了大规模的研究,使中药鉴定的手段从传统的形态表征扩展到了遗传物质DNA:核糖体上的ITS保守区序列、叶绿体上的psbA-tmH序列、18S rRNA及tmK基因等[5-6]。川贝母的分子鉴别方法也得到了突飞猛进的发展,《中国药典》2015版已经收录了川贝母的聚合酶链式反应-限制性内切酶长度多态性方法[1,7-9]。
本实验按照《中国药典》2015版川贝母项下聚合酶链式反应-限制性内切酶长度多态性方法,进行川贝母鉴别研究,发现聚合酶链式反应(PCR)结果出现干扰后续判断的非特异性条带,酶切结果模糊。因此,对川贝母的分子鉴别方法进行了再研究,并通过一些经济实用的实验对现有方法进行了补充。改进后非特异性条带得到明显抑制,酶切结果清楚容易判断。
1 材料
1.1 试验药材 川贝母对照品(粉末)来源于中国食品药品检定研究院(批号:121000-201108) ,川贝母样品1(药品委托检验:江阴市天江药业有限公司,委托编号SZ2016QS0106,产地:四川阿坝);川贝母样品2(药品委托检验:江阴市天江药业有限公司,委托编号SZ2016QS0107,产地:拉萨);川贝母样品3(药品委托检验:苏州九珍堂健康药业有限公司,委托编号SZ2016QS0229,产地:四川);川贝母样品4(药品委托检验:吴江上海蔡同德堂中药饮片有限公司,委托编号SZ2015QS0607),以上川贝母样品均为饮片。
1.2 仪器和试剂 PCR仪(AB Applied Biosystems),核酸电泳仪(Bio-Rad Power Pac TM Basic),凝胶成像系统(GEL DocTM XR+ Bio RAD),高速低温离心机(Thermo scientific Biofuge primo R)。DNA提取试剂为TIANGEN Plant Genomic DNA Kit DP305-02(批号:N226,吸附柱批号:N2106),DREAM Taq Green PCRMaster Mix(2×)为Thermo Scientific公司产品(批号:00108596),限制性内切酶SmaⅠ(批号:K6001BA)购自TaKaRa,引物ITS1:5’CGTAACAAGGTTTCCGTAGGTGAA3’和ITS2:5’GCTACGTTCTTCATCGAT3’合成于上海生工(批号:9304435540和9304435541), GelRed购自BIOTIUM公司,批号11G0127),TIANGEN 100 bp DNA Ladder(所有条带:100、200、300、400、500、600、700、800、900、1 000 bp)和50 bp DNA Ladder(所有条带:50、100、150、200、250、300、350、400、500 bp)。其他试剂药品皆为国产或进口的分析纯试剂。
2 川贝母鉴别方法研究
2.1 药典方法
2.1.1 基因组DNA提取 从供试品随机抽取少许,置乳钵中,加适量液氮,充分研磨。取30 mg左右粉末置1.5 mL离心管中,按植物基因组DNA提取试剂盒使用说明书步骤提取基因组DNA,提取得到的供试品DNA置零下20 ℃保存备用。对照品DNA制备:取川贝母对照品30 mg左右置1.5 mL离心管中,按前述方法提取川贝母对照品基因组DNA。
2.1.2 PCR反应 PCR反应体系:在200 μL PCR管中进行,反应总体积为25 μL,DREAM Taq Green Pcr Master Mix(2×)12.5 μL,20 μmol·L-1的引物各0.5 μL ,DNA模板1 μL ,去离子水10.5 μL。PCR反应参数:95 ℃预变性4 min,循环反应30次(95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s),72 ℃延伸5 min。
2.1.3 酶切反应 酶切反应体系:在1.5 mL离心管中进行,反应总体积为20 μL,10X酶切缓冲液2 μL,0.1%BSA 2 μL,供试组PCR反应液6 μL,SmaⅠ 2 μL,去离子水8 μL。酶切反应在30 ℃水浴反应2 h,结束时加入2 μL 10×Loading buffer终止酶切反应。
2.1.4 电泳检测 按琼脂糖凝胶电泳法(三部附录Ⅳ B)。电泳条件:电泳缓冲液为TAE,胶浓度为2%,在融化的琼脂糖中加入核酸胶染色剂GelRed; 5 V·cm-1恒压电压下,电泳时间约50 min。
供试品与对照药材PCR反应溶液、供试品与对照药材酶切反应溶液的上样量:6 mL;DNA分子量标记(100 bpDNA Ladder和50 bpDNA Ladder)上样量:3 μL;电泳结束后,取凝胶片在凝胶成像仪上检视。按照药典方法规定的PCR条件进行川贝母的鉴别时发现,川贝母对照品PCR结果有比较明显的非特异性带出现,大小在200~300 bp之间,如图1所示。按照药典方法对PCR产物直接酶切操作,结果出现条带模糊,无法区分目的条带是否存在的现象。
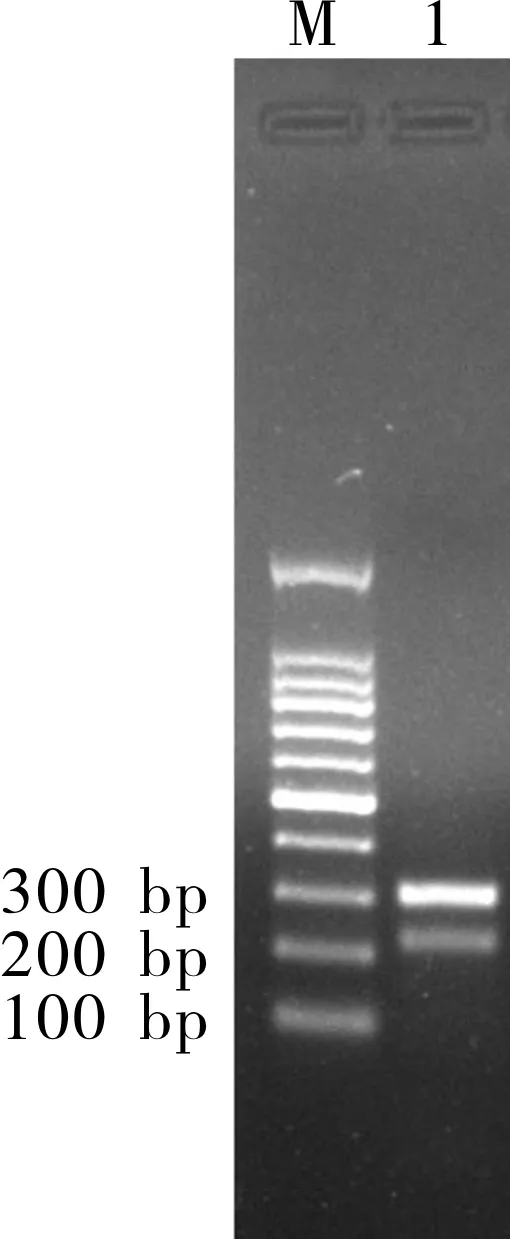
注:M:100 bp DNA Ladder; 泳道1:川贝母对照品。
图1 川贝母对照药材PCR结果电泳图
2.2 改进后的方法
2.2.1 非特异性条带的干扰 使用Primer5软件对设计引物进行分析,结果如表1所示。从引物Tm计算结果可以发现,Tm在47.3~64 ℃之间,所以56 ℃只是在药典标准发布者的条件下(PCR仪和PCR试剂)的最佳温度,在本次操作的PCR反应体系中还有提高的空间。

表1 引物分析结果
2.2.2 PCR条件的优化 优化后的PCR反应体系:在200 μL离心管中进行,反应总体积为25 μL ,DREAM Taq Green Pcr Master Mix(2×)12.5 μL (Thermo Scientific,批号:00134703),20 μmol·L-1的引物(上海生工,引物1批号:9304435540和引物2批号:9304435541)各0.2 μL ,DNA模板2 μL,去离子水10.1 μL。阴性对照将模板替换为灭菌去离子水。PCR反应参数:95 ℃预变性4 min,循环反应30次(95 ℃ 30 s,梯度58~63 ℃ 30 s,72 ℃ 30 s),72 ℃延伸5 min。
为了减少非特异性条带的出现,加大了DNA模板量,减少了引物量,并适当提高了退火温度。结果如图2所示,退火温度在61 ℃时,主带亮度没有明显减少的同时,非特异性条带得到了明显抑制。
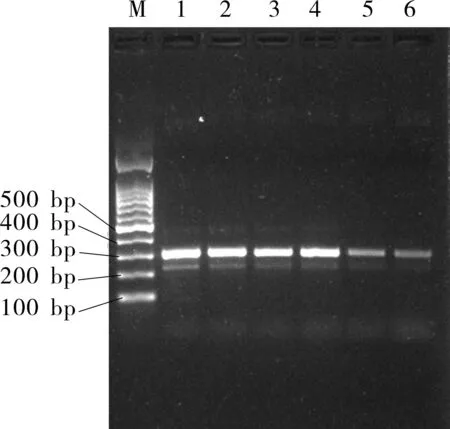
注:M:100 bp DNA Ladder; 泳道1:58 ℃;泳道2:59 ℃;泳道3:60 ℃;泳道4:61 ℃;泳道5:62 ℃;泳道6:63 ℃。
图2 川贝母对照药材梯度PCR结果电泳图
2.2.3 PCR产物的纯化 尝试使用乙醇沉淀法对PCR反应液进行缓冲液置换后再进行酶切。乙醇沉淀法:(1)加入1/10体积的醋酸钠(3 mol·L-1,pH 5.2)于DNA溶液中充分混匀,使其最终浓度为0.3 mol·L-1; (2)加入2.5倍体积预冷的无水乙醇混合后再次充分混匀置于-20 ℃中15~30 min;(3)14 000 r·min-1离心15 min 4 ℃,小心移出上清液,吸去管壁上所有的液滴;(4) 加入1/2离心管容量的70%乙醇,14 000 r·min-1离心5 min 4 ℃,小心移出上清液; (5)于室温下将开盖的EP管置于实验桌上以使残留的液体挥发至干;(6) 加适量的去离子水溶解DNA沉淀。
2.3 改进后方法的应用 基因组提取、PCR产物酶切及电泳检测方法同药典方法,PCR反应体系及条件进行了优化,具体参数见“2.2.2”项,并在PCR之后酶切之前增加了纯化步骤。按照优化后的方法对川贝母样品1~4进行分子鉴别,PCR结果和酶切结果如图3和图4所示,在300 bp左右有目的条带的出现,200~300 bp出现的非特异性条带得到明显抑制,酶切之后,在100~200 bp之间有明显酶切片段。结果该方法能够适用于日常川贝母检品的鉴别。

注:M:100 bp DNA Ladder; 泳道1:川贝母对照品;泳道2:SZ2016QS0106供试品;泳道3:SZ2016QS0107供试品;泳道4:SZ2016QS0229供试品;泳道5:SZ2015QS0607供试品。
图3 供试品和川贝母对照药材PCR结果电泳图

注:M:50 bp DNA Ladder; 泳道1:川贝母对照品;泳道2:SZ2016QS0106供试品;泳道3:SZ2016QS0107供试品;泳道4:SZ2016QS0229供试品;泳道5:SZ2015QS0607供试品。
图4 酶切结果电泳图
3 讨论
按照《中国药典》2015版川贝母项下聚合酶链式反应-限制性内切酶长度多态性方法,进行川贝母鉴别研究发现,PCR结果在200~300 bp出现一条明显的非特异性条带,直接干扰后续酶切结果的判断;PCR产物直接酶切后发现条带模糊,无法区分目的条带是否存在。因此,对PCR反应条件进行了再研究,通过减小引物与模板的比率和提高退火温度,减少了PCR反应中错配的发生;使用简单实用的乙醇沉淀法对PCR产物进行了纯化,杜绝了PCR产物中的PCR缓冲体系对酶切体系的干扰。改进的方法应用于多批川贝母的鉴别,结果均良好。
随着中药材的分子鉴别法不断被药典收录,分子鉴别法的特殊性也逐渐显示出来。和其他药典方法相比,分子鉴别法由于灵敏度高,细微试剂仪器的不同就有可能造成很大的结果差别。正因为这种现象的存在,中国药典2015版四部才收录了通则9 107种中药材DNA条形码分子鉴定法指导原则。同时,由于分子鉴别法灵敏度高,不同的中药饮片形式(完整个体,部分个体,粉末)给如何取样进行基因组提取带来了不小的困难[10]。而且在酶切完成后,有时会出现没有酶切完全的现象,也可能是由于样品混有伪品引起的。
[1] 国家药典委员会.中国药典(一部)[S].北京:中国医药科技出版社,2015:250-251.
[2] 王爱华,王丽丽.中药川贝母的历史沿革及临床应用分析[J].世界临床医学,2015,9(11):180-182.
[3] 孙韬,彭成.川贝母止嗽颗粒的平喘作用研究[J] .时珍国医国药,2013,24(7):1575-1578.
[4] 余芳蓉.川贝母性状及混淆品与伪品鉴别[J].实用中医内科杂志,2010,24(5):98-99.
[5] 霍锋,张泷,张娅.DNA分子标记技术在药用植物鉴别中应用[J].安徽农业科学,2010,38(8):4089-4091.
[6] 蔡佩欣,胡学善,黄文秀,等.DNA芯片技术用于贝母的基因分型和种类鉴别 [J].药学学报,2003,38(3):185-190.
[7] 徐传林,李会军,李萍,等.川贝母药材分子鉴定方法研究[J].中国药科大学学报,2010,41(3):226-230.
[8] 周亭亭,于文静,李明成,等.川贝母DNA检测试剂盒的研制与评价[J].中国药学杂志,2014,49(6):501-504.
[9] 谭莹,张丽华,李明成,等.中药川贝母DNA指纹鉴定研究[J].中国药学杂志,2011,46(1):14-16.
[10] 张文娟,刘薇,魏锋,等.聚合酶链式反应-限制性片段长度多态性法用于检定川贝母掺伪情况的研究[J] .药物分析杂志,2014,34(10):1830-1835.
Implementation and improvement for molecular identification of Fritillariae cirrhosae bulbus
BAO Fangming,XUE Man
(SuzhouInstituteforFoodandDrugControl,Suzhou,Jiangsu215104,China)
Objective To improve the molecular identification method of Fritillariae cirrhosae bulbus in Chinese Pharmacopoeia (2015 version),and to provide reference for implementation of the standards of Chinese Pharmacopoeia.Methods Primer quantity was reduced while template quantity was improved.And the annealing temperature was changed from 56 ℃ to 61 ℃.Ethanol precipitation was used for PCR purification.Results Using original method,one nonspecific band (200 bp to 300 bp) was found in PCR result and the result of restriction endonucleases digestion was too fuzzy to identify.After the method was improved,the nonspecific band was obviously inhibited,while the purpose band was not significantly affected.The result of restriction endonucleases digestion was clear for identification.Good results were achieved with the improved method.Conclusion This method has good repeatability and can be used for molecular identification of Fritillariae cirrhosae bulbus.
Fritillariae cirrhosae bulbus;Molecular identification;Quality standard of traditional Chinese medicine
薛满,男,副主任医师,研究方向:生药学,E-mail:xueman_szyjs@126.com
10.3969/j.issn.1009-6469.2016.10.015
2016-05-26,
2016-07-22)
