铜在日本青鳉体内的累积特征及其对肝脏组织结构的影响
2016-12-06赵艳民王洪盼温泉曹伟刘志超杨晨晨刘宪斌秦延文
赵艳民,王洪盼,,温泉,曹伟,刘志超,杨晨晨,刘宪斌,秦延文,*
1.中国环境科学研究院环境基准与风险评估国家重点实验室国家环境保护河口与海岸带环境重点实验室,北京100012
2.天津科技大学天津市海洋资源与化学重点实验室,天津300457
铜在日本青鳉体内的累积特征及其对肝脏组织结构的影响
赵艳民1,王洪盼1,2,温泉1,曹伟1,刘志超1,杨晨晨1,刘宪斌2,秦延文1,*
1.中国环境科学研究院环境基准与风险评估国家重点实验室国家环境保护河口与海岸带环境重点实验室,北京100012
2.天津科技大学天津市海洋资源与化学重点实验室,天津300457
为了解水体铜(Cu(II))在日本青鳉(Oryzias latipes)脑、鳃、肝脏、性腺和肌肉组织中的累积特征,以及Cu(II)对肝脏组织结构的影响,本文采用生态学单因子梯度实验,进行20 d的日本青鳉毒性暴露试验。结果显示,日本青鳉各个组织对Cu(II)的累积量随着浓度的升高而增多,但不同组织对Cu(II)的累积量有较大的差异,铜累积量由大到小依次为:肝脏>脑>鳃>性腺>肌肉。铜暴露后的日本青鳉肝细胞出现肿大、大小不一、排列混乱,静脉扩张淤血,部分肝细胞固缩和坏疽等现象。肝脏是日本青鳉蓄积铜的主要器官之一,实验发现高浓度的Cu(II)对肝脏组织结构造成了明显的损伤,进而严重影响日本青鳉的存活率。
铜离子;日本青鳉;累积;组织结构
日本青鳉(Oryzias latipes)隶属于辐鳍鱼纲(Actinopterygii)、鹤鱵目(Beloniformes)、异鳉科(Adrianichthyidae),青鳉属(Oryzias),成鱼体长20~40 mm之间,广泛分布于中国,东部从辽河到海南省,西到关中及四川省均有分布,国外在朝鲜西部及日本本州也有分布。日本青鳉已被经济合作发展组织(OECD)、国际标准化组织(ISO)及美国环境保护局(US EPA)等机构推荐为实验用鱼之一[1]。
重金属进入生物体后可与生物体内的大分子如核酸、酶、蛋白质等结合而积累在生物体内的各个组织器官中。近年来,国内外众多研究者针对铜对水生动物组织的累积及分布特征开展了相关研究,主要有罗非鱼(Oreochromis mossambicus)、淡水白鲳(Colossoma brachypomum)、鲤鱼(Cyprinus carpio)和鲫鱼(Carassius auratus)[2-6],而铜在日本青鳉组织中的积累以及对肝脏组织结构造成的影响还未见报道。由于生物体内器官的特点及代谢机制的差异性,导致生物体对铜、镉等重金属的吸收和解毒机制不完全相同,乃至同一生物体的不同器官组织对重金属的积累分布也会有差异。本研究在饲养日本青鳉的水体中添加不同浓度的Cu(II),通过测定其脑、鳃、肝脏、性腺、肌肉内的铜含量,以及采用组织切片技术,从细胞学的角度初步了解重金属铜对肝脏组织结构的影响,以期为研究重金属在鱼体内的积累、分布及迁移规律提供理论参考,为渔业工程制定水质标准和环境保护提供理论依据。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
实验采用电感耦合等离子体质谱仪ICP-MS 7500(安捷伦科技有限公司,美国)、FD-1C-80冷冻干燥机(北京博医康技术公司,北京)、EG35B可调式电热板(北京莱伯泰科仪器股份有限公司,北京)、Leica CM1950冷冻切片机(Leica公司,德国)等器材。CuSO4·5H2O购自国药集团化学试剂有限公司,其他使用的化学品均为分析纯(AR)。试验前称取CuSO4·5H2O 3.906 g,定容1 L,配制成一定浓度的母液,实验时再根据预实验的结果稀释成所需的实验浓度。
1.2 试验用日本青鳉与饲养管理
日本青鳉由中国环境科学研究院人工模拟养殖基地驯养,成鱼体长(2.82±0.31)cm,体重(0.42±0.12) g。实验用水为经曝气的自来水配制,pH值为7.1~7.4,溶解氧为6.8~8mg·L-1,总硬度(均值)250mg·L-1(以CaCO3计),水温(24±1)℃。光照周期为16 h∶8 h(昼∶夜)。
实验水体的Cu(II)对日本青鳉暴露试验采用静态染毒法,在15 L的实验水族箱中加入10 L含不同铜离子浓度的饲养水体。根据铜对日本青鳉的急性毒性试验,Cu(II)对日本青鳉的96 h-LC50为2.032mg·L-1,正式试验组的浓度设定分别取96 h-LC50的1/50、1/20、1/10及1/5,即分别为0.04、0.10、0.20及0.40mg·L-1。每个水族箱放入10尾日本青鳉鱼,持续曝气,每个浓度组设3个平行,实验暴露时间20 d。
1.3 分析方法
1.3.1 铜含量的测定
取出实验鱼的鳃、脑、肝脏、卵巢和肌肉组织,在60℃下烘48 h,至样品干燥,粉碎研磨后准确称重。然后置于三角瓶中,加入2 mL浓HNO3(质量分数65%)和0.5 mL HClO4(质量分数70%)混匀放置过夜,然后在120℃下消解3 h,至溶液澄清为止,冷却后定容到10 mL,用去离子水稀释至刻度并摇匀。使用电感耦合等离子体质谱仪直接测定样品中的Cu(II)含量,每实验组测定3个平行样。
1.3.2 组织切片
取日本青鳉肝脏的新鲜组织,用冷冻切片专用胶水包埋,Leica CM1950冷冻切片机(Leica公司,德国)冷冻切片,厚度为8μm,H.E.染色,脱水封片。用LeicaDM2500显微镜(Leica公司,德国)进行观察和拍照。
1.4 数据处理
本实验所得数据均用SPSS19.0软件进行处理。以3个平行组数据计算平均值±标准差(Mean±SD),采用单因素方差分析(one-way ANOVA)方法检验,显著性水平P<0.05。
2 结果(Results)
2.1 不同铜离子浓度条件下日本青鳉的存活率
不同Cu(II)浓度实验组日本青鳉存活率见图1。暴露20 d后,随着水体中Cu(II)浓度的上升,日本青鳉的存活率降低。0.04、0.10mg·L-1Cu(II)浓度组日本青鳉存活率分别为88.89%、82.22%,组间没有显著性差异(P>0.05),但与对照组相比显著性降低(P<0.05),0.40mg·L-1浓度组日本青鳉存活率降低至53.33%,约为对照组的1/2。
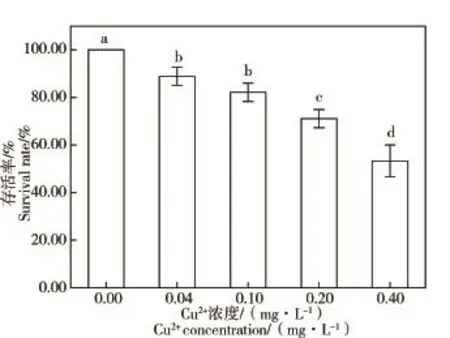
图1 不同Cu(II)浓度条件下处理20 d后日本青鳉的存活率注:图中上标字母相同表示差异不显著(P>0.05)。Fig.1 Survival rate ofOryzias latipesexposed to different concentrations of Cu(II)for 20 daysNote:Bars with the same letter show no significant difference(P>0.05).
2.2 Cu(II)在日本青鳉各组织中的累积
日本青鳉不同的组织器官对Cu(II)具有不同的吸收能力。总体结果是肝脏>脑>鳃>性腺>肌肉(见图2)。对照组日本青鳉脑、鳃、肝脏、性腺和肌肉中Cu(II)的含量分别为32.27、15.48、20.41、5.85和2.35μg·g-1(干重)。
实验组日本青鳉肝脏中的铜含量随着水体铜浓度的增加迅速增高,浓度为0.04mg·L-1处理组青鳉肝脏铜积累量已达59.14μg·g-1(干重),与对照组相比有显著性差异(P<0.05),0.40mg·L-1浓度组积累量高达137.59μg·g-1(干重),与对照组相比具有显著性差异(P<0.05),是对照组的6.74倍,且分别是同一Cu(II)浓度处理组脑、鳃、性腺和肌肉中Cu(II)含量的1.39倍、2.10倍、5.92倍和16.44倍。
暴露浓度在0~0.20mg·L-1的浓度范围内,日本青鳉脑中的铜含量与对照组相比无显著性差异(P>0.05);当Cu(II)浓度达到0.40mg·L-1时,脑中的Cu(II)含量急剧上升,达到98.69μg·g-1(干重),是对照组的3.06倍,显著高于对照组(P<0.05)。
日本青鳉鳃中的铜含量随着Cu(II)浓度的升高而增加,但在0~0.10mg·L-1的浓度范围内增加量与对照组无显著差异(P>0.05);当Cu(II)浓度达到0.20mg·L-1时,鳃中的Cu(II)含量达到32.55μg·g-1(干重),显著高于对照组(P<0.05)。
性腺中Cu(II)含量较低,当水体中Cu(II)浓度为0.10mg·L-1时,性腺中Cu(II)含量为8.55μg·g-1(干重),与对照组无显著性差异(P>0.05);当Cu(II)浓度在0.20mg·L-1以上时,性腺中的Cu(II)含量均显著高于对照组(P<0.05)。而且随着浓度的增大,积累量越来越大。
肌肉组织中Cu(II)含量最低,但当处理组中Cu(II)浓度为0.04mg·L-1时,肌肉组织中Cu(II)含量显著地增加到5.16μg·g-1(干重),显著高于对照组(P<0.05)。随着处理组Cu(II)浓度的升高,肌肉中Cu(II)含量也随之增高,显著高于对照组(P<0.05)。

图2 不同Cu(II)浓度下日本青鳉各组织中的铜离子含量注:图中上标字母相同表示差异不显著(P>0.05),反之表明差异显著(P<0.05)。Fig.2 Copper content in different tissue ofOryzias latipes exposed to different concentrations of Cu(II)Note:Bars with the same letter show no significant difference(P>0.05);conversely show significant difference(P<0.05).
2.3 Cu(II)对日本青鳉肝脏组织的影响
组织学结果显示,对照组中的日本青鳉肝脏组织结构没有受到显著地损伤,其肝脏细胞排列规则且比较完整,胞质比较均匀,胞质染色较深(图3A)。经过20 d的铜暴露下,发现日本青鳉肝脏组织的结构损伤主要包括:静脉扩张淤血、部分肝细胞固缩和坏疽,而且随着暴露水体铜离子浓度的增加,肝脏的结构损伤更严重。0.1mg·L-1处理组日本青鳉肝脏出现了少许的静脉扩张淤血(图3B);0.2mg·L-1处理组肝脏出现多处静脉扩张淤血(图3C);0.4mg·L-1处理组肝脏出现了较为严重的结构损伤:肝脏细胞固缩和坏疽以及大量的静脉扩张淤血等(图3D)。
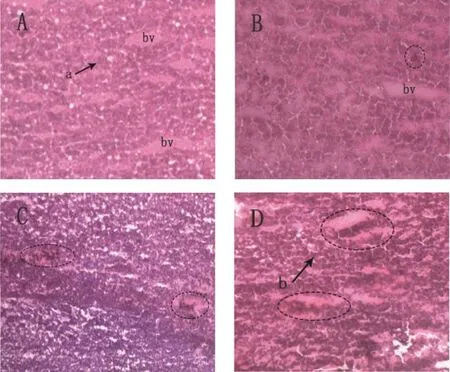
图3 对照组(A)与铜处理组(B~D)日本青鳉肝脏的组织切片注:(A)对照组日本青鳉肝脏组织,正常的肝细胞(a)和血管(bv),H.E.,×200;(B)0.1mg·L-1处理组,静脉扩张淤血,H.E., ×200;(C)0.2mg·L-1处理组,静脉扩张淤血,H.E.,×200;(D)0.4mg·L-1处理组,静脉扩张淤血,部分肝细胞固缩和坏疽(b),H.E.,×200。Fig.3 Liver histology ofOryzias latipesin control(A)and copper exposed group(B-D)
3 讨论(Discussion)
3.1 水体Cu(II)对日本青鳉体内Cu(II)分布的影响
通常认为鱼体对重金属的吸收途径主要为:1)鱼体鳃吸收水体中重金属离子(溶解态),并且通过血液输送到各组织器官中;2)经过消化道吸收水体或残留在饵料中的重金属;此外,重金属进入鱼体内还可以通过水体与体表的渗透交换作用[6]。本研究表明,日本青鳉体内所观测的各个组织中都有铜积累,但Cu(II)在日本青鳉体内的积累具有高度的选择性。铜主要积累于肝脏和脑中,而在鳃、性腺和肌肉中积累较少,各组织内铜累积量排序为肝脏>脑>鳃>性腺>肌肉。这与Kargin等[2]、刘晓燕等[4]、陈再忠等[45]报道的罗非鱼、淡水白鲳、鲤鱼、鲫鱼和锦鲤的结果类似。铜是生物体必需的微量元素,也是脑、血、肝等铜蛋白组成的成分,在多种酶活性中扮演重要角色。它们起着维持生命正常发育和新陈代谢的作用。但过量的Cu(II)可使鱼体肝脏中的溶酶体膜磷脂发生氧化反应,进而使溶酶体膜破裂,大量释放水解酶,最终引起鱼体肝组织坏死[4]。
鱼体肝脏组织对铜的富集较高,原因主要是在Cu(II)作用下肝脏能够迅速并大量合成金属硫蛋白(MT),使得重金属大量蓄积在组织体内,从而成为蓄积重金属的重要靶器官[7];肝脏中形成了大量铜金属硫蛋白,并以非毒的形式存于鱼体内,所以铜在内脏中的累积量远远大于肌肉和鳃组织[3]。
3.2 Cu(II)对日本青鳉肝脏组织的影响
肝脏是鱼类体内进行代谢和解毒的重要器官,而且也是铜对鱼类产生危害的靶器官[8-9],鱼中毒后肝脏表现为多发性的溶解坏死和细胞的变性。重金属对生物体的危害作用,主要是由于其能诱导产生活性氧自由基从而造成氧化损伤[10-12]。
本实验对照组中的日本青鳉肝脏组织,其肝脏细胞排列规则而且比较完整,胞质比较均匀,胞质染色较深。这与郭海山等[13]、陈辉辉等[14]研究的草鱼、唐鱼的结果类似。经过20 d的铜暴露下,低浓度Cu(II)处理组日本青鳉肝脏出现了少许的细胞排列混乱、大小不一、肥大等较轻的结构损伤,这与Bruslé等[15]报道的结果类似,分析原因可能为肝脏组织自身具有降低其毒性的能力,所以较低浓度下肝脏结构损伤较小;当毒物浓度过高,超过了肝脏的解毒能力,就会对肝脏的组织结构产生不同程度的影响[16]。刘香江等[17]、Daoust等[18]的研究表明高浓度铜暴露时矛尾复虾虎鱼、虹鳟肝脏组织出现静脉扩张淤血、细胞核固缩、胞浆内出现大量的空泡;Strmac和Braunbeck[19]的研究结果表明,高浓度苯基锡醋酸暴露时斑马鱼肝脏组织细胞出现严重固缩现象;Korkmaz等[20]、Velmurugan等[21]的研究表明高浓度氯氰菊酯暴露时尼罗罗非鱼、鲮鱼肝脏组织出现了肥大、肝窦变窄及脂肪空泡;本次试验中,高浓度Cu(II)处理组日本青鳉肝脏出现了大量的静脉扩张淤血、部分肝细胞固缩和坏疽等较为严重的结构损伤。铜对日本青鳉肝脏结构损伤的现象与其他相关毒物对鱼类肝脏的毒害作用以及由于环境污染等原因而造成鱼类的肝脏组织结构的变化结果基本一致,可能是因为铜代谢主要在肝脏中完成,而肝脏组织细胞的变性、坏死等又对肝功能造成障碍,致使铜离子积聚在鱼体各个组织器官中,最终鱼类的毒性反应加重[17,19]。
[1]张丽俏.基于日本青鳉急性毒性实验的水质监测技术构建[D].济南:山东师范大学,2011:12—14 Zhang L Q.Construction of water quality monitoring technology based on theOryzias latipesacute toxicity[D]. Jinan:Shandong Normal University,2011:12—14(in Chinese)
[2]Kargin F,Cogun H Y.Metal interactions during accumulation and elimination of zinc and cadmium in tissues of the freshwater fishTilapia nilotica[J].Bulletin of Environmental Contamination and Toxicology,1999,63(4): 511—519
[3]马桂云,林小兰,严少华,等.铜在鲫鱼体内的积累特征研究[J].化学世界,2007,48(1):49—52 Ma G Y,Lin X L,Yan S H,et al.Study on accumulation characteristic of copper in fishCarassius auratus[J]. Chemistry World,2007,48(1):49—52(in Chinese)
[4]刘晓燕,王化敏.铜、锌在鲫鱼幼鱼组织中的积累与分布[J].理化检验(化学分册),2009,45(2):235—237
[5]陈再忠,沈芾,孔令富.重金属镉在锦鲤各组织中的富集[J].江苏农业科学,2011,39(6):387—389
[6]张林宝,吴惠丰,孙伟,等.菲律宾蛤仔对铜、镉暴露的蓄积作用及抗氧化酶系统的响应研究[J].南方水产科学,2013,9(5):64—70 Zhang L B,Wu H F,Sun W,et al.Bioaccumulation and antioxidant responses in Manila clam(Ruditapes philippinarum)under cadmium and copper exposure[J].South China Fisheries Science,2013,9(5):64—70(in Chinese)
[7]刘长发,陶澍,龙爱民,等.铅与镉在被金鱼吸收积累过程中的相互作用[J].生态学报,2001,21(11):1863—1868 Liu C F,Tao S,Long A M,et al.Interactions of lead and cadmium on uptake and accumulation by gold fish,Carassius auratus[J].Acta Ecologica Sinica,2001,21(11): 1863—1868(in Chinese)
[8]Varanka Z,Rojik I,Varanka I,et al.Biochemical and morphological changes in carp(Cyprinus carpioL)liver following exposure to copper sulfate and tannic acid[J]. Comparative Biochemistry and Physiology,2001,128(3): 467—478
[9]Monteiro S M,Mancera J M,Fontainhas-Fernandes A,et al.Copper induced alterations of biochemical parameters in the gill and plasma ofOreochromis niloticus[J].Comparative Biochemistry and Physiology,2005,141(4): 375—383
[10]Stohs S J,Bagchi D.Oxidative mechanisms in the toxicity of metal ions[J].Free Radical Biology and Medicine, 1995,18(2):321—336
[11]Gaetke L M,Chow C K.Copper toxicity,oxidative stress, and antioxidant nutrients[J].Toxicology,2003,189(1-2): 147—163
[12]McGeer J C,Niyogi S,Smith D S.3-Cadmium[J].Fish-Physiology,2011,31(2):125—184
[13]郭海山,赵德福,冯明.铜、锌离子(Cu2+,Zn2+)引起鱼类中毒的组织病理研究初报[J].河南水产,1990(3):9—11
[14]陈辉辉.铜,镉,氯氰菊酯和溴氰菊酯对唐鱼(Tanichthys albonubes Lin)的毒性效应[D].武汉:华中农业大学,2011:21—22Chen H H.Toxic effects of copper,cadmium,cypermethrin and deltamethrin exposure onTanichthys albonubes Lin[D].Wuhan:Huazhong Agricultural University, 2011:21—22(in Chinese)
[15]Bruslé J,Gonzalez I,Anadon G,et al.The structure and function of fish liver[M]//Munshi J S D,Durra H M (Eds).Fish Morphology.New York:Science Publishers, 1996
[16]Thophon S,Kruatrachue M,Upatham E S,et al.Histopathological alterations of white sea bass,Lates calcarifer,in acute and subchronic cadmium exposure[J].Environmental Pollution,2003,121(3):307—320
[17]刘香江.重金属铜和镉(Cu和Cd)及乙酞甲胺磷对矛尾复虾虎鱼毒性效应的研究[D].武汉:华中农业大学, 2010:28—29 Liu X J.Toxic effects of waterborne heavy metal(copper and cadmium)and acephate exposure onSynechogobius hasta[D].Wuhan:Huazhong Agricultural University, 2010:28—29(in Chinese)
[18]Daoust P Y,Wobeser G,Newstead J D,et al.Acute pathological effects of inorganic mercury and copper in gills of rainbow trout[J].Veterinary Pathology,1984,21(1): 93—101
[19]Strmac M,Braunbeck T.Effects of triphenylin acetate on survival,hatching success,and liver ultrastructure of early life stages of zebrafish(Danio rerio)[J].Ecotoxicology and Environmental Safety,1997,44:25—39
[20]Korkmaz N,Cengiz E I,Unlu E,et al.Cypermethrin-induced histopathological and biochemical changes in Nile tilapia(Oreochromis niloticus),and the protective and recuperative effect of ascorbic acid[J].Environmental Toxicology and Pharmacology,2009,28(2):198—205
[21]Velmurugan B,Selvanayagam M,Cengiz E I,et al.Histopathology of lambda-cyhalothrin on tissues(gills,kidney, liver and intestine)ofCirrhinus mrigala[J].Environmental Toxicology and Pharmacology,2007,24:286—291
Accumulation Characteristic of Cu(II)in Oryzias latipes and Its Effect on Liver Histology Structure
Zhao Yanmin1,Wang Hongpan1,2,Wen Quan1,Cao Wei1,Liu Zhichao1,Yang Chenchen1,Liu Xianbin2,Qin Yanwen1,*
1.State Key Laboratory of Environmental Criteria and Risk Assessment,State Environmental Protection Key Laboratory of Estuary and Coastal Environment,Chinese Research Academy of Environmental Sciences,Beijing 100012,China
2.Tianjin Key Laboratory of Marine Resources and Chemistry,Tianjin University of Science and Technology,Tianjin 300457,China
30 April 2015 accepted 6 July 2015
In the present study,we investigate the accumulation characteristic of Cu(II)in various tissues ofOryzias latipes,as well as to explore the effects of Cu(II)on liver.Oryzias latipeswere exposed to Cu(II)solutions for 20 days using singe gradient factor experiments.We found that the accumulation of Cu(II)in vivo enhances significantly in a concentration dependent manner with the increase of Cu(II)concentration.In addition,the accumulations of Cu(II)varied sharply in different tissues,and the accumulations presented an order as following:liver>brain>gill>gonad>muscle.Light microscopic observation showed that the histology structure of liver changed greatly after Cu(II)exposure,such as the enlargement,chaotical arrangement and size variation of the hepatocytes,and the congestion of the central vein with blood cells and focal necrosis of hepatytes.The liver was one of the main tissues of accumulation of Cu(II).In this study,we found exposure to high concentrations of Cu(II)could bring severe damage to the liver tissue structure,which maybe ultimately affect the survival and growth ofOryzias latipes.
Cu(II);Oryzias latipes;accumulation;histology structure
2015-04-30 录用日期:2015-07-06
1673-5897(2016)1-323-06
X171.5
A
10.7524/AJE.1673-5897.20150430002
赵艳民,王洪盼,温泉,等.铜离子在日本青鳉体内的累积特征及其对肝脏组织结构的影响[J].生态毒理学报,2016,11(1):323-328
Zhao Y M,Wang H P,Wen Q,et al.Accumulation characteristic of Cu(II)inOryzias latipesand its effect on liver histology structure[J].Asian Journal of Ecotoxicology,2016,11(1):323-328(in Chinese)
国家水体污染控制与治理科技重大专项项目(2012ZX7503)
赵艳民(1979-),男,副研究员,研究方向为环境毒理与风险评价,E-mail:zhaoym@craes.org.cn
),E-mail:qinyw@craes.org.cn
简介:秦延文(1973—),女,博士,研究员,主要研究方向环境化学及环境风险评价。
