磷酸三苯酯对斑马鱼早期生命阶段的神经毒性研究
2016-12-06彭涛王思思任琳芮倩倩邵璐滢孙立伟傅正伟
彭涛,王思思,任琳,芮倩倩,邵璐滢,孙立伟,傅正伟
1.浙江工业大学生物工程学院,杭州310032
2.浙江工业大学海洋学院,杭州310032
3.浙江工业大学环境学院,杭州310032
磷酸三苯酯对斑马鱼早期生命阶段的神经毒性研究
彭涛1,王思思1,任琳2,芮倩倩2,邵璐滢2,孙立伟3,*,傅正伟1
1.浙江工业大学生物工程学院,杭州310032
2.浙江工业大学海洋学院,杭州310032
3.浙江工业大学环境学院,杭州310032
磷酸三苯酯(triphenyl phosphate,TPP)作为多溴联苯醚类阻燃剂的替代产品,是一类生产和需求量均相当高的有机磷酸酯类阻燃剂,目前已在多种环境介质以及生物体内均有不同程度检出。由于结构和有机磷农药具有相似性,其对生物的神经毒性值得关注。本研究以斑马鱼为实验动物,研究了TPP(5~625μg·L-1)的胚胎发育毒性和行为毒性,并通过检测乙酰胆碱酯酶活性以及神经系统相关基因的转录水平,探讨其可能的毒性机制。研究发现,TPP可导致斑马鱼胚胎孵化时间延长,体长变短,心率变慢。同时,TPP暴露也可以影响斑马鱼幼鱼在持续光照和明暗周期刺激下的游泳行为,表现为低浓度增加而高浓度降低其游泳速度。而TPP暴露后幼鱼乙酰胆碱酯酶活性以及神经发育相关基因转录水平的变化可能是导致其行为毒性的原因。虽然实验中所设定的暴露浓度高于环境中一般浓度,但TPP在短期暴露中所表现出的胚胎和神经发育毒性表明TPP对于水生生物可能存在一定风险,需要进一步研究加以确认。
有机磷酸酯阻燃剂;胚胎毒性;行为毒性;基因转录;乙酰胆碱酯酶
磷酸三苯酯(triphenyl phosphate,TPP)是一类生产量相当高的有机磷酸酯类阻燃剂,被广泛用于聚氯乙烯、印刷电路板、胶卷以及液压液中[1]。在2005年,美国环保局就曾预测,由于多溴联苯醚类阻燃剂被逐步禁用,作为其替代产品,TPP的需求量和生产量都将逐步增加[2]。TPP本身具有高挥发性,此外,与多溴联苯醚类阻燃剂类似,TPP是通过添加而非化学键结合的方式加入到最终产品中,这也大大增加了其进入环境介质的能力[3]。多项研究表明,TPP在空气、地表水、沉积物、灰尘以及多种生物体内均有不同程度的检出[3],因此,TPP的环境暴露可能对人类和其他生物产生健康风险,特别在其发育的敏感窗口期尤为引人关注[4]。
研究表明,TPP可通过其在塑料中的沥出和挥发以及液压液的泄露等途径进入水体环境中[5]。国外研究发现TPP在河流中的浓度一般在低于检测限到几十ng·L-1之间[3,6],而丹麦环保局则曾检测到7 900 ng·L-1的高浓度[5]。对于污水处理厂而言, TPP浓度相对较高,挪威的一项研究发现进出水中其浓度分别高达3 100~14 000 ng·L-1和1 700~3 500 ng·L-1[7]。在我国的地表水中,TPP也是检出频率最高的有机磷酸酯阻燃剂之一。在华北地区, 95%的河流水样中有TPP检出,最高浓度为15.7 ng·L-1,这与松花江和珠江的结果类似[8-10]。此外,TPP在我国多个城市的自来水中也均有检出,平均值为40.0 ng·L-1[11]。TPP也存于瓶装水中,其浓度可高达14.8 ng·L-1[11]。
虽然有学者认为TPP并不是持久性或者可生物富集的[12],但目前发现其在野生生物体内也有检出。早在1999年,丹麦环保局就曾在鱼体中检测到TPP,其浓度高达600μg·kg-1[5]。而挪威和瑞典所进行的一系列研究则表明TPP可在鱼类、蟹类以及水鸟中存在[3,7,13-15]。对于北美地区,在淡水鱼以及大湖区水鸟的血清和鸟蛋中均发现有TPP[16-17]。但是,关于TPP对生物的毒性,相关研究则非常有限。
有机磷酸酯阻燃剂在结构上和有机磷杀虫剂类似,而后者已被证实可损害脑部发育,具有神经毒性[18]。因此,有机磷酸酯阻燃剂是否也具有神经毒性值得关注。目前,已有研究表明TDCPP等有机磷酸酯阻燃剂可以导致神经毒性[18-19],然而,有关TPP对于硬骨鱼类的神经发育毒性还鲜有报道。因此,本论文将以国际上通用的模式鱼斑马鱼为实验动物,通过胚胎发育毒性、幼鱼行为毒性、乙酰胆碱酯酶(AChE)活性等指标,并结合神经系统相关基因的转录水平变化,探讨TPP对于斑马鱼幼鱼的毒性,从而为有机磷阻燃剂的生态风险评价提供依据。
1 材料与方法(Materials and methods)
1.1 化学试剂
磷酸三苯酯(TPP,纯度>99%,CAS:115-86-6)购自美国Sigma公司,用二甲基亚砜(DMSO)配制成母液,-20℃保存。
1.2 实验动物
AB系斑马鱼购于中科院水生所,养殖用水为经活性碳过滤并曝气的自来水,水温控制在(28±1)℃,光周期为14 h:10 h(昼:夜),溶氧不低于7mg·L-1。饲养期每天投喂饲料3次,即颗粒商品饵料2次和刚孵化的丰年虫幼虫1次,并及时清除多余饵料和排泄物。
1.3 斑马鱼胚胎发育毒性实验
收集斑马鱼鱼卵,镜检并挑选发育正常的受精后2 h斑马鱼胚胎。胚胎暴露于TPP溶液中,浓度设置为5,25,125和625μg·L-1。暴露在96孔板中进行,每孔1个胚胎,相应的暴露液为100μL。同时设溶剂对照(0.01%DMSO)。每个浓度3个平行,每个平行20个胚胎。暴露持续120 h,期间每天换水。每天观察并记录畸形数和孵化数,测定胚胎48 h的心跳,并在120 h时测定其行为毒性。在暴露结束后测量幼鱼体长。
1.4 斑马鱼幼鱼行为毒性实验
在120 h时将96孔板置于Zebralab高通量行为分析仪(ViewPoint Life Sciences,France)中进行行为毒性测试。主要测试鱼在自由游泳行为和在光周期下的游泳行为。自由游泳行为是指在20 min连续光照下的运动行为,而光周期实验持续30 min,明暗周期设置为10 min暗-10 min亮-10 min暗,检测斑马鱼对暗亮转换刺激的反应。在实验之前需进行10 min的适应,实验后剔除不能正常发育幼鱼的行为数据。
1.5 斑马鱼幼鱼乙酰胆碱酯酶活性检测
按照上述暴露条件另处理斑马鱼胚胎至120 h,采样并整体匀浆,检测其乙酰胆碱酯酶活性。每个处理组3个平行,每个平行30条幼鱼(剔除未正常发育个体)。乙酰胆碱酯酶活的测定是基于将乙酰胆碱转变为蓝色产物三硝基苯的显色反应。按照乙酰胆碱酯酶检测试剂盒说明书(南京建成),在酶标仪上(Powerwave,Biotek,US)进行检测。检测光波长为412 nm。总蛋白浓度用BCA法进行测定。
1.6 神经系统相关基因的转录水平检测
将检测完行为毒性的幼鱼(剔除未正常发育个体)整体匀浆,每个浓度3个平行,每个平行15条幼鱼,按照Trizol(Takara,Japan)厂家使用说明,提取总RNA。以紫外分光光度计测定 RNA浓度,并以A260 nm/A280 nm比值(1.8~2.0)以及琼脂糖凝胶电泳确定RNA纯度。每个样取500 ng的RNA进行cDNA第一链合成(ReverTra Ace qPCR RT kit,Toyobo)。基于之前的研究[20],选择乙酰胆碱酯酶基因(ache)以及mbp,syn2a,shha,gap43,elavl3,α1-tublin,gfap等与神经发育相关的基因,进行荧光定量PCR分析。所用的仪器为Mastercycler ep realplex (Eppendorf),并使用SYBR Green荧光定量PCR试剂盒(Toyobo,Japan)。PCR反应条件为 95°C 3 min;95°C 15 s,60°C 1 min,40个循环。相对转录水平以管家基因β-actin进行校正。
1.7 统计分析
组间差异分析通过单因素方差分析(ANOVA)并以Dunnett’s检验进行多重比较。设P<0.05时有统计学差异。
2 结果(Results)
2.1 TPP对斑马鱼胚胎发育的影响
TPP不同浓度暴露后对斑马鱼的胚胎发育毒性结果如表1所示。从表中可以看出,TPP暴露后斑马鱼胚胎随暴露浓度升高其孵化时间延长,心率变慢,体长变短,并在高浓度有显著性差异。同时畸形率有上升趋势而孵化率下降,但未见统计学差异。
2.2 TPP对斑马鱼幼鱼游泳行为的影响
自由游泳行为是在连续20 min光照条件下对斑马鱼幼鱼的运动轨迹追踪。从图1A中可以看出,低浓度(5μg·L-1)TPP暴露后可使幼鱼游动速度显著加快,之后随着暴露浓度的升高,其游泳速度降低,并在最高暴露浓度(625μg·L-1)与对照有显著差异。同时我们还进行了光周期刺激实验,结果见图1B。从图中可以看出,由暗转明时,幼鱼游泳速度变慢,而由明转暗时,其速度则变快。与自由游泳相类似,在光周期刺激实验中,TPP暴露后幼鱼的游泳速度不论是在光期还是暗期均呈现低浓度上升而高浓度下降的趋势。在前后两个暗期中,最低浓度组的幼鱼与对照组相比游泳速度显著上升,而最高浓度则显著下降。在明期中,最低浓度组有上升但没有显著差异,而最高浓度组则显著下降。
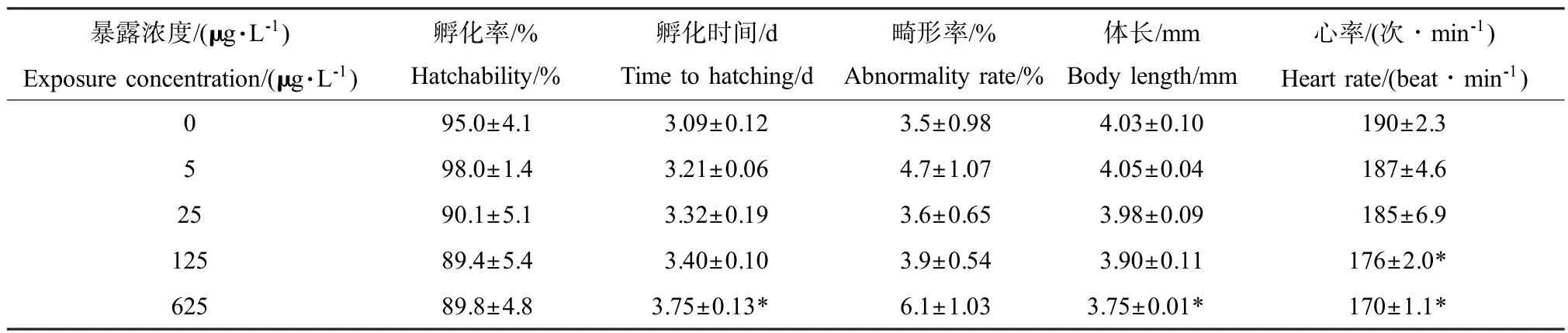
表1 TPP对斑马鱼胚胎的发育毒性Table 1 Developmental toxicology of TPP on zebrafish embryo
2.3 TPP暴露对斑马鱼幼鱼乙酰胆碱酯酶活性以及神经系统相关基因的转录水平影响
一般认为乙酰胆碱酯酶是水环境中暴露于神经毒性化合物的生物标志物。从图2中可以看出,25μg·L-1的TPP可诱导乙酰胆碱酯酶活性上升,但未见显著差异,而更高浓度的TPP(125和625μg·L-1)则可抑制酶活。而对于乙酰胆碱酯酶的基因转录(图3)而言,最低浓度(5μg·L-1)TPP暴露使ache的mRNA水平升高,而最高浓度(625μg·L-1)TPP则降低其转录水平。

图1 TPP暴露对斑马鱼幼鱼(A)自由游动速度和(B)光周期刺激实验中游泳速度的影响Fig.1 Effects of TPP on the speed of zebrafish larvae in(A)the free swimming or(B)the dark-light-dark photoperiod stimulation test

图2 TPP暴露对斑马鱼幼鱼体内乙酰胆碱酯酶活性的影响Fig.2 The changes of acetylcholinesterase(AChE)activity in zebrafish larvae following exposure to TPP

图3 TPP暴露对斑马鱼幼鱼体内神经系统相关基因转录水平的影响Fig.3 Transcriptional responses of genes related to nervous system in zebrafish larvae following exposure to TPP
此外,我们还研究了一系列神经系统相关基因的转录水平(见图3)。其中α1-tubulin,elavl3,shha和gap43是在神经元干细胞或者发育的神经元中表达,从图中可以看出在所设定的TPP暴露浓度范围内,随着暴露浓度升高,α1-tubulin基因转录水平呈先上升后下降的趋势,且在最低和最高浓度处理组与对照组相比有统计学差异。而对于gap43,elavl3, shha等3个基因而言,随着TPP暴露浓度的上升,虽然其mRNA水平也呈现先上升后下降的趋势,但仅有gap43基因在最高浓度组与对照组有显著差异。基因syn2a是突触形成的生物标志物,TPP暴露后其转录水平在高浓度组有显著上升。而gfap和mbp是在组成神经系统的其他类型细胞中表达,在TPP暴露后,mbp水平在最高浓度组显著上升,而gfap在除最低浓度之外的3个浓度组均比对照组显著升高。
3 讨论(Discussion)
TPP可能对人类影响较低,但对于水生生物则具有很强的毒性[3]。目前对于TPP的水生生物毒性研究多集中在急性毒性上。有研究认为TPP是对鱼类、虾类以及大型溞毒性最大的三苯基类有机磷酸酯[5,21]。然而,亟需更多的毒性数据以判明其生态风险。
目前,国际上普遍认可鱼胚胎在毒性测试中的应用不受动物福利相关法规的限制。同时,由于鱼胚胎毒性数据和传统的鱼类急性毒性间存在良好的相关性,斑马鱼胚胎作为毒理学动物模型其应用越来越广泛。本研究发现较高浓度的TPP可导致斑马鱼胚胎孵化时间延长,体长变短,心率变慢,而其中心率是相对敏感的毒性指标。然而,其对于畸形率和孵化率没有影响。类似的,之前的研究也显示斑马鱼胚胎在高达20mg·L-1的TPP暴露浓度下,孵化率和存活率均没有显著变化,而2mg·L-1也未见畸形率上升[22]。而对于心率的变化,已有研究显示500μg·L-1的TPP可以导致斑马鱼胚胎发育期心脏的发育畸形,同时也可以改变与心脏发育相关基因的转录水平[4,23],因此,我们所观察到的心率变化可能和以上机理有关。
一般而言,鱼类游泳行为的变化与毒物暴露呈现一定的关系。我们的研究发现,不论是在持续光照下还是在光周期刺激下,随TPP的暴露浓度的升高,斑马鱼幼鱼的游泳速度均呈现先上升后下降的趋势,并在最低和最高浓度和对照组有显著差异。斑马鱼幼鱼在暴露于低浓度污染物时平均游泳速度上升,一般是表明其对污染物的逃避反应,是鱼通过行为对环境的一种适应性机制。而在最高浓度游泳速度下降,则很可能意味着此浓度的TPP已对斑马鱼幼鱼的机体(特别是神经系统)造成一定的损伤。此外,和胚胎发育毒性的结果相比较也可以看出,斑马鱼幼鱼游泳行为是相对敏感的毒性指标。之前关于有机磷酸酯阻燃剂的研究也发现,TDCPP和TCEP均可导致斑马鱼幼鱼平均游泳速度下降[19]。
乙酰胆碱酯酶(AChE)在神经系统的信息传导中起重要作用[24]。研究发现有机磷和氨基甲酸酯农药对生物的AChE具有明显的抑制作用,从而破坏生物的神经功能,导致一系列生物学效应。如前所述,既然有机磷酸酯阻燃剂和有机磷农药在分子结构上存在相似性,因此,有必要确定TPP是否能如有机磷农药一样抑制AChE活性。从结果中可以发现,TPP在125和625μg·L-1可使AChE活性降低。从转录水平上看,高浓度TPP暴露后ache的mRNA水平也显著下降,与酶活数据相符,但低浓度对ache转录水平的诱导则可能是反映了斑马鱼幼鱼对TPP暴露的补偿调节。此外,由于功能蛋白在其基因转录后还需经过多个步骤才能表现出其生物学作用,因此酶活数据和mRNA水平的变化不完全一致在之前的研究中也多有发现,比如多溴联苯醚DE-71暴露后斑马鱼的AChE酶活显著升高,但在转录水平上未见差异[24]。
本论文所研究的神经发育相关基因中,α1-tubulin,elavl3,shha和gap43等4个基因是在神经元干细胞或者在发育的神经元中表达。其中,微管蛋白α1-tublin是一种中间丝纤维蛋白,对维持神经细胞结构具有重要意义,已有许多研究将其作为神经细胞骨架的生物标志物[20]。神经系统特异性RNA结合蛋白elavl3是斑马鱼早期神经元的标志基因。音猬因子shaa是一种重要的形态发生素,在调节脊椎动物器官发育中起关键作用。而生长相关蛋白gap43作为蛋白激酶C的主要底物,通常视为神经发育期间轴突生长的生物标记物[20]。因此,高浓度TPP暴露导致gap43和α1-tublin转录水平的下降可能意味着神经元发育受到干扰,而低浓度的诱导效应则很可能表明其对TPP暴露的补偿作用。此外,我们也注意到shha在神经系统以外也有表达,因此,虽然shha转录水平有先上升后下降的趋势,但由于RNA提取过程中鱼体整体匀浆,可能导致这种变化未见显著性差异。
此外,突触蛋白syn2a是一种神经磷蛋白质,在突触形成和神经递质释放过程中发挥重要作用[20]。在TPP暴露后,较高浓度可诱导其转录水平。类似的诱导作用也发生在gfap和mbp基因中。神经胶质纤维酸性蛋白gfap是一种中间丝蛋白,在中枢神经系统的放射状胶质细胞和星形胶质细胞中有高表达,而髓鞘碱性蛋白mbp则是髓鞘形成的生物标志物。这3个基因的转录水平上升,则可反映神经系统对TPP损害效应的补偿。类似的,对于乙醇这种公认对生物体神经发育有显著作用的化合物而言,在暴露后的斑马鱼幼鱼体内,包括gfap在内的多个基因转录水平出现显著诱导[20]。
对于TPP的神经毒性,不同研究有不同的结论。Anderson等[25]研究表明其可能有神经毒性,Ni等[26]则发现其和延迟神经毒性相关,而Pakalin等[12]研究发现TPP神经毒性较低。然而,丹麦环保局发现动物实验中没证据表明TPP有神经毒性,而TPP生产车间中的操作人员和对照组相比也未表现出差异[5]。我们的研究则表明TPP暴露能改变神经发育相关基因的转录水平,影响在行为和认知功能的调节中起重要作用的乙酰胆碱酯酶,并导致斑马鱼幼鱼游泳行为的改变。
总而言之,在本研究所设定的浓度范围内,TPP暴露斑马鱼胚胎可导致孵化时间延长,体长变短,心率变慢。同时,TPP暴露也可以影响斑马鱼幼鱼的游泳行为,而这种行为的变化则很可能是由于神经发育相关基因转录水平以及乙酰胆碱酯酶的变化所导致。虽然我们所设定的TPP浓度其最低值接近于环境中地表水或者污水处理厂进出水的极端高值,但我们的研究结果是基于短期暴露,因此,环境浓度长时间暴露对野生生物还是有可能存在危害。WHO认为TPP在水环境中浓度较低,不会对水中生物造成毒性[27],而美国环保局则认为 TPP作为decaBDE的替代品是有问题的[28]。因此,对于TPP的生态风险,还需要更多的研究加以确证。此外我们的研究也为其它有机磷酸酯阻燃剂的毒性评价提供了有益的参考。
[1]Brooke D,Crookes M,Quarterman P,et al.Environmental Risk Evaluation Report:Triphenyl Phosphate(CAS no. 115-86-6)[R].Bristol,UK:Environment Agency,2009
[2]USEPA.Furniture Flame Retardancy Partnership:Environmetnal Profiles of Chemical Flame-Retardant Alternatives for Low-Density Polyurethane Foam[R].Washington DC,2005
[3]van der Veen I,de Boer J.Phosphorus flame retardants: Properties,production,environmental occurrence,toxicity and analysis[J].Chemosphere,2012,88(10):1119-1153
[4]Isales G M,Hipszer R A,Raftery T D,et al.Triphenyl phosphate-induced developmental toxicity in zebrafish: Potential role of the retinoic acid receptor[J].Aquatic Toxicology,2015,161:221-230
[5]Lassen C,Lokke S.Brominated Flame Retardants:Substance Flow Analysis and Assessment of Alternatives.DK EPA Report No.494 1999[R].Danish Environmental Protection Agency(EPA),1999
[6]Bacaloni A,Cavaliere C,Foglia P,et al.Liquid chromatography/tandem mass spectrometry determination of organophosphorus flame retardants and plasticizers in drinking and surface waters[J].Rapid Communications in Mass Spectrometry,2007,21(7):1123-1130
[7]Green N,Schlabach M,Bakke T,et al.Screening of selected metals and new organic contaminants 2007.Phosphorus flame retardents,polyfluorinated organic compounds,nitro-PAHs,silver,platinum and sucralose in air, wastewater treatment falcilities,and freshwater and marine recipients[R].Norsk institutt for vannforskning,2008
[8]Wang R M,Tang J H,Xie Z Y,et al.Occurrence and spatial distribution of organophosphate ester flame retardants and plasticizers in 40 rivers draining into the Bohai Sea, North China[J].Environmental Pollution,2015,198:172-178
[9]Wang X W,Liu J F,Yin Y G.Development of an ultrahigh-performance liquid chromatography–tandem mass spectrometry method for high throughput determination of organophosphorus flame retardants in environmental water[J].Journal of Chromatography A,2011,1218(38): 6705-6711
[10]Wang X,He Y,Lin L,et al.Application of fully automatic hollow fiber liquid phase microextraction to assess the distribution of organophosphate esters in the Pearl River Estuaries[J].Science of the Total Environment,2014, 470:263-269
[11]Li J,Yu N Y,Zhang B B,et al.Occurrence of organophosphate flame retardants in drinking water from China [J].Water Research,2014,54:53-61
[12]Pakalin S,Cole T,Steinkellner J,et al.Review on production processes of decabromodiphenyl ether(decaBDE) used in polymeric applications in electrical and electronic equipment,and assessment of the availability of potential alternatives to decaBDE[R].European Commission,Di-rectorate General Joint Research Center,European Chemicals Bureau,2007
[13]Sundkvist A M,Olofsson U,Haglund P.Organophosphorus flame retardants and plasticizers in marine and fresh water biota and in human milk[J].Journal of Environmental Monitoring,2010,12(4):943-951
[14]Campone L,Piccinelli A L,Ostman C,et al.Determination of organophosphorous flame retardants in fish tissues by matrix solid-phase dispersion and gas chromatography [J].Analytical and Bioanalytical Chemistry,2010,397(2): 799-806
[15]Sucralose B A,Tetrabrombisphenol A,Siloxanes P D. Screening of new contaminants in samples from the Norwegian Arctic[R].Norwegian Pollution Control Authority,2009
[16]Su G,Greaves A K,Gauthier L,et al.Liquid chromatography-electrospray–tandem mass spectrometry method for determination of organophosphate diesters in biotic samples including Great Lakes herring gull plasma[J]. Journal of Chromatography A,2014,1374:85-92
[17]McGoldrick D J,Letcher R J,Barresi E,et al.Organophosphate flame retardants and organosiloxanes in predatory freshwater fish from locations across Canada[J].Environmental Pollution,2014,193:254-261
[18]Dishaw L V,Powers C M,Ryde I T,et al.Is the PentaBDE replacement,tris(1,3-dichloropropyl)phosphate (TDCPP),a developmental neurotoxicant?Studies in PC12 cells[J].Toxicology and Applied Pharmacology, 2011,256(3):281-289
[19]Dishaw L V,Hunter D L,Padnos B,et al.Developmental exposure to organophosphate flame retardants elicits overt toxicity and alters behavior in early life stage zebrafish (Danio rerio)[J].Toxicological Sciences,2014,142(2): 445-454
[20]Fan C Y,Cowden J,Simmons S O,et al.Gene expression changes in developing zebrafish as potential markers for rapid developmental neurotoxicity screening[J].Neurotoxicology and Teratology,2010,32(1):91-98
[21]Leisewitz A,Kruse H,Schramm E.Substituting Environmentally Relevant Flame Retardants:Assessment Fundamentals.Results and Summary Overview[R].Environmental Research Plan of the German Federal Ministry for the Environment,Nature Conservation and Nuclear Safety, 2000
[22]Liu C S,Wang Q W,Liang K,et al.Effects of tris(1,3-dichloro-2-propyl)phosphate and triphenyl phosphate on receptor-associated mRNA expression in zebrafish embryos/larvae[J].Aquatic Toxicology,2013,128:147-157
[23]Du Z,Wang G,Gao S,et al.Aryl organophosphate flame retardants induced cardiotoxicity during zebrafish embryogenesis:By disturbing expression of the transcriptional regulators[J].Aquatic Toxicology,2015,161:25-32
[24]Chen L G,Huang C J,Hu C Y,et al.Acute exposure to DE-71:Effects on locomotor behavior and developmental neurotoxicity in zebrafish larvae[J].Environmental Toxicology and Chemistry,2012,31(10):2338-2344
[25]Andresen J A,Grundmann A,Bester K.Organophosphorus flame retardants and plasticisers in surface waters[J]. Science of the Total Environment,2004,332(1-3):155-166
[26]Ni Y,Kumagai K,Yanagisawa Y.Measuring emissions of organophosphate flame retardants using a passive flux sampler[J].Atmospheric Environment,2007,41(15): 3235-3240
[27]WHO.EHC 111:Triphenyl Phosphate[R].Geneva, Switzerland,1991
[28]US-EPA.Report on Alternatives to the Flame Retardant DecaBDE:Evaluation of Toxicity,Availability,Affordability,and Fire Safety Issues.A Report to the Governor and the General Assembly[R].Illinois,2007
Neurotoxicity of Triphenyl Phosphate on the Early Life Stages of Zebrafish
Peng Tao1,Wang Sisi1,Ren Lin2,Rui Qianqian2,Shao Luying2,Sun Liwei3,*,Fu Zhengwei1
1.College of Biotechnology and Bioengineering,Zhejiang University of Technology,Hangzhou 310032,China
2.Ocean College,Zhejiang University of Technology,Hangzhou 310032,China
3.College of Environment,Zhejiang University of Technology,Hangzhou 310032,China
6 May 2015 accepted 29 May 2015
Triphenyl phosphate(TPP)belongs to the family of organophosphate flame retardants(OPFRs).Due to the phase-out of some brominated flame retardants,the production and use of TPP has gradually increased as alternatives.TPP is a frequently detected contaminant in the environment and wildlife,and the effects of TPP on the developing nervous system are of concern since OPFRs are structurally similar to organophosphate pesticides.In this study,the zebrafish were employed as experimental animal,and the developmental toxicity of TPP(5~625μg·L-1) on embryo and the behavioral toxicity on larvae were investigated.Moreover,in order to explore the underlying mechanisms,the activity of acetylcholinesterase(AChE)enzyme and the transcriptional responses of nervous sys-tem genes were measured.The results showed that TPP exposure delayed the time to hatching,and decreased the heart rate and body length.Additionally,TPP exposure caused the changes of swimming behaviors of larvae in the free swimming or the dark–light–dark photoperiod stimulation test,and resulted in the increase of swimming speed at low concentration while the decrease at high concentration.The changes of AChE activity and transcriptional responses of nervous system genes might afford the explanation for the behavioral toxicity.Although the exposure concentration of TPP used in this study exceeded the environmental concentration,the developmental toxicity on embryo the behavioral toxicity on larvae after short term exposure demonstrated that TPP might pose a risk to aquatic organism,and deserved more investigations in the future.
organophosphate flame retardants(OPFRs);embryonic toxicity;behavioral toxicity;acetylcholinesterase(AChE)
2015-05-06 录用日期:2015-05-29
1673-5897(2016)1-254-07
X171.5
A
10.7524/AJE.1673-5897.20150506001
彭涛,王思思,任琳,等.磷酸三苯酯对斑马鱼早期生命阶段的神经毒性研究[J].生态毒理学报,2016,11(1):254-260
Peng T,Wang S S,Ren L,et al.Neurotoxicity of triphenyl phosphate on the early life stages of zebrafish[J].Asian Journal of Ecotoxicology,2016,11 (1):254-260(in Chinese)
国家自然科学基金项目(No.21377118)
彭涛(1989-),男,硕士生,研究方向为生态毒理学,E-mail:52382967@qq.com
),E-mail:sunliwei@zjut.edu.cn
简介:孙立伟(1980—),男,环境科学博士,副教授,硕士生导师。主要研究方向为生态毒理学,已发表论文40余篇。
