国产防污漆中铜的海洋环境风险评估
2016-12-06梅承芳梁慧君周小翠田亚静邓桂荣许玫英栾天罡曾国驱
梅承芳,梁慧君,周小翠,田亚静,邓桂荣,许玫英,栾天罡,曾国驱,*
1.广东省微生物研究所,广东省菌种保藏与应用重点实验室,广州510070
2.广东省微生物研究所,省部共建华南应用微生物国家重点实验室,广州510070
3.中山大学生命科学学院,水产品安全教育部重点实验室,广州510275
4.佛山市环境健康与安全评价研究中心,佛山528000
5.环境保护部环境保护对外合作中心,北京100035
国产防污漆中铜的海洋环境风险评估
梅承芳1,2,3,梁慧君4,周小翠4,田亚静5,邓桂荣1,2,许玫英1,2,栾天罡3,曾国驱1,2,*
1.广东省微生物研究所,广东省菌种保藏与应用重点实验室,广州510070
2.广东省微生物研究所,省部共建华南应用微生物国家重点实验室,广州510070
3.中山大学生命科学学院,水产品安全教育部重点实验室,广州510275
4.佛山市环境健康与安全评价研究中心,佛山528000
5.环境保护部环境保护对外合作中心,北京100035
为有效控制防污漆中杀生物活性物质给海洋环境带来的不利影响,亟需开展活性物质的环境风险评估研究,为筛选环境友好型活性物质提供依据。以25种国产防污漆中的铜为评估对象,采用防污漆活性物质环境风险评估的针对性方法,分步进行暴露评估、危害性评估和风险表征。暴露评估采用海洋防污剂预测环境浓度模型(MAMPEC)中的港口、码头和开阔海域等典型暴露场景;危害性评估基于铜对淡水和海水水生生物的慢性毒性数据,采用物种敏感度分布法和评估因子法;风险表征采用熵值法。结果表明,铜对全部水生生物和海水生物的预测无效应浓度分别为2.8和2.3μg·L-1,藻类对铜最为敏感。除1种配方外,其余24种防污漆配方中铜的风险熵均小于1,可判定铜为“相对低风险”类活性物质,使用上述防污漆时铜对生态环境造成的风险较小。铜在不同暴露场景中的环境风险分析表明其对水流交换较弱海域的码头造成的风险最大,其次是默认港口和码头,对于公海造成的风险最小。根据现有的评估结果,设计含铜型防污漆配方时,应使铜的释放速率不大于33.5μg·cm-2·d-1,以避免对较封闭海域的生态环境造成不可忽视的风险。
铜;海洋环境风险评估;防污漆活性物质;物种敏感度分布法;典型暴露场景;环境预测浓度;预测无效应浓度
船舶和人工设施受到海洋生物 (如藤壶、藻类和软体动物等)附着后,造成自重和航行阻力,加速物体表面腐蚀,严重影响船舶和水下设施的性能与使用寿命,造成巨大的经济损失[1-5]。目前普遍采用的防生物污损处理技术是在接触海水的船舶表面涂布含有杀生物活性物质的防污漆,这些活性物质可缓慢释放至海水中从而抑制污损生物的附着和生长[6-7]。防污漆的广泛使用导致在世界范围内的港口和码头检测出高浓度的活性物质[8-13],其对海洋环境造成的潜在生态风险日益受到广泛关注。我国积极履行《关于持久性有机污染物的斯德哥尔摩公约》,淘汰含滴滴涕的防污漆[14-15],但在防污漆活性物质的环境风险评估研究领域尚属萌芽,这与中国作为防污漆出口和使用大国的地位极不相称。为了有效控制防污漆活性物质给海洋环境带来的不利影响,为我国相关法规和产品技术标准的制定提供依据,亟需开展针对海港、码头和开阔海域等典型默认暴露场景中活性物质海洋环境风险的相关研究[16]。
铜作为目前应用最为广泛的防污漆无机活性物质[17-18],已被许多研究证明是海水中铜的一个重要的人为来源,成为近海的常见污染物[13,19-22]。多个国家已有防污漆来源铜污染的相关报道:如英国埃塞克斯河口可溶态铜的浓度最高达20μg·L-1[23];美国圣地亚哥海湾表层海水中可溶态铜的平均浓度为8.5μg·L-1[24]。尽管铜是所有生命体必需的微量元素,对新陈代谢过程中的多种酶如细胞色素氧化酶、过氧化氢酶、超氧化物歧化酶等具有重要的生理功能[25],但在较低浓度时依然可对生物产生毒性效应[26-28]。有研究表明铜在港口的大量积累会导致海藻大量死亡,防污漆中铜与有机活性物质(即共杀生物质)对海洋的联合危害几乎等同于三丁基锡(TBT)类物质[29]。目前国内外相关研究主要集中在铜的毒害效应、防污漆中铜的释放速率、典型港口码头铜的暴露水平和全部来源铜的环境风险评估等方面[18,21-22,27,30-33]。 本文采用防污漆活性物质海洋环境风险评估的针对性方法,围绕国产防污漆中铜在欧美典型暴露场景中的海洋环境风险开展评估,为我国环境友好型防污漆的研发及其是否满足发达国家技术法规中对环境风险的要求提供初步依据。这是防污漆中铜海洋环境风险评估的首次针对性研究报道。
1 评估对象(Object of assessment)
代表性地选取了来自我国12家防污漆生产企业的25种常用含铜防污漆为评估对象,收集上述25种防污漆配方的各项参数(见表1),用于计算使用期内不同防污漆中的铜释放到海水中的速率。
2 评估方法(Assessment methods)
主要采用ISO 13073-1《船舶和海洋技术-船舶防污底系统的风险评估第1部分:用于船舶防污底系统的杀生物活性物质的海洋环境风险评估方法》[34]与欧盟风险评估指南文件[35]中的方法开展风险评估。由于无机物通常不可降解,且铜作为生命体的必须营养元素广泛存在于自然界中,因而有机活性物质环境风险研究中的持久性和富集性评估并不适用于铜[34]。本研究采用了针对无机活性物质的评估方法,在考虑环境背景浓度的基础上进行铜的生态环境风险评估,主要包括以下3个部分:暴露评估、危害性评估和风险表征。暴露评估和危害性评估分别用于获得铜在环境中的预测浓度 (predicted environmental concentration,PEC)和铜对水生生物的预测无效应浓度 (predicted no effect concentration, PNEC),将PEC/PNEC之比风险熵(hazard quotient, HQ)作为风险评估的量化指标即为风险表征。
2.1 释放速率的估算
首先估算活性物质进入海水的释放速率,这是活性物质暴露于海洋环境的重要途径。目前估算活性物质的释放速率主要有3种方法,分别是质量平衡法、实验室测试法和现场测定法。由于后两种方法缺乏规范的试验标准且测试成本昂贵,因而本研究采用专为环境风险评估而开发的质量平衡法,根据已获得验证的通用经验模型,按照公式(1)采用防污漆的各项参数(表1)计算25种防污漆中的铜进入海水的释放速率R,单位为μg·cm-2·d-1[34,36]。
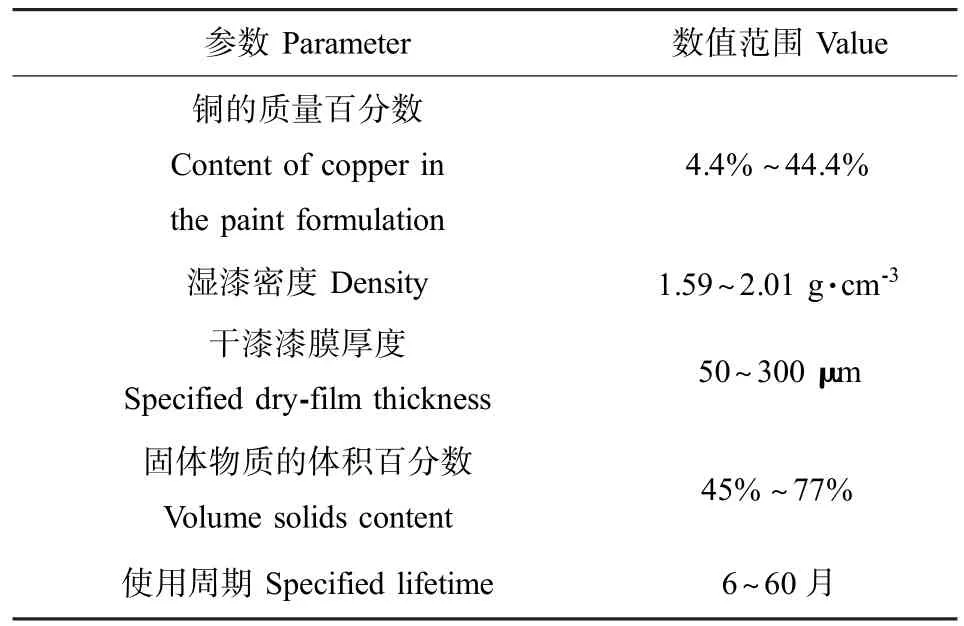
表1 25种国产含铜防污漆的各项配方参数Table 1 Paint formulation parameters for 25 Chinese antifouling paints containing copper
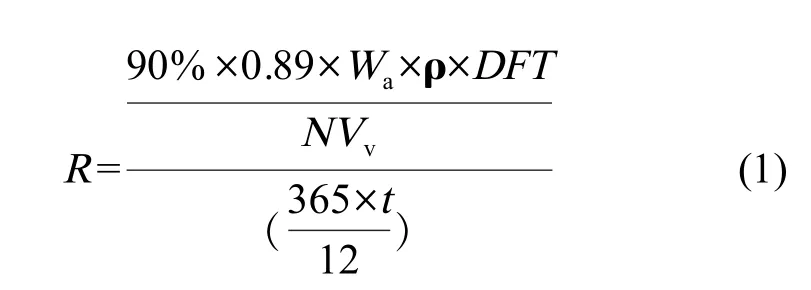
式中:
wa防污漆配方中活性物质的质量百分数,%;
ρ 湿漆密度,g·cm-3;
DFT 防污漆使用期内的干漆漆膜厚度,μm;
NVv防污漆中含有固体物质的体积百分数,%;
t 防污漆的使用期,以月计。
2.2 暴露评估
采用专为防污漆活性物质环境风险评估开发的海洋防污剂预测环境浓度模型 (Marine Antifoulant Modelto PredictEnvironmentalConcentrations, MAMPEC)计算铜的 PEC[16,34]。本研究选择了MAMPEC模型中的4个主要默认暴露场景(见表2)。由于目前生产使用的防污漆均为含铜型防污漆,因而设定铜在防污漆中的使用因子为100%。输入2.1中算得铜的释放速率 (3.9~36.2μg·cm-2·d-1),通过模型运算获得25种配方防污漆的铜在上述4个暴露场景中的环境预测浓度。
海水和沉积物中铜的背景浓度以及海洋环境中铜在溶解相和颗粒相之间的分配性(悬浮颗粒物/水分配系数,distribution coefficient,KD)对于估算防污漆中铜在海洋中的PEC十分关键[37]。欧洲铜业协会在2008年组织对大西洋和欧美澳主要河口的铜背景浓度和KD数据进行了汇总和统计,确定了相应的典型值。由于本研究主要是为考察国产防污漆中铜的环境风险是否满足发达国家技术法规的要求,为我国环境友好型防污漆的研发提供依据,因而在进行暴露评估时直接采用了上述典型值进行运算(详见表2)。计算港口(DCH)和码头(DM和DMPF)等近海暴露场景中的PEC时,采用铜的河口KD值;计算远海(DOS)场景中的PEC时,采用铜的远海KD值。通过模型运算得到溶解态的铜在海水中的预测浓度PECSW(PECSeaWater,单位为μg·L-1)和铜在海洋沉积物中的预测浓度PECSed(PECSediment,单位为μg·g-1干重)。
2.3 危害性评估
2.3.1 毒性数据的收集和处理
根据欧盟风险评估指南文件,优先采用慢性毒性数据即无可观察效应浓度(no observed effect concentration,NOEC)来推导铜的PNEC[35]。铜对水生生物的慢性毒性数据主要来自美国环保局ECOTOX数据库(http://www.epa.gov/ecotox/)和欧盟化学品信息数据库[32]。对收集到的数据进行了严格筛选和系统整理,主要遵循以下原则[34-35,38]:(1)毒性试验采用标准的测试方法;(2)研究完整地阐述了试验方式、数据处理和试验结果,满足试验有效性的全部要求;(3)试验期间对铜的背景浓度和暴露浓度进行分析测定,实测浓度和理论浓度偏差较大时(相对偏差大于20%)采用实测浓度计算结果;(4)毒性终点应反映种群群落或生态系统效应水平的存活率(死亡率)、生长变化、行为变化或繁殖(孵化)率等经典指标;(5)不考虑铜与其他物质的联合毒性数据,试验用水具有一定环境代表性;(6)试验时间分别大于4 d和48 h的无脊椎动物/鱼类毒性数据和藻类毒性数据;(7)同一物种的相同评价终点具有多个NOEC时,采用上述值的几何平均值;(8)同一物种的不同评价终点具有多个NOEC时,选用最低值即最敏感的评价终点;(9)在一个完整试验中针对同一物种的不同生命阶段具有多个NOEC时,选用最敏感生命阶段的毒性数据;(10)防污漆活性物质的主要暴露场景为港口、码头等近海海域,分布有淡水、半咸水和海水,栖息着广盐性的水生生物,因此铜的长期毒性数据同时包括了对淡水生物和海水生物的数据。
2.3.2 SSD曲线的构建和分析
筛选后得到的数据,根据生物的来源和活性物质环境风险评估对不同分类群毒性数据的需求[16],将数据分3种情况考虑:(1)全部物种;(2)全部物种分为淡水生物和海水生物;(3)全部物种分为3个营养级水平:藻类、无脊椎动物和鱼类。采用 SPSS 16.0软件对全部物种、淡水水生生物、海水水生生物、藻类、无脊椎动物和鱼类的毒性数据分别进行对数正态分布检验(Kolmogorov-Smirnov test,K-S检验)。采用Sigmplot 10.0软件构建各类生物的物种敏感度分布曲线(species sensitivity distribution, SSD)。目前拟合SSD曲线尚无特定的模型,本研究比较多种不同模型的拟合效果后,选择拟合度最高的Sigmoid和Logistic模型计算相应生物的5%累积概率对应的效应浓度,即5%危害浓度(hazardous concentration for 5%of the species,HC5),初步分析各类生物对铜的敏感性。
2.3.3 PNEC的推导
利用得到的HC5,采用评估因子法,选择适当的评估系数计算铜对水生生物的PNECW(PNECWater)。铜对全部物种和海水生物的 PNECW分别记为PNECAW和PNECSW,用于近海和远海暴露场景海水的风险表征分析。采用平衡分配法计算铜对沉积物生物的 PNECSed(PNECSediment)[34-35]。根据全部物种PNECAW和铜河口KD(56.234 m3·kg-1)算得的PNECSed视为近海环境铜对沉积物生物的预测无效应浓度,记为PNECSed1;根据海水生物 PNECSW和远海 KD(131.826 m3·kg-1)算得的PNECSed视为开阔海域铜对沉积物生物的预测无效应浓度,记为 PNECSed2。PNECSed1和PNECSed2分别用于近海和远海暴露场景沉积物的风险表征。
2.4 风险表征分析
本研究采用熵值法来评估我国防污漆来源的铜对于海洋环境造成的生态风险。计算DCH、DM和DMPF等3个近海暴露场景中PECSW与PNECAW、PECSed与PNECSed1的比值,作为铜对水生生物和沉积物生物的风险熵 HQ;计算 DOS公海场景中PECSW与PNECSW、PECSed与PNECSed2的比值,作为铜对海水生物和沉积物生物的HQ。铜对水生生物的HQ记为HQSW(HQSeaWater),对沉积物生物的HQ记为HQSed(HQSediment)。对不同暴露场景中铜的风险熵进行分析,确定防污漆中铜的环境风险级别。若HQ大于等于1,则铜为“高风险”类物质,表明它对海洋环境的生态风险较高;若HQ小于1,则铜为“相对低风险”类物质,表明防污漆中使用铜给海洋环境带来的生态风险可被接受。

表2 用于暴露评估的各项参数Table 2 Parameters used for exposure assessment
3 结果与讨论(Results and discussion)
3.1 暴露评估
MAMPEC模型是一款专用于预测活性物质环境浓度的最新模型,集二维水力学和化学归趋于一体,专用于预测环境中活性物质的浓度,得到了欧盟、美国和其他经合组织(OECD)国家主管机构的认可[34]。MAMPEC模型考虑了释放因子 (如释放速率、运输强度、停留时间和水下船体表面积)、非使用释放、化合物相关性质(如挥发性、形态、水解、光解和生物降解),以及与特定环境相关的特性(如水流、潮汐、盐度、DOC和悬浮物浓度)。模型提供了码头、港口、公海和航道等4种防污漆活性物质在海洋中释放和暴露的典型场景以及与之相对应的释放场景,建立这些场景的原始参数(包括水利、环境和释放参数)来自于欧盟和美国多个港口、码头和开阔海域的长期监测数据,具有一定的代表性和适用性[34,39]。采用MAMPEC模型中的4种默认暴露场景:DCH、DM、DOS和DMPF分别预测25种防污漆配方中的铜在海水和沉积物中的浓度,预测结果见图1。25种配方的铜在DMPF场景的预测环境浓度PEC最高,水中PECSW为1.7~6.4μg·L-1,沉积物中PECSed为39.3~232μg·g-1,在DCH和DM场景的PEC次之,在DOS公海场景的PEC最低,几乎等于环境背景浓度。DMPF场景PEC最高的主要原因是该场景设置的潮差为0 m,水流速度为0.2 m·s-1,因而潮汐和水流交换较弱,导致铜在环境中的累积浓度较高。DMPF场景的环境原型为波罗的海和地中海[39],正是由于波罗的海半封闭的特性,它已被国际海事组织确认为需要特殊保护的高敏感海域。DCH场景中设置的潮差和流速分别为1 m和1.5 m·s-1,明显高于DMPF,因而其水流交换较强,得到的PEC值较低。DOS场景中PEC最低,海水和沉积物中PEC的数量级分别为10-3~10-4ng·L-1和10-2~10-3ng·g-1,使得该场景中的PECSW和PECSed几乎等同于铜在环境中的背景浓度,原因可能与公海远离海岸有关,说明防污漆来源的铜在开阔海洋环境的总铜中所占的比例可以忽略不计。
3.2 危害性评估
铜对于各类生物的慢性毒性数据特征详见表3。全部水生生物的毒性数据包括了来自51个物种的120个毒性值,其中淡水生物种(25个)和海水生物种(26个)的数量基本相当。在3个营养级水平的毒性数据中,无脊椎动物物种的数量 (28个)最多,其次为鱼类(15个)和藻类(8个)。各种生物慢性毒性值的范围、平均值和标准差相差不大。对各类生物毒性数据的正态分布检验结果和SSD曲线的拟合参数详见表4。其中K-S检验的显著性水平范围为0.505~0.996,大于0.05,各组数据均符合对数正态分布。Sigmoid和Logistic模型的拟合度较高,决定系数(R2)均在0.990以上。全部水生生物的5%危害浓度HC5为5.5μg·L-1,淡水生物和海水生物的HC5分别为5.7和4.6μg·L-1,表明海水生物对铜稍微更敏感一些。3个营养级水平的分类群中,藻类的HC5(3.3μg·L-1)最低,其次是鱼类 (5.1μg·L-1),无脊椎动物的HC5(6.1μg·L-1)最大,表明藻类对于铜最为敏感,而相对来说无脊椎动物对于铜的耐受性较强。
1.2 纳入与排除标准 纳入标准:(1)所有患者诊断明确,主要是通过术前电子肠镜及活组织病理检查诊断;(2)术前CT检查未发现远处脏器转移;(3)肿瘤下缘位于距肛缘≤5 cm且>3 cm;(4)术前获得患者及家属知情同意。排除标准:(1)合并有严重器官功能障碍,无法耐受手术;(2)有远处癌转移(腹主动脉、肺部、肝、腹腔等);(3)有腹部手术病史。

图1 25种国产防污漆中的铜在不同暴露场景海水和沉积物中的预测环境浓度Fig.1 Predicted environmental concentrations of copper in 25 Chinese antifouling paints in sea water and sediment of different exposure scenarios
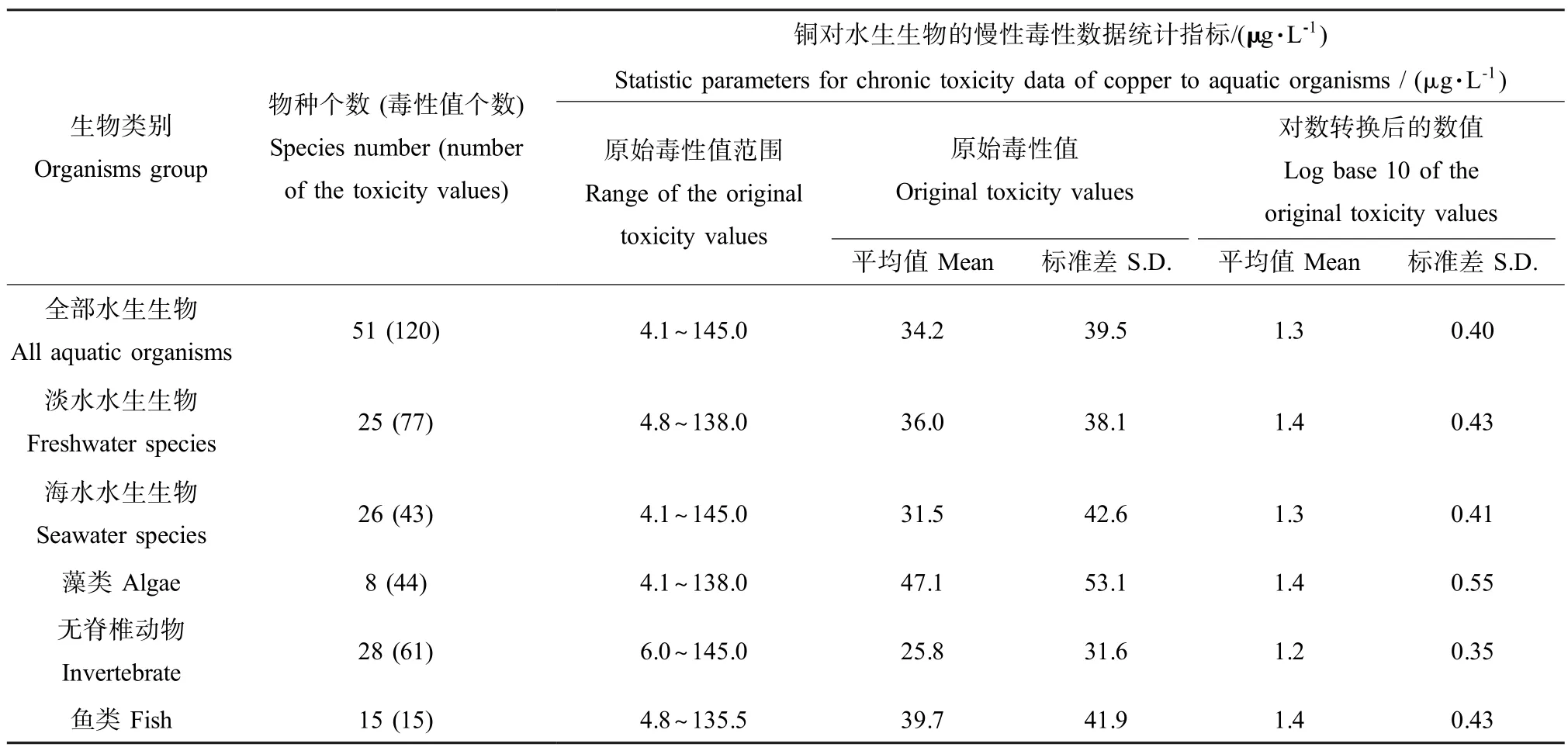
表3 铜对各类水生生物的慢性毒性数据特征Table 3 Statistic parameters for chronic toxicity data of copper to different taxonomic groups of aquatic organisms

表4 各类水生生物慢性毒性数据的统计检验结果及物种敏感度分布曲线的拟合参数Table 4 Test results and fitting parameters of species sensitivity distribution for different taxonomic groups of aquatic organisms
王振等[40]通过分析铜对不同水生物种的急性毒性数据,得出了淡水各类群均比相应各类群在海水系统中对铜更敏感以及藻类对铜最敏感的研究结论,而本文的结果则是海水生物对铜稍敏感一些,对于藻类的敏感性结论则一致。结果差异的原因可能是由于王振等分析的是铜对于水生生物的急性毒性数据,而本研究采用了铜对水生生物的慢性毒性数据。Hutchinson等[41]的研究表明与急性毒性数据相比,慢性毒性试验中淡水和海水生物之间的敏感性差异较小。各类生物的SSD曲线能更为直观地比较不同类别的水生生物对于铜的敏感性,由图2可知,虽然海水生物的HC5略低,但总体而言淡水和海水生物对铜的敏感性差异不大。低浓度时藻类更易受到铜的影响,当浓度大于8.69μg·L-1时,无脊椎动物则比藻类和鱼类更为敏感。
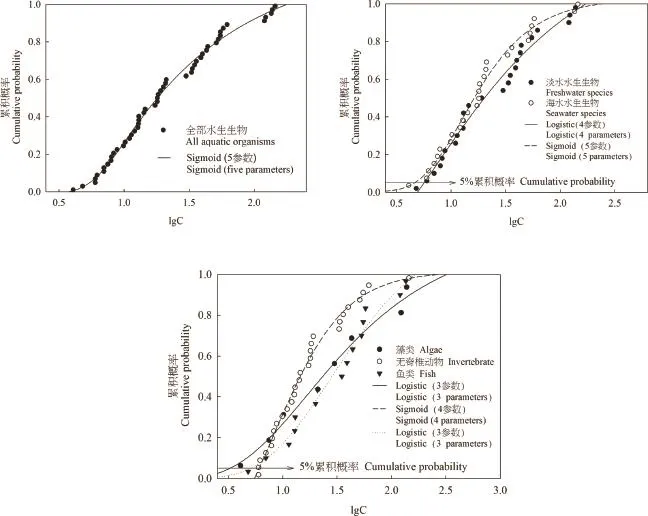
图2 各类水生生物慢性毒性数据的物种敏感度分布曲线注:C,浓度(μg·L-1)Fig.2 Species sensitivity distribution curves for different taxonomic groups of aquatic organismsNote:C,concentration(μg·L-1)
虽然得到铜的毒性数据比较丰富,覆盖了2个代表性海洋分类群(棘皮动物和软体动物),但由于缺乏高质量的多物种海水生态系统和野外试验数据,根据评估系数的选取原则同时参考相关研究中的方法[16,32,35],采用了评估系数“2”用于推导铜的PNEC。得到铜的对于全部水生生物的PNECAW和对于海水生物的PNECSW,分别为2.8和2.3μg·L-1。根据PNECAW和PNECSW,采用平衡分配法计算铜对沉积物生物的PNEC,得到铜在近岸海洋环境和开阔海洋的PNECSed1和PNECSed2分别为156μg·g-1和300μg·g-1。
本研究利用构建SSD曲线和评估因子法得到的铜的PNECAW(2.8μg·L-1)和PNECSW(2.3μg·L-1)与欧盟得到的铜对于海水生物的PNEC(2.6μg·g-1)[32]相似,分析原因是本研究中筛选得到的毒性值与欧盟推导PNEC时采用的毒性值部分重叠,且基于同样的理由都采用了“2”为评估系数。PNECAW和PNECSW比吴丰昌等[42]的研究中利用SSD法得到的铜对于淡水生物的长期浓度限值(9.44μg·L-1)明显偏低,原因可能与采用毒性数据的生物种类和推导方法不同有关。如本研究同时采用了铜的淡水和海水生物毒性数据,且由于评估目的主要是为满足发达国家技术法规对活性物质环境风险的要求,因而未针对性纳入我国本地物种的毒性数据,同时计算PNEC时采用了评估因子法;而吴丰昌等的研究主要是针对淡水水生生物,包括了我国本地物种的毒性数据,得到铜的长期浓度限值是采用短期浓度限值除以急慢性比率。由于铜对淡水生物的毒性数据(77个)比对海水生物(43个)的更为丰富,且淡水环境中铜的背景浓度要高于海水环境,如果仅推导铜对淡水生物的 PNEC时可考虑采用评估系数“1”,这样得到的PNEC(5.7μg·L-1)也与吴丰昌等[42]的研究中采用毒性百分数排序法推导出的铜长期浓度限值(5.63μg·L-1)十分接近。但本研究认为开展活性物质的环境风险评估时必须纳入对海水生物的毒性数据,重点评价对海洋生态系统造成的不良影响,这是由于防污漆中的主要释放场所是海洋。今后如能获得高质量的铜海水生态系统和野外毒性研究数据,可考虑将评估因子从“2”降至“1”,使得评估结果更加真实。
3.3 风险表征
铜在不同暴露场景中的风险熵详见表5。其中DMPF场景中铜的风险熵值最高,HQSW和HQSed平均值分别为1.24和0.72,有18种配方中铜的HQSW大于1,2种配方中(包括于上述18种配方内)铜的HQSed大于1,表明当这18种防污漆投入使用时,其释放的铜属于环境“高风险”类活性物质,对于水流交换较弱海域码头的海洋生态环境造成的风险较大。这一结果与暴露评估时DMPF场景得到的PEC值较高直接相关。DCH、DM和DOS等3个场景中铜的风险熵均小于1,表明在默认的港口、码头和公海等暴露场景中,防污漆来源的铜对于海洋生态环境带来的风险较低,可忽略不计。
此外,将HQ分为<0.5、0.5~1.0、1.0~2.0、>2.0共4个等级分别统计每个等级的防污漆配方个数(见表3),同时比较不同场景中的HQ平均值和HQ的分级统计结果,按照风险由高及低的顺序对4个暴露场景进行排序的结果为一致:DMPF>DM>DCH>DOS,表明防污漆中使用铜对水流交换较弱海域的码头造成的环境风险最大,对于港口和码头造成的风险居中,对于公海造成的环境风险最小。
同一暴露场景中铜对于海水生物的风险熵HQSW显著高于对沉积物生物的风险熵HQSed,表明防污漆中的铜对于海水生物造成的风险更大。DOS场景中25种配方防污漆的HQ值完全相同,这与暴露评估时该场景中铜的PEC值几乎等同于海洋环境中铜的背景浓度有关。
3.4 不确定性分析
环境风险评估的不确定性主要来源于以下暴露评估和危害性评估过程。
(1)暴露评估时采用了MAMPEC模型中的多个默认暴露场景,通过模型运算获得了铜在环境中的预测浓度。构建这些暴露场景的布局、水力学以及释放参数来自欧洲和美国多个港口、码头和海域的平均数据以及长期监测的平均值,具有较好的广泛性和代表性。但场景默认参数与真实环境参数毕竟存在差异,如将本研究中得到的结果应用于某个特定的真实环境时,可能导致评估结果出现偏差。例如,港口的货物吞吐量直接反映了进出港的船舶数量,是计算防污漆中活性物质释放量的重要参数。若某港口的吞吐量远超平均水平,在危害性评估结果和其他场景参数保持不变的前提下,防污漆中的铜对于该港口海洋环境造成的风险应比本研究中确定的风险更高。若能对活性物质的环境浓度开展系统监测则可提高环境风险评估的质量。此外,由于目前的暴露场景参数均以国外环境为原型,若要评估防污漆活性物质给我国海洋环境造成的风险,还应大力开发和应用以我国代表性港口、码头和海域为原型的防污漆典型暴露场景。
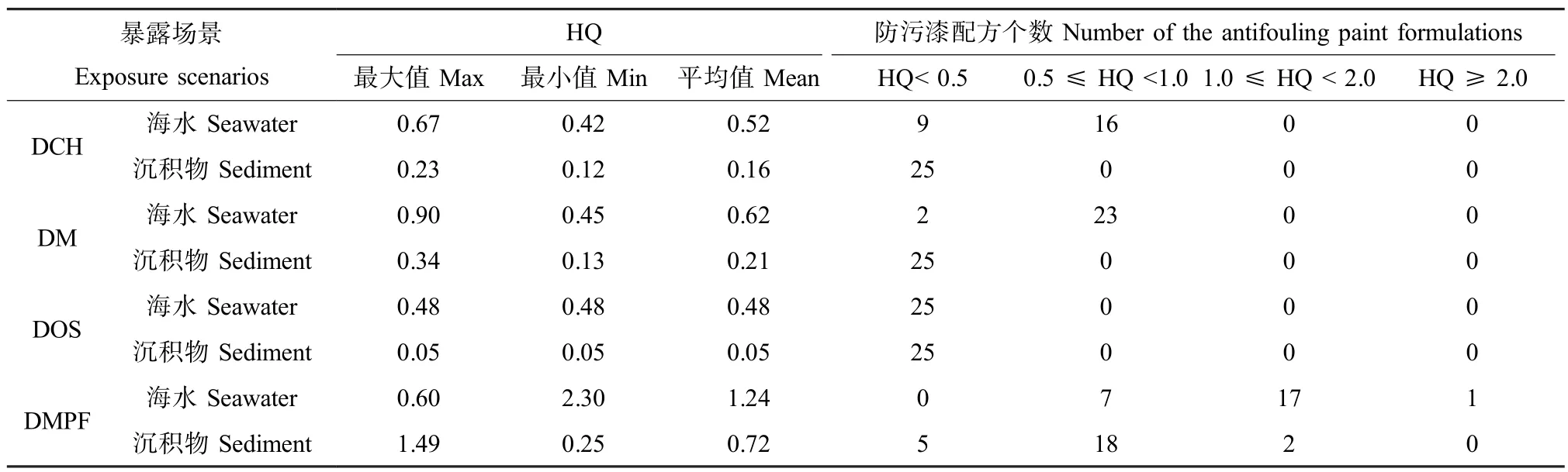
表5 不同暴露场景中铜的风险熵Table 5 Hazard quotients of copper in different exposure scenarios
(2)有研究针对防污漆中铜的释放速率进行过统计和比较,发现采用质量平衡法计算得到的释放速率普遍高于其在海洋环境中的实际释放量[43],使得暴露评估得到了过高的PEC值,进而导致风险熵偏高、风险评估结果过于保守。现场直接测定法原则上最能有效地反映环境中活性物质的真实释放速率,但由于其试验步骤繁琐、成本昂贵等原因而难以推广作为释放速率的标准试验方法用于风险评估[20,44]。此时较为可行的方法是采用经过大量统计得到的修正因子对质量平衡法算得的释放速率进行修正,使其更接近于环境中的真实速率,以降低暴露评估的不确定性[45]。
(3)危害性评估时,通过严格筛选获得了铜对于多个物种的慢性毒性数据,采用铜的NOEC构建SSD曲线推导铜的PNEC,保证了风险评估的准确性。但由于缺乏铜的海水生态系统和野外毒性研究数据,为了降低仅依靠实验室获得的有限物种的毒性数据外推到整个生态系统时产生的不确定性,采用了评估因子“2”,可能导致得到的PNEC偏低。如能获得高质量的铜的复杂生态系统试验数据,可减小危害性评估过程中的不确定性。
3.5 风险评估的优化
对于风险评估过程中存在的不确定性,可采取针对性措施,提高评估结果的准确性。本研究中比较可行的方法是参考已经获得的经验值对铜的释放速率进行校正,通过优化暴露评估进一步优化风险评估的结果。Finnie[45]收集整理了近十几年来公开发表和美国海军内部研究获得的多种典型含铜防污漆在不同环境中铜的释放速率,对不同方法得到的铜释放速率进行了统计比较和详细分析,提出对于全部类型的含铜防污漆,将质量平衡法算得的铜释放速率除以修正因子“2.9”后与现场测定法获得的释放率十分接近,修正后的释放速率既反映了真实环境中铜进入海洋环境的速率,又避免了现场测定法的繁琐步骤和高昂成本,

图3 可能具有“高风险”的18种配方防污漆的铜在释放速率校正前后的风险熵Fig.3 Hazard quotients of copper in 18 antifouling paints possible with“high risk”before and after adjustment of the release rates
适用于活性物质的环境风险评估。考虑到修正因子“2.9”为根据多年数据统计得到的一个经验值,具有较好的可靠性和参考意义,因此本研究对于在DMPF场景中HQ大于1的18种防污漆配方,应用修正因子“2.9”对于释放速率进行校正,校正后的数值为1.3~12.5μg·cm-2·d-1。利用校正后的释放速率重新计算铜在DMPF场景中的PEC和HQ。校正后得到的PECSW为1.3~2.9μg·L-1,PECSed为23.7~90.7μg·g-1,比校正前的PEC明显降低。释放速率校正前后的HQ对比见图3,结果表明校正后仅有1种防污漆配方(21#配方)的HQSW大于1,为1.05,其余17种配方中铜的HQSW均小于1;校正后配方21#、22#中铜的HQSed也降低至1以下。因此,通过对释放速率的校正,使得17种配方中的铜由原来的“高风险”降至“相对低风险”,优化了风险评估结果。本研究中得到防污漆中铜的海洋环境风险级别与Hall等[27]针对欧洲主要海域所有来源铜的生态风险评估结果一致:对于非特殊性的海洋环境,铜属于低风险类物质。只是本研究在考虑铜环境背景浓度的基础上仅针对防污漆来源的铜进行了评估,而Hall等基于相关海域中铜的实际监测浓度整体评估了铜的海洋环境风险。21#防污漆配方在4个暴露场景中的HQ最高,这是由于所有配方中它的释放速率最大(校正前后分别为36.2、12.5μg·cm-2·d-1),表明防污漆中活性物质的释放速率直接影响到其环境风险,两者之间存在正相关性。
假设HQSW=1,PNECAW(2.8μg·L-1)保持不变,可反推算得PECSW=2.8μg·L-1,通过MAMPEC软件可以确定此时铜的释放速率为33.5μg·cm-2·d-1。该数值可为防污漆生产企业提供一个较好的参考,即在设计含铜防污漆配方时应充分考虑漆的各项参数对于铜释放速率的影响,使根据设计好的配方参数计算得到的释放速率不大于33.5μg·cm-2·d-1,以避免由于无法通过发达国家管理机构的环境风险评估而造成产品出口受阻,同时避免对弱水流交换等特殊性海域的生态环境带来过高的风险。将33.5μg·cm-2·d-1乘以14即可得到船舶入水14 d内所允许防污漆释放铜的总量:452μg·cm-2。在瑞典西海岸,游艇(船长度<12 m)和船舶(船长度>12 m)防污漆14 d内的铜释放限量分别为200与770μg·cm-2[13],本文得到的铜释放量限值介于上述两者之间,这可能与上述限值分别针对不同类型的船舶而本文并未对船舶类型进行区分有关。
4 结论
a.25种国产含铜防污漆配方中,仅1种配方中铜的风险熵略大于1,其余配方的风险熵均小于1,可以判定铜为“相对低风险”类活性物质,使用上述防污漆时铜对生态环境造成的风险较小。
b.在防污漆的多种典型暴露环境中,防污漆来源的铜对于水流交换较弱海域的码头环境造成的风险最大,其次为默认港口和码头环境,对于公海造成的风险最小。同一暴露场景中,铜对于海水生物产生的风险要高于对沉积物生物的风险。
c.低浓度时海水生物比淡水生物、藻类比无脊椎动物和鱼类对铜更为敏感。
d.防污漆中铜环境风险评估的不确定性主要来源于暴露场景的限制性、释放速率的过大估算以及复杂生态系统毒性数据的缺乏等方面,可通过开展活性物质环境浓度的监测、引入释放速率的修正因子、开展铜的复杂生态系统和野外毒性研究来提高评估结果的可靠性和应用性。
e.在现有评估条件下,设计含铜防污漆配方时应使铜的释放速率不大于33.5μg·cm-2·d-1,以免对较封闭海域的生态环境带来过高的风险。
致谢:感谢蒋峰和Kevin Long在释放速率计算方面提供的帮助,感谢环境保护部环境保护对外合作中心和中国涂料协会在防污漆参数收集阶段提供的帮助与支持。
[1]Champ M A.A review of organotin regulatory strategies, pending actions,related costs and benefits[J].Science of the Total Environment,2000,258:21–71
[2]Voulvoulis N,Scrimshaw M D,Lester J N.Comparative environmental assessment of biocides used in antifouling paints[J].Chemosphere,2002,47:789–795
[3]Almeida E,Diamantino T C,De Sousa O.Marine paints: The particular case of antifouling paints[J].Progress in Organic Coatings,2007,59:2–20
[4]刘超,付玉彬,郑纪勇.环境友好型防污剂及海洋防污涂料的研究进展[J].材料开发与应用,2009,24(4):69–74 Liu C,Fu Y B,Zhen J Y.Review on environmental friendly biocides and marine antifouling coatings[J].Development and Application of Materials,2009,24(4):69–74(in Chinese)
[5]张春燕,于良民,姜晓辉,等.防污剂Sea–Nine211的环境归宿及其生态毒性研究进展[J].环境科学与技术, 2010,33(2):107–111 Zhang C Y,Yu L M,Jiang X H,et al.Progress in study of antifoulant sea-nine211:Fate in aquatic environment and its toxicity[J].Environment Science&Technology, 2010,33(2):106-110(in Chinese)
[6]黄运涛,彭乔.海洋生物污损的防治方法及研究进展[J].全面腐蚀控制,2004,18(1):3–5 Huang Y T,Peng Q.The prevention method and research development of marine fouling[J].Total Corrosion Control,2004,18(1):3–5(in Chinese)
[7]Takahashi K.Release rate of biocides from antifouling paints[J].Ecotoxicology of Antifouling Biocides,2009,1: 3–22
[8]Voulvoulis N,Scrimshaw M D,Lester J N.Occurrence of four biocides utilized in antifouling paints,as alternatives to organotin compounds,in waters and sediments of commercial estuary in the UK[J].Marine Pollution Bulletin, 2000,11:938–946
[9]Haglund K,Pettersson A,Pedersén M,et al.Seasonal distribution of the anti–fouling compound irgarol®1051 outside a marina in the Stockholm archipelago[J].Bulletin of Environmental Contamination and Toxicology, 2001,66:55–58
[10]Konstantinou I K,Albanis T A.Worldwide occurrence and effects of anti–fouling paint booster biocides in the aquatic environment:A review[J].Environment International,2004,30:235–248
[11]Eklund B,Elfström M,Borg H.Tributyltin originates from pleasure boats in Sweden in spite of firm restrictions [J].Open Environmental Sciences,2008,2:124–132
[12]Turner A.Marine pollution from antifouling paint particles[J].Marine Pollution Bulletin,2010,60:159–171
[13]Ytreberg E,Karlsson J,Eklund B.Comparison of toxicity and release rates of Cu and Zn from anti–fouling paintsleached in natural and artificial brackish seawater[J].The Science of the Total Environment,2010,408:2459–2466
[14]姜晓辉,于良民,董磊,等.新型防污剂异噻唑啉酮的衍生物的合成、生物毒性与防污性能研究[J].精细化工,2007,24(2):125–128 Jiang X H,Yu L M,Dong L,et al.Synthesis and the toxicity and antifouling capability of new isothiazolinone derivatives[J].Fine Chemicals,2007,24(2):125–128(in Chinese)
[15]姚宝书,冉庆云,陈万伦.辣椒碱自抛光防污涂料及其制备方法:中国专利,CN1477166[P].2004
[16]梅承芳,陈进林,田亚静,等.防污漆中活性物质海洋环境风险评估关键技术探讨[J].生态毒理学报,2015, 10(1):53–67 Mei C F,Chen J L,Tian Y J.Review on recent approaches for marine environmental risk assessment of active substances in antifouling paints[J].Asian Journal of Ecotoxicology,2015,10(1):53–67(in Chinese)
[17]王科,肖玲,于雪艳,等.防污剂对海洋环境的影响探讨[J].中国涂料,2010,25(8):24–30 Wang K,Xiao L,Yu X Y,et al.Discussion on the influence of biocides on marine environment[J].China Coatings,2010,25(8):24-30(in Chinese)
[18]Jones B,Bolam T.Copper speciation survey from UK marinas,harbours and estuaries[J].Marine Pollution Bulletin,2007,54(8):1127–1138
[19]Matthiessen P,Reed J,Johnson M.Sources and potential effects of copper and zinc concentrations in the estuarine waters of Essex and Suffolk,United Kingdom[J].Marine Pollution Bulletin,1999,38:908–920
[20]Schiff K,Diehl D,Valkirs A.Copper emission from antifouling paint on recreational vessel[J].Marine Pollution Bulletin,2004,48:371–377
[21]Warnken J,Dunn R J K,Teasdale P R.Investigation of recreational boats as a source of copper at anchorage sites using time– integrated diffusive gradients in thin film and sediment measurements[J].Marine Pollution Bulletin, 2004,49:833–843
[22]Biggs T W,D’Anna H.Rapid increase in copper concentrations in a new marina,San Diego Bay[J].Marine Pollution Bulletin,2012,64:627–635
[23]Matthiessen P,Reed J,Johnson M.Sources and potential effects of copper and zinc concentrations in the estuarine waters of Essex and Suffolk,United Kingdom[J].Marine Pollution Bulletin,1999,38:908–920
[24]Schiff K,Brown J,Diehl D,et al.Extent and magnitude of copper contamination in marinas of the San Diego region,California,USA[J].Marine Pollution Bulletin, 2007,54:322–328
[25]US EPA.Summary review of the health effects associated with copper[R].Cincinnati:Health issue assessment, 1987
[26]Andersson S,Kautsky L.Copper effects on reproductive stages of Baltic Sea Fucus vesiculosus[J].Marine Biology,1996,125:171–176
[27]Hall L W,Anderson R D.A deterministic ecological risk assessment for copper in European saltwater environments [J].Marine Pollution Bulletin,1999,38:207–218
[28]Nadella S R,Fitzpatrick J L,Franklin N,et al.Toxicity of dissolved Cu,Zn,Ni and Cd to developing embryos of the blue mussel(Mytilus trossolus)and the protective effect of dissolved organic carbon[J].Comparative Biochemistry and Physiology C,2009,149:340–348
[29]Katranitsas A,Castritsi–Catharios J,Persoone G.The effects of a copper–based antifouling paint on mortality and enzymatic activity of a non–target marine organism [J].Marine Pollution Bulletin,2003,46:1491–1494
[30]Singh N,Turner A.Leaching of copper and zinc from spent antifouling paint particles[J].Environmental Pollution,2009,157:371–376
[31]Bao V W W,Leung K M Y,Kwok K W H,et al.Synergistic toxic effects of zinc pyrithione and copper to three marine species:Implications on setting appropriate water quality criteria[J].Marine Pollution Bulletin,2008,57: 616–623
[32]European Copper Institute.Voluntary risk assessment reports– copper and copper compounds[EB/OL].Belgium:ECI,2008.http://www.echa.europa.eu/web/guest/ copper– voluntary– risk– assessment– reports? search_criteria=7440–50–8,2013
[33]王增焕,林钦,李刘冬,等.大型海藻对重金属镉、铜的富集动力学研究[J].中国环境科学,2013,33(1):154–160 Wang Z H,Lin Q,Li L D,et al.Kinetic study on the bioconcentration of cadmium and copper by large-sized seaweedGracilaria lemaneiformis[J].China Environmental Science,2013,33(1):154–160(in Chinese)
[34]ISO.ISO 13073–1,Ship and marine technology–Risk assessment on anti–fouling systems on ships–Part 1:Marine environmental risk assessment method of biocidally active substances used for anti–fouling systems on ships[S].2012
[35]European Commission.Technical Guidance Document on Risk Assessment,Part II[R].Italy:Euroean Chemicals Bureau(ECB)JRC–Ispra(VA),2003
[36]ISO.ISO 10890 Paints and varnishes–Modelling of biocide release rate from antifouling paints by mass–balance calculation[S].2010
[37]Turner A.Trace–metal partitioning in estuaries:Importance of salinity and particle concentration[J].Marine Chemistry,1996,54:27–39
[38]Klimisch H J,Andreae M,Tillmann U.A systematic approach for evaluating the quality of experimental toxicological and ecotoxicological data[J].Regulatory Toxicology and Pharmacology,1997,25:1–5
[39]Van Hattum B,Baart A D,Boon J G.Computer model to generate predicted environmental concentrations(PECs) for antifouling products in the marine environment[M/ OL].Amsterdam:IVM,2002.http://www.deltares.nl/en/ software/1039844/mampec/1232327,2013
[40]王振,金小伟,王子健.铜对水生生物的毒性:类群特异性敏感度分析[J].生态毒理学报,2014,9(4):640–646 Wang Z,Jin X W,Wang Z J.Taxon-specific sensitivity differences of copper to aquatic organisms[J].Asian Journal of Ecotoxicology,2014,9(4):640–646(in Chinese)
[41]Hutchinson T H,Scholz N,Guhl W.Analysis of the ecetoc aquatic toxicity(EAT)database IV-Comparative toxicity of chemical substances to freshwater versus saltwater organisms[J].Chemosphere,1998,36(1):143–153
[42]吴丰昌,冯承莲,曹宇静,等.我国铜的淡水水生水质基准研究[J].生态毒理学报,2011,6:617–628 Wu F C,Feng C L,Cao Y J,et al.Aquatic life ambient freshwater quality criteria for copper in China[J].Asian Journal of Ecotoxicology,2011,6:617–628(in Chinese)
[43]Thomas K,Raymond K,Chadwick J,et al.The effects of short–term changes in environmental parameters on the release of biocides from antifouling coatings:Cuprous oxide and tributyltin[J].Applied Organometallic Chemistry, 1999,13:453–460
[44]Valkirs A O,Seligman P F,Haslbeck E,et al.Measurement of copper release rates from antifouling paint under laboratory and in situ conditions:Implications for loading estimation to marine water bodies[J].Marine Pollution Bulletin,2003,46:763–779
[45]Finnie A A.Improved estimates of environmental copper release rates from antifouling products[J].Biofouling, 2006,22(5–6):279–291
Marine Environmental Risk Assessment of Copper in Chinese Antifouling Paints
Mei Chengfang1,2,3,Liang Huijun4,Zhou Xiaocui4,Tian Yajing5,Deng Guirong1,2,Xu Meiying1,2, Luan Tiangang3,Zeng Guoqu1,2,*
1.Guangdong Provincial Key Laboratory of Microbial Culture Collection and Application,Guangdong Institute of Microbiology,Guangzhou 510070,China
2.State Key Laboratory of Applied Microbiology Southern China,Guangdong Institute of Microbiology,Guangzhou 510070,China
3.MOE Key Laboratory Aquatic Product Safety,School of Life Sciences,Sun Yat-Sen University,Guangzhou 510275,China
4.Foshan Center for Environmental Health&Safety Assessment,Foshan 528000,China
5.Foreign Economic Cooperation Office,Ministry of Environmental Protection,Beijing 100035,China
21 April 2015 accepted 20 July 2015
In order to efficiently control the adverse effects of the biocidally active substances in antifouling paints on marine environment and provide a basis for screening the environment friendly active substances,it is urgent to assess the environmental risk of active substances.In this study,the marine environmental risk of copper,the most widely used biocidally active substance,in 25 formulations of Chinese antifouling paints was assessed using the methods developed specifically for the active substances,which include exposure assessment,hazard assessment and risk characterization.In exposure assessment,typical exposure scenarios such as harbor,marina and open sea in Marine Antifoulant Model to Predict Environmental Concentrations(MAMPEC)were used.Hazard assessment was based on all the available chronic toxicity data of copper to aquatic organisms,and the species sensitivity distribution(SSD)method was used associated with the assessment factor method.The risk level was determined by the quotient method.The results indicated that the predicted no effect concentrations(PNEC)of copper were 2.8 and 2.3μg·L-1for all aquatic organisms and seawater species,respectively,and algae is the most sensitive taxa to copper.Except for one formulation,the hazard quotients of copper in other 24 paint formulations were lower than 1, indicating that copper can be determined as“relative low risk”.The use of copper in such paints as antifouling active ingredient results in a negligible risk to the marine environment.In different scenarios,copper showed different environmental risks with the descending order as:marina with poor flushed,default marina,default harbor and open sea.According to the assessment results,the release rate of copper should not be greater than 33.5μg·cm-2·d-1in order to avoid posing a significant risk to the marine environment with enclosed character.
copper;marine environmental risk assessment;active substance in antifouling paints;species sensitivity distribution method(SSD);typical exposure scenario;predicted environmental concentration(PEC);predicted no effect concentration(PNEC)
2015-04-21 录用日期:2015-07-20
1673-5897(2016)1-182-12
X171.5
A
10.7524/AJE.1673-5897.20150421003
梅承芳,梁慧君,周小翠,等.国产防污漆中铜的海洋环境风险评估[J].生态毒理学报,2016,11(1):182-193
Mei C F,Liang H J,Zhou X C,et al.Marine environmental risk assessment of copper in Chinese antifouling paints[J].Asian Journal of Ecotoxicology, 2016,11(1):182-193(in Chinese)
全球环境基金(GEF)中国用于防污漆生产的滴滴涕替代项目之环境保护领域化学品管理防污漆活性物质环境风险评估机构能力建设子项目;广东省海洋经济创新发展区域示范专项(No GD2012-D01-002);广东省科技计划项目(2013B090800004)
梅承芳(1979-),女,高级工程师,研究方向为生态毒理学及环境风险评估,E-mail:meichf@gdim.cn
),E-mail:zenggq@gddcm.com
简介:曾国驱(1966—),男,博士,研究员,主要研究方向为生态毒理学,发表学术论文30余篇。
