三氯乙基磷酸酯阻燃剂对日本鹌鹑胚胎的发育毒性
2016-12-06张俊江张效伟于红霞
张俊江,张效伟,于红霞
南京大学环境学院污染控制与资源化研究国家重点实验室,南京210023
三氯乙基磷酸酯阻燃剂对日本鹌鹑胚胎的发育毒性
张俊江,张效伟*,于红霞
南京大学环境学院污染控制与资源化研究国家重点实验室,南京210023
三氯乙基磷酸酯(tris(2-chloroethyl)phosphate,TCEP)是有机磷阻燃剂的一种。文献报道TCEP在多种环境介质中均有检出,且检出浓度较高,同时被报道能够产生神经毒性与致癌性,然而其对生态生物在敏感生命阶段的发育毒性还不清楚。为研究TCEP对鸟类的发育毒性,本次试验采用胚胎注射的方法,用TCEP对日本鹌鹑胚胎进行21 d暴露,研究TCEP对鹌鹑胚胎的致死效应和对体重以及脏器系数的影响。实验结果显示TCEP对鹌鹑胚胎的LD50为118μg·g-1egg,95%置信区间为73.3~163μg·g-1egg,最低效应浓度(LOEL)是83.1μg·g-1egg,最高无效应浓度(NOEL)是8.31μg·g-1egg。脏器系数的方差分析结果显示TCEP对幼鸟的肝脏、脑、心脏的发育产生显著的影响,166μg·g-1egg浓度下,鹌鹑胚胎的肝脏(P=0.0005),脑(P= 0.0024)和心脏(P=0.0005)的脏器系数受到了明显的影响。本次试验的结果为开展TCEP对鸟类的生态风险评估提供了数据支撑。
三氯乙基磷酸酯;日本鹌鹑;器官发育
鸟类胚胎注射实验是一种在国外使用广泛,方法成熟的毒性实验方法,最早在Allred等[1]发表的论文中使用。研究鸟类胚胎发育毒性的传统方法是通过母代暴露,然后通过富集传递给子代。这种方法不仅实验周期长,而且进入鸟蛋中的浓度也具有不确定性,需要通过化学分析后进行毒性实验。而鸟类胚胎注射实验能够明显缩短实验周期,保证实验的平行性,并且,针对一些不便养殖的野生鸟类,我们也可以通过收集野生鸟蛋注射的方法进行毒性试验,这对化学品的生态风险评估具有很大的推动作用。有文献报道,与成鸟暴露实验相比,鸟类胚胎注射实验的敏感性强[2]。鸟类胚胎注射实验研究的是从受精卵开始,发育到幼体的过程,而这个过程在哺乳类动物中很难进行研究,实验成本很高,同时,鸟类又是与哺乳类动物在进化上最接近的物种,鸟类的胚胎注射结果能够近似体现哺乳类动物的结果。美国环保局在2001年的报告中详细描述了鸟类胚胎注射实验在二恶英类似物的的生态风险评估中的应用[3]。而2006年发布“Study Plan For Avian Egg Injection Study”(http://www.dec.ny.gov/docs/ wildlife_pdf/wpavwldin.pdf)文中对野生鸟蛋的采集与孵化条件以及暴露方式有详尽的描述。但目前在国内,很少有研究使用鸟类胚胎注射的方法进行化学品的生态风险评估。
三氯乙基磷酸酯(TCEP)作为有机磷阻燃剂的一种被广泛的使用在家具、塑料、油漆等领域[4]。在国内,许多环境介质,例如饮用水[5]和底泥[6]之中都有TCEP的检出,最高浓度分别达到了48.8 ng·L-1和3.17μg·kg-1。环境中TCEP能够通过食物链的富集进入鸟类体内,进而对鸟类产生影响。针对鸟类体内TCEP的浓度,最近的研究表明,在广州省养殖场内的鸡鸭体内的TCEP浓度达到了33.7~162 ng·g-1脂重[7]。休伦湖地区的银鸥(herring gull)蛋内TCEP的浓度达到了0.02~0.55 ng·g-1湿重[8]。另一项研究表明,五大湖区银鸥蛋白中TCEP浓度达到了(1.46±0.77)ng·g-1湿重,蛋黄中浓度达到了(1.38 ±0.31)ng·g-1湿重[9]。这些数据引起我们对TCEP对鸟类毒性的兴趣。
毒理学研究证明,TCEP具有致癌性[10],同时对大鼠[11]和小鼠[12]产生神经毒性。在H295R细胞中, TCEP能够引起17β雌二醇和睾酮浓度的上升,暗示了TCEP的内分泌干扰效应[13]。大鼠在TCEP的暴露下,显示出生殖方面的负效应,例如生殖力的下降,生殖周期的增长,以及精子的密度和活力的下降[14]。以上的毒理学信息提示我们,TCEP可能对幼体的发育过程产生毒性效应。但是目前并没有关于鸟类的毒性数据报道出来。发育毒性作为生态风险评估中的重要一部分,对于群落演替以及生态系统的稳定有重要的影响。而日本鹌鹑(Coturnix coturnix japonica)作为本土的模式生物的一种,具有很高的经济价值。考虑到鸟类在生态系统中的重要作用,本次实验选择鹌鹑胚胎作为受试生物,研究TCEP对鹌鹑胚胎的发育毒性以及器官脏器系数的影响。
1 材料与方法(Materials and methods)
1.1 实验材料
日本鹌鹑种蛋从南京本地的养殖场中一次性购买,二甲亚砜(HPLC级,dimethyl sulfoxide,DMSO, Sigma Aldrich),TCEP(97%,Sigma Aldrich),无水乙醇(分析纯,南京化学试剂有限公司)。
1.2 实验方法
1.2.1 鹌鹑蛋准备
将购买来的鹌鹑蛋进行筛选,将蛋壳有裂缝或破损以及大小异常的蛋剔除掉。称重记录,并用记号笔编号,然后放在13~15℃的培养箱中储藏(时间不超过1周),湿度65%左右。在注射开始前的一天,将鹌鹑蛋取出置于室温下复苏。在储藏和复苏时保证钝端向上。
1.2.2 浓度设置与胚胎注射
胚胎注射的方法参考前人的研究并做了少许改动[15]。前人的研究表明,0.1~0.2μL·g-1蛋的注射剂量不会引起明显的胚胎死亡[16]。根据上一步得出鹌鹑蛋的平均重量(12.03±0.95)g,确定每个蛋注射2μL。由于蛋的重量差异并不显著,所以采用统一的剂量注射,而不是根据不同蛋的重量进行不同剂量的注射。由于TCEP的密度为1.39 g·mL-1,所以注射剂量的最大值为2.78mg,另外设置浓度组0.831、8.31、83.1、166μg·g-1egg 4个浓度组,以DMSO为助溶剂,溶剂对照组和空白对照组。
鹌鹑蛋的注射在生物安全柜(ESCD CLASSⅡ)内完成。每个蛋在移入超生物安全柜前先用70%酒精擦拭消毒。根据前人的研究,气室由于能够使化学物质更加容易且快速的进入胚胎中所以在本次试验中被选为注射位点[17]。用锉刀将蛋钝端蛋壳锉薄,用移液枪(Rainin pipetman pipet-lite 20xls with RFID LTS)和针形枪头在锉薄的蛋壳的位置打孔,并将2μL对应溶液打到鹌鹑蛋气室靠近内膜的位置。枪头每次注射完进行更换。每个浓度组设置30个蛋。注射后的鸟蛋用融化的石蜡封口。每个胚胎的注射过程要在30 min之内完成。
1.2.3 鸟蛋孵化与解剖
将鹌鹑蛋放在孵化机(万盛微电脑全自动数显孵化机,南京万盛孵化设备有限公司)内孵化,孵化条件遵循前人的研究[18]。孵化时钝端朝上,温度控制在37.8℃左右,湿度控制在65%左右。每一个半小时翻蛋一次,每次翻转90°。鹌鹑的孵化期大约是17~18 d。在第15天的时候将鹌鹑转移到对应剂量组的笼子里。孵化21 d后如果仍不出壳,就将蛋壳打开进行观察和记录。将出壳以后的鹌鹑称重并记录,对明显的病理学特征进行记录。然后断头处死,解剖。取出鹌鹑的肝脏、脑、心脏、肺,分别称量。对于21 d没有出壳的鸟蛋进行破壳,观察胚胎是否存活,并对实验组中未受精的蛋进行排除。
1.3 数据分析
本次试验的数据使用GraphPad Prism 5.0 software(San Diego,CA)和SPSS18.0(SPSS Inc.)处理。LD50使用logistic拟合求得,将器官的湿重除以对应鹌鹑的体重获得该个体的脏器系数。对死亡率数据进Fisher exact test。对于鹌鹑的体重以及脏器系数,首先采用shapiro-wilk法进行正态分布的检验,对于符合正态分布的组进levene检验方差齐性,对于符合方差齐性的数据进行one-way ANOVA,Dunnett法进行两两比较检验显著性差异,对于不符合正态分布或者方差齐性的进行Mann-Whitney检验。
2 结果(Results)
2.1 TCEP对鹌鹑胚胎的毒性效应
Fisher exact test结果显示,空白组和溶剂对照组的死亡率并没有显著性差异(P=0.419)。说明助溶剂DMSO并不会对胚胎死亡率产生显著性的影响,后续分析均采用溶剂对照进行比较。TCEP对鹌鹑胚胎致死率见图1,说明0.831~231μg·g-1egg TCEP对鹌鹑胚胎产生明显的剂量效应相关的致死现象,致死率随着浓度的升高而上升。结果显示, 83.1、166、231μg·g-1egg 3个浓度的TCEP会导致显著性致死效应。经计算TCEP对鹌鹑胚胎的LD50=118μg·g-1egg。95%置信区间为73.3~163μg·g-1egg。本次试验的最低效应浓度(LOEL)是83.1μg·g-1egg,最高无效应浓度(NOEL)是8.31μg·g-1egg。
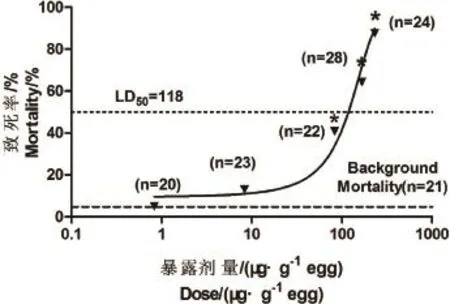
图1 TCEP对鹌鹑胚胎的剂量效应曲线注:图中“*”表示Fisher exact test中P<0.05,“n”表示处理组中的个体数。Fig.1 Dose-response curve of TCEP on quail embryoNote:”*”meansPvalue<0.05 in the Fisher exact test.“n”means the sample number in each treatment group.
2.2 TCEP对鹌鹑幼鸟的体重以及脏器系数的影响
脏器系数作为毒理学中一项敏感指标,脏器系数的上升往往意味着器官可能出现了水肿、充血、积水、增生等病变[19]。T检验的结果显示空白对照和溶剂对照之间的体重与脏器系数均不存在显著性差异,说明助溶剂DMSO对这些指标不产生影响,后续分析均采用溶剂对照数据进行比较(图2)。
方差分析的结果显示,TCEP对鹌鹑幼鸟的体重并不产生影响,但对于幼鸟的肝脏(P=0),脑(P= 0.01),心脏(P=0.005)的发育产生显著的影响。尤其是肝脏和脑的脏器系数,在0.831~166μg·g-1egg浓度区间内表现出随浓度上升而增加的趋势。在166μg·g-1egg浓度下,肝脏(P=0.0005),脑(P= 0.0024)和心脏(P=0.0005)脏器系数均有显著增加。
对于231μg·g-1egg浓度组,虽然数据显示出从幼鸟体重到脏器系数都观测到减轻的趋势,但是由于样本数太少,统计检验的结果并不具有显著性。在231μg·g-1egg浓度下,死亡率已经达到了87.5%,而且出壳以后的幼鸟均发现有腿部发育不良,不能稳定站立的现象,说明231μg·g-1egg浓度对鹌鹑的发育已经造成很大影响。
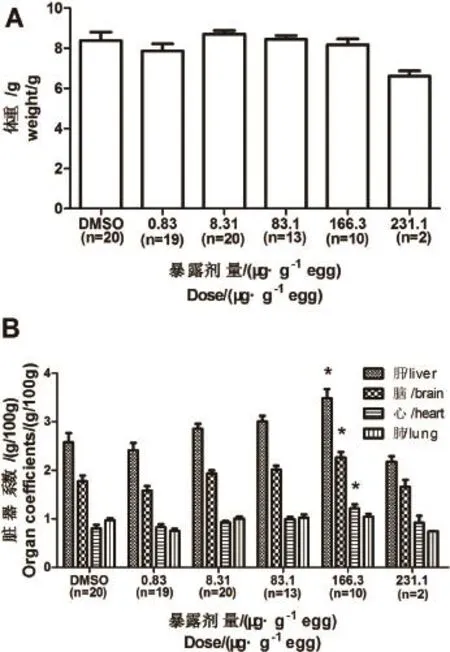
图2 TCEP对鹌鹑幼鸟体重(A)和脏器系数(B)的影响注:标注“*”为Dunnett检验中P<0.05。Fig.2 Effect on body weight(A)and organ coefficient(B) of quail embryo by TCEPNote:“*”meantPvalue<0.05 in Dunnett test.
3 讨论(Discussion)
把鸟类胚胎注射实验应用到化学品生态风险评估的研究在国内还不常见。本研究通过鸟类胚胎注射实验获得TCEP对日本鹌鹑胚胎发育毒性的LD50、NOEL、LOEL值,对尽快开展该类污染物对鸟类生态风险评估起到了推动作用。WHO报道TCEP大鼠经口急性毒性LD50为1 150mg·kg-1体重[10],ECOTOX数据库中收录小鼠90 d暴露TCEP的LOEL为700mg·kg-1[20],而日本青鳉急性毒性LC50为66~245mg·L-1[21]。本次实验首次报道了此类化合物对鸟类的毒性效应,弥补了TCEP在鸟类中毒性效应的空白。
TCEP暴露对鹌鹑胚胎体重及脏器系数产生影响,可以推断,TCEP对鸟类发育的毒性效应,主要通过影响幼鸟肝脏、脑、心脏的发育产生,不是首先对个体体重产生影响。同时观测到0.83~166μg·g-1egg浓度范围内脏器系数,尤其是肝脏和脑,随暴露浓度的升高而升高,但是231μg·g-1egg浓度组却表现出下降趋势。这个结果暗示:可能0.83~166μg·g-1egg浓度范围内的TCEP的暴露仍然在生物体恢复机制能承受范围内,致毒机理在这个浓度范围内保持一致;而在231μg·g-1egg浓度的TCEP已经超出了本身恢复机制的承受范围,对鹌鹑胚胎造成不可逆的毒性效应,致毒机理也与之前有很大区别。
前人的研究表明,700mg·kg-1的TCEP对大鼠进行16周的暴露,观测到肝脏和肾脏重量的上升,并且观测到对脑海马组织的损伤,脑部的损伤主要体现在海马组织CA1区域锥体细胞的缺失[22],上述肝脏重量上升的现象与本次实验观测到对肝脏的影响相符合。WHO报道 50μmol·kg-1C14标记的TCEP在进行大鼠暴露实验时,富集最明显的器官是肝脏和肾脏[10]。这暗示了TCEP进入生物体内以后作用机理可能是首先会在肝脏进行代谢,因此对肝脏造成了明显的毒性效应,然后通过肾脏代谢排出体外。另一项研究中,2年时间的44和88mg·kg-1TCEP暴露对前脑和脑干产生了由胶质细胞增生,矿化,出血,以及血铁黄素的积累构成的衰退损伤[23],这又与本次实验中脑部脏器系数的上升相吻合,暗示本研究中鹌鹑幼鸟的脑部同样有出现增生与矿化的可能。针对TCEP神经化学机制的药理学研究表明,TCEP能够对γ-氨基丁酸(GABA)有拮抗作用,而不是类胆碱型的激活剂[12]。这可能就是TCEP对脑部发育产生影响的原因。本次试验发现TCEP的暴露对鸟类心脏发育的影响实属首次。
针对TCEP的鸟类风险评估,可以利用风险熵法(Hazard Quotient,HQ)模型进行:HQ=EEC/ERC,其中EEC为环境暴露浓度,ERC为环境风险临界基准。由于目前针对鸟类只有本文的数据,就取本次实验的NOEL(8.31μg·g-1egg)作为ERC进行计算, EEC取前文提到的Chen等[8]和Greaves等[9]报道的鸟蛋中TCEP的浓度。按照这个公式计算,2个文献中TCEP浓度计算所得HQ均小于10-3,所以当地TCEP产生的生态风险很小。
本次实验没有测定TCEP实际暴露浓度与在器官中的富集情况,如果能有这些信息,对于进一步推测其在鸟类体内的代谢途径有很大帮助,对TCEP对鸟类的生态风险有一个更加详尽的理解。另外对TCEP依然需要更加深入的毒性机理研究,通过寻找生物标志物来进行更加敏感的毒性筛选与风险评估。
[1]Allred P M,Strange J R.The effects of 2,4,5-trichlorophenoxyacetic acid and 2,3,7,8-tetrachlorodibenzo-pdioxin on developing chicken embryos[J].Archives of Environmental Contamination and Toxicology,1977,6(1): 483-489
[2]Giesy J P,Ludwig J P,Tillitt D E.Dioxins,dibenzofurans, PCBs and colonial,fish-eating water birds[M]//Dioxins and Health.Springer,1994:249-307
[3]Suter G.Analysis of laboratory and field studies of reproductive toxicity in birds exposed to dioxin-like compounds for use in ecological risk assessment.EPA/600/R-03.[R].Washington DC:EPA,2003
[4]Marklund A,Andersson B,Haglund P.Screening of organophosphorus compounds and their distribution in various indoor environments[J].Chemosphere,2003,53(9): 1137-1146
[5]Li J,Yu N,Zhang B,et al.Occurrence of organophosphate flame retardants in drinking water from China[J]. Water Research,2014,54:53-61
[6]Cao S,Zeng X,Song H,et al.Levels and distributions of organophosphate flame retardants and plasticizers in sediment from Taihu Lake,China[J].Environmental Toxicology and Chemistry,2012,31(7):1478-1484
[7]Ma Y,Cui K,Zeng F,et al.Microwave-assisted extraction combined with gel permeation chromatography and silica gel cleanup followed by gas chromatography-mass spectrometry for the determination of organophosphorus flame retardants and plasticizers in biological samples[J].Analytica Chimica Acta,2013,786:47-53
[8]Chen D,Letcher R J,Chu S.Determination of non-halogenated,chlorinated and brominated organophosphate flame retardants in herring gull eggs based on liquid chromatography–tandem quadrupole mass spectrometry[J]. Journal of Chromatography A,2012,1220:169-174
[9]Greaves A K,Letcher R J.Comparative body compartment composition and in ovo transfer of organophosphate flame retardants in North American Great Lakes herring gulls[J].Environmental Science&Technology,2014,48 (14):7942-7950
[10]World Health Organization.International Programme on Chemical Safety,Environmental Health Criteria 209,Tris (chloropropyl)phosphate and Tris(2-chloroethyl)phosphate[R].Geneva:World Health Organization,1998
[11]Tilson H,Veronesi B,Mclamb R,et al.Acute exposure to tris(2-chloroethyl)phosphate produces hippocampal neuronal loss and impairs learning in rats[J].Toxicology and Applied Pharmacology,1990,106(2):254-269
[12]Umezu T,Yonemoto J,Soma Y,et al.Tris(2-chloroethyl) phosphate increases ambulatory activity in mice:Pharmacological analyses of its neurochemical mechanism[J]. Toxicology and Applied Pharmacology,1998,148(1): 109-116
[13]Liu X,Ji K,Choi K.Endocrine disruption potentials of organophosphate flame retardants and related mechanisms in H295R and MVLN cell lines and in zebrafish[J].A-quatic Toxicology,2012,114-115:173-181
[14]Chapin R E,Sloane R A,Haseman J K.The relationships among reproductive endpoints in Swiss mice,using the reproductive assessment by continuous breeding database [J].Toxicological Sciences,1997,38(2):129-142
[15]Cohen-Barnhouse A M,Zwiernik M J,Link J E,et al. Sensitivity of Japanese quail(Coturnix japonica),Common pheasant(Phasianus colchicus),and White Leghorn chicken(Gallus gallus domesticus)embryos to in ovo exposure to TCDD,PeCDF,and TCDF[J].Toxicological Sciences:An Official Journal of the Society of Toxicology,2011,119(1):93-103
[16]Powell D,Aulerich R,Meadows J,et al.Effects of 3,3′, 4,4′,5-pentachlorobiphenyl(PCB 126)and 2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD)injected into the yolks of chicken(Gallus domesticus)eggs prior to incubation [J].Archives of Environmental Contamination and Toxicology,1996,31(3):404-409
[17]Heinz G,Hoffman D,Kondrad S,et al.Factors affecting the toxicity of methylmercury injected into eggs[J].Archives of Environmental Contamination and Toxicology, 2006,50(2):264-279
[18]Fair J M,Hansen E S,Ricklefs R E.Growth,developmental stability and immune response in juvenile Japanese quails(Coturnix coturnix japonica)[J].Proceedings of the Royal Society of London Series B:Biological Sciences, 1999,266(1430):1735-1742
[19]袁本利.药物安全评价中脏器系数的意义及不足[J].中国新药杂志,2003,12(11):960-963
[20]Chapin R E,Sloane R A,Haseman J K.Reproductive endpoints in general toxicity studies:Are they predictive? [J].Reproductive Toxicology,1998,12(4):489-494
[21]Tsuji S,Tonogai Y,Ito Y,et al.The influence of rearing temperatures on the toxicity of various environmental pollutants for killifish(Oryzias latipes)[J].Japanese Journal of Toxicology&Environmental Health,1986,32(1):46-53
[22]Matthews H,Dixon D,Herr D,et al.Subchronic toxicity studies indicate that tris(2-chloroethyl)phosphate administration results in lesions in the rat hippocampus1[J]. Toxicology and Industrial Health,1990,6(1):1-15
[23]Program N T.NTP toxicology and carcinogenesis studies of tris(2-chloroethyl)phosphate(CAS No.115-96-8)in F344/N rats and B6C3F1 mice(gavage studies)[J].National Toxicology Program Technical Report Series,1991, 391
Assessment on the Developmental Toxicity of Tris(2-Chloroethyl)Phosphate in Japanese Quail Embryo
Zhang Junjiang,Zhang Xiaowei*,Yu Hongxia
State Key Laboratory of Pollution Control and Resource Reuse,School of the Environment,Nanjing University,Nanjing 210023,China
30 April 2015 accepted 11 June 2015
Tris(2-chloroethyl)phosphate(TCEP),one of the organophosphate flame retardants,has been frequently detected in the environment at a wide concentration range.It has also been reported to cause neurotoxicity and carcinogenicity in mammals.However,limited knowledge is available on the developmental toxicity of TCEP on avian species.Here TCEP was assessed by use of embryos of Japanese quail(Coturnix coturnix japonica).The quail embryos were exposed to TCEP for 21 days and the mortality rate was assessed.The effect on the organ coefficients and body weight were also evaluated.Results showed LD50of TCEP on quail embryos was 118μg·g-1egg with a 95%confidence interval of 73.3~163μg·g-1egg.The lowest observed effect level(LOEL)was 83.1μg·g-1egg and the no observed effect level(NOEL)was 8.31μg·g-1egg.Furthermore,TCEP had a significant effect on the development of brain,liver and heart.The organ coefficients of liver,brain and heart from 166μg·g-1eggTCEP exposure group,were altered significantly(Pvalue=0.0005,0.0024 and 0.0005,respectively).These results provided valuable development toxicity data for the ecological risk assessment of TCEP to avian species.
TCEP;Japanese quail;organ development
2015-04-30 录用日期:2015-06-11
1673-5897(2016)1-167-06
X171.5
A
10.7524/AJE.1673-5897.20150430003
张俊江,张效伟,于红霞.三氯乙基磷酸酯阻燃剂对日本鹌鹑胚胎的发育毒性[J].生态毒理学报,2016,11(1):167-172
Zhang J J,Zhang X W,Yu H X.Assessment on the developmental toxicity of tris(2-chloroethyl)phosphate in Japanese quail embryo[J].Asian Journal of Ecotoxicology,2016,11(1):167-172(in Chinese)
环保公益性行业科研专项经费项目(201209016);江苏省科技支撑计划社会发展基金项目(BE2011776)
张俊江,男,硕士研究生,研究方向为生态毒理学与转录组学,E-mail:921514080@qq.com;
),E-mail:zhangxw@nju.edu.cn
简介:张效伟(1978—),男,动物学和环境毒理学博士、教授、博士生导师,主要从事生态毒理学和健康风险评估方面的研究,发表英文SCI论文80多篇,包括以一作或通讯作者在环境领域高影响刊物Environmental Science&Technology和Toxicological Science等上发表论文20多篇。
