抗β1肾上腺素受体自身抗体在心衰患者血清中的分布及其对不同亚型T淋巴细胞增殖能力的影响研究
2016-12-06沈晓棠
沈晓棠
赤峰市医院 心内三科 (赤峰 024000)
·论 著·
抗β1肾上腺素受体自身抗体在心衰患者血清中的分布及其对不同亚型T淋巴细胞增殖能力的影响研究
沈晓棠
赤峰市医院 心内三科 (赤峰 024000)
目的 探讨抗β1肾上腺素受体自身抗体(β1-AA)在心衰(HF)患者血清中的分布,及其对不同亚型T淋巴细胞增殖能力的影响研究。方法 选取2010年12月至2013年12月赤峰市医院收治的符合纳入标准的HF患者70例,作为试验组;选取同时间段我院无HF、无肝肾功能异常的其他疾病患者70例,作为对照组;并选择若干只健康、β1-AA阴性的雄性c型小鼠,体质量约20 g。对照组和试验组均应用ELISA检测β1-AA滴度;将检测β1-AA呈阳性的患者的β1-AA提纯,按照不同质量浓度梯度注入到雄性c型小鼠淋巴细胞中,并利用CCK8试剂盒检测不同亚型T淋巴细胞增殖能力,应用AnnexinV/PI双染法检测不同亚型T淋巴细胞凋亡情况。结果 与对照组相比,试验组β1-AA滴度较高(t=15.216,P<0.001), β1-AA阳性检出率高(2=53.178,P<0.001)。β1-AA按照不同质量浓度梯度注射到c型小鼠淋巴细胞后,未激活小鼠淋巴细胞差异无统计学意义(t=1.408,P=0.161);CD3/CD28激活后差异有统计学意义(t=10.161,P<0.001;t=18.084,P<0.001;t=20.187,P<0.001;t=27.525,P<0.001);β1-AA促进了不同亚型T淋巴细胞乳酸脱氢酶(LDH)的释放(t=18.891,P<0.001;t=15.162,P<0.001;t=16.192,P<0.001;t=17.991,P<0.001)。结论 β1-AA可以损害不同亚型T淋巴细胞,加重HF患者病情。
β1肾上腺素受体自身抗体;心衰;不同亚型T淋巴细胞;凋亡;增殖能力
目前,心衰(HF)已成为重大公共卫生事件[1]。 HF往往由各种疾病引起心肌收缩能力减弱,从而使心脏的血液输出量减少,不足以满足机体需要,并由此产生一系列症状和体征。 抗β1肾上腺素受体自身抗体(β1-AA)是新近发现的一种存在于许多类型心血管疾病患者血清中的自身抗体,能够与β1-肾上腺素受体(β1-AR)细胞外第二环抗原肽段结合,发挥类受体激动剂样作用。运用现代医学科技,对HF的发病机制进行研究,可以降低病人死亡率,提高预后效果[2]。现报道如下。
1 资料与方法
1.1 临床资料
选取2010年12月至2013年12月赤峰市医院收治的70例HF患者为试验组患者,纳入标准:经超声心动图、心电图、X线体格检查确诊为HF患者,自愿参与本次研究并签署知情同意书。排除标准:伴有严重器质性疾病;心功能Ⅳ级;收缩压<90 mm Hg; 心率<55 次/min。另外,选取同时间段我院无HF、无肝肾功能异常的其他疾病患者70例为对照组。两组年龄、性别和入院时间比较,差异无统计学意义(P>0.05),具有可比性(表1)。
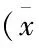
表1 两组患者一般情况比较±s)
1.2 实验动物
采用若干只健康、体质量约20 g、β1-AA阴性的雄性c型小鼠。所有小鼠均由我院特定动物实验中心供应,合格证明齐全。
1.3 检测方法
试验组和对照组均应用ELISA检测β1-AA滴度[3],β1-AA呈阳性患者应用 IgG亲和纯化试剂盒提纯β1-AA,提纯β1-AA后,按0.01、0.10、1.00、10.0 μmol/L 4种质量浓度梯度注入到雄性c型小鼠淋巴细胞中,并以同样质量浓度的阴性β1-AA注射到同种雄性c型小鼠淋巴细胞中,利用CCK8试剂盒检测不同亚型T淋巴细胞增殖能力[4-5],应用AnnexinV/PI双染法检测不同亚型T淋巴细胞凋亡情况[6]。
1.4 统计学方法

2 结果
2.1 两组β1-AA检测情况
试验组的β1-AA滴度较高(t=15.216,P<0.001),β1-AA阳性数所占比例达68.57%,远高于对照组(8.57%)(2=53.178,P<0.001)(表2)。

表2 两组β1-AA检测情况
2.2 β1-AA对不同亚型T淋巴细胞增殖能力的影响
利用CCK8试剂盒检测得出,未激活小鼠T淋巴细胞差异无统计学意义(t=1.408,P=0.161);激活CD3/CD28小鼠T淋巴细胞后,各质量浓度均可抑制不同亚型T细胞增殖(t=10.161,P<0.001;t=18.084,P<0.001;t=20.187,P<0.001;t=27.525,P<0.001)(表3)。
2.3 β1-AA对不同亚型T淋巴细胞凋亡情况
β1-AA促进不同亚型T淋巴细胞乳酸脱氢酶(LDH)的释放,加速T淋巴细胞凋亡(t=18.891,P<0.001;t=15.162,P<0.001;t=16.192,P<0.001;t=17.991,P<0.001)(表4)。
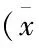
表3 不同亚型T淋巴细胞增殖情况±s)
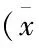
表4 不同亚型T淋巴细胞LDH释放情况±s)
3 讨论
随着社会不断发展,竞争力不断提升,人们在日常生活中的运动、饮食等方面形成许多不良习惯,因此,高血压、高血糖、高血脂等一系列疾病随之到来,HF的发病率上升,严重影响患者健康,降低患者生活质量[7]。HF的病因复杂,常与感染、心律失常、过度劳累、情绪波动、心脏病加重等有关[8],其病理生理十分复杂,多种机制相互作用[9],可以由神经体液、心肌肥厚、心肌损害等先出现代偿机制[10],但是,代偿有一定限度,导致心肌细胞能量供应相对或绝对不足,使心肌收缩力和心室顺应性下降[11],最终会导致HF发生。临床上通常把HF分为急性HF和慢性HF[12],其临床表现为恶心、纳差、呼吸困难、疲倦、少尿等,常伴有水电解质平衡紊乱、肾功能不全、心律失常等[13]。
HF已成为心内科医生乃至整个医学界亟需解决的问题。通过本研究可以看出,应用ELISA检测70例HFβ1-AA滴度,HF病人的β1-AA滴度明显高于无HF、无肝肾功能异常的其他疾病患者(t=15.216,P<0.001);HF病人的β1-AA阳性人数远高于无HF、无肝肾功能异常的其他疾病患者(2=53.178,P<0.001),是其8倍左右(68.57%/8.57%),表明HF患者血清中分布较多的β1-AA,可能β1-AA参与了HF过程或者存在于某些疾病,如高血压、冠心病等,并且可能存在年龄关系[14]。
ELISA检测得出的54例β1-AA呈阳性的患者,提纯其β1-AA;其余86例患者提纯阴性β1-AA。利用CCK8试剂盒检测不同亚型T淋巴细胞增殖能力。通过本研究可以看出,未激活小鼠T淋巴细胞不存在β1-AA导致的增殖抑制(t=1.408,P=0.161);但激活CD3/CD28小鼠T淋巴细胞使用阳性β1-AA后,则在不同质量浓度梯度的β1-AA均有抑制T淋巴细胞增殖现象(t=10.161,P<0.001;t=18.084,P<0.001;t=20.187,P<0.001;t=27.525,P<0.001),提示β1-AA可以抑制增殖,其可能导致T淋巴细胞无法增殖分化以及释放淋巴因子[15],从而破坏了人体的细胞免疫,抑制了体液免疫的发生,降低机体免疫力,导致更多并发症的发生。
LDH广泛存在于机体组织细胞中,心肌细胞尤甚[16]。当组织细胞受到破坏时,LDH可释放入血,导致血清中LDH滴度升高。通过本研究可以看出,β1-AA促进不同亚型T淋巴细胞LDH的释放(t=18.891,P<0.001;t=15.162,P<0.001;t=16.192,P<0.001;t=17.991,P<0.001),表明β1-AA可以破坏或者加速T淋巴细胞的凋亡,使血液中的LDH增高。
综上所述,β1-AA可以抑制不同亚型的T淋巴细胞增殖,促进其凋亡,导致HF患者病情加重,预后效果可能较差。
[1]王瑾, 吕婷婷,王丽,等.扩张型心肌病患者血清中的β1-肾上腺素受体自身抗体通过β1-肾上腺素受体抑制CD4+T淋巴细胞的增殖作用[J].中华微生物学和免疫学杂志,2013,33(7):518-524.
[2]Gong Y, Xiong H, Du Y,etal. Autoantibodies against β1-adrenoceptor induce blood glucose enhancement and insulin insufficient via T lymphocytes[J].Immunol Res, 2016,64(2):584-593.
[3]李笑, 杜芸辉,吕婷婷,等.心衰患者血清中β1肾上腺素受体自身抗体抑制不同亚型T淋巴细胞的增殖[J].中华微生物学和免疫学杂志,2014,34(3):205-211.
[4]Zhao Y, Huang H, Du Y,etal. β1-Adrenoceptor autoantibodies affect action potential duration and delayed rectifier potassium currents in guinea pigs [J]. Cardiovasc Toxicol, 2015,15(1):1-9.
[5]Lip G Y, Wrigley B J, Pisters R,etal. WITHDRAWN: Antiplatelet agents versus control or anticoagulation for heart failure in sinus rhythm [J]. Cochrane Database Syst Rev, 2016,5:CD003333.
[6]李笑, 杜芸辉,左骞,等.β1肾上腺素受体自身抗体及其在心力衰竭发生发展中的作用[J].生理科学进展,2013,44(5):385-389.
[7]杨大英. 卡维地洛对老年心衰伴室律失常患者抗β1、β2和α1肾上腺素受体自身抗体的作用[J].中国老年学杂志,2013,33(10):2442-2443.
[8]Woods K, Knights A J, Anaka M,etal.Mismatch in epitope specificities between IFNγ inflamed and uninflamed conditions leads to escape from T lymphocyte killing in melanoma[J].J Immunother Cancer, 2016,4:10.
[9]Wang Z, Ding L, Wang Z,etal. Circulating CD4(+)CXCR5(+) T Cells Exacerbate B Cell Antibody Production in Crohn′s Disease Through IL-21 Secretion [J]. Immunol Invest, 2015,44(7):665-677.
[10] 苗梦露, 李七一,严士海,等.抗心衰颗粒对舒张性心衰大鼠RAAS及心肌细胞内TGF-β1的影响[J].南京中医药大学学报,2013,29(3):247-250.
[11] 游广辉. 加味真武汤对阿霉素诱导心衰大鼠模型的保护作用及其机制[J].中国生化药物杂志,2015,35(11):33-36.
[12] Kuuliala K, Kuuliala A, Koivuniemi R,etal.Constitutive STAT3 Phosphorylation in Circulating CD4+ T Lymphocy-tes Associates with Disease Activity and Treatment Response in Recent-Onset Rheumatoid Arthritis [J].PLoS One, 2015,10(9):e0137385.
[13] Piconese S, Barnaba V,etal. Stability of Regulatory T Cells Undermined or Endorsed by Different Type-1 Cytokines [J]. Adv Exp Med Biol, 2015,850:17-30.
[14] 姜玲, 丁立群,王礼彬,等.血清脑尿钠肽水平监测对老年心衰患者β1受体阻滞剂合理使用的影响[J].中国老年学杂志,2013,33(6):1286-1287.
[15] Kuse N, Rahman M A, Murakoshi H,etal. Different Effects of Nonnucleoside Reverse Transcriptase Inhibitor Resistance Mutations on Cytotoxic T Lymphocyte Recognition between HIV-1 Subtype B and Subtype A/E Infections [J]. J Virol, 2015,89(14):7363-7372.
[16] 霍卫松, 张磊,高宇哲,等.心衰标志物可视化联合检测方法研究[J].影像科学与光化学,2015,33(4):275-284.
A Study on the Distribution of β1-AA in the Serum of Patients with Congestive Heart Failure and Its Effect on the Proliferation of Different Subtypes of T lymphocytes
Shen Xiaotang.
The Third Department of Cardiology, Chifeng Municipal Hospital, Chifeng 024000, China
Objective To explore the distribution of β1-AA in the serum of patients with congestive heart failure and its effect on the proliferation of T lymphocyte proliferation. Methods 70 patients with congestive heart failure treated in Chifeng Municipal Hospital from December of 2010 to December of 2013 were selected and divided into the experiment group. Another 70 cases without heart failure or liver and kidney dysfunction were selected and divided into the control group. Besides, a number of healthy, β1-AA-negative male c mice with 20g were selected. Enzyme-linked immunosorbent assay (ELISA) was used to detect the β1-AA titer of both groups. The β1-AA of β1-AA-positive patients were purified and injected to the lymphocyte of the selected c mice according to the different β1-AA concentration gradients. CCK8 was used to detect different subtypes of T lymphocyte proliferation. AnnexinV/PI staining was used to detect different subtypes of T lymphocyte apoptosis. Results Compared with the control group, the experiment group had higher β1-AA titer (t=15.216,P<0.001) and higher rate of β1-AA positive detection (2=53.178,P<0.001). After the injection of β1-AA with different concentrations into the lymphocyte of c mice, no statistical significance was found in the activation of lymphocytes (t=1.408,P=0.161), but there was statistical significance after the activation of CD3/CD28 (t=10.161,P<0.001;t=18.084,P<0.001;t=20.187,P<0.001;t=27.525,P<0.001). β1-AA promoted the release of lactate dehydrogenase in the different subtypes of T lymphocytes (t=18.891,P<0.001;t=15.162,P<0.001;t=16.192,P<0.001;t=17.991,P<0.001). Conclusion β1-AA can damage different subtypes of T lymphocytes and aggravate the conditions of patients with congestive heart failure.
β1-AA;Congestive heart failure;Different subtypes of T lymphocytes;Apoptosis;Proliferation ability
http://www.cnki.net/kcms/detail/51.1705.R.20161027.1712.080.html
10.3969/j.issn.1674-2257.2016.05.021
R331
A
