AFP、 PIVKA-Ⅱ联合AFP-L3诊断肝硬化患者合并肝癌的价值研究
2016-12-06曲远青
秦 燕,肖 毅,王 曦,彭 燕,谢 静,曲远青,赵 鑫
1.成都军区总医院 检验科(成都 610083) 2.成都军区总医院 超声科(成都 610083)3.成都市第七人民医院 检验科(成都 610071)
·论 著·
AFP、 PIVKA-Ⅱ联合AFP-L3诊断肝硬化患者合并肝癌的价值研究
秦 燕1,肖 毅1,王 曦2,彭 燕1,谢 静1,曲远青1,赵 鑫3
1.成都军区总医院 检验科(成都 610083) 2.成都军区总医院 超声科(成都 610083)3.成都市第七人民医院 检验科(成都 610071)
目的 探索甲胎蛋白(AFP)和异常凝血酶原Ⅱ (PIVKA-Ⅱ)联合甲胎蛋白异质体(AFP-L3)在肝硬化患者中诊断肝癌的价值。方法 回顾性分析261例肝硬化合并肝癌患者实验室检查结果作为试验组,同时纳入202例肝硬化未合并肝癌患者实验室检查结果作为对照组,采用ROC曲线分析3者单独运用及联合运用在诊断肝癌及早期肝癌中的价值。结果 463例患者中,男301例(65%),乙肝患者321例(69%)。ROC曲线分析显示:AFP、PIVKA-Ⅱ和AFP-L3单独运用诊断肝癌的曲线下面积分别为0.771 (95% CI, 0.731~0.811)、0.809 (95% CI, 0.764~0.854) 和0.758 (95% CI, 0.728~0.789)。3者联合运用诊断肝癌曲线下面积提高为0.882 (95% CI, 0.851~0.914),诊断敏感性和特异性分别为88.6% 和75.1%。AFP、PIVKA-Ⅱ和AFP-L3单独运用诊断早期肝癌的曲线下面积分别为0.744 (95% CI, 0.698~0.791)、0.718 (95% CI, 0.664~0.773) 和 0.678 (95% CI, 0.604~0.752)。3者联合运用诊断早期肝癌曲线下面积提高为0.773 (95% CI, 0.704~0.842),诊断敏感性和特异性分别为87.6% 和73.2%。结论 AFP、PIVKA-Ⅱ和AFP-L3联合运用相对于单独运用各指标可明显提高肝硬化患者中肝癌及早期肝癌的诊断率。
甲胎蛋白;甲胎蛋白异质体;异常凝血酶原Ⅱ;肝细胞肝癌
肝细胞肝癌(hepatocellular carcinoma, HCC) 是全球第3大常见癌症[1],而中国肝癌的发病率高于世界平均值,2011年中国肝癌发病人数约35.6万,发病率为26.39/10万[2]。由于多数患者诊断出肝癌时已处于中晚期,患者预后较差,因此如何提高肝癌的早期诊断率显得尤为重要。乙肝导致肝硬化,在肝硬化基础上容易并发肝癌,所以对肝硬化患者进行随访复查非常必要,但随访复查的方法仍然存在争议[3]。超声是目前最常用的随访手段,但美国肝病研究协会的分析报告显示,该种方法在肝硬化患者中检出肝癌的灵敏度仅为63%,其主要原因是由于肝癌可被粗糙回声的肝硬化背景所掩盖。肿瘤标志物通过血液进行检测,能反复抽取且创伤小,易被患者接受。甲胎蛋白(AFP)或异常凝血酶原Ⅱ(PIVKA-Ⅱ)已用于临床中肝癌的检出,并取得较理想的结果[4],近年来,甲胎蛋白异质体(AFP-L3)作为一种新的肝癌肿瘤标志物被认为是早期诊断肝癌有效的标志物[5],但3者联合运用在肝硬化患者中诊断肝癌的价值却鲜有报道。为此,本研究拟探索AFP、PIVKA-Ⅱ及AFP-L3单独运用与联合运用在肝硬化患者中诊断肝癌及早期肝癌的价值,以期为后期相关研究奠定基础。
1 资料与方法
1.1 临床资料
回顾性研究分析成都军区总医院2012年9月至2015年9月肝硬化患者的临床资料。试验组入组标准:1)年龄>20岁;2)确诊肝硬化患者;3)完整的AFP、PIVKA-Ⅱ和AFP-L3检查结果;4)随访期间发现肝癌或小肝癌。排除标准:1)入组前诊断为肝癌;2)肝移植病史;3)与肝癌同时合并其他癌症。最终261例患者(M: 55.3;IQR: 49.5~65.7)纳入试验组,选择同期临床资料与试验组相匹配的肝硬化未合并肝癌患者作为对照组,最终202例患者(M: 53.9; IQR: 47.4~67.8)纳入对照组。
1.2 肝硬化及肝癌定义
肝硬化定义: 1)血小板<100/L,且超声检查结果提示肝硬化,包括伴有脾脏增大>12 cm,肝脏边缘变钝或呈结节样;2)食管或胃底静脉曲张;3)肝硬化并发症,如腹水、静脉曲张出血和肝性脑病[6]。肝癌定义采用美国肝病研究协会和欧洲肝病研究协会对肝癌的非侵入性诊断标准——CT或MRI出现动脉期明显强化病灶且静脉期或延迟期强化减退的病灶,无论病灶大小;并结合巴塞罗那临床肝癌(BCLC)分期系统。该研究采用的早期肝癌病例为满足上述强化特点且直径<3 cm的单个肿瘤[7]。
1.3 血清标志物测量
AFP和AFP-L3采用μTAS 测定 (光纯药工业株式会社,日本大阪),PIVKA-Ⅱ采用酶联免疫测定法(富士瑞必欧,日本东京)。AFP以20 ng/mL作为临界值,≥20 ng/mL诊断为AFP阳性,PIVKA-Ⅱ以40 mAU/mL作为临界值,≥40 mAU/mL诊断为PIVKA-Ⅱ阳性。此外,AFP-L3以5%作为临界值,≥5%诊断为AFP-L3阳性。联合诊断中各项指标若有1项为阳性,则判为联合诊断阳性。
1.4 统计学方法
统计分析采用STATA version 9.0 (StataCorp LP, College Station, TX)。定量变量采用中位数(四分位数间距)描述,采用Mann-Whitney U检验进行组间比较,定性资料采用例数(%)描述,组间比较采用2检验或Fisher精确法。采用ROC曲线分析各指标单独运用的诊断价值。通过逻辑回归建立统计学模型分析肿瘤指标联合运用的诊断价值。检验水准α设定为0.05。
2 结果
2.1 临床资料基线特征
试验组与对照组基线特征比较见表1。AST、 AFP、 PIVKA-Ⅱ及AFP-L3水平试验组高于对照组,差异有统计学意义(P<0.05); 白蛋白水平试验组低于对照组,差异有统计学意义(P<0.05);两组其余指标比较差异无统计学意义(P>0.05)。
2.2 标志物诊断肝癌价值
标志物诊断肝癌,AFP ROC曲线下面积为0.771(95% CI, 0.731~0.811);PIVKA Ⅱ ROC曲线下面积为0.809(95% CI, 0.764~0.854);AFP-L3 ROC曲线下面积为0.758(95% CI, 0.728~0.789);而3者联合诊断曲线下面积为0.882(95% CI, 0.851~0.914),诊断敏感性和特异性分别为88.6% 和75.1%(表2)。3者联合诊断曲线下面积与3者单独应用比较,差异均有统计学意义(P=0.017,0.031,0.024),ROC曲线见图1。
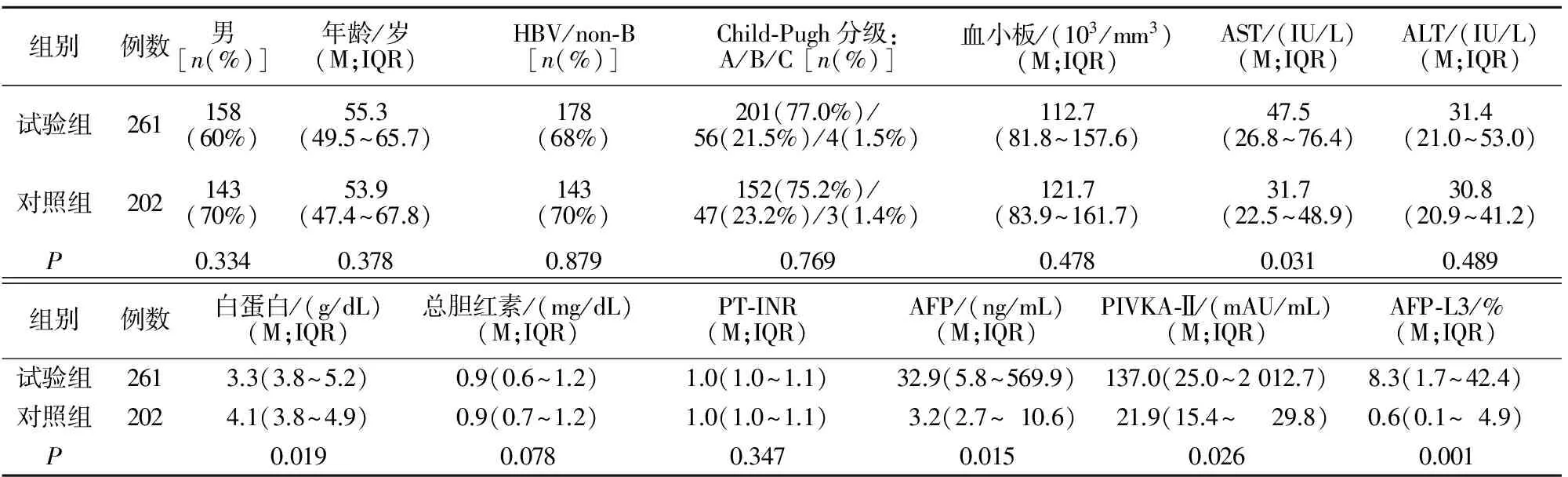
表1 试验组与对照组基线特征比较
注:HBV:乙型肝炎病毒;AST:天冬氨酸转氨酶;ALT:谷丙转氨酶;PT-INR:凝血酶原时间国际标准化比值;AFP:甲胎蛋白;PIVKA-Ⅱ:异常凝血酶原Ⅱ;AFP-L3:甲胎蛋白异质体
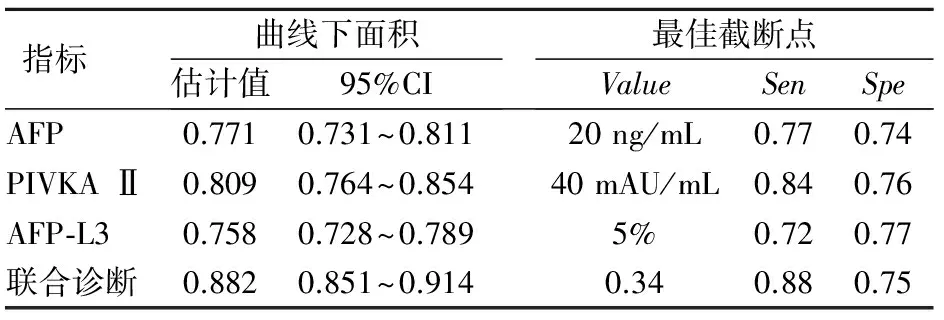
表2 肿瘤标志物诊断肝癌的曲线下面积、敏感性和特异性

图1 AFP、PIVKA Ⅱ和AFP-L3单独及3者联合诊断肝癌的ROC曲线图
2.3 标志物诊断早期肝癌价值
标志物诊断早期肝癌,AFP ROC曲线下面积为0.744(95% CI, 0.698~0.791);PIVKA Ⅱ ROC曲线下面积为0.718(95% CI, 0.664~0.773);AFP-L3 ROC曲线下面积为0.678(95% CI, 0.604~0.752)。3者联合诊断早期肝癌的曲线下面积为0.773 (95% CI, 0.704~0.842),诊断敏感性和特异性分别为87.6% 和73.2%(表3)。虽然3者联合诊断早期肝癌曲线下面积最大,但3者联合与AFP或PIVKA Ⅱ单独使用诊断曲线下面积差异无统计学意义(P=0.084,0.235),与AFP-L3单独使用曲线下面积比较差异有统计学意义(P=0.016),ROC曲线见图2。

表3 肿瘤标志物诊断早期肝癌的曲线下面积、敏感性和特异性

图2 AFP、PIVKA Ⅱ和AFP-L3单独及3者联合诊断早期肝癌的ROC曲线图
2.4 AFP<20 ng/mL时标志物诊断肝癌价值
当AFP < 20 ng/mL,试验组患有肝癌者121例, 对照组无肝癌患者62例。PIVKA Ⅱ ROC曲线下面积为0.744(95%CI,0.692~0.796);AFP-L3 ROC曲线下面积为0.725(95%CI,0.667~0.784)。两者联合诊断肝癌的曲线下面积为0.794(95%CI,0.746~0.841),诊断敏感性和特异性分别为83.6%,74.5%(表4)。PIVKA Ⅱ 与AFP-L3联合使用诊断曲线下面积与两者单独运用进行比较,差异均无统计学意义(P=0.063,0.058),ROC曲线见图3。
表4 AFP<20 ng/mL时肿瘤标志物诊断肝癌的曲线下面积、敏感性和特异性

指标 曲线下面积估计值95%CI最佳截断点ValueSenSpePIVKAⅡ0.7440.692~0.79640mAU/mL0.770.71AFP⁃L30.7250.667~0.7845%0.790.78联合诊断0.7940.746~0.8410.380.830.74

图3 AFP < 20 ng/mL时,PIVKA-Ⅱ与AFP-L3单独及两者联合诊断肝癌的ROC曲线图
3 讨论
本研究评估了不同肿瘤标志物在肝硬化患者中诊断肝癌的有效性,对肿瘤标志物AFP、PIVKA-Ⅱ和AFP-L3被单独或联合运用诊断肝癌的有效性进行了评估。首先,3种标志物在肿瘤患者体内均高于非肿瘤患者。既往研究均采用慢性肝病患者作为研究对象,而该研究只有诊断为肝硬化的患者才纳入研究,因为只有肝硬化才是肝癌发生的最常见原因。且既往研究采用超声作为肝癌的诊断手段之一,而慢性肝病导致的背景回声粗糙会降低肝癌的检出率[8]。而本研究采用CT或MRI作为肝癌的检查手段,由于密度或软组织分辨率明显提高,因此该研究较既往研究确立的标准更客观可靠。
本研究发现,PIVKA-Ⅱ相对于AFP和AFP-L3来说,在肝硬化背景下检查肝癌具有更高的曲线下面积,该结果与Durazo等[4]研究结果基本一致。分析其可能的原因为,活动性肝炎或肝硬化很少造成无肝癌患者的PIVKA-Ⅱ水平假性增高,因此,PIVKA-Ⅱ被认为比AFP或AFP-L3早期诊断肝癌更有效。然而,有较多研究同样发现,PIVKA-Ⅱ在检测早期肝癌时价值是有限的。本研究发现,单独运用PIVKA-Ⅱ对于诊断早期肝癌曲线下面积为0.718,同样不甚理想。分析其可能的原因为,虽然PIVKA-Ⅱ可能是肝硬化患者中检出肝癌最佳的指标,但可能因为研究人群中大部分为中晚期肝癌,所以相对于早期肝癌的诊断,PIVKA-Ⅱ单独使用并不理想。PIVKA-Ⅱ联合AFP、AFP-L3是否能较3者单独运用提高诊断准确性,目前仍存在争议。Volk等[9]研究证实,3者联合运用能提高诊断准确性,而Durazo等[4]研究结果却与之相反。本研究结果与Volk等[9]研究结果较一致。本研究认为存在这种差异可能的原因为纳入研究人群的病因不同,中国乙型肝炎病毒感染人数众多,肝硬化致病多为乙肝病毒感染,而在欧美发达国家,肝硬化主要为酒精性,所以是否不同的病因造成研究结果不一致,需要今后开展大样本、多种族研究来得出结论。
本研究发现,在诊断早期肝癌中,AFP、PIVKA-Ⅱ和AFP-L3联合运用显示出最高的ROC曲线下面积。3者单独运用中,AFP具有最好的曲线下面积。Nakamura等[7]研究发现,对于小于3 cm的肝脏肿瘤,AFP具有最高的诊断价值,而对于中晚期肝癌,PIVKA-Ⅱ的诊断价值高于AFP,本研究结果基本与Nakamura等[7]一致。但本研究发现,3者联合可提高诊断价值,尽管其与AFP或PIVKA Ⅱ单独运用曲线下面积比较差异无统计学意义,我们仍建议在今后的临床工作中3者联合运用,因为3者联合运用诊断早期肝癌的敏感性达87.6%,而对于早期肝癌的诊断,高灵敏度被认为比高特异度更重要。部分肝癌患者AFP并不增高,所以如何在这部分患者中筛查出肝癌,是目前医务工作者亟待解决的问题[10]。本研究进一步对AFP水平<20 ng/mL患者进行了探索,虽然PIVKA-Ⅱ和AFP-L3联合运用与两者单独运用诊断效能差异无统计学意义,但两者联合运用提高了在该类人群中检测出肝癌的诊断效能,提示我们需要进一步研究在低AFP水平下提高肝癌诊断效能的生物标志物。
总之,本研究发现AFP、 PIVKA-Ⅱ联合AFP-L3运用能明显提高在肝硬化患者中检测出肝癌和小肝癌的能力。本研究不足之处有3个方面:第一,本研究为回顾性研究,不可避免存在偏倚;第二,本研究只探索了3者联合或3者单独运用的诊断价值,而未探索其诊断的成本效益,下一步我们将进一步对其进行研究,拟筛选出在保持高诊断效能的情况下最佳的成本效益比;第三,本研究为单中心研究,有待扩大样本量、多中心研究来验证结论。
[1]Dhir M, Melin A A, Douaiher J,etal. A review and update of treatment options and controversies in the management of hepatocellular carcinoma [J]. Ann Surg,2016,263(6):1112-1125.
[2]Chen W, Zheng R, Zuo T,etal. National cancer incidence and mortality in China, 2012 [J]. Chin J Cancer Res, 2016,28(1):1-11.
[3]Sato Y, Nakata K, Kato Y,etal. Early recognition of hepatocellular carcinoma based on altered profiles of alpha-fetoprotein [J].N Engl J Med, 1993,328(25):1802-1806.
[4]Durazo F A, Blatt L M, Corey W G,etal. Des-gamma-carboxyprothrombin, alpha-fetoprotein and AFP-L3 in patients with chronic hepatitis, cirrhosis and hepatocellular carcinoma [J].J Gastroenterol Hepatol, 2008,23(10):1541-1548.
[5]Kagebayashi C, Yamaguchi I, Akinaga A,etal. Automated immunoassay system for AFP-L3% using on-chip electrokine-tic reaction and separation by affinityelectrophoresis [J]. Anal Biochem, 2009,388(2):306-311.
[6]Marrero J A, Feng Z, Wang Y,etal. Alpha-fetoprotein, des-gamma carboxyprothrombin, and lectin-bound alpha-fetoprotein in early hepatocellular carcinoma [J]. Gastroenterology, 2009,137(1):110-118.
[7]Nakamura S, Nouso K, Sakaguchi K,etal. Sensitivity and specificity of des-gamma-carboxy prothrombin for diagnosis of patients with hepatocellular carcinomas varies according to tumor size [J].Am J Gastroenterol, 2006,101(9):2038-2043.
[8]Singal A,Volk M L,Waljee A,etal. Meta-analysis: surveill-ance with ultrasound for early-stage hepatocellular carcinoma in patients with cirrhosis [J].Aliment Pharmacol Ther, 2009,30(1):37-47.
[9]Volk M L, Hernandez J C, Su G L,etal. Risk factors for hepatocellular carcinoma may impair the performance of biomarkers: a comparison of AFP, DCP, and AFP-L3 [J]. Cancer Biomark, 2007,3(2):79-87.
[10] Shang S, Plymoth A, Ge S,etal. Identification of osteopon-tin as a novel marker for early hepatocellular carcinoma [J]. Hepatology, 2012,55(2):483-490.
The Value Research on the Combination of AFP, PIVKA-Ⅱ, and AFP-L3 as Tumor Markers to Detect Hepatocellular Carcinoma in Cirrhotic Patients
Qin Yan1, Xiao Yi1, Wang Xi2, Peng Yan1, Xie Jing1, Qu Yuanqing1, Zhao Xin3.
1. Department of Microbiology and Immunology, General hospital of Chengdu Military Region, Chengdu 610083, China; 2. Department of Ultrasound, General hospital of Chengdu Military Region, Chengdu 610083, China; 3. Department of Clinical Laboratory, The Sevevth People′s Hospital of Chengdu City, Chengdu 610071, China
Objective To investigate the diagnostic value of the combination of alpha-fetoprotein (AFP), protein induced by vitamin K absence or antagonist-Ⅱ (PIVKA-Ⅱ) and lens culinaris agglutinin-reactive fraction of AFP (AFP-L3) as tumor markers to detect hepatocellular carcinoma (HCC) in cirrhotic patients. Methods The retrospective method was used to analyze the laboratory data of 261 cirrhotic patients with HCC in the experiment group and those of 202 cirrhotic patients without HCC occurrence in the control group. The receiver operating characteristic curve (ROC) was used to analyze the value of the individual markers and the combined markers in diagnosing HCC and early HCC in cirrhotic patients. Results Among the 463 patients, 65% patients (n=301) were male and 69% cases (n=321) were patients with chronic hepatitis B. When AFP, PIVKA-Ⅱ, and AFP-L3 were used as the individual tumor marker, the areas under the receiver operating characteristic curve (AUROC) for HCC diagnosis were 0.771 (95% CI, 0.731-0.811) for AFP, 0.809 (95% CI, 0.764-0.854) for PIVKA-Ⅱ, and 0.758 (95% CI, 0.728-0.789) for AFP-L3 respectively, and the AUROC for early HCC diagnosis were 0.744 (95% CI, 0.698-0.791) for AFP, 0.718 (95% CI, 0.664-0.773) for PIVKA-Ⅱ, and 0.678 (95% CI, 0.604-0.752) for AFP-L3 respectively. When AFP, PIVKA-Ⅱ, and AFP-L3 were used as the combined tumor marker, the AUROC increased to 0.882 (95% CI, 0.851-0.914) for HCC diagnosis and 0.773 (95% CI, 0.704-0.842) for early HCC diagnosis respectively, and the sensitivity and specificity were 88.6% and 75.1% in overall HCC diagnosis, and 87.6% and 73.2% in early HCC diagnosis respectively. Conclusion The diagnostic accuracy is much higher by combining AFP, PIVKA-Ⅱ, and AFP-L3 as the tumor markers than by using them individually in detecting HCC and early HCC in cirrhotic patients.
AFP; AFP-L3; PIVKA-Ⅱ; Hepatocellular carcinoma
http://www.cnki.net/kcms/detail/51.1705.R.20161027.1710.070.html
10.3969/j.issn.1674-2257.2016.05.016
R735.7
A
