苯并咪唑衍生物BMT-1对Jurkat细胞增殖及凋亡的影响*
2016-12-06唐信威赵波波欧阳寒梅
樊 苗,孙 海,唐信威,赵波波,欧阳寒梅,邹 强
1.成都医学院 基础医学院(成都 610500);2.成都医学院 科研实验中心(成都 610500)
·论 著·
苯并咪唑衍生物BMT-1对Jurkat细胞增殖及凋亡的影响*
樊 苗1,孙 海1,唐信威1,赵波波1,欧阳寒梅1,邹 强2△
1.成都医学院 基础医学院(成都 610500);2.成都医学院 科研实验中心(成都 610500)
目的 探讨苯并咪唑衍生物BMT-1对急性T淋巴细胞白血病Jurkat细胞增殖及凋亡的影响。方法 采用CCK-8测定BMT-1对Jurkat细胞增殖的影响,采用流式细胞术检测BMT-1对Jurkat细胞的细胞周期、细胞凋亡和线粒体膜电位的影响。结果 BMT-1可显著抑制Jurkat细胞增殖,呈剂量依赖效应,GI50为1.08 μmol/L。BMT-1可诱导Jurkat细胞SubG1峰显著增强、凋亡细胞比例显著增加和线粒体膜电位显著改变。结论 苯并咪唑衍生物BMT-1能显著抑制Jurkat细胞增殖,并诱导细胞凋亡。
苯并咪唑衍生物;Jurkat细胞;细胞凋亡
急性淋巴细胞白血病是血液系统常见的恶性肿瘤,表现为大量原始及幼稚的淋巴细胞增殖累积侵犯多个造血器官和组织,表现为细胞恶性增殖、分化异常和凋亡受抑。目前治疗白血病多采取以化疗为主的综合治疗,而通过诱导白血病细胞凋亡,是化疗药物作用的主要作用机制之一[1]。
苯并咪唑衍生物是一类含氮芳香杂环化合物,因具有抗炎[2]、抗风湿免疫[3]、抗肿瘤[4]和抗寄生虫[5]等广泛的生物活性和应用前景越来越受到研究人员的青睐,前期研究发现苯并咪唑衍生物BMT-1[2-(1H-benzimidazol-2-yl)-4,5,6,7-tetrahydro-2H-indazol-3-ol]能够抑制骨髓瘤细胞增殖、并诱导细胞凋亡,且不影响正常淋巴细胞的存活[6]。但目前,尚未见BMT-1抑制急性T淋巴细胞白血病Jurkat细胞增殖的报道。本文探讨BMT-1对的Jurkat细胞的增殖和凋亡作用,旨在为临床抗白血病药物开发应用提供科学理论依据。
1 材料与方法
1.1 主要试剂与仪器
BMT-1购于Chembridge公司;CCK-8试剂盒购于日本Dojingdo公司;细胞周期检测试剂盒购于上海碧云天生物技术公司;细胞凋亡检测试剂盒购于美国Roche公司;线粒体膜电位检测试剂盒购于美国Sigma公司;美国Biotek公司Powerwave XS全波长酶标仪,美国BD公司Accuri C6流式细胞仪。
1.2 细胞培养
急性T淋巴细胞白血病Jurkat细胞为四川大学华西医学院传代保存株。细胞在5% CO2,37 ℃恒温及饱和湿度的培养箱中,使用含10%灭活胎牛血清的RPMI-1640培养基常规培养,定期换液或传代。
1.3 CCK-8法检测细胞增殖抑制率
取对数生长期Jurkat细胞2×104个/孔细胞密度,加入96孔平底板,每孔体积200 μL,除对照组外,实验组加入不同浓度的BMT-1作用48 h后,加入20 μL CCK-8,继续培养4 h,使用酶标仪选择450 nm波长检测光吸收值,实验重复3次,结果取平均值。按以下公式计算药物对肿瘤细胞生长抑制率:[(Ti-Tz)/(C-Tz)]×100 ,公式中Ti代表药物组培养48 h后测定的OD值;Tz代表不含药物组,起始培养测定的OD值;C代表不含药物组,培养48 h后测定的OD值[7]。
1.4 细胞周期和细胞凋亡的检测
Jurkat细胞按2×105个/mL接种于12孔细胞培养板,2 mL/孔,加入不同浓度BMT-1作用24 h后,收集细胞,用预冷的PBS重悬洗涤,70%乙醇4 ℃固定过夜,使用PI染色,37 ℃避光孵育30 min,使用BD公司Accuri C6流式细胞仪进行检测、CFlow software (version 1.0.227.4)进行数据分析。Annexin V-FITC /PI 双染法检测细胞凋亡,按照试剂盒说明书进行操作。收集不同浓度BMT-1作用后的Jurkat细胞,用预冷的PBS洗涤并重悬于100 μL含有Annexin V-Fluos和PI结合缓冲液中,室温避光孵育15 min后,用流式细胞术检测细胞凋亡情况[8]。
1.5 JC-1染色法检测细胞线粒体膜电位的改变
不同浓度的BMT-1作用Jurkat细胞12 h后,按照试剂盒说明书进行操作,细胞浓度调整为5×105个/mL,加JC-1染色液,37 ℃孵育20 min,采用流式细胞术检测细胞线粒体膜电位的变化[9]。
1.6 统计学方法
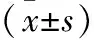
2 结果
2.1 BMT-1抑制Jurkat细胞增殖
不同浓度BMT-1作用Jurkat细胞48 h后,用CCK-8法测定BMT-1对Jurkat细胞的GI50。结果显示,BMT-1可显著抑制Jurkat细胞增殖,呈剂量依赖关系。抑制Jurkat细胞的活性GI50是1.08 μM(图1)。
图1 BMT-1抑制Jurkat细胞增殖
注:A. BMT-1化学结构式;B. BMT-1可抑制Jurkat细胞增殖,呈剂量依赖关系,GI50为1.08 μmol/L
2.2 BMT-1对Jurkat细胞周期的影响 不同浓度(0.625、1.250、2.500和5.000 μmol/L)BMT-1作用Jurkat细胞24 h后进行细胞周期检测。结果显示,BMT-1可显著阻滞Jurkat细胞周期于SubG1期且呈剂量依赖关系(图2)。
2.3 BMT-1诱导Jurkat细胞凋亡
BMT-1作用Jurkat细胞24 h后,用Annexin V和PI双染法流式细胞术检测细胞凋亡率。结果显示,BMT-1在剂量为0.625、1.250、2.500和5.000 μM时,均能够诱导Jurkat细胞发生凋亡,凋亡比例明显增加且呈剂量依赖关系(图3)。
2.4 BMT-1降低Jurkat细胞线粒体膜电位
不同浓度BMT-1作用Jurkat细胞12 h后,使用荧光染料JC-1进行染色,用流式细胞术检测线粒体膜电位的变化。与空白对照组比较,经不同浓度BMT-1作用的Jurkat细胞,线粒体膜电位降低的细胞比例明显增加且呈剂量依赖关系(图4)。

图 2 BMT-1对Jurkat细胞周期的影响

图3 BMT-1诱导Jurkat细胞凋亡

图4 BMT-1对Jurkat细胞膜电位的影响
3 讨论
越来越多的资料显示,细胞凋亡异常在许多恶性肿瘤的发病学中占有重要地位[10],在造血系统恶性肿瘤的临床治疗中,目前大多数化疗药物是通过诱导细胞凋亡来清除肿瘤细胞。本实验中苯并咪唑衍生物BMT-1能显著抑制Jurkat细胞增殖,刺激48 h后的半数抑制率(GI50)为1.08 μmol/L。经BMT-1作用Jurkat细胞用PI染色后,采用流式细胞仪进行细胞周期分析,随药物剂量增加,SubG1期细胞比例明显增加。而SubG1峰是细胞凋亡的重要标志[11]。不同浓度BMT-1作用Jurkat细胞,与对照组相比,Jurkat凋亡细胞比例显著增加,线粒体膜电位下移明显。线粒体在细胞凋亡中占有重要作用,多种凋亡刺激如化疗药物的使用均可活化线粒体途径[12]。上述结果表明BMT-1能够抑制Jurkat细胞增殖,其作用机制可能是通过降低细胞线粒体膜电位诱导Jurkat细胞凋亡来实现抑制细胞增殖的作用。
线粒体途径是细胞凋亡通路中的关键环节和特征性事件[13]。现临床治疗血液系统肿瘤常用的化疗药物如羟基喜树碱、阿糖胞苷及高三尖杉脂碱等均可诱导肿瘤细胞凋亡,其作用机制可能是通过破坏或改变线粒体跨膜电位或细胞色素C的释放和 caspase的活化诱导肿瘤细胞凋亡来抑制肿瘤细胞增殖[14]。如喜树碱诱导Jurkat细胞后,线粒体膜通透化使大量细胞色素C释放,使ATP耗竭及活性氧增加,激活胞质和线粒体中的caspase,导致线粒体膜电位丧失,使肿瘤细胞发生凋亡,细胞周期检测到明显的SubG1凋亡峰[15]。
苯并咪唑衍生物因其良好的生物活性为制药发展提供了良好的药物前体。之前有研究报道,苯并咪唑衍生物可诱导多种肿瘤细胞系抗有丝分裂和抑制肿瘤细胞增殖[16-17]。BMT-1是一种全新结构的苯并咪唑衍生物,目前,有BMT-1诱发多发性骨髓瘤细胞系凋亡的报道,但尚未见其诱导血液系统肿瘤细胞系凋亡的报道。Jurkat细胞源于人T淋巴细胞白血病细胞系,是目前研究T 淋巴细胞凋亡的较好模型。本实验初步观察了BMT-1对Jurkat细胞凋亡作用,结果表明,BMT-1可显著抑制Jurkat细胞增殖,作用于Jurkat细胞后,可使细胞内线粒体膜电位显著降低且呈一定的剂量依赖效应,其降低程度反映了线粒体膜受损的程度,是细胞凋亡的早期事件,反映细胞进入不可逆的凋亡程序。
综上所述,苯并咪唑衍生物BMT-1可通过降低细胞线粒体膜电位诱导细胞凋亡从而抑制Jurkat细胞增殖。BMT-1可作为先导化合物,用于进一步设计开发新型高效抗肿瘤药物,为白血病治疗提供更多药物选择。
[1]Zhu J, Sammons M A, Donahue G,etal. Gain-of-function p53 mutants co-opt chromatin pathways to drive cancer growth[J]. Nature, 2015,525(7568):206-211.
[2]Moneer A A, Mohammed K O, El-Nassan H B. Synthesis of novel substituted thiourea and benzimidazole derivatives containing a pyrazolone ring as anti-inflammatory agents[J]. Chem Biol Drug Des, 2016,87(5):784-793.
[3]Liu J, Huang N, Li N,etal. 2-(1H-Benzimidazol-2-yl)-4,5,6,7-tetrahydro-2H-indazol-3-ol, a benzimidazole derivative, inhibits T cell proliferation involving H+/K+-ATPase inhibition[J]. Molecules, 2014,19(11):17173-17186.
[4]Sharma P, Thummuri D, Reddy T S,etal. New (E)-1-alkyl-1H-benzo[d]imidazol-2-yl)methylene)indolin-2-ones: Synthesis, in vitro cytotoxicity evaluation and apoptosis inducing studies[J]. Eur J Med Chem, 2016(122):584-600.
[5]Oh S, Kim S, Kong S,etal. Synthesis and biological evaluation of 2,3-dihydroimidazo[1,2-a]benzimidazole derivatives against Leishmania donovani and Trypanosoma cruzi[J]. Eur J Med Chem, 2014,84:395-403.
[6]Yang T, Li M H, Liu J,etal. Benzimidazole derivative, BMT-1, induces apoptosis in multiple myeloma cells via a mitochondrial-mediated pathway involving H+/K+-ATPase inhibition[J]. Oncol Rep, 2014,31(6):2743-2750.
[7]Wang Q, Wu S, Zhao X,etal. Mechanisms of dihydroartemisinin and dihydroartemisinin/holotransferrin cytotoxicity in T-cell lymphoma cells[J]. PLoS One, 2015,10(10):e137331.
[8]Havelek R, Seifrtova M, Kralovec K,etal. The effect of Amaryllidaceae alkaloids haemanthamine and haemanthidine on cell cycle progression and apoptosis in p53-negative human leukemic Jurkat cells[J]. Phytomedicine, 2014,21(4):479-490.
[9]Ovadje P, Chatterjee S, Griffin C,etal. Selective induction of apoptosis through activation of caspase-8 in human leukemia cells (Jurkat) by dandelion root extract[J]. J Ethnopharmacol, 2011,133(1):86-91.
[10] Chaabane W, User S D, El-Gazzah M,etal. Autophagy, apoptosis, mitoptosis and necrosis: interdependence between those pathways and effects on cancer[J]. Arch Immunol Ther Exp (Warsz), 2013,61(1):43-58.
[11] Kajstura M, Halicka H D, Pryjma J,etal. Discontinuous fragmentation of nuclear DNA during apoptosis revealed by discrete “sub-G1” peaks on DNA content histograms[J]. Cytometry A, 2007,71(3):125-131.
[12] Jiang X, Jiang H, Shen Z,etal. Activation of mitochondrial protease OMA1 by Bax and Bak promotes cytochrome c release during apoptosis[J]. Proc Natl Acad Sci U S A, 2014,111(41):14782-14787.
[13] Cheng X, Bennett R L, Liu X,etal. PKR negatively regulates leukemia progression in association with PP2A activation, Bcl-2 inhibition and increased apoptosis[J]. Blood Cancer J, 2013,3(3):e144.
[14] Bhalla K, Ibrado A M, Tourkina E,etal. High-dose mitoxantrone induces programmed cell death or apoptosis in human myeloid leukemia cells[J]. Blood, 1993,82(10):3133-3140.
[15] Sanchez-Alcazar J A, Ault J G, Khodjakov A,etal. Increased mitochondrial cytochrome c levels and mitochondrial hyperpolarization precede camptothecin-induced apoptosis in Jurkat cells[J]. Cell Death Differ, 2000,7(11):1090-1100.
[16] Chang W L, Chang C S, Chiang P C,etal. 2-Phenyl-5-(pyrrolidin-1-yl)-1-(3,4,5-trimethoxybenzyl)-1H-benzimidazole, a benzimidazole derivative, inhibits growth of human prostate cancer cells by affecting tubulin and c-Jun N-terminal kinase[J]. Br J Pharmacol, 2010,160(7):1677-1689.
[17] Liu J F, Huang Y L, Yang W H,etal. 1-benzyl-2-phenylbenzimidazole (BPB), a benzimidazole derivative, induces cell apoptosis in human chondrosarcoma through intrinsic and extrinsic pathways[J]. Int J Mol Sci, 2012,13(12):16472-16488.
The Effect of Benzimidazole Derivative BMT-1 on the Proliferation and Apoptosis of Jurkat Cells
Fan Miao1, Sun Hai1, Tang Xinwei1, Zhao Bobo1, Ouyang Hanmei1, Zou Qiang2△.
1. School of Basic Medical Sciences, Chengdu Medical College, Chengdu 610500, China; 2. Center for Scientific Research,Chengdu Medical College, Chengdu 610500, China
Objective To explore the effect of benzimidazole derivative BMT-1 on the proliferation and apoptosis of Jurkat cells. Methods CCK-8 was used to detect the effect of BMT-1 on the proliferation of Jurkat cells, and the flow cytometer was adopted to measure the effect of BMT-1 on the cell cycle, cell apoptosis and mitochondrial membrane potential of Jurkat cells. Results BMT-1 strongly inhibited the growth of Jurkat cell with a GI50 value of 1.08 μmol/L in dose-dependent manner. It induced the enhancement of SubG1 phase of Jurkat cells, elevated the proportion of apoptosis, and changed the mitochondrial membrane potential of Jurkat cells greatly. Conclusion Benzimidazole derivative BMT-1 could significantly inhibit proliferation and induce apoptosis in Jurkat cells.
Benzimidazole derivative; Jurkat cell; Apoptosis
http://www.cnki.net/kcms/detail/51.1705.R.20161027.1704.052.html
10.3969/j.issn.1674-2257.2016.05.002
国家自然科学基金项目(No: 81273530)
R96
A
△通信作者:邹强,E-mail:qiangzou99@gmail.com
