精索静脉曲张对睾丸超微结构和精子形态影响的实验研究
2016-12-06张明贾晓鹏王晓波胡现斌于国强
张明 贾晓鹏 王晓波 胡现斌 于国强
·论著·
精索静脉曲张对睾丸超微结构和精子形态影响的实验研究
张明 贾晓鹏 王晓波 胡现斌 于国强
目的 揭示精索静脉曲张导致男性不育的机制。方法 将 SD(Sprayue-Dawley)三级雄性大鼠随机编号,双数为实验组即精索静脉曲张组,单数组为观察组,精索静脉曲张动物模型按Turner法制造。第12周将2组大鼠分别脱颈处死,摘取2组动物左侧睾丸后,以透射电镜观察睾丸的超微结构。摘取2组动物的附睾,并分离出其内精子。观察精子密度、活力及运动参数。在光学显微镜下观察精子的形态,计算精子畸形率。结果 实验组电镜观察与观察组相比较,支持细胞、间质细胞及精子细胞核明显变化(P<0.05)。实验组的结果与观察组比较,精子的运动指标:MAD、WPB、LIN、BCF值无明显的变化(P>0.05),其他观察指标比较差异有统计学意义(P<0.05)。结论 精索静脉曲张导致睾丸精原细胞核等超微结构的改变,对睾丸间质细胞、支持细胞造成创伤。精索静脉曲张可降低精子的运动能力,并使精子的畸形率明显增加。
精索静脉曲张;大鼠;动物模型;睾丸细胞;精子
在男性不育症的病因中,精索静脉曲张占第一位,因其影响男性的生育能力的问题越来越受到重视[1]。大量研究表明,精索静脉曲张的患者睾丸萎缩、精子产生量减少、性激素下降。但是精索静脉曲张导致男性不育的机制尚不明确[2]。本课题对雄性大鼠制造精索静脉曲张的动物模型,通过观察实验组大鼠的睾丸的病理变化以及精子形态和运动的异常,探讨精索静脉曲张导致男性不育的病机制。
1 材料与方法
1.1 动物分组及模型建立
1.1.1 选择动物和分组:选择饲养条件相同的健康SD(Sprayue-Dawley)三级(青春期)雄性大鼠共40只(河北医科大学实验动物中心提供),鼠龄40~60 d,体重240~280 g。将入组大鼠采用随机原则分组:实验组(精索静脉曲张组)20只,观察组(假手术组)20只。
1.1.2 制造动物模型:动物模型按Turner[3]的方法制造:①将所有入组大鼠麻醉。②制定实验组静脉曲张模型:固定大鼠在实验板上,纵切口,部位为上腹部左侧0.5 cm处,分离出肾脏、左肾静脉、左肾上腺静脉,在左肾上腺静脉和左肾静脉之间置于直径约0.8 mm注射器针头,将针头、左肾静脉用3-0的丝线在其交叉处结扎,拔出针头。③观察组(假手术组),分离左肾静脉,不结扎。其余步骤与实验组相同。④术后处理:避免感染,所有入组大鼠,给予青霉素剂量20万U,1次/d,腹腔注射,连用3 d。⑤判断动物模型是否成功:术后第12周,处死所有大鼠,实验组大鼠,左右两侧肾脏比较:重量、形态无明显差别,而左侧精索静脉明显扩张(直径>1 mm)表示成功。
1.2 标本采集、检测
1.2.1 睾丸电镜标本观察:①摘取入组大鼠的左侧睾丸,切取睾丸组织(约1 mm)。②按如下步骤制备切片:固定24 h(1%多聚甲醛及2%戊二醛混合液),漂洗12 h( pH值7.4的PBS液),再固定2 h(1%四氧化锇酸液),再漂洗(pH值7.4的PBS液),脱水(梯度乙醇),包埋(环氧树脂)、切片、染色(醋酸双氧铀及枸橼酸铅)。③用透射电子显微镜(HITACHI-H7500型)观察切片。
1.2.2 精液标本采集及检测方法:所有入组大鼠,分离出附睾尾部,,将尾部纵行切开3个切口,放入离心管内,加PBS液到2 ml,然后放入水浴箱(水温为37℃)内,精子自由游出, 约温浴20 min[4]。
1.2.2.1 观察精子运动的能力:采用计算机辅助精液分析仪(CASA)系统观察精子运动能力并分析数据参数。
1.2.2.2 观察精子的形态:将精子悬液固定,1%伊红染液染色[5]。用光镜观察精子的形态并作出形态学分析。
1.3 统计学分析 应用SPSS 13.0统计软件,正态分布的计量资料以±s表示,非正态分布用中位数表示,均数比较用t检验,中位数比较用Wilcoxon 符号秩检验,P<0.05为差异有统计学意义。
2 结果
2.1 电镜观察超微结构的结果
2.1.1 支持细胞:观察组表现:细胞形态不规则或高锥体形或三角形,基部与基膜紧密相连,顶部向曲精小管腔面突出。核大呈椭圆形或三角形,不规则,顶部形成陷窝,核仁明显,胞质有丰富的滑面内质网,有发达的高尔基复合体,在侧面见到Sertoli-Sertoli细胞连接。实验组表现:基底膜水肿,基部与基膜分离,Sertoli-Sertoli连接断裂,细胞大片融合,细胞器明显胞质减少,细胞胞质内出现大的空泡。见图1、2。

图1 假手术组精索静脉曲张大鼠睾丸组织支持细胞电镜观察结果(×15000)

图2 精索静脉曲张组精索静脉曲张大鼠睾丸组织支持细胞电镜观察结果(×15000)
2.1.2 间质细胞:①观察组表现:细胞形态不规则,表面有大量细长的微绒毛,胞质呈嗜酸性,线粒体多,呈管嵴状,富含滑面内质网,细胞核较大,呈圆形或卵圆形,胞质内无颗粒。②实验组表现:细胞表面的微绒毛明显减少,细胞器明显减少,胞质内有大量溶酶体颗粒。大量细胞凋亡。见图3、4。

图3 假手术组精索静脉曲张大鼠睾丸组织间质细胞电镜观察结果(×20000)>

图4 精索静脉曲张组精索静脉曲张大鼠睾丸组织间质细胞电镜观察结果(×20000)
2.1.3 实验组精子细胞表现为:精子细胞头部无顶体,核畸形,核膜消失,染色质浓缩成块状。见图5。
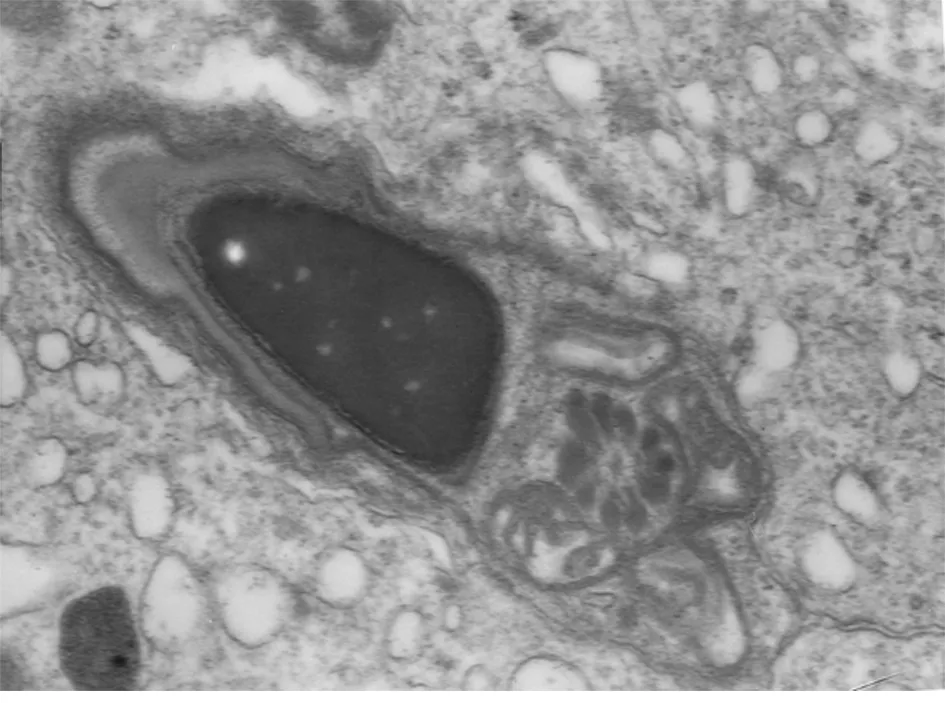
图5 精索静脉曲张组精索静脉曲张大鼠睾丸组织精子细胞电镜观察结果(×20 000)
2.2 精液分析的结果 实验组与观察组相比,MAD、LIN、BC、WOB四个参数值无明显变化,MOT、STR两个参数值明显降低(P<0.05);精子密度、精子活率、a、b级快速前向运动、VAP、VSL、VCL、ALH的值明显降低(P<0.01);精子细胞的畸形率显著增加(P<0.01)。见表1。
表1 2组CASA系统的精液分析结果 n=20,±s

表1 2组CASA系统的精液分析结果 n=20,±s
注:与观察组比较,*P<0.05,#P<0.01
项目观察组实验组精子密度(106/ml)260.19±159.82100.76±86.43#MOT(%)4.38±7.9444.63±16.54*直线运动精子密度(106/ml)48.35±28.9616.72±9.23#直线运动精子活率(%)19.70±11.0611.08±6.80#VAP(μm/ml)20.76±6.5414.94±5.08#a(%)23.88±7.9015.20±7.73#b(%)9.74±4.816.21±2.68#VCL(μm/ml)42.74±15.6721.21±13.10#VSL(μm/ml)12.74±5.207.33±3.30#BCF(Hz)7.17±1.267.26±1.62MAD(°/s)266.21±37.92266.00±40.04LIN%24.78±8.9621.35±9.53STR%56.09±7.4750.2±7.11*WOB%40.96±12.0639.08±12.10ALH(μm/ml)1.14±0.450.65±0.42#精子畸形率(%)22.88±3.7355.33±1.04#
3 讨论
随着社会发展,男性不育越来越受到关注。在男性不孕的众多病因中,精索静脉曲张位居首位,病例中占 19%~41%[6]。但精索静脉曲张导致不育的机制尚不清楚。
睾丸支持细胞被认为是一种极性细胞,具有旺盛的分泌功能,主要分泌雄激素结合蛋白、激素类(如抑制素和激动素)等物质,并具有营养和吞噬功能。睾丸间质细胞可合成、分泌雄激素-睾酮。睾酮对生精过程具有维持效应[7]。孟庆杰等[8]指出受精能力与精子的顶体形态结构密切相关,精子的顶体形态结构可作为评价男性生育能力的指标。顶体消失或顶体畸形,使得精子的活动率明显下降,精子与卵子结合受阻,影响受精,导致不育。
精子密度也是影响男性生育能力的指标。本研究证明,精索静脉曲张的大鼠,精子密度、精子活率明显下降(P<0.05)。精索静脉曲张使得精子成熟障碍,主要是精索静脉曲张启动了免疫系统,产生大量的抗精子抗体,使得精子成熟障碍[9],从而影响男性的生育能力。
通常采用精子的密度、活力、运动方式参数对精子运动能力进行测定[10]。精子与卵子相遇前,精子在子宫和输卵管处获能后,精子运动方式发生剧烈而活跃的运动才能在女性输卵管内穿行,与等待的卵子结合完成受精。本研究表明,实验组精子活力参数VCL、VSL、VAP明显降低 (P<0.01)。而BCF、MAD值两组之间无显著变化(P>0.05)。精子运动方式参数实验组与观察组相比,运动方式参数LIN、WOB之间差异无统计学意义(P>0.05),而ALH、STR之间存在差异(ALH:P<0.01;STR:P<0.05),但参数STR两组之间差异无统计学意义(P=0.046)。此结果有待进一步验证其准确性。也就是精索静脉曲张使得精子运动能力下降,精子无法于输卵管穿行,完成受精,影响了男性的生殖能力。
Liu等[11]研究指出形态正常的精子才能与透明带紧密结合,并穿过透明带,完成受精过程。本研究表明,精索静脉曲张使精子畸形率明显升高 (P<0.01),导致男性不育。
综上所述,本实验解释了精索静脉曲张的大鼠模型,睾丸细胞的超微结构(包括支持细胞、间质细胞)、精子的形态异常导致精子的运动、活度等方面异常,导致受精不能完成,引起不育。这为临床上精索静脉曲张的男性不育患者,临床治疗提供了可靠的依据。
1 麦芒,何学军,王鲁华,等.精索静脉曲张患者精索静脉血与外周血性激素含量对照分析.放射免疫学杂志,2003,16:74-76.
2 郭应禄,李宏军主编.男性不育症.第1版.北京:人民军医出版社,2003.278-283.
3 Turner TT.The study of varicocele through the use of animal models.Hum Reproduction Update,2001,7:78-84.
4 蒲育栋,王坤,党瑜慧,等.芹菜汁对小鼠精液参数及毒性作用的影响.中国计划生育学杂志,2008,3:156-158.
5 范瑞泉,魏青,丘钦英,等.小鼠精子畸形试验改良法与传统法效果比较.华南预防医学,2004,30:51-52.
6 Lui WY,Mruk D,Lee WM,et al.Sertoli cell tight junction dynamics: their regulation during spermatogenesis.Biol Reprod.,2003,68:1087-1097.
7 姚泰主编.生理学.第7版.北京:人民卫生出版社,2001.503-504.
8 孟庆杰,邹成安,周玉霞,等.正常男性与不育男性的精子运动参数CASA分析.中国男科学杂志,2002,16:125-126.
9 Green S,Fishel S.Morphology comparison of individually selected hyperactivated and nonhyperactivated human spermatozoa.Hum Reprod,1999,14:123-130.
10 Bozheddomov VA,Teodorovich OV.Epidemiology and causes of auto immune male infertility.Urologiia,2005,1:35-44.
11 Liu de Y,Baker HW.Frequency of defectives permzona pellucida interaction in severely teratozoo spermic infertile men.Hum Reprod,2003,18:802-807.
10.3969/j.issn.1002-7386.2016.22.030
项目来源:河北省医学科学研究重点课题计划(编号:2012-A09)
063000 河北省唐山市,华北理工大学附属医院急诊科(张明),呼吸内科(王晓波);河北医科大学第三医院泌尿外科(贾晓鹏);河北省武安市第一人民医院泌尿外科(胡现斌);河北省玉田县医院外一科(于国强)
贾晓鹏,050051 石家庄市,河北医科大学第三医院泌尿外科;
E-mail:41110571@qq.com
R 195
A
1002-7386(2016)22-3466-03
2016-05-23)
