体外培养的乳鼠皮层神经元氧糖剥夺后轴突损伤的实验观察
2016-12-06田青叶文华陶玉倩
田青 叶文华 陶玉倩
·基础研究论著·
体外培养的乳鼠皮层神经元氧糖剥夺后轴突损伤的实验观察
田青 叶文华 陶玉倩
目的 建立乳鼠皮层神经元体外培养模型,观察氧糖剥夺处理对神经元轴突损伤的影响。方法 取出生24 h内的SD大鼠大脑皮层神经元,采用逐渐降低培养液中血清浓度和添加阿糖胞苷的方法培养、纯化神经元,观察其形态并鉴定。建立氧糖剥夺模型,随机分为正常对照组和氧糖剥夺处理组(2、4、6、8 h各1组)。采用噻唑蓝比色法测定神经元活性,βⅢ-tubulin 免疫荧光染色观察轴突形态学变化。结果 神经元培养3~5 d后,胞体变得饱满并分出轴突和树突,突起之间逐渐交织成密集网络,神经元微管相关蛋白-2(MAP-2)标记阳性率>95%。与正常对照组相比,随着氧糖剥夺时间的延长,轴突网络逐渐损伤、崩解,同时神经元活性呈梯度下降(P<0.01)。结论 该研究成功建立了神经元体外原代培养及氧糖剥夺模型,并观察到在氧糖剥夺处理过程中神经元的轴突损伤及同时出现的神经元活性下降。
新生乳鼠;大脑皮层神经元;氧糖剥夺;轴突损伤
缺血性脑卒中发生后,由于胞内钙超载,继发瀑布样的损伤反应,导致神经细胞坏死和凋亡[1]。目前,在缺血性脑卒中中,对于神经细胞死亡的病理生理机制已有大量实验研究证实并阐述,但却很少关注神经元轴突损伤在其中起到的作用。已有研究表明,轴突损伤可能是一个早期诱发神经元死亡的重要因素[2]。然而,在缺血性脑卒中急性病理生理过程中,有关实验观察少见报道。本次研究拟建立体外培养的乳鼠皮层神经元模型,观察氧糖剥夺处理对神经元轴突损伤和细胞活性的影响。
材料与方法
一、主要试剂、仪器和实验动物
牛血清白蛋白(BSA)、Hochest33258、脱氧核糖核酸酶I (DNaseI)(美国Sigma公司);Neurobasal培养基、B27(美国Invitrogen公司);小鼠抗大鼠MAP-2抗体(美国Programma公司);倒置显微镜和荧光显微镜(Olympus公司)。实验动物为新生24 h内的SD大鼠,雌雄不限(中山大学医学院实验动物中心)。
二、主要溶液配制
种植培养液: 98 ml Neurobasal培养基,2 ml B27, 1 ml BSA。维持培养液: 98 ml Neurobasal培养基,2 ml B27。缺氧液:KCl 0.224 g,NaCl 9.116 g,MgSO40.492 g,CaCl20.221 g, KH2PO40.17 g,HEPES 2.383 g,超纯水定容至1 L,调节pH至7.35。
三、神经元取材、培养、纯化
选取2只乳鼠,取大脑皮层,剪碎后收集组织碎片,消化后反复吹散、离心;用37℃预热的种植培养液重悬细胞,吹散为单细胞悬液,接种于培养皿/板中,置于培养箱中培养。24 h后加入阿糖胞苷(浓度10 μmol/L)抑制胶质细胞生长,3 d后用维持培养液半量换液,以后每间隔3~4 d半量换液1次。
四、神经元氧糖剥夺 模型的建立
选取生长良好、分布均匀的神经元,吸弃原有培养液,加入缺氧液轻漂洗1~2次,后换入缺氧液(100 μl/96孔培养板,1 ml/35 mm培养皿),然后将其置入密闭盒中,向盒中持续缓慢通入体积分数为5%CO2和95%N2气体30 min,以置换盒内氧气;将通气后的密闭盒完全密闭后,置入37℃培养箱中继续培养,达到所需缺氧时间后进行相应的实验观察。
五、神经元形态观察及免疫荧光染色鉴定
神经元种植于培养皿后,连续在普通倒置显微镜下对其进行形态学观察。培养至5~6 d,应用神经元标记物MAP-2进行免疫荧光染色,同时用Hoechst33258标记细胞核。具体方法参考文献[3],其中一抗为小鼠抗大鼠MAP-2,荧光二抗为FITC偶联的羊抗小鼠。荧光显微镜下观察、拍照,随机选择10个视野, 取平均值,计算:MAP-2标记阳性率(%)= MAP-2染色阳性细胞数/Hoechst33258标记的细胞数×100%。
六、氧糖剥夺处理致神经元轴突损伤的观察
神经元接种于培养皿中,培养5~6 d后,随机分为5组,其中1组为正常对照组,另外4组分别进行氧糖剥夺处理2、4、6、8 h。氧糖剥夺处理相应时间后,进行轴突标记物βⅢ-tubulin免疫荧光染色,并用Hoechst33258标记细胞核(方法同前),其中一抗为兔抗大鼠βⅢ-tubulin,荧光二抗为Cy3偶联的羊抗兔。
七、细胞活性检测
使用96孔培养板,将神经元随机分为正常对照组和氧糖剥夺处理组(分别处理2、4、6和8 h),每组设1个空白对照孔和6个平行复孔。避光状态下,每孔加入终浓度为5 mg/ml 的噻唑蓝 20 μl,37℃培养箱内放置4 h后,弃去上清,加入DMSO 100 μl,振荡溶解紫色结晶物,后用酶标仪检测吸光度值(D490 nm),计算细胞存活率(%)=D处理组/D正常组×100%。实验结果均经重复实验3次。
八、统计学处理
结 果
一、神经元形态观察及鉴定
1. 神经元总体形态观察
神经元种植于培养皿,24 h后已完全贴壁,可见有细小突起开始从胞体爬出,并逐渐向外周延伸。培养3 d后,胞体变得饱满、立体,折光性强,多呈圆形、椭圆形或梭形;从胞体分出1~2条相对较粗、长的轴突和若干条细、短树突,突起之间开始彼此联接。培养5 d后,胞体更加饱满,突起之间逐渐交织成密集网络(图1)。
2.神经元生长锥形态观察
神经元种植于培养皿,24 h后可观察到神经元突起开始从胞体爬出,并逐渐向外周延伸,在突起的末端可见呈扇形膨大的生长锥(图2,箭头示)。
图1 新生SD大鼠大脑皮层神经元(6 d,×200)

图2 新生SD大鼠大脑皮层神经元生长锥(24 h, ×200)
3.神经元经阿糖胞苷纯化后MAP-2免疫荧光鉴定
神经元经阿糖胞苷纯化后,用神经元标记物MAP-2进行免疫荧光染色,同时Hoechst33258标记细胞核。可见神经元胞体、突起MAP-2染色阳性,胞核则被Hoechst33258标记为蓝色(图3)。计算得:神经元MAP-2标记阳性率(%)>95%,神经元纯度符合要求,可用于后续实验。

图3 纯化后神经元MAP-2免疫荧光染色(×200)
二、氧糖剥夺处理对神经元轴突及活性的影响
1. 氧糖剥夺处理后导致神经元轴突损伤
正常情况下,神经元培养到5~6 d,可观察到饱满的胞体,胞核大,轴突平滑、粗壮(图4D),逐渐交织成为紧密而复杂的神经轴突网络(图4A)。而经氧糖剥夺处理4 h后,神经元胞体皱缩变形,胞核固缩,轴突变得纤细、粗糙,呈断续串珠样(图4E),神经元之间仍有联系,但神经轴突网络开始崩解(图4B)。氧糖剥夺处理8 h后,神经元胞体、胞核及轴突(图4F)已消失,只残留部分碎片,轴突网络也完全崩解为颗粒样碎片,细胞之间失去网络联系(图4C)。
2. 氧糖剥夺处理后导致神经元活性下降
与正常对照组相比,氧糖剥夺处理2 h后,细胞活性即出现明显下降,其细胞存活率降至70%;随时间延长,细胞存活率也逐步下降;氧糖剥夺处理8 h后,细胞活性降至最低值14%(多组间D490nm比较,χ2值为27.87,P<0.05;存活率比较,χ2值为28.09,P<0.05,见表1。


组 别D490nm存活率(%)正常对照组0.89±0.03100.00±0.00氧糖剥夺2h0.63±0.0170.12±2.20氧糖剥夺4h0.45±0.0150.33±2.01氧糖剥夺6h0.28±0.0231.62±2.88氧糖剥夺8h0.12±0.0514.04±5.70
讨 论
目前,国内外皮层神经元原代培养材料来源有两种:胎鼠和新生鼠。胎鼠来源的神经元处于分裂增殖阶段,分化程度低,神经元体外生存能力较强,易于成功培养。所以,国外研究中多采用胎鼠(多取自15~18 d胎龄)作为神经元的实验材料来源。但是,胎鼠脑体积小,不便取材,每次原代培养均需处死孕鼠,此种方法耗资较大,操作繁琐,且易造成鼠源的浪费。而以出生24 h新生鼠作为取材来源,其神经细胞虽已近分裂晚期,分化较高,但仍处于幼年阶段,适应性、可塑性仍较强,并且此法对孕鼠无伤害,可保证孕鼠和新生鼠的长期供应,既可满足实验需求,又具有操作性强的特点[4]。因此,本实验采用新生24 h内的大鼠作为取材对象,通过动态观察,可见神经元体外生长状态良好,与既往文献报道一致。
神经元发育和再生过程中,其突起末端膨大,呈扇形,最早由Cajal描述称为生长锥[5]。本实验中,原代皮层神经元种植于培养皿后24 h,在普通倒置相差显微镜光镜下即可观察到轴突末端的生长锥,其形态特点与文献报道吻合。生长锥位于所有突起活跃生长的尖端,轴突的延伸实际上是生长锥尖端前伸和回缩反应相竞争的结果,轴突的形状记录了生长锥的历史[6]。
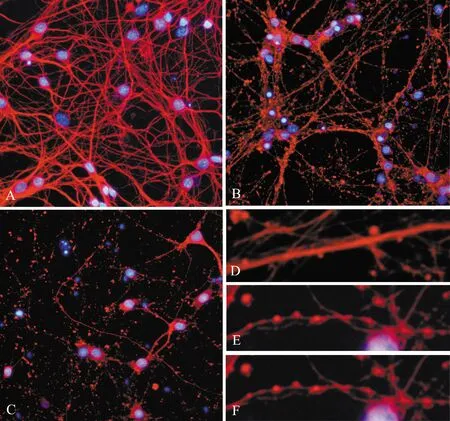
图4 氧糖剥夺处理致轴突损伤(βⅢ-tubulin/Hoechst33258 染色)(×200)
神经元培养液可采用有和无血清两种[7]。血清虽可为神经元生长提供丰富营养,但因其同时也为神经胶质细胞等杂质细胞等提供了生长条件,从而影响了神经元的纯度;而无血清培养液虽营养相对缺乏,但可防止杂质细胞过度增殖,从而提高了神经元纯度。并且,由于血清直接从动物血液内提取,含有很多不明成分,对实验结果可造成一些不可预测的影响,而无血清培养基成分清楚,有利于实验条件的稳定。因此,目前无血清培养法被多数研究者采用[4, 8]。神经元培养液配方:Neurobasal培养基和神经生长添加剂B27,已被国内外普遍认可并使用。而本研究取两者之长,通过逐渐降低培养液中的血清浓度来进行培养。在神经元种植入培养皿的第1日,使用含1% FBS的培养液,能够给神经细胞提供充足营养,保持细胞活性;然后,在后续的换液过程中,通过半量更换无血清的培养液,逐渐降低培养液中的血清浓度,选择性地促进神经元生长,抑制神经胶质细胞等的生长,使神经元得以纯化。另外,在培养1 d后,加入有丝分裂抑制剂阿糖胞苷进一步纯化;利用MAP-2这一特异性分布于神经元胞浆和突起中的细胞骨架蛋白作为标记物,进行免疫荧光染色鉴定,结果显示神经元纯度达95%以上,能够满足后续实验要求。
缺血缺氧性脑损伤是缺血性脑卒中的基础病理过程,有关动物模型和细胞模型国内外报道较多,造模方法也不尽相同[9-10]。考虑到本研究的研究目的和实验条件的可操作性,我们选择了神经元的氧糖剥夺模型,它是在体外细胞水平下充分模拟缺血性脑血管病病理过程的经典模型[11]。本研究应用不含糖的缺氧液,完全替换原细胞培养液,使得神经元处于一个酸碱平衡但能量、营养供给完全缺失的状态;同时将神经元置入已充填95%N2和5%CO2的密闭容器中,以达到剥夺神经元供氧的目的。结果显示氧糖剥夺处理2 h,即可观察到神经元活性的明显下降;并且随着缺氧时间延长,神经元活性逐渐下降;氧糖剥夺处理8 h及以上时间,神经元活性降至最低值;神经元存活率与缺氧时间有良好的负性梯度。此氧糖剥夺模型能够较好地模拟体内神经元缺血缺氧性损伤,具有易操作、易控制、重复性好的特点。
脑梗死发生后,神经元死亡的初始引发机制还有很多未知,而轴突损伤对于整个神经元死亡来说可能是一个早期引发因素。本研究应用氧糖剥夺处理体外培养的神经元以模拟脑梗死后的急性期,以轴突标记物βⅢ-tubulin荧光染色法和噻唑蓝法,分别在不同时间梯度观察了氧糖剥夺处理对神经元轴突形态学及活性的影响。随着氧糖剥夺时间的延长,轴突网络逐渐支离崩解,细胞存活率也逐步下降;氧糖剥夺处理8 h,轴突网络已基本完全消失,此时细胞活性也降至最低值。以上结果表明氧糖剥夺处理可诱导神经元轴突网络的损伤、崩解,并同时导致神经元活性下降。
神经元轴突损伤后,轴突本身会发生一系列变性反应,其中华勒变性是一种经典类型。损伤后,华勒变性发生迅速,轴突骨架结构如微管、神经微丝等去组装并呈现无序性地颗粒聚集,同时髓鞘发生肿胀、收缩、断裂,最后崩解为脂质颗粒[12]。上述文献报道与本研究神经元氧糖剥夺处理后观察到的形态学变化相符,表明体外培养的神经元遭受缺氧缺糖性损伤后,轴突可发生类似于华勒变性的崩解变性反应。
除了轴突本身变性反应,轴突受损的神经元胞体也会因此发生一系列反应,称为“逆向性反应”或“胞体反应”[13]。本研究观察到,氧糖剥夺处理神经元可诱发轴突损伤,同时细胞活性下降,结合文献报道,可以推测在神经元氧糖剥夺的病理机制中,轴突损伤有可能通过逆向性胞体反应诱发神经元死亡。然而,对于胞体反应的起始机制尚不清楚。由于轴突断裂而丧失靶源性营养因子、逆行性损伤电流反应如高钙内流等被认为是轴突损伤诱发胞体死亡的部分因素[13-14]。在缺血性脑损伤急性期,在病理性细胞凋亡的过程中,轴突损伤可在早期发生,继而由于轴浆运输的破坏、细胞间相互营养支持的减少等诱发细胞死亡。
本研究成功建立了神经元体外原代培养及氧糖剥夺模型,并观察到在神经元氧糖剥夺处理过程中的轴突损伤及同时出现的神经元活性下降,而有关轴突及轴突网络损伤的分子生物学机制,则需要进一步的研究来探讨。
[1]Puyal J, Ginet V, Clarke PG. Multiple interacting cell death mechanisms in the mediation of excitotoxicity and ischemic brain damage: a challenge for neuroprotection. Prog Neurobiol,2013,105:24-48.
[2]Raff MC, Whitmore AV, Finn JT. Axonal self-destruction and neurodegeneration. Science,2002,296(5569):868-871.
[3]张仁坤,李晓红,陈星,陈彦婷,涂悦,张赛. 胚胎SD大鼠神经干细胞原代培养及分化鉴定的实验研究. 武警后勤学院学报(医学版),2016,25(5):337-340.
[4]Kivell BM, McDonald FJ, Miller JH. Serum-free culture of rat post-natal and fetal brainstem neurons. Brain Res Dev Brain Res,2000,120(2):199-210.
[5]Meldolesi J. Neurite outgrowth: this process, first discovered by Santiago Ramon y Cajal, is sustained by the exocytosis of two distinct types of vesicles. Brain Res Rev,2011,66(1-2):246-255.
[6]Lowery LA, Van Vactor D. The trip of the tip: understanding the growth cone machinery. Nat Rev Mol Cell Biol,2009,10(5):332-343.
[7]田凤艳,宁琴,罗小平. 大鼠原代皮质神经元无血清培养的影响因素及优化培养方法. 中华实用儿科临床杂志,2010,25(14):1094-1097.
[8]Roth S, Zhang S, Chiu J, Wirth EK, Schweizer U. Development of a serum-free supplement for primary neuron culture reveals the interplay of selenium and vitamin E in neuronal survival. J Trace Elem Med Biol,2010,24(2):130-137.
[9]周立兵,李新钢. 左卡尼汀对老年大鼠脑缺血再灌注损伤HMGB1表达的影响. 新医学,2015,46(8):503-506.
[10]郭慧,俞丹,周晖,童煜,陶于洪. 新生大鼠海马神经元体外氧-糖剥夺再灌注模型的建立. 中华妇幼临床医学杂志(电子版),2016,12(3):286-290.
[11]Albrecht J, Hanganu IL, Heck N, Luhmann HJ. Oxygen and glucose deprivation induces major dysfunction in the somatosensory cortex of the newborn rat. Eur J Neurosci,2005,22(9):2295-2305.
[12]Coleman MP, Freeman MR. Wallerian degeneration, wld(s), and nmnat. Annu Rev Neurosci,2010,33:245-267.
[13]Ben-Yaakov K, Fainzilber M. Retrograde injury signaling in lesioned axons. Results Probl Cell Differ,2009,48:327-338.
[14]Pacheco S, Marcet-Ortega M, Lange J, Jasin M, Keeney S, Roig I. The ATM signaling cascade promotes recombination-dependent pachytene arrest in mouse spermatocytes. PLoS Genet,2015,11(3):e1005017.
(本文编辑:杨江瑜)
Experimental observation of OGD-induced axonal injury in neonatal rat models with primary cultured cortical neurons
TianQing,YeWenhua,TaoYuqian.
DepartmentofNeurology,theThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China
,TaoYuqian,E-mail:taoyuqiansums@163.com
Objective The neonate rat models with primary cultured cortical neurons were established. The impact of oxygen and glucose deprivation (OGD) treatment on neuronal axonal injury was observed. Methods Cerebral cortical neurons of neonatal Sprague-Dawley (SD) rats aged < 24 h were obtained. The neurons were cultured and purified by gradual reduction of serum concentration and supplement of cytarabine (Ara-c) into the culture medium. The neuronal morphology and identification were carried out. OGD models were established. Cultured cortical neurons were randomly divided into control and OGD treatment groups(2,4,6,8 h group). Neuronal activity was determined by methylthiazolyldiphenyl-tetrazolium-bromide (MTT) assay. Morphological changes of the axon were observed with βⅢ-tubulin immunofluorescence staining. Results After 3-5 d culture, the neuron cell body became plump presenting with axons and dendrites, which gradually constructed a dense network. The positive rate of microtubule associated protein 2 (MAP-2) was >95%. Compared with the control group, the axonal network was gradually damaged and disrupted along with the prolonged OGD treatment. Meantime, the neuronal activity was decreased in a gradient manner (P<0.01). Conclusion In this study, OGD-treated neonate rat models with primary cultured cortical neurons were established. Neuronal axonal injury accompanied with decreased neuronal activity was observed after OGD treatment.
Neonatal rat; Cerebral cortical neuron; Oxygen and glucose deprivation; Axon injury
10.3969/j.issn.0253-9802.2016.11.003
510630 广州,中山大学附属第三医院神经内科(田青);528200 佛山,佛山市南海区人民医院ICU(叶文华);510080 广州,中山大学附属第一医院神经科(陶玉倩)
,陶玉倩,E-mail: taoyuqiansums@163.com
2016-08-06)
