金黄色葡萄球菌的临床分布及耐药性分析
2016-12-06李思怡徐恩洁
李思怡, 徐恩洁, 张 丽
(新疆医科大学第一附属医院医学检验中心, 乌鲁木齐 830054)
金黄色葡萄球菌的临床分布及耐药性分析
李思怡, 徐恩洁, 张 丽
(新疆医科大学第一附属医院医学检验中心, 乌鲁木齐 830054)
目的 分析金黄色葡萄球菌在临床感染的分布特点及耐药性,为临床合理选择抗菌药物提供理论参考。 方法 采用 VITEK-2Compact全自动细菌鉴定仪进行菌种鉴定,对新疆医科大学第一附属医院2013年5月-2015年5月210株临床标本分离的金黄色葡萄球菌的分布进行回顾性分析,细菌药敏试验采用K-B纸片扩散法,PCR法检测耐药基因分布情况,耐甲氧西林金葡菌(MRSA)耐药性测定选择头孢西丁法。结果 2013年5月-2015年5月临床分离210株金黄色葡萄球菌中115株mecA 基因阳性,即为MRSA,阳性率为54.76%,其余95株为甲氧西林敏感金葡菌(MSSA)。MRSA的分离率较高且对常用抗菌药物多有较高的耐药率。MRSA对氨苄西林、克林霉素和美罗培南3种药物的耐药率均为100.00%,MSSA对美罗培南耐药率为100.00%,药敏试验未检出万古霉素和替考拉宁对MRSA及MSSA耐药株。MRSA耐药率高于MSSA,差异有统计学意义(P<0.05)。 结论 病人感染金黄色葡萄球菌的耐药严重,临床治疗应进行细菌学培养与药敏试验结果合理选择临床用物,并进一步加强对MRSA耐药性的检测。
金黄色葡萄球菌; 临床分布; 耐药分析
金黄色葡萄球菌是一种革兰染色阳性球菌,在自然界广泛分布,是临床常见的致病菌之一,其可产生多种侵袭性酶和毒素等毒力因子,引起皮肤表面软组织感染、菌血症、败血症和侵入导管性感染等多种病变,不及时治疗严重者可导致死亡的发生[1]。按细菌菌株耐药性基因的改变,金黄色葡萄球菌通常情况下多被分为耐甲氧西林金葡菌(methicillin-resistant S.aureus,MRSA)和甲氧西林敏感金葡菌(methicillin-susceptible S.au-reus,MSSA)两种,根本不同点在于前者基因染色体中含有一葡萄球菌盒式染色体基因(staphylococcal cassette chromosome mec,SCCmec)[2]。近年来随着临床广谱抗生素的广泛大量使用,耐MRSA感染率和分离率呈逐年增高趋势,致其对多种抗菌素的耐药性不断增强,对用药的选择带来较大困难,引起临床治疗时间延长,治疗效果降低[3]。本研究选取2013年5月-2015年5月新疆医科大学第一附属医院收治的2 260例患者,对其临床送检标本的病原菌进行分析,旨在进一步明确特定基因区域的金黄色葡萄球菌的主要流行克隆,阻断其感染途径,减少耐药菌株在患者中传播,以控制金黄色葡萄球菌传播流行。
1 材料与方法
1.1 标本采集 选取2013年5月-2015年5月新疆医科大学第一附属医院收治的住院时间>48 h 的患者2 260例,其中男性1 238例,女性1 020例,年龄8~72岁,平均年龄50岁。患者的送检标本包括血液、尿液、脓液、分泌物、深部痰液、胸腹水及各种引流液等,对以上送检标本经培养后检出的病原菌(同一患者的重复菌株均剔除)[4]进行分析。
1.2 试剂和仪器 金黄色葡萄球菌DNA提取试剂盒购自美国Promega公司,Taq酶和dNTP等限制性核酸内切酶购自英国OXOID公司,载体和连接酶购自德国QIAGEN公司;MH琼脂购自宝生物公司,革兰阳性菌鉴定卡和细菌自动鉴定仪购自美国Merek公司。Bio-Radicycler 荧光定量PCR系统购于美国Bio公司,蛋白酶K为法国梅里埃公司产品,电泳仪DYY-8C型双稳定时电泳仪电源购自上海博金有限公司。
1.3 诊断标准 根据中华人民共和国国家卫生和计划委员会制定的《医院感染诊断标准》[5]确定是否为医院感染。
1.4 抗生素 氨苄西林、苯唑西林、青霉素、头孢唑肟、头孢吡肟、头孢唑林、复方新诺明、万古霉素、左氧氟沙星、莫西沙星、克林霉素、美罗培南、利福平、诺氟沙星、替考拉宁均为华北制药厂产品。
1.5 方法
1.5.1 菌株分离鉴定 依照《全国临床检验操作规程》标准[6]进行临床标本采集、分离细菌鉴定和细菌培养纯化,革兰染色,筛选MRSA和MSSA,利用头孢西丁纸片法。质控阳性菌株为ATCC 43300,阴性质控菌株为ATCC 25923。
1.5.2 药敏试验 金黄色葡萄球菌药敏试验采用K-B纸片法。配成菌液麦氏比浊浓度为0.55;菌液涂布 MH 培养基3次,旋转50℃/次。琼脂吸收平板上的水分,贴纸片离皿边缘不低于16 mm,纸片间距 25 mm。反转平板,于37℃孵育过夜,测量并记录抑菌圈直径大小,观察结果为头孢西丁抑菌圈直径>22 mm ;MRSA观察结果为头孢西丁抑菌圈直径<20.5 mm。
1.5.3 金黄色葡萄球菌耐药基因检测1.5.3.1 金黄色葡萄球菌DNA模板制备 DNA模板制备利用裂解煮沸法。无菌接种环挑取过夜菌单菌落,置含55 U/mL Lysostaphin 的TE缓冲液中,混匀,置36.5℃中水浴,后100℃煮沸,以12 000 r/min(离心半径8.7 cm)离心8 min,上清即为 金黄色葡萄球菌DNA,置-20℃保存。
1.5.3.2 耐药基因检测 参照文献[7]设计引物。上游引物:5′-AGAGTAGCACTCGAATTAGGCAGT-3′,下游引物:5′-AGTTCTGCAGTACCGGATTTGC-3′。由上海生物工程有限公司公司合成。PCR反应体系(20 μL):DNA模板2 μL,上、下游引物各1 μL,10×PCR缓冲液2 μL,Taq酶1 μL,10 mmol/L dNTP混合液2 μL,镁离子2 μL,无菌ddH2O(重蒸水)补足20 μL。反应条件:96℃预变性5 min;96℃变性30 s,55℃退火32 s,75℃延伸40 s,共30个循环;75℃延伸5 min。PCR扩增产物与溴酚蓝指示剂混合后采用1.0%琼脂糖凝胶电泳28 min(电压1 200 V),采用凝胶成像仪进行观察结果并拍照记录结果。
2 结 果
2.1 金黄色葡萄球菌的临床标本分布情况 2013年5月-2015年5月从本院收治的住院2 260例患者的各种临床标本中共分离出病原菌1 358株,其中210株金黄色葡萄球菌,占15.46%;检出MRSA 115株,检出率54.76%;检出MSSA 95株,检出率45.24%。210 株金黄色葡萄球菌的临床标本来源主要分离自分泌物的分离率较高,为44.29%,其次为痰液、血液、中段尿、拭子、穿刺液、骨髓及大便,分别占分离株构成比的16.67%、10.95%、8.10%、6.19%、5.71%、4.29%和1.90%(表1)。
2.2 金黄色葡萄球菌的耐药性情况 MRSA对15种常用抗生素耐药率:氨苄西林、克林霉素和美罗培南均为100%,苯唑西林89.57%,青霉素87.83%,头孢唑肟和左氧氟沙星均为85.22%,头孢唑林80.00%,诺氟沙星68.57%,头孢吡肟56.22,复方新诺明54.78%,利福平53.91%,莫西沙星15.65%,未检出万古霉素和替考拉宁耐药株。MSSA对抗生素耐药率:美罗培南为100%,克林霉素89.47%,复方新诺明73.68%,青霉素68.42%,头孢唑肟64.21%,头孢唑林63.16%,氨苄西林61.05%,左氧氟沙星58.95%,苯唑西林54.74%,利福平40.00%,头孢吡肟33.68%,诺氟沙星26.32%,莫西沙星17.89%,未检出万古霉素和替考拉宁耐药株(表2)。
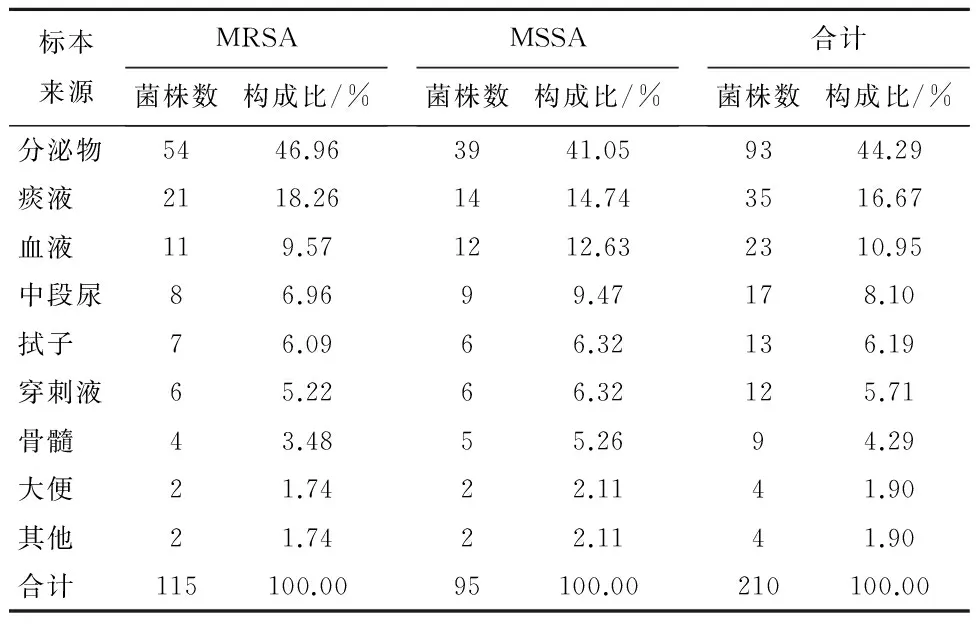
表1 210株金黄色葡萄球菌株分布情况
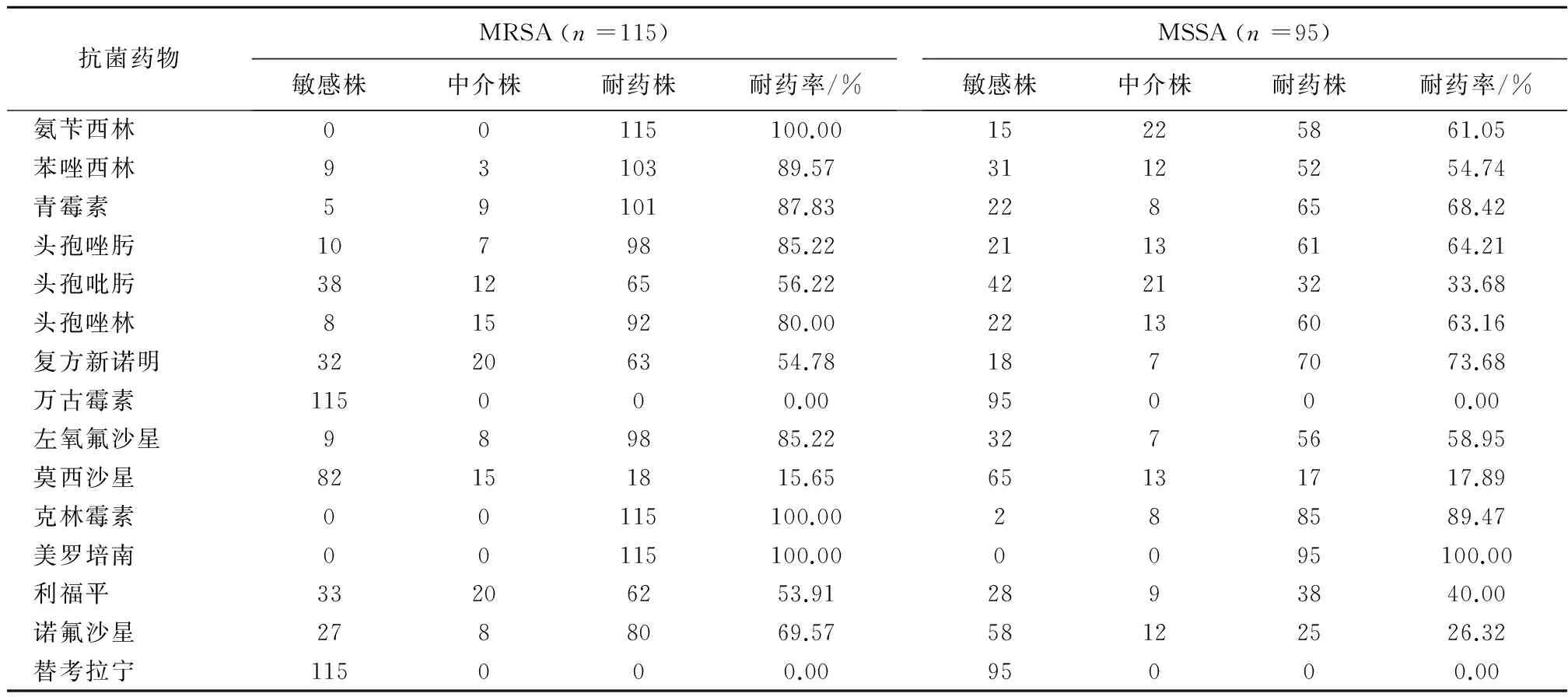
表2 金黄色葡萄球菌分离株耐药情况
2.3 耐药基因携带情况 PCR检测210株金黄色葡萄球菌115株mecA基因阳性(图1),即为MRSA,阳性率为54.76%,其余95株为MSSA。
3 讨论
金黄色葡萄球菌是临床最常见的革兰阳性球菌,自20 世纪 80 年代开始随着各类抗菌药物的临床广泛应用,MRSA因其具有较强的外界环境适应能力和定植能力,以及对抗生素的耐受能力,MRSA的分离率呈逐年增加趋势,成为临床感染的重要病原菌之一,给医师治疗带来困难和挑战[8]。
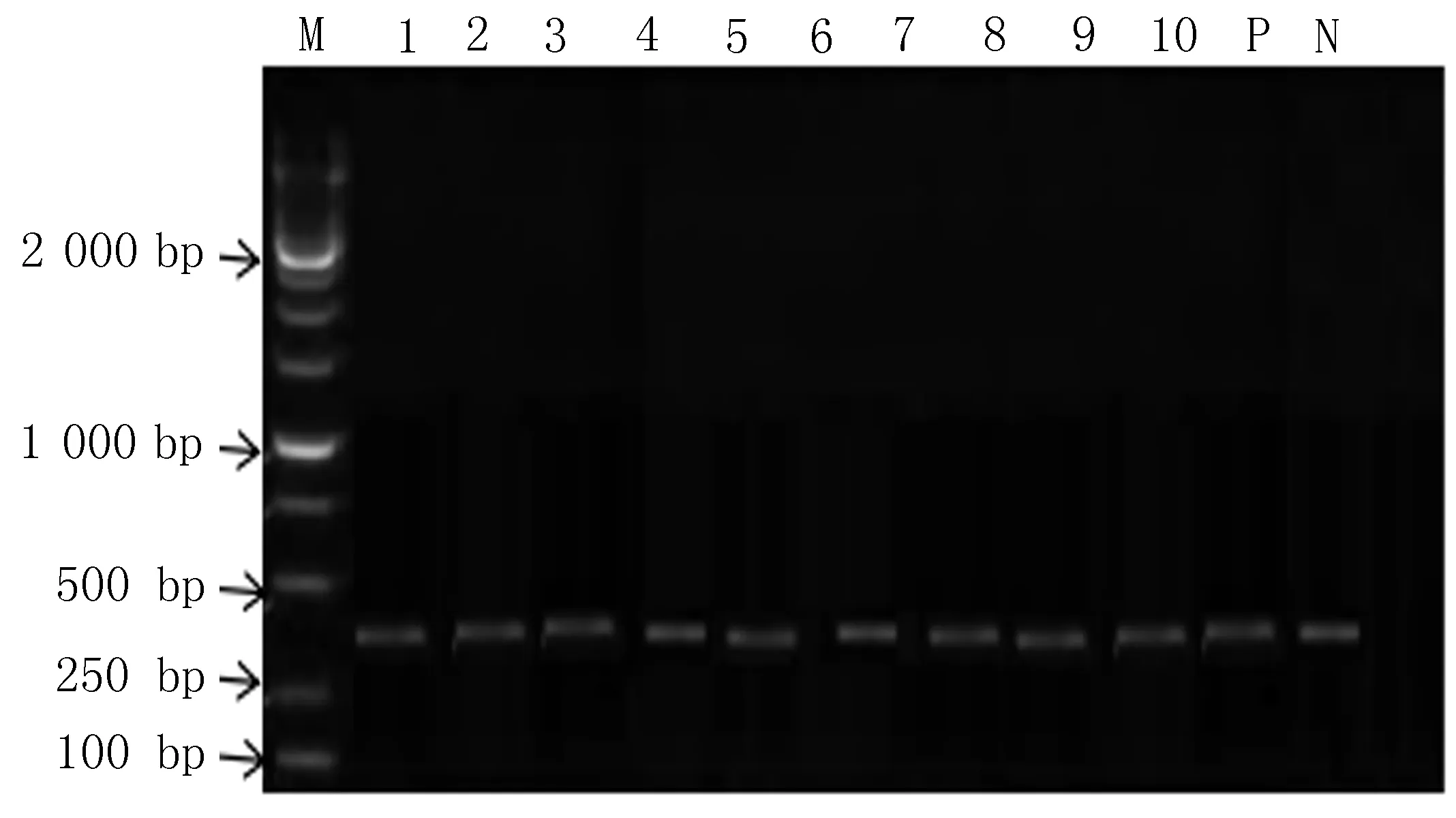
M: DNA分子标志物; 1~10: 金黄色葡萄球菌分离株; P: 阳性对照; N: 阴性对照
图1 金黄色葡萄球菌分离株mecA基因 PCR产物电泳图
2013年5月-2015年5月新疆医科大学第一附属医院检验科共分离出210 株金黄色葡萄球菌的临床标本来源主要分离自分泌物的分离率较高, 为44.29%,其次为痰液、血液、中段尿、拭子、穿刺液、骨髓及大便,分别占分离株构成比的16.67%、10.95%、8.10%、6.19%、5.71%、4.29%和1.90%。药敏试验显示, MRSA对15种常用抗生素耐药率:氨苄西林、克林霉素和美罗培南均为100%,苯唑西林89.57%,青霉素87.83%,头孢唑肟和左氧氟沙星均为85.22%,头孢唑林80.00%,诺氟沙星68.57%,头孢吡肟56.22,复方新诺明54.78%,利福平53.91%,莫西沙星15.65%,未检出万古霉素和替考拉宁耐药株。MSSA对抗生素耐药率:美罗培南为100%,克林霉素89.47%,复方新诺明73.68%,青霉素68.42%,头孢唑肟64.21%,头孢唑林63.16%,氨苄西林61.05%,左氧氟沙星58.95%,苯唑西林54.74%,利福平40.00%,头孢吡肟33.68%,诺氟沙星26.32%,莫西沙星17.89%,未检出万古霉素和替考拉宁耐药株。
药敏试验结果表明MRSA对青霉素类和头孢菌素类等β-内酰胺类药物耐药严重,且对喹诺酮类、大环内酯类、可林霉素类抗菌药物的耐药率也呈逐渐增高趋势。210株金黄色葡萄球菌,占15.46%(210/1 358);检出115株mecA 基因阳性,即为MRSA,检出率为54.76%,检出MSSA 95株,检出率为45.24%。mecA基因耐药多伴有其他耐药基因的发生,因此,建议临床金黄色葡萄球菌感染用药应结合药敏试验结果,合理用药,以防耐药及耐多药的出现。MRSA对氨苄西林、克林霉素和美罗培南均产生完全耐药菌株,与近年来抗菌药物的大量广泛不合理应用有关。金黄色葡萄球菌表面有能自身合成的青霉素蛋白(PBPs),参与细胞壁的内肽酶和转肽酶的合成等,催化糖肽的交叉反应,在细菌感染中起着至关重要的作用[9]。金黄色葡萄球菌可以合成5种PBPs,β-内酰胺类抗生素可与上述青霉素蛋白共价进行结合,导致细菌死亡[10]。PBP2a与头孢菌素类抗生素亲和力低,生理作用与PBPs相同,可合成细胞壁,其PBPs与β-内酰胺类抗生素结合以后,PBP2a可代替失活的PBPs,使细菌有正常的生理功能[11]。金黄色葡萄球菌基因MecA位于MRSA染色体内,编码的PBP2a基因导致头孢菌素β-内酰胺类发生耐药。靶位改变是金黄色葡萄球菌对大环内酯类抗生素的主要耐药机制之一[12]。大环内酯类抗生素可与50S核糖体上的23SrRNA发生结合,引起细菌失去活性[13]。
金黄色葡萄球菌感染已成为广泛关注的公共卫生问题之一。临床应结合细菌的分离培养鉴定,进行药敏试验以及MRSA 的检测,进一步区分MRSA与MSSA,对于目前出现的MRSA出现的耐药率较高问题,临床应进一步加强MRSA的菌株基因鉴定及耐药性监测分析,为合理选择使用抗菌药物提供理论参考,以减少或延缓金黄色葡萄球菌耐药性的产生。
[1] 李丽民, 吴先华, 徐礼锋. 金黄色葡萄球菌的临床分布及耐药性分析[J]. 中华医院感染学杂志, 2014, 24(4):787-789.
[2] 韩清. 2006~2010耐甲氧西林金黄色葡萄球菌的测定与耐药性变迁[J]. 中华医院感染学杂志, 2012,15(22):3365-3367.
[3] Stefani S,Chung DR,Lindsay J A,et al. Meticillin resistant Staphylococcus aureus (MRSA):global epidemiology and harmonisation of typing methods[J]. Int J Antimicrob Agents,2012, 39(4):273-282.
[4] 罗祥文, 汤小燕.金黄色葡萄球菌的临床分布及耐药性分析[J].临床肺科杂志,2012, 17(3):422-424.
[5] Cheng H, Yuan W, Zeng F, et al. Molecular and phenotypic evidence for the spread of three major methicillin-resistant Staphylococcus aureus clones associated with two characteristic antimicrobial resistance profiles in China[J]. J Antimicrob Chemother, 2013, 68(11):2453 -2457.
[6] Liu M, Liu J, Guo Y, et al. Characterization of virulence factors and genetic background of Staphylococcus aureus isolated from Peking University People’s Hospital between 2005 and 2009[J]. Curr Microbiol, 2010, 61(5):435-443.
[7] Lee S, Kwon KT, Kim HI, et al. Clinical implications of cefazolin inoculum effect and β-lactamase type on methicillin susceptible Staphylococcus aureus bacteremia[J]. Microb Drug Resist, 2014, 20(6):568-574.
[8] 张永扬, 张东军, 于涛. 重症病房金黄色葡萄球菌分布与耐药性分析[J]. 寄生虫病与感染性疾病,2014,12(3):125-128.
[9] Daniel A, Euler C, Collin M, et al.Synergism between a novel chim-eric lysin and oxacillin protects against infection by methicillin-re-sistant staphylococ-cus aureus[J]. Antimicrob Agents Chemother, 2010, 54(4):1603-1612.
[10] 许文, 杨联云. 耐甲氧西林金黄色葡萄球菌流行病学和耐药机制研究进展[J]. 检验医学与临床, 2013, 10(1):75-78.
[11] 杜中玉, 李琳, 李冰, 等. 金黄色葡萄球菌耐药性与生物被膜能力的鉴定[J].现代食品科技,2014, 30(3):69-75.
[12] Weisser M, Schoenfelder SM, Orasch C, et al. Hypervariability of biofilm formation and oxacillin resistance in a Staphylococcus epidermidis strain causing persistent severe infection in an immunocompromised patient[J]. J Clin Microbiol, 2010, 48(7):2407-2412.
[13] 李英. 儿科患者院内感染金黄色葡萄球菌耐药情况分析[J]. 中国病原生物学杂志, 2016, 11(1):82-86.
(本文编辑 张巧莲)
The analysis of clinical distribution and drug resistance of Staphylococcus aureus
LI Siyi, XU Enjie, ZHANG Li
(DepartmentofClinicalLaboratory,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830054,China)
Objective To analyze the distribution and drug resistance of Staphylococcus aureus in clinical infection, so as to provide theoretical reference for rational selection of antibiotics in clinical. Methods Strain identification was conducted by the Vitek-2 compact automatic bacteria identification instrument and distribution of 210 strains of clinical isolated staphylococcus aureus in the First Affiliated Hospital of Xinjiang Medical University from May 2013 to May 2015 were retrospectively analyzed. And K-B paper disk diffusion method was used for bacterial susceptibility test, PCR method was used to test the resistance gene distribution, and cephalosporin Xi Ding method was used for determination of resistance to methicillin resistant Staphylococcus aureus (MRSA). Results 115 strains of 210 strains of Staphylococcus aureus were MECA gene positive for MRSA, which the positive rate was 54.76% and the left of 95 strains were methicillin sensitive Staphylococcus strains (MSSA). Higher MRSA separating rate would lead to higher resistance rate for common antimicrobial drugs. The drug resistance rate of MRSA to ampicillin, clindamycin and meropenem all were 100.00%, and the drug resistance rate of MSSA to meropenem was 100.00%. The drug sensitivity test did not detected out of MRSA and MSSA strains resistant to vancomycin and teicoplanin. The MRSA resistance rate was higher than that of MSSA, which the difference was statistically significant (P<0.05). Conclusion The patients of the First Affiliated Hospital of Xinjiang Medical University from May 2013 to May 2015 had serious drug resistance of Staphylococcus aureus infection and clinical treatment should be conducted with bacterial culture and drug sensitivity test results are reasonable choice for clinical use, and need to further strengthen the detection of MRSA.
staphylococcus aureus; clinical distribution; drug resistance
新疆医科大学第一附属医院院内管理课题(2015GL18)
李思怡(1969-),女,主管技师,研究方向:为微生物学,E-mail:1907926997@qq.com。
R446.5
A
1009-5551(2016)12-1534-04
10.3969/j.issn.1009-5551.2016.12.013
2016-09-20]
