氧疗对慢性阻塞性肺疾病患者血尿酸水平的影响
2016-12-06柯媛媛伍增龙瞿珍清
柯媛媛 伍增龙 瞿珍清
广东省佛山市高明区人民医院心内科,广东佛山528500
氧疗对慢性阻塞性肺疾病患者血尿酸水平的影响
柯媛媛伍增龙瞿珍清
广东省佛山市高明区人民医院心内科,广东佛山528500
目的探讨慢性阻塞性肺疾病(COPD)患者血尿酸水平的变化及氧疗对COPD患者血尿酸水平的影响。方法收集2012年1月~2015年3月在佛山市高明区人民医院住院的COPD缓解期患者184例,根据肺功能分为Ⅰ级39例(1组)、Ⅱ级52例(2组)、Ⅲ级49例(3组)及Ⅳ级44例(4组),检测空腹血尿酸水平、动脉氧分压、二氧化碳分压,给予低流量(1~2 L/min)吸氧,每天至少吸氧12 h,1周后再次检测空腹血尿酸水平,比较各组患者氧疗前后血尿酸水平的变化。结果四组患者氧疗前随COPD级别加重,血尿酸水平逐渐升高,分别为(315.64± 26.50)、(406.22±99.61)、(523.76±155.47)、(597.05±192.53)μmol/L,组间比较差异有高度统计学意义(P<0.01)。氧疗后,2、3、4组血尿酸水平较吸氧前下降,差异有统计学意义(P<0.05或0.01)。2组氧疗前后血尿酸水平[(406.22±99.61)比(364.55±102.36)μmol/L)]比较,差异有统计学意义(P<0.05),3组氧疗前后血尿酸水平[(523.76± 155.47)比(473.16±123.47)μmol/L)]比较,差异有高度统计学意义(P<0.01),4组氧疗前后血尿酸水平[(597.05± 192.53)比(507.65±202.43)μmol/L]比较,差异有高度统计学意义(P<0.01),1组患者氧疗前后血尿酸水平[(315.64±26.50)比(302.58±32.14)μmol/L]比较,差异无统计学意义(P>0.05)。结论随着COPD病情加重,血尿酸水平升高,氧疗可降低COPD患者血尿酸水平。
氧疗;慢性阻塞性肺疾病;尿酸;肺功能
慢性阻塞性肺病(chronicobstructivepulmonarydisease,COPD)是呼吸系统常见疾病,是全世界致残和致死的主要疾病之一[1]。COPD的主要特征为持续气流受限,常表现为呼吸困难和不同程度的低氧血症。许多研究表明COPD患者血尿酸水平升高[2-3],且高尿酸血症可作为COPD缺氧严重程度及早期死亡的预测因子[4-5]。但COPD与血尿酸之间的相互关系及影响机制尚未完全明确,也有许多研究表明在低氧血症时血尿酸水平升高,故推测慢性阻塞性肺病血尿酸升高可能与低氧血症有关[6]。氧疗可改善COPD患者的低氧血症,并可减轻氧化应激反应及炎症损伤,延缓肺动脉高压的形成,提高患者的生活质量及生存率,但氧疗是否可影响COPD患者的血尿酸水平,目前较少有此方面的研究。本研究拟观察慢性阻塞性肺病患者血尿酸水平的变化,与疾病严重程度的相关性,及氧疗对血尿酸水平的影响。
1 资料与方法
1.1一般资料
选择2012年1月~2015年3月在佛山市高明区人民医院住院的COPD缓解期患者184例,诊断符合2013年中华医学会呼吸病学分会修订的慢性阻塞性肺病诊治指南[7],以吸入支气管舒张剂后FEV1/FVC<70%为标准,排除合并痛风、心衰、急性心肌梗死、恶性肿瘤、放化疗、血液病、慢性肾功能不全的患者。对所有患者行肺功能检查,并按该指南中的标准对患者进行分级,其中COPDⅠ级39例(1组)、Ⅱ级52例(2组)、Ⅲ级49例(3组)、Ⅳ级44例(4组)。四组患者一般资料比较,差异无统计学意义(P>0.05)。见表1。
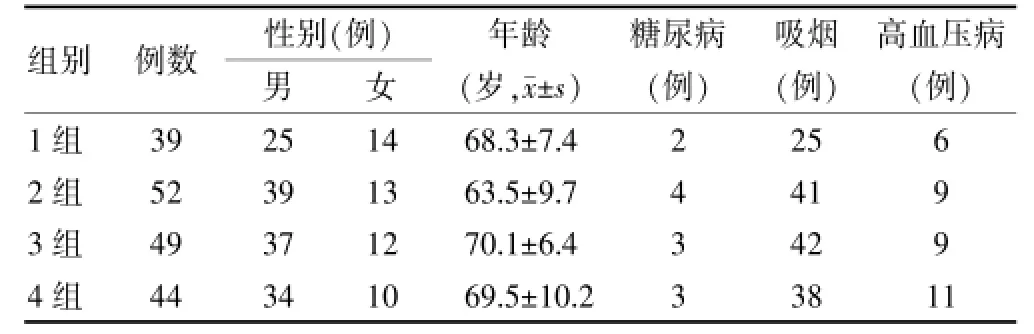
表1 四组患者一般资料比较
1.2方法
所有患者于入院后未治疗前采取股动脉或桡动脉血,进行血气分析。入院后次日清晨采血,测肝功肾功、血尿酸、血糖、血脂、血常规,入院后给予低流量(1~2 L/min)鼻塞吸氧,每天至少吸氧12 h,1周后再次采取清晨空腹血,测血尿酸水平。
1.3统计学方法
采用统计软件SPSS 13.0对数据进行分析,多组间比较采用方差分析,两两比较采用LSD-t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1四组患者氧疗前血尿酸水平比较
随着COPD分级加重,动脉氧分压逐渐下降,血尿酸水平逐渐升高,动脉二氧化碳分压逐渐升高,组间比较差异有统计学意义(P<0.05)。各组间血尿酸两两比较均有统计学差异(P<0.05)。见表2。
表2 四组患者氧疗前血尿酸、动脉氧分压、动脉二氧化碳分压比较(s)
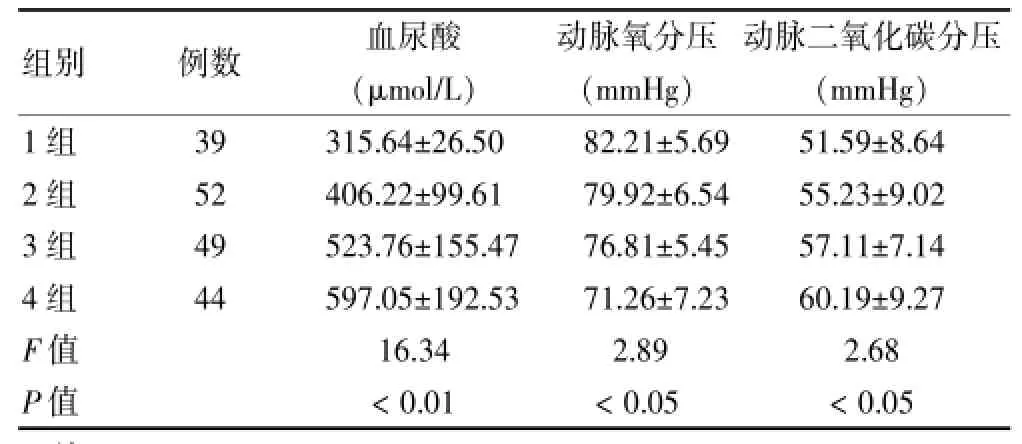
表2 四组患者氧疗前血尿酸、动脉氧分压、动脉二氧化碳分压比较(s)
注:1 mmHg=0.133 kPa
组别例数血尿酸(μ m o l / L )动脉氧分压(m m H g )动脉二氧化碳分压(m m H g ) 1组2组3组4组F值P值3 9 5 2 4 9 4 4 3 1 5 . 6 4 ± 2 6 . 5 0 4 0 6 . 2 2 ± 9 9 . 6 1 5 2 3 . 7 6 ± 1 5 5 . 4 7 5 9 7 . 0 5 ± 1 9 2 . 5 3 1 6 . 3 4<0 . 0 1 8 2 . 2 1 ± 5 . 6 9 7 9 . 9 2 ± 6 . 5 4 7 6 . 8 1 ± 5 . 4 5 7 1 . 2 6 ± 7 . 2 3 2 . 8 9<0 . 0 5 5 1 . 5 9 ± 8 . 6 4 5 5 . 2 3 ± 9 . 0 2 5 7 . 1 1 ± 7 . 1 4 6 0 . 1 9 ± 9 . 2 7 2 . 6 8<0 . 0 5
2.2各组患者氧疗前、后血尿酸水平比较
四组患者氧疗后血尿酸水平较氧疗前下降,2、3、4组吸氧前后比较差异有统计学意义(P<0.05)。见表3。
表3 各组患者氧疗前、后血尿酸水平比较(μmol/L,s)
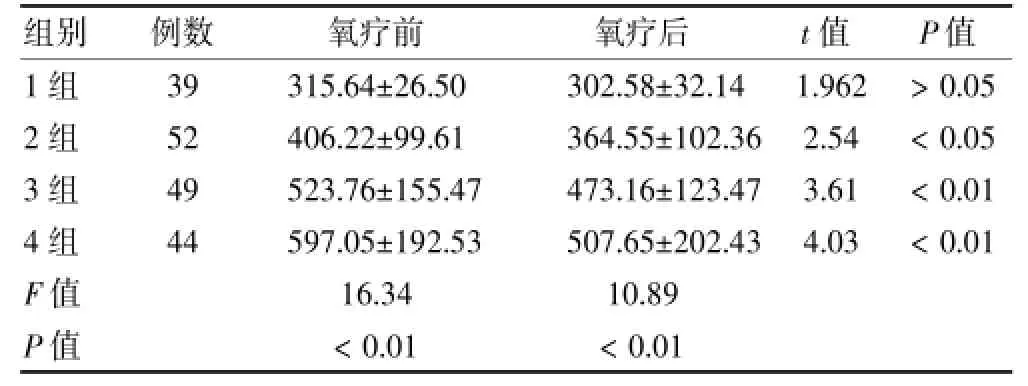
表3 各组患者氧疗前、后血尿酸水平比较(μmol/L,s)
组别例数氧疗前氧疗后t值P值1组2组3组4组F值P值3 9 5 2 4 9 4 4 3 1 5 . 6 4 ± 2 6 . 5 0 4 0 6 . 2 2 ± 9 9 . 6 1 5 2 3 . 7 6 ± 1 5 5 . 4 7 5 9 7 . 0 5 ± 1 9 2 . 5 3 1 6 . 3 4<0 . 0 1 3 0 2 . 5 8 ± 3 2 . 1 4 3 6 4 . 5 5 ± 1 0 2 . 3 6 4 7 3 . 1 6 ± 1 2 3 . 4 7 5 0 7 . 6 5 ± 2 0 2 . 4 3 1 0 . 8 9<0 . 0 1 1 . 9 6 2 2 . 5 4 3 . 6 1 4 . 0 3>0 . 0 5<0 . 0 5<0 . 0 1<0 . 0 1
3 讨论
近年来,随着人民生活水平的不断提高,高尿酸的患病率呈逐年上升趋势。国内外对于高尿酸血症与代谢性疾病及其他心脑血管疾病的相关性有了许多新的研究和认识。越来越多的研究证据凸显了高尿酸血症的危害。高尿酸血症可作为2型糖尿病、高血压病、心血管疾病、慢性肾病等发生发展的独立危险因素[8],高尿酸血症可以预测心血管死亡及全因死亡,是预测心血管事件发生的独立危险因素。也有研究显示高尿酸血症可作为COPD死亡及急性加重期的预测因子[9],且与COPD的严重程度及低氧血症呈正相关[4-6]。
尿酸是嘌吟代谢的终产物,主要来源于食物及内源性的嘌吟转化分解。其中2/3的尿酸是内源性的嘌吟代谢转化而成。大部分的尿酸通过肾脏排出体外,小部分通过肠道排出。当体内尿酸生成增加或排泄减少就会引起高尿酸血症。尿酸是体内重要的抗氧化物质,也是重要的致氧化反应的物质,尤其是高尿酸血症时,致氧化作用更明显。当组织或细胞缺氧时,无氧代谢增加,血尿酸生成增多。血尿酸增高时,机体的活性氧簇增加,激活炎性反应,促进血管平滑肌细胞增殖及内皮细胞损伤,抑制内皮细胞NO的生成,并且激活肾素-血管紧张素系统,导致胰岛素抵抗。
COPD是一种以气流持续受限为特征的疾病,呈进行性发展,与肺对有害气体或有害颗粒的异常炎性反应有关。目前认为COPD的主要发病机制为:①慢性炎性反应;②蛋白酶和抗蛋白酶失衡;③氧化抗氧化失衡;④气道重塑;⑤遗传因素。其中氧化抗氧化失衡被认为是COPD的主要发病机制之一。COPD患者肺部氧化剂来源主要有外源性和内源性两种途径。外源性的氧化剂主要来源于空气污染和烟雾,内源性的氧化剂主要是中性粒细胞和巨噬细胞等炎症细胞释放的氧自由基。氧化应激时氧自由基可与细胞膜或脂蛋白上多价不饱和脂肪酸侧链发生反应形成脂质过氧化,该反应又能产生新的氧自由基,如此形成链式反应,可持续损害细胞膜,造成气道上皮的损伤。此外氧化应激反应还能导致抗蛋白酶失活、黏液过度分泌、移行至肺部的中性粒细胞数量增加和变形能力降低,导致气道中分泌物储留、促炎性介质的基因表达增加。组蛋白去乙酰化酶活性降低致糖皮质激素抗炎作用下降。
推测COPD引起高尿酸血症与下列因素有关:①COPD患者自身抗氧化能力减弱,体外及体内各种氧化剂可导致抗蛋白酶的氧化失活、气道上皮损伤、黏液腺分泌增加及机体的炎性反应。尿酸是嘌吟代谢的终产物,被认为有促进氧化和抗氧化的双重作用。COPD患者氧化/抗氧化失衡和炎性反应增加可能会导致血尿酸升高[10]。此外,高尿酸血症可加重机体的氧化应激反应及炎症损伤,可能进一步促进COPD病情加重及恶化[11-12]。②COPD患者常表现为不同程度的缺氧和/或二氧化碳储留,缺氧时可加速体内主要储能物质三磷酸腺苷向二磷酸腺苷转变并降解为黄嘌吟,使尿酸生产增加。而且组织缺氧时,三磷酸腺苷生成减少,对磷酸核糖核酸酰胺转移酶的抑制作用减低,使嘌吟增加,继发血尿酸增多。此外缺氧时无氧糖酵解增加,血乳酸增加,乳酸可竞争性抑制肾近曲小管分泌尿酸,使尿酸排泄减少,促进血尿酸升高。COPD患者由于长期缺氧及反复感染,可刺激骨髓造血,导致红细胞生成增加,而在COPD患者机体微循环障碍及酸碱失衡状态下,红细胞破坏增多,致尿酸生产增加。慢性缺氧可能加重氧化与抗氧化平衡的失衡[13],促进血尿酸水平升高。长期缺氧可加重肺动脉高压和右心室负荷增加,促进嘌吟分解代谢,尿酸生成增多。③COPD患者可能因为水电解质、酸碱平衡紊乱,致肾血流量减少和肾小球滤过率下降,使尿酸排泄减少。COPD患者后期常并发心衰及浮肿,可能应用利尿剂,进一步加重高尿酸血症的形成。从以上发病机制可以看出,缺氧可能是COPD患者血尿酸升高的一个重要的影响因素,COPD患者因持续性气流受限,常表现为不同程度的低氧血症,故推测随着肺功能减退及低氧血症加重,血尿酸水平会逐步升高[14-15]。本研究发现随着肺功能减退,血尿酸水平升高,从COPDⅠ级至Ⅳ级,血尿酸平均水平从(315.64±26.50) μmol/L升至(597.05±192.53)μmol/L,组间比较差异有统计学意义(P<0.05),进一步证实COPD患者血尿酸水平升高可能与缺氧有关,与现有研究报道一致[16-17]。尿酸可刺激还原型辅酶Ⅱ氧化酶,产生氧化剂,降低局部一氧化氮水平,导致内皮细胞功能障碍,使血管内壁增厚、血管平滑肌增值,促进肺动脉收缩[18-20],从而促进肺动脉高压进展,进一步加重缺氧及肺功能下降。因此如慢性阻塞性肺病合并高尿酸血症可能形成恶性循环,促进病情进展。这也可以进一步解释为何血尿酸水平随肺功能减退而升高。氧疗可以改善COPD患者低氧血症,减轻肺血管收缩,减低红细胞压积,从而有利于降低肺动脉压[21-23]。此外氧疗可增加迷走神经活性,抑制毛细血管通透性和炎症介质的释放,故氧疗可从多种机制改善氧化和抗氧化失衡,低氧血症和肺动脉高压,减低血尿酸水平。本研究发现, COPDⅡ~Ⅳ级患者氧疗后,血尿酸水平较氧疗前下降,差异有统计学意义(P<0.05),但肺功能Ⅰ级患者氧疗前后血尿酸水平无统计学差异,推测可能与COPDⅠ级患者血尿酸水平升高不明显,低氧血症也没有Ⅱ~Ⅳ级患者明显,故氧疗对改善血尿酸效果不明显。
本研究存在局限:①非随机分组,而是根据患者的COPD分级进行分组,无空白实验对照组,对实验结果的分析可能存在偏倚。②血尿酸与COPD的关系没有进行多因素分析,尤其是氧疗后血尿酸水平的变化,未排除其他因素对血尿酸的影响,如利尿剂、抗菌素、降压、降糖药物的使用等。
综上所述,血尿酸水平可反映COPD患者病情及缺氧的严重程度,血尿酸升高可能加重COPD的病情进展,临床上应重视COPD患者血尿酸的检测。氧疗可能改善COPD患者血尿酸水平,但其确切机制尚需进一步研究,且本研究未进行多变量分析,不排除其他治疗因素干扰实验结果。既往研究显示高尿酸血症可作为COPD患者病情严重程度及早期死亡的预测因子,经过治疗后血尿酸水平下降,是否对预后改善有预测价值,也需要进一步研究探讨。
[1]Vestbo J,Hurd SS,Agustí AG,et al.Global strategy for the diagnosis,management and prevention of chronic obstructive pulmonary disease,GOLD executive summary[J].Am J Respir Crit Care Med,2013,187(4):347-365.
[2]Aida Y,Shibata Y,Osaka D,et al.The relationship between serum uric acid and spirometic values in participants in a health check:the Takahata study[J].Int J Med Sci,2011, 8(6):470-478.
[3]冼美兰.COPD稳定期患者血尿酸、尿酸/肌酐水平测定的临床意义[J].中国现代医生,2014,52(6):51-53.
[4]Zhang X,Liu L,Liang R,et al.Hyperuricemia is a biomarker of early mortality in patients with chronic obstructive pulmonary disease[J].Int J Chron Obstruct Pulmon Dis, 2015,26(10):2519-2523.
[5]Ozanturk E,Ucar ZZ,Varol Y,et al.Urinary uric acid excretion as an indicator of severe hypoxia and mortality in patients with obstructive sleep apnea and chronic obstructive pulmonary disease[J].Rev Port Pneumo,2016,22(1):18-26
[6]宋瑞红,张靖,陈福仙.血清尿酸与AECOPD相关性分析[J].临床肺科杂志,2012,17(3):410-411.
[7]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J].中华结核和呼吸杂志,2013,36(4):210-216.
[8]Zhu Y,Pandya BJ,Choi HK.Comorbidities of gour and hyperuricemia in ths US general population:NHANES 2007-2008[J].Am J Med,2012,125:679-687.
[9]Bartziokas K,Papaioannou AI,Loukides S,et al.Serum uric acid as a predictor of mortality and future exacerbations of COPD[J].Eur Respir J,2014,43(1):43-53.
[10]李艳丽.慢性阻塞性肺疾病患者血尿酸和血清细胞因子水平测定的临床意义[J].中国医师进修杂志2012, 35(19)25-27.
[11]Bardin T,Richette P.Definition of hyperuricemia and gouty conditions[J].Curr Opin Rheumatol,2014,26(2): 186-191.
[12]Billiet L,Doaty S,Katz JD,et al.Review of hyperuricemia as new marker for metabolic syndrome[J].ISRN Rheumatol,2014,2014:852954.
[13]Wang L,Tang Y,Liu S,et al.Metabonomic profiling of serum and urine by(1)HNMR-based spectroscopy discriminates patients with chronic obstructive pulmonary disease and healthy individuals[J].PLoS One,2013,8(6):e65675-e65682.
[14]易星航.血清尿酸与肌酐比值与慢性阻塞性肺疾病肺功能的关系[J].成都医学院学报,2012,7(2):271-272.
[15]李艳丽.慢性阻塞性肺疾病患者血尿酸和血清细胞因子水平测定的临床意义[J].中国医师进修杂志,2012, 35(19):25-27.
[16]李杰,江莲.COPD继发肺动脉高压患者血清尿酸检测的临床意义[J].医学信息,2014,27(7):27.
[17]沈剑,钱翠,高航,等.血尿酸肌酐比与慢性阻塞性肺疾病急性加重期患者CAT评分相关性研究[J].中华临床医师杂志,2012,6(21):6995-6996.
[18]Castillo-Martinez D,Marroquin-Fabian E,Lozada-Navarro AC,et al.Levels of uric acid may predict the future development of pulmonary hypertension in systemic lupus erythematosus:a seven-year follow-up study[J]. Lupus,2016,25(1):61-66.
[19]李震南,何建国,柳志红,等.血尿酸水平与特发性肺动脉高压病情和预后的关系[J].中华医学杂志,2012,92(46):3261-3264.
[20]Kim KJ,Baek IW,Park YJ,et al.High levels of uric acid in systemic lupus erythematosus is associated with pulmonary hypertension[J]Int J Rheum Dis,2015,18(5): 524-532.
[21]王爱玲,于海荣,孙阁,等.无症状高尿酸血症对大鼠血压及尿蛋白β2-微球的影响[J].河北医学,2015,14(6): 905-907.
[22]雷应军,胡振红,刘海潮,等.无创正压通气对COPD合并肺源性心脏病急性加重期患者疗效和血气、炎性指标的影响[J].疑难病杂志,2016,15(3):233-235,240.
[23]宋军平,张清生,李建华,等.长程家庭氧疗联合舒利迭、噻托溴铵吸入治疗稳定期中重度COPD的临床疗效[J].国际医药卫生导报,2012,18(18):2713-2716.
Influences of oxygen therapy to uric acid in patients with chronic obstructive pulmonary disease
KE YuanyuanWU ZenglongQU Zhenqing
Department of Cardiology,Gaoming People's Hospital,Guangdong Province,Foshan528500,China
Objective To explore the changes of uric acid in patients with chronic obstructive pulmonary disease (COPD),and study the influences of oxygen therapy to uric acid of patients with COPD.Methods From January 2012 to March 2015,in Gaoming People's Hospital,184 patients with COPD during remission were enrolled and divided into four groups according to the pulmonary function.39 patients were at theⅠstage of COPD(group 1),52 patients were at theⅡstage(group 2),49 patients were at theⅢstage(group 3)and 44 patients were at theⅣstage(group 4).The levels of fasting blood uric acid,PO2and PCO2were tested of all patients.A low flow of oxygen(1-2 L/min)was taken by all the patients at least 12 hours a day for 7 d.Fasting blood uric acid was tested again after the oxygen therapy. The serum uric acid before and after oxygen therapy of each group was compared.Results The serum uric acid level of COPD before oxygen therapy was increased with the classification of lung function.The level of serum uric acid of the four groups was(315.64±26.50),(406.22±99.61),(523.76±155.47),(597.05±192.53)μmol/L,which had significant difference among the four groups(P<0.01).After oxygen treatment,the uric acid level of the group 2,group 3,group 4 decreased(P<0.05 or<0.01).The serum uric acid level of the group 2 before and after oxygen treatment was compared[(406.22±99.61)vs(364.55±102.36)μmol/L],the difference was statistically significant(P<0.05),the serum uric acid level of the group 3 before and after oxygen treatment was compared[(523.76±155.47)vs(473.16±123.47) μmol/L],the difference was statistically significant(P<0.01),and the serum uric acid level of the group 4 before and after oxygen treatment was compared[(597.05±192.53)vs(507.65±202.43)μmol/L],the difference was statistically significant(P<0.01).The differences of the uric acid level of the group 1 before and after oxygen therapy[(315.64± 26.50)vs(302.58±32.14)μmol/L]was no statistically significant(P>0.05).Conclusion The level of uric acid is positively correlated with classification of lung function.Oxygen therapy may reduce the level of uric acid of COPD.
Oxygen therapy;Chronic obstructive pulmonary disease;Uric acid;Pulmonary function
R544.1
A
1673-7210(2016)06(b)-0105-04
广东省佛山市卫生局医学科研立项课题(20160328)。
(2016-03-11本文编辑:苏畅)
