Stomatin样蛋白2通过PI3K通路对儿童哮喘的影响
2016-12-06王贞程玮张雯
王贞 程玮 张雯
西安市儿童医院呼吸二科,陕西西安710003
Stomatin样蛋白2通过PI3K通路对儿童哮喘的影响
王贞程玮张雯
西安市儿童医院呼吸二科,陕西西安710003
目的研究Stomatin样蛋白2(STOML2)基因表达在儿童哮喘发病中的作用。方法选择2013年9月~2014年3月在西安市儿童医院(以下简称“我院”)呼吸科住院的14例哮喘患儿为研究对象,选择同期在我院进行健康体检的9例正常儿童作为对照。采用RT-qPCR和Western blot方法检测两组儿童外周血单个核细胞(PBMC)中STOML2和磷脂酰肌醇3激酶(PI3K)mRNA和蛋白的表达水平;构建STOML2过表达载体并转染气道平滑肌细胞(ASMC),MTT法检测细胞的生长,观察STOML2过表达对PI3K表达的影响。结果与正常儿童比较,哮喘患儿PBMC中STOML2 mRNA及蛋白水平显著降低,而PI3K水平显著升高,差异均有统计学意义(P<0.05)。体外实验结果显示,过表达STOML2会抑制气道平滑肌细胞生长,并抑制PI3K的表达。结论STOML2在哮喘患儿中低表达,过表达STOML2抑制ASMC的生长,其可能是通过抑制PI3K活性实现的。
儿童哮喘;Stomatin样蛋白2;磷脂酰肌醇3激酶;气道平滑肌细胞
支气管哮喘(简称“哮喘”)是儿童最常见的慢性呼吸道疾病之一。据国际儿童哮喘与变态反应研究(the International Study of Asthma and Allergies in Childhood,ISAAC)统计,全球大约已有3亿例哮喘患者,其中以发展中国家居多[1]。最近的流行学调查结果显示,我国儿童哮喘两年现患率为2.32%,累计患病率为3.02%[2],消耗着巨大的医疗卫生资源。目前,哮喘的发病机制尚未完全清楚,经典免疫学说认为哮喘的发病机制主要与Th1/Th2功能失衡有关,但其并不能完全解释哮喘的发病。Stomatin样蛋白2(Stomatinlike Protein 2,STOML2)是Stomatin家族的一员,为线粒体内膜蛋白。研究表明,Stomatin在多种癌症中均高表达,进而调控细胞的增殖和迁移[3-4]。陈继承[5]研究发现,人工合成的糖皮质激素——地塞米松,一种治疗儿童哮喘的常用药,可上调人肺腺癌A549细胞和大鼠肺脏中Stomatin的表达,从而增强肺泡上皮细胞膜的稳定性。另一方面,T细胞STOML2的缺失会引起线粒体呼吸的改变及CD4+T细胞应答的缺失[6],而上调STOML2可促进T细胞分化,发挥免疫调节作用并抑制凋亡[7-8]。这些研究均提示STOML2表达异常可能与哮喘的发病有关。本实验以哮喘患儿为研究对象,构建STOML2过表达载体并将其导入人气道平滑肌细胞(airway smooth muscle cell,ASMC)中,研究STOML2基因表达在儿童哮喘发病中的作用及其可能的机制。
1 对象与方法
1.1对象
选取2013年9月~2014年3月在西安市儿童医院(以下简称“我院”)呼吸科就诊的住院患儿作为哮喘组,其中男9例,女5例,年龄5~12,平均(8.2± 3.5)岁,哮喘诊断符合中华医学会哮喘诊断标准[9]。选择同期在我院儿童保健科门诊进行健康体检的儿童作为对照组,其中男5例,女4例,年龄6~13,平均(8.2±3.1)岁,均无哮喘疾病家族史,1个月内无呼吸道感染及无过敏性疾病史或其他疾病史。本研究经我院医学伦理委员会批准。
1.2实验材料
Trizol试剂购自美国Invitrogen公司。ASMC购自美国Cambrex Bioscience公司。pCDNA3.1质粒、限制性内切酶EcoRⅠ、XhoⅠ和T4连接酶购自美国NEB公司。大肠杆菌DH5α为我院实验室保存。兔抗人STOML2抗体和PI3Kp85抗体购自Santa Cruz公司。SYBR Premix Ex TaqⅡ和反转录试剂盒购自大连宝生物工程公司,MTT试剂盒购自碧云天生物技术有限公司,引物由上海生工生物工程股份有限公司合成。
1.3实验方法
1.3.1标本采集及细胞培养清晨取研究对象的静脉血5mL,肝素抗凝。常规分离外周血单个核细胞(PBMC),培养于含10%小牛血清的RPMI 1640培养液中,待用。ASMC也培养于含10%小牛血清的RPMI 1640中。
1.3.2STOML2真核表达载体的构建及分组根据人STOML2基因全长mRNA序列(序列号为:NM_012999.1)设计STOML2的引物。STOML2上游引物为:5'-GTGACTCTCGACAATGTAAC-3',下游引物为:5'-TGATCTCATAACGGAGGCAG-3'。并在上、下游引物的5'端分别引入EcoRⅠ和XhoⅠ两个限制性酶切位点。提取ASMCs的mRNA,逆转录合成cDNA,而后PCR扩增STOML2基因。扩增条件为:95℃预变性5 min;95℃45s,62℃45s,72℃45s,35个循环;72℃延伸5 min。EcoRⅠ和XhoⅠ双酶切PCR扩增产物及pCDNA3.1质粒并用T4连接酶连接片段。产物转化至DH5α细胞后,抽提重组质粒并测序鉴定。将Lipofectamine 2000和pCDNA3.1-STOML2重组质粒以2.0:0.8(v/v)的比例混合并转染ASMCs。实验分为3组:Blank组(未做任何处理)、pCDNA3.1组(转染pCDNA3.1空质粒)及STOML2组(转染pCDNA3.1-STOML2重组质粒)。转染24 h后,提取细胞蛋白,检测STOML2的表达水平并评测转染效率。
1.3.3RT-qPCR检测STOML2及PI3K的mRNA水平表达Trizol试剂抽提各组细胞总RNA并用分光光度计测定RNA吸光度值(OD值),然后用反转录试剂盒反转录合成cDNA。PCR反应体系共20 μL: SYBR Premix Ex TaqⅡ混合液10 μL,cDNA模板2 μL,上下游引物各1 μL,去离子水6 μL。反应条件为: 94℃预变性5 min;然后94℃,30 s;56℃,30 s;72℃, 40 s,共35个循环;72℃,延伸5 min。根据2-ΔΔCt计算方法计算基因相对表达水平。STOML2引物参见实验方法1.3.2。PI3K上游引物为:5'-CAAAGCCGAGAACCTATTGCGAG-3',下游引物为:5'-GTTTGACTTCGCCATCTACCAC-3'。
1.3.4Western blot检测STOML2及PI3K的蛋白表达量RIPA裂解细胞后测定蛋白浓度,随后将25 μg蛋白经12%SDS-PAGE分离后,电转到硝酸纤维素膜上。而后,用PBS封闭液(含3%脱脂奶粉,0.1% Tween-20)对膜进行封闭(室温封闭1 h)。封闭后,加入STOML2(1:800)、PI3Kp85(1:500)及β-actin(1:1000)一抗,4℃孵育过夜,随后用辣根过氧化物酶标记的二抗(1:2000)室温孵育2 h。用ECL发光系统检测目的条带,Image Pro Plus 6.0软件对条带进行灰度分析。
1.3.5MTT法检测细胞生长将对数生长期细胞以5× 103个/孔接种于96孔培养板。当细胞达到80%融合时,按步骤转染pCDNA3.1-STOML2重组质粒,并于转染后72 h进行MTT实验检测。每孔加入20 μL MTT(5 mg/mL)后加入150 μL二甲基亚砜。然后用酶标仪测定490 nm处吸光值。
1.4统计学方法
采用SPSS 16.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,多组间数据比较采用ANOVA单因素方差分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1哮喘患儿与正常儿童STOML2表达水平
为了检测STOML2在哮喘患儿PBMC中的表达情况,本实验分离了两组儿童的PBMC并通过RT-qPCR和Western blot方法进行了测定。RT-qPCR结果显示,哮喘患儿PBMC中STOML2-mRNA水平(0.41±0.05)显著低于对照组(0.77±0.04),Western blot结果也验证了这一现象(P<0.05)。见图1。
2.2STOML2过表达载体的构建
在ASMC中,与Blank组比较,转染STOML2过表达载体可显著提高STOML2的mRNA及蛋白表达水平,差异均有统计学意义(P<0.05)。与pCDNA3.1组比较,STOML2组STOML2的mRNA及蛋白水平也显著升高,差异均有统计学意义(P<0.05)。说明STOML2过表达载体构建成功。见表1、图2。

图1 哮喘患儿与正常儿童PBMC中STOML2的表达水平
表1 各组STOML2 mRNA及蛋白表达水平比较(±s,n=4)

表1 各组STOML2 mRNA及蛋白表达水平比较(±s,n=4)
注:与Blank组比较,*P<0.05;与pCDNA3.1组比较,#P<0.05
组别mRNA表达蛋白表达Blank组1.00±0.051.00±0.02 pCDNA3.1组1.00±0.091.03±0.07 STOML2组3.19±0.24*#2.19±0.16*#
2.3过表达STOML2抑制ASMC细胞增殖
为了探讨STOML2影响哮喘的机制,在体外测定了过表达STOML2对ASMC细胞增殖的影响。MTT实验结果显示,与Blank组[(95.00±1.45)%]和pCDNA3.1组[(95.17±2.69)%]比较,STOML2组[(50.13± 3.11)%]细胞增殖能力显著降低,差异均有统计学意义(P<0.05)。见图3。
2.4PI3K表达水平
为了进一步探讨STOML2调控哮喘的机制,本实验从体内外水平检测了PI3K的表达。体内实验显示,与对照组[mRNA水平:(0.33±0.02);蛋白水平:(0.43±0.03)]比较,哮喘患儿PBMC中PI3K水平[mRNA水平:(0.72±0.04);蛋白水平:(1.03±0.12)]显著升高(P<0.05),见图4A。细胞实验显示,与Blank组[mRNA水平:(1.00±0.05);蛋白水平:(1.00±0.07)]比较,STOML2组PI3K水平[mRNA水平:(0.54±0.06);蛋白水平:(0.48±0.09)]显著降低,差异均有统计学意义(P<0.05),提示过表达STOML2可显著降低PI3K的水平与PI3K水平呈负相关,见图4B。
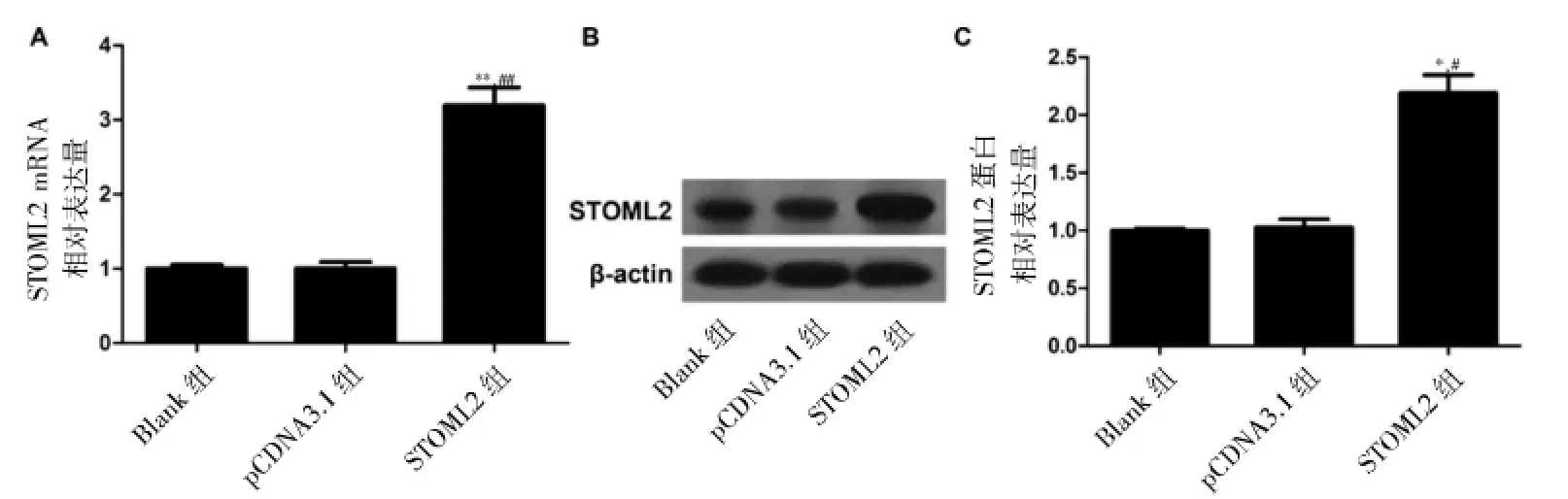
图2 STOML2过表达载体的效果
3 讨论
STOML2属于Stomatin样蛋白家族,是细胞呼吸链复合物正确发展的必须基因[10],调控细胞增殖、黏着等多种功能[11]。STOML2位于染色体9p13.1上,其在多种癌症中发挥着生物学功能。Zhang等[11]发现喘患儿外周血PBMC中低表达,提示STOML2在哮喘发病中扮演一定的角色。
气道炎症和气道重构(如气道平滑肌层的增生和肥大及基底的增厚)是支气管哮喘的重要病理表现[14]。然而现在关于气道重构的机制尚不明确,哮喘时ASMC增生是气道重构的主要原因[3]。Johnson等[4]通过体外培养哮喘患者ASMC发现,与非哮喘患者比较,哮喘患者ASMC的增殖能力明显升高。本实验进一步构建了STOML2过表达载体并检测了其对ASMC增殖的影响。实验结果表明过表达STOML2可以抑制ASMC细胞增殖。这与Revez等[15]人的发现一致,即STOML2是一个潜在的哮喘风险基因。
越来越多的研究表明,PI3K信号通路在哮喘的病理生理过程中起着重要作用[16],且对ASMC增殖起着正向调节的作用。Scott等[17]报道指出,在牛ASMC中,活化PI3K会增强DNA的有丝分裂,而PI3K抑制剂wortmannin可显著减少DNA合成。另一方面,研究也发现抑制调节性体细胞(regulatory T cells,Treg)中PI3K信号通路的活化有助于维持Treg细胞种群的体内平衡和免疫功能[18]。而PI3K信号可以通过参与Th1/Th2、Treg/Th17的失衡参与哮喘的发病过程[19-20]。 STOML2在人食管鳞状细胞癌、肺癌、喉癌及子宫内膜癌组织中均高表达,在人食管鳞状细胞癌细胞系KYSE450中,沉默STOML2伴随着细胞生长、增殖和细胞黏着的抑制。STOML2在上皮性卵巢癌及胃腺癌细胞中高表达,且与患者的不良预后有显著相关性[12-13]。之前研究表明,地塞米松作为一种可治疗哮喘的糖皮质激素,可引起大鼠肺脏Stomatin的上调[5], STOML2缺失也会引起T细胞应答的缺失[6-7],提示STOML2可能与哮喘有关。本研究发现STOML2在哮本研究发现,STOML2负调节PI3K信号通路,即在哮喘患儿PBMC中,STOML2的低表达伴随着PI3K的升高,而在ASMC中,过表达STOML2可以显著降低PI3K的水平,这为哮喘的治疗提供了一个潜在的基因靶点。
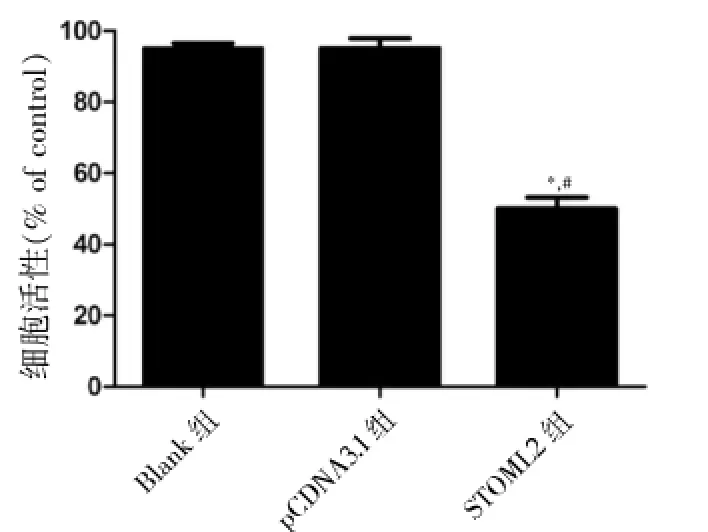
图3 过表达STOML2对细胞增殖的影响
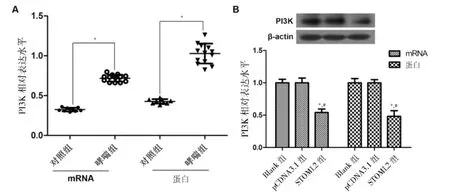
A:哮喘患儿和正常儿童PI3K mRNA及蛋白表达水平;B:ASMC中各组PI3K mRNA及蛋白表达水平;与对照组/Blank组比较,*P<0.05;与pCDNA3.1组比较,*#P<0.05
综上所述,本研究表明STOML2在哮喘患儿外周血PBMC中低表达,并且过表达STOML2可以抑制ASMC细胞凋亡,而此过程可能与PI3K信号通路有关。因此,STOML2有望成为治疗哮喘的靶标分子。
[1]The International Study of Asthma and Allergies in Childhood.The Global Asthma Report 2014[EB/OL].http://www. globalasthmareport.org/index.php.
[2]陈育智.中国城区儿童哮喘患病率调查[J].中华儿科杂志,2003,41(2):123.
[3]Ammit AJ,Panettieri RA,Jr.Airway smooth muscle cell hyperplasia:a therapeutic target in airway remodeling in asthma?[J].Prog Cell Cycle Res,2003,5:49-57.
[4]Johnson PR,Roth M,Tamm M,et al.Airway smooth muscle cell proliferation is increased in asthma[J].Am J Respir Crit Care Med,2001,164(3):474-477.
[5]陈继承.低氧和糖皮质激素上调stomatin的机制及其生物学意义[D].上海:第二军医大学,2011.
[6]Christie DA,Mitsopoulos P,Blagih J,et al.Stomatin-like protein 2 deficiency in T cells is associated with altered mitochondrial respiration and defective CD4+T cell responses[J].J Immunol,2012,189(9):4349-4360.
[7]Kirchhof MG,Chau LA,Lemke CD,et al.Modulation of T cell activation by stomatin-like protein 2[J].J Immunol, 2008,181(3):1927-1936.
[8]Christie DA,Lemke CD,Elias IM,et al.Stomatin-like protein 2 binds cardiolipin and regulates mitochondrial biogenesis and function[J].Mol Cell Biol,2011,31(18): 3845-3856.
[9]中华医学会儿科学分会呼吸学组.儿童支气管哮喘诊断与防治指南[J].中华儿科杂志,2008,46(10):745-753.
[10]Mitsopoulos P,Chang YH,Wai T,et al.Stomatin-like protein 2 is required for in vivo mitochondrial respiratory chain supercomplex formation and optimal cell function[J]. Mol Cell Biol,2015,35(10):1838-1847.
[11]Zhang L,Ding F,Cao W,et al.Stomatin-like protein 2 is overexpressed in cancer and involved in regulating cell growth and cell adhesion in human esophageal squamous cell carcinoma[J].Clin Cancer Res,2006,12(5):1639-1646.
[12]Sun F,Ding W,He JH,et al.Stomatin-like protein 2 is overexpressed in epithelial ovarian cancer and predicts poor patient survival[J].BMC Cancer,2015,15:746.
[13]Li XH,He F,Yan SM,et al.Increased expression of stomatin-like protein 2(STOML2)predicts decreased survival in gastric adenocarcinoma:a retrospective study[J].Med Oncol,2014,31(1):763.
[14]Berair R,Brightling CE.Asthma therapy and its effect on airway remodeling[J].Drugs,2014,74(12):1345-1369.
[15]Revez JA,Matheson MC,Hui J,et al.Identification of STOML2 as a putative novel asthma risk gene associated with IL6R[J].Allergy,2016,DOI:10.1111/all.12869.
[16]聂颖,李昌崇.PI3K信号通路对T细胞发育,活化,增殖,分化及支气管哮喘的作用[J].中华哮喘杂志:电子版,2011,(5):348-352.
[17]Scott PH,Belham CM,al-Hafidh J,et al.A regulatory role for cAMP in phosphatidylinositol 3-kinase/p70 ribosomal S6 kinase-mediated DNA synthesis in plateletderived-growth-factor-stimulated bovine airway smoothmuscle cells[J].Biochem J,1996,318(Pt 3):965-971.
[18]Huynh A,DuPage M,Priyadharshini B,et al.Control of PI(3)kinase in Treg cells maintains homeostasis and lineage stability[J].Nat Immunol,2015,16(2):188-196.
[19]Duan W,Aguinaldo Datiles AM,Leung BP,et al.An anti-inflammatory role for a phosphoinositide 3-kinase inhibitor LY294002 in a mouse asthma model[J].Int Immunopharmacol,2005,5(3):495-502.
[20]聂颖,张维溪,崇蕾,等.PI3K信号通路对哮喘小鼠调节性T细胞与Th17失衡的调控作用[J].中国病理生理杂志,2012,28(2):332-337.
Effect of STOML2 on childhood asthma through PI3K pathway
WANG ZhenCHENG WeiZHANG Wen
The Second Department of Respiration,Xi'an Children's Hospital,Shaanxi Province,Xi'an710003,China
Objective To investigate the effect of Stomatin-like Protein 2(STOML2)expression on pathogenesis of childhood asthma.Methods Totally 14 children with asthma who were hospitalized in the Department of Respiration, Xi'an Children's Hospital(“our hospital”for short)were recruited from September 2013 to March 2014,and 9 healthy children who
physical check-ups in our hospital at the same period were taken as controls.The mRNA and protein levels of STOML2 and phosphatidylinositol 3 kinase(PI3K)in peripheral blood mononuclear cell(PBMC)of children in two groups were detected by RT-qPCR and Western blot.In addition,STOML2 over-expressed vector was synthesized and transfected to airway smooth muscle cells(ASMC).The cell viability was detected by 3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT)assay,and the effect of STOML2 over-expression on the level of PI3K was observed.Results The mRNA and protein levels of STOML2 in PBMC of asthmatic children were significantly decreased when compared with those in normal children,while the PI3K level was markedly increased,the differences were statistically significant(P<0.05).In vitro assay showed that over-expression of STOML2 inhibited the growth of ASMC and the expression of PI3K.Conclusion STOML2 is decreased in asthmatic children and over-expression of STOML2 inhibited the growth of ASMC,which is accompanied by inhibiting PI3K pathway.
Childhood asthma;Stomatin-like Protein 2;PI3K;Airway smooth muscle cell
R562.2
A
1673-7210(2016)06(b)-0020-05
(2016-03-05本文编辑:任念)
