循环型microRNA-92a在先天性巨结肠中的表达及上调CDX2基因的研究
2016-12-06邱胜华刘健陈运平郭洪娜
邱胜华,刘健,陈运平,郭洪娜
(山东省临沂市沂水中心医院1.小儿外科,2.检验科,山东 临沂 276400)
循环型microRNA-92a在先天性巨结肠中的表达及上调CDX2基因的研究
邱胜华1,刘健2,陈运平2,郭洪娜2
(山东省临沂市沂水中心医院1.小儿外科,2.检验科,山东 临沂 276400)
目的探讨循环型microRNA-92a(miR-92a)在先天性巨结肠(HD)中的表达,以及通过上调尾侧型同源转录因子-2(CDX2)基因抑制肠神经干细胞(ENSCs)增殖的可能机制。方法选取2013年1月-2015年12月在山东省临沂市沂水中心医院行先天性巨结肠根治术16例HD患儿的术前血清标本。实时荧光定量聚合酶链反应(qRT-PCR)检测血清miR-92a mRNA的表达。提取孕15 d胎鼠肠管ENSCs,通过免疫学方法鉴定ENSCs;免疫磁珠法分选Nestin+ENSCs,脂质体转染使Nestin+ENSCs内过表达miR-92a,噻唑蓝法检测细胞的增殖活性,qRT-PCR、Western blot检测CDX2基因的表达。结果HD患儿血清中miR-92a mRNA的相对表达量为(23.5±4.66),高于对照组(t=12.661,P=0.000);ENSCs细胞培养早期Nestin染色阳性,具有向Tuj-1阳性、胶质纤维酸性蛋白阳性细胞分化的潜能;ENSCs过表达miR-92a后,CDX2 mRNA的相对表达为(13.024±3.882),高于对照组(F=47.212,P=0.000),CDX2蛋白表达为(0.436±0.0828),高于对照组(F=48.793,P=0.000),细胞的增殖活性在转染后24、48和72 h明显受抑制。结论miR-92a通过上调CDX2基因的表达,抑制ENSCs的增殖,可能促进HD发生、发展。
先天性巨结肠;循环型miR-92a;CDX2基因;肠神经干细胞
先天性巨结肠(hirschsprung's disease,HD)是小儿外科常见的先天性消化道畸形[1]。有研究发现在胚胎发育过程中,肠神经干细胞(enteric neural stem cells,ENSCs)通过不断的迁移、增殖和分化,形成肠道的神经系统,当各种原因引起肠道神经系统的正常形成时,将导致肠道神经节细胞的变性或缺失,形成HD[2-3]。microRNA(miRNA)通过与靶基因mRNA的3’-UTR端特异性的碱基配对,在转录后水平调控靶基因的表达,在消化道的形成过程中发挥重要调控作用[4],本研究通过实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测miR-92a mRNA在HD患儿血清中的表达,体外分离和培养SD大鼠ENSCs,通过脂质体在大鼠ENSCs内过表达miR-92a,检测miR-92a靶基因尾侧型同源转录因子-2(caudal-related homeobox transcription factor-2,CDX2)的变化,初步探讨循环型miR-92a及其靶基因CDX2在HD发生、发展中的作用,从而为HD的诊疗提供理论依据。
1 资料与方法
1.1主要材料
1.1.1临床样本选取2013年1月-2015年12月在临沂市沂水中心医院行先天性巨结肠根治术16例HD患儿的术前血清标本作为观察组。其中,男性9例,女性7例;平均年龄(1.30±0.29)岁。纳入标准:①符合HD的临床诊断标准;②术前未行药物或手术治疗;③术后病理检查确诊为HD。同期选择10例健康体检婴儿作为对照组,其中男、女各5例,平均年龄(1.20±0.24)岁,两组婴儿的年龄和性别等人口基线特征具有可比性。
1.1.2实验动物孕15 d清洁级SD大鼠,购自中国科学院上海实验动物中心。
1.1.3主要试剂改良伊格尔培养基(dulbecco's modified eagle medium,DMEM)/F12培养液(美国Hyclone公司),胎牛血清(江苏杭州四季青公司),表皮生长因子(上海碧云天生物技术公司),碱性成纤维细胞生长因子、N2和B27购自美国Gibco公司,TRIzol RNA(美国Invitrogen公司),逆转录试剂盒(日本TaKaRa公司),二氨基联苯胺显色试剂盒(福建福州迈新生物公司),Lipofectamine 2000(美国Invitrogen公司),链霉-青霉素(美国Gibco公司),聚丙烯酰胺凝胶电泳凝胶试剂盒(上海碧云天生物技术公司),兔抗鼠Nestin抗体、兔抗鼠Tuj-1抗体、兔抗鼠胶质纤维酸性蛋白(glial fibrg aciciic protein,GFAP)抗体、兔抗CDX2均购自美国Abcam公司,miR-92a(Gene ID:407 048,185 bp)、β-actin(Gene ID:11 461,148 bp)、CDX2(Gene ID:1 045,204 bp)引物均由上海生工生物工程股份服务有限公司合成。见附表。

附表miR-92a、β-actin、CDX2的引物序列
1.2实验方法
1.2.1qRT-PCR检测血清miR-92a mRNA的表达收集两组外周静脉血2 ml,室温静置10 min,800 r/min离心5 min,吸取上清液,按照mir VanaTMPARISTM kit试剂盒说明书纯化血浆总RNA,取总RNA 500 ng,应用日本TaKaRa公司逆转录试剂盒将其逆转录为cDNA,反应条件:42℃预变性15 min,95℃变性2 min。以cDNA为模板,进行qRT-PCR,以β-actin为内参照进行扩增,反应条件:95℃预变性3 min,95℃变性15 s,60℃退火15 s,72℃延伸40 s,共40个循环。通过qRT-PCR仪特定软件程序记录并分析检测数据结果,实验重复3次,根据公式Folds= 2-△△Ct计算各检测目的基因的相对表达量,△△Ct=(Ct检测基因-Ctβ-actin)实验组-(Ct检测基因-Ctβ-actin)对照组。1.2.2ENSCs的分离、培养和鉴定配置ENSCs培养液,每100ml基础培养液中含90ml DMEM/F12培养液、1 ml N2添加剂、2 ml B27添加剂,皮生长因子和碱性成纤维细胞生长因子各2 ml(浓度均为20μg/L)、青霉素、链霉素各2 ml(100 IU/ml)、1 ml L-谷氨酰胺(2 mmol/L),完全培养液的配置则需加入10 ml胎牛血清。参照朱利斌[5]和LINDLEY等[6]建立的大鼠ENSCs分离方法,提取ENSCs,具体要点如下:孕15 d SD大鼠颈椎脱臼处死,腹部消毒后进入腹腔,游离胎鼠肠管,剥离并剪碎肠管外纵肌,0.5mg/ml胶原酶4℃过夜消化,200目筛网过滤后,800 r/min离心5 min,弃去上清液,移液器吸取1~3 ml ENSCs培养液重悬细胞,800 r/min离心5 min后弃去上清液,加入ENSCs完全培养液1~3 ml,并小心吹打细胞,调整细胞浓度至1~5×106个/ml,接种到干细胞专用培养瓶,37℃、5%二氧化碳CO2培养,1~3 d半量换液1次,根据细胞生长情况及时传代。选取处于对数生长期的细胞,0.25%胰蛋白酶消化后,800 r/m离心5 min,取1 ml ENSCs培养液小心吹打细胞沉淀,制备成单细胞悬液,取0.1~0.5 ml单细胞悬液滴加到多聚赖氨酸处理过的盖玻片,放入培养箱中培养,倒置相差显微镜下观察细胞爬片后,4%多聚甲醛室温固定5~10 min,1%胎牛血清封闭10 min,分别加入Nestin(1∶100)、Tuj-1(1∶300)、GFAP抗体(1∶100),室温孵育1 h,4℃过夜,加入相应的荧光标记的二抗,室温避光孵育2 h,免疫荧光显微镜下观察细胞染色情况。
1.2.3ENSCs分选和转染选取处于对数生长期的ENSCs细胞,加入Nestin抗体5μg,4℃孵育30 min,与包被羊抗兔免疫球蛋白G(Immunoglobulin G,IgG)免疫磁珠4℃孵育30 min,放入磁性细胞分离系统细胞分离柱内,磷酸盐缓冲溶液冲洗2次,撤去磁场,再次冲洗,所得细胞即为Nestin+ENSCs,将分选后的ENSCs按1×105个/ml接种于6孔板,培养箱中培养24h,将miR-92a mimics(转染组)或Mimics control(阴性对照组)100 pmol与脂质体Lipofectamine 2000 5μl充分混匀,室温孵育30 min,将转染混合物加入到含有ENSCs的6孔板中,室温孵育6 h,加入ENSCs完全培养液,放入培养箱中培养24~48 h,未转染的ENSCs作为空白对照组,Trizol试剂法提取3组细胞总RNA,qRT-PCR检测细胞内miR-92a mRNA的表达。取3组细胞,分别在转染24、48和72h后,胰蛋白酶消化后接种于96孔板,每孔加入20μl无血清的噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]液(5mg/ml),放入培养箱中培养4 h后终止培养,弃去孔内上清液,每孔加入150μl二甲基亚砜,在酶联免疫检测仪490 nm波长处测定每孔光密度(optical delnsity,OD)值,计算各实验组的细胞抑制率,细胞抑制率(%)=(1-实验组OD值/空白对照组OD值)× 100%。
1.2.4qRT-PCR、Western blot检测miR-92a靶基因CDX2的表达实验开始前利用miRBase、Target Scan检索miR-92a的碱基序列并预测其靶基因,结果显示,CDX2是其可能的靶基因,取转染组、阴性对照组、空白对照组3组细胞,Trizol法提取细胞内总RNA,qRT-PCR检测转染细胞内CDX2 mRNA的表达。收集3组细胞,利用无线电免疫沉淀(radioimmunoprecipitation assay,RIPA)裂解细胞提取细胞总蛋白,经聚丙烯酰胺凝胶电泳电泳分离后,转至硝酸纤维素(nitrocellulose filter membrane,NC)膜上,5%脱脂奶粉室温封闭1 h,加入兔抗CDX2抗体(1∶300)4℃过夜,加辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG(1∶4 000),室温条件下摇动2 h,显色剂显色,应用英国Syngene公司的Gene Tools软件分析CDX2蛋白的表达。
1.3统计学方法
采用SPSS 16.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,两组间的比较用t检验;多组间比较用单因素方差分析(One-way,ANOVA),差异有统计学意义后,用SNK检验进行组间两两比较,P<0.05为差异有统计学意义。
2 结果
2.1HD血清中miR-92a mRNA的表达
HD患儿血清中miR-92a mRNA的相对表达量为(23.50±4.66),对照组为(4.41±1.07),经t检验,差异有统计学意义(t=12.661,P=0.000),HD组患儿血清miR-92a mRNA的相对表达高于对照组。见图1。
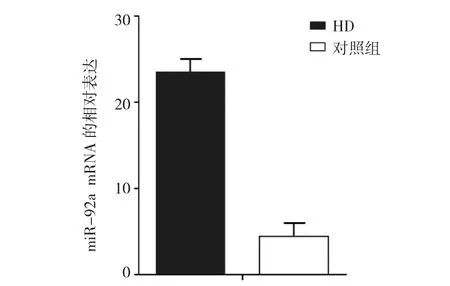
图1 两组血清miR-92a mRNA的相对表达(±s)
2.2ENSCs的培养和鉴定
细胞培养第1天,培养瓶内可见大量的细胞碎片,2~4d细胞数量开始增多,可见球形细胞团块,5~7d出现神经球样结构(neurosphere-like bodies,NLBs),8~10 d可见悬浮生长的肠神经球。随着培养时间的延长,细胞表面逐渐形成细长突起,并与周围细胞之间形成蛛网状连接。免疫学鉴定结果显示,NLBs样球形结构形成早期Nestin染色阳性,细胞表面逐渐形成细长突起,细胞间形成蛛网状连接后,Tuj-1、GFAP染色阳性,表明NLBs样球形结构具有神经干细胞的特性,能够分化为神经元和神经胶质细胞。在形成NLBs样球形结构过程中,随着培养时间的延长,Nestin+细胞占细胞总数的比例越多,差异有统计学意义(F=70.364,P=0.000)。见图2。

图2 ENSCs的培养和鉴定
2.3转染后ENSCs内miR-92a mRNA的表达及对细胞增殖影响
qRT-PCR结果显示,转染后ENSCs内miR-92a mRNA的相对表达为(2.447±0.529),阴性对照组为(0.119±0.0317),空白对照组为(0.122±0.0276),经方差分析,差异有统计学意义(F=96.103,P=0.000),转染组高于阴性对照组(0.119±0.0317)和空白对照组(0.122±0.0276)。两两比较,经SNK检验,转染组高于阴性对照组(q=9.709,P=0.000)和空白对照组(q=9.968,P=0.000);阴性对照组与空白对照组的miR-92a mRNA表达比较,差异无统计学意义(q= 0.664,P=0.877)。MTT结果显示,转染24、48和72 h后,miR-92a过表达对ENSCs细胞抑制率分别为(43.6±9.42)%、(38.4±6.71)%和(18.5±4.11)%,阴性对照组分别为(5.3±0.85)%、(3.7±0.66)%和(3.5±0.62)%,经SNK检验,差异有统计学意义(q= 15.331、10.472和19.028,P=0.000),转染组24、48和72 h的ENSCs细胞抑制率高于阴性对照组。见图3。

图3 转染后ENSCs内miR-92a mRNA的表达及对细胞增殖影响(±s)
2.4转染后ENSCs内CDX2的表达
qRT-PCR检测结果显示,转染后ENSCs内CDX2 mRNA的相对表达为(13.024±3.882),高于阴性对照组(1.103±0.0439)和空白对照组(1.085± 0.0396),差异有统计学意义(F=47.212,P=0.000)。Western blot检测结果显示,转染后ENSCs内CDX2蛋白表达增加,蛋白表达水平为(0.436±0.0828),高于阴性对照组(0.139±0.0308)和空白对照组(0.145±0.0325),差异有统计学意义(F=48.793,P=0.000),转染组CDX2蛋白的表达高于阴性对照组(q=8.532,P= 0.000)和空白对照组(q=7.308,P=0.000),阴性对照组和空白对照组间CDX2蛋白的表达差异无统计学意义(q=0.216,P=0.736)。见图4。
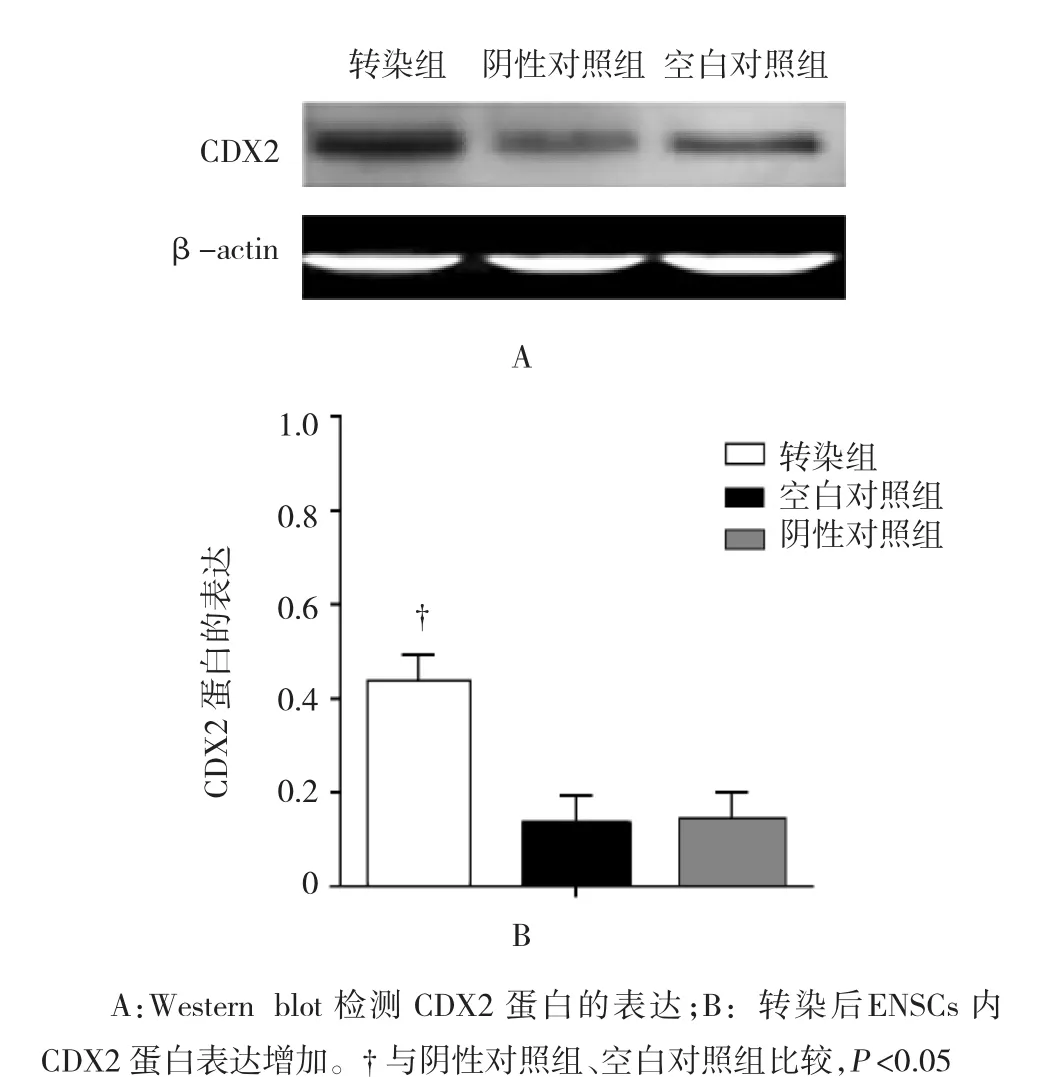
图4 Western blot检测转染后ENSCs内CDX2蛋白的表达
3 讨论
肌间神经丛和黏膜下神经丛共同构成肠神经系统,调节肠道生理功能,研究发现肠神经系统神经元数量>1×1010,肠道运动、感觉等生理功能的实现依赖于肠神经元的相互作用[7]。结肠末端肠管神经节细胞的变性或缺失是HD发病的病理基础[8],大量研究证实,ENSCs是能够特异性分化的单能干细胞,多种因素参与ENSCs向神经节细胞分化的过程[9]。张飞[10]利用浓度为0.5%苯扎氯铵去除肠神经节细胞,制备无神经节细胞的HD模型,与人HD在形态学、组织学、功能等特征无明显差异,移植ENSCs后,结肠的神经功能恢复,表明ENSCs异常的增殖、分化过程是导致HD的发病重要病因。
miRNA在胚胎发育及分化过程中发挥重要作用,既往研究发现,miR-9、miR-128、miR-126通过靶向抑制元素1-沉默转录因子、抑制元素1-辅助沉默因子等调节基因调控神经干细胞的分化和增殖[11]。miR-92a是miR-17-92簇成员,参与调节间充质干细胞等干细胞的分化和增殖过程[12],但对ENSCs的作用却鲜有报道。本实验通过检测HD血清中miR-92a mRNA的表达,结果显示,HD患儿血清miR-92a mRNA表达是正常婴儿的5倍,与TANG等[13]的结果相似,表明循环型miR-92a可能促进HD的发生、发展。笔者从孕15 d清洁级SD大鼠的胎鼠肠管内提取ENSCs,通过免疫荧光证实在ENSCs培养早期Nestin蛋白阳性,Nestin+细胞数随着培养时间的延长也越多。当NLBs开始形成棘状突起后,Tuj-1、GFAP蛋白表达阳性。Nestin蛋白是鉴定神经干细胞常用的标志物,Tuj-1、GFAP蛋白分别是神经元、神经胶质细胞特异性标志蛋白,表明NLBs具有神经干细胞特性,能够分化为神经元、神经胶质细胞。
CDX2基因位于染色体13q12-13,在胚胎发育、分化过程中促进内胚层向后肠的发育[14],在胎儿期广泛表达,在新生儿期表现出组织特异性,仅在肠道表达,过表达的CDX2具有抑制神经干细胞增殖和限制分化的作用[15]。随着生物信息学的迅猛发展,利用Target Scan等分析软件是寻找miRNA靶基因常用方法,笔者通过利用miRBase、TargetScan检索miR-92a的碱基序列并预测其靶基因,结果显示CDX2是其可能的靶基因,通过脂质体在ENSCs内过表达miR-92a,CDX2表达上调,ENSCs的增殖活性亦明显受抑制,表明miR-92a可能通过上调CDX2基因,抑制ENSCs的增殖,结合HD患儿miR-92a的表达情况,可以初步推测miR-92a上调CDX2基因的表达,可能促进HD发病过程。本实验的不足之处:①实验过程中未检测HD患儿肠组织中miR-92a的表达及ENSCs的分布;②笔者仅通过Target Scan等软件预测miR-92a的靶基因,通过在ENSCs内过表达miR-92a亦证实miR-92a上调CDX2基因的表达,与李红等[16]研究结果相同,但是未用荧光素酶双报告基因系统等靶基因分析手段加以证实;③CDX2基因的上调抑制ENSCs细胞的增殖活性,对ENSCs向神经元的分化是否具有作用笔者未加探讨,虽然已有实验证实miRNA在神经干细胞分化过程中具有促进或限制干细胞分化的特性,但是miR-92a对ENSCs分化过程是否存在限制或促进作用,仍未可知,下一步的研究工作将对上述不足之处进行探讨研究。
综上所述,HD患儿血清中miR-92a呈过表达。通过胎鼠肠管提取的ENSCs在细胞培养早期具有神经干细胞特性,能够分化为神经元和神经胶质细胞,通过脂质体转染,使ENSCs过表达miR-92a,CDX2基因表达上调,细胞的增殖活性受到抑制,表明miR-92a通过上调CDX2基因的表达可能促进HD的发生、发展过程,其具体机制仍有待进一步研究。
[1]杨利静,杨合英,贾佳,等.116例疑诊新生儿先天性巨结肠的诊治分析[J].临床小儿外科杂志,2015,4:284-286.
[2]MCKEOWN S J,STAMP L,HAO M M,et al.Hirschsprung disease:a developmental disorder of the enteric nervous system[J]. Wiley Interdisciplinary Reviews Developmental Biology,2013,2(1): 113-129.
[3]高婷婷.肠神经干细胞移植治疗先天性巨结肠研究进展[J].中华小儿外科杂志,2014,35(7):549-552.
[4]唐峰波,杨铭.MiR-200家族与消化道肿瘤的相关研究[J].中华临床医师杂志:电子版,2016,1:110-115.
[5]朱利斌,刘征吉,李仲荣,等.大鼠肠神经干细胞分离和体外培养的初步研究[J].温州医学院学报,2007,37(1):5-8.
[6]LINDLEY R M,HAWCUTT D B,CONNELL M G,et al.Properties of secondary and tertiary human enteric nervous system neurospheres[J].Journal of Pediatric Surgery,2009,44(6):1249-1256.
[7]FURNESS J B.The enteric nervous system[J].Developmental Biology,2012,366(1):64-73.
[8]ZHANG D,BRINAS I M,BINDER B J,et al.Neural crest regionalisation for enteric nervous system formation:Implications for Hirschsprung's disease and stem cell therapy[J].Developmental Biology,2010,339(2):280-294.
[9]FURNESS J B.The enteric nervous system:normal functions and enteric neuropathies[J].Neurogastroenterology Motility,2008,20 Suppl 1(s1):32-38.
[10]张飞.神经干细胞移植治疗无神经节细胞性巨结肠病的实验研究[J].中外妇儿健康,2011,7:139.
[11]张强业.先天性巨结肠(Hirschsprung's disease)中Neurexin、Neuroligin蛋白的表达变化及生长素Ghrelin的表达对巨结肠形成病因的初步探索研究[D].山东:山东大学,2013.
[12]张振武,安洋,滕春波,等.miR-17-92基因簇microRNAs对哺乳动物器官发育及肿瘤发生的调控[J].遗传,2009,31(11):1094-1100.
[13]TANG WB,LI H X,TANG J W,et al.Specific serum microRNA profile in the molecular diagnosis of Hirschsprung's disease[J]. Journal of Cellular&Molecular Medicine,2014,18(8):1580-1587.
[14]李毅.脐带间充质干细胞过表达CDX2后MUC2的表达研究[D].上海:第二军医大学,2014.
[15]武洋,辛彦.CDX2基因与肠型胃癌关系的研究进展[J].世界华人消化杂志,2007,15(18):2037-2041.
[16]李红.miR-92a在胃黏膜肠上皮化生中调控CDX2的作用与机制研究[D].陕西:第四军医大学,2014.
(童颖丹 编辑)
Expression of serum microRNA-92a in Hirschsprung's disease and its role in up-regulation ofCDX2
Sheng-hua Qiu1,Jian Liu2,Yun-ping Chen2,Hong-na Guo2
(1.Department of Pediatric Surgery;2.Clinical Laboratory,Yishui Central Hospital of Linyi,Linyi,Shandong 276400,China)
Objective To investigate the expression of serum miR-92a in Hirschsprung's disease(HD)and its role in regulation ofCDX2and inhibition of enteric neural stem cells(ENSCs).Methods Serum miR-92a was detected by real-time PCR in 16 patients with Hirschsprung's disease from January 2013 to December 2015 in Yishui Central Hospital of Linyi.ENSCs were collected from SD rats of gestational day 15,and identified by immunological method.ENSCs were over-expressed with miR-92a using lipofectin transfection after being separated by magnetic activated cell sorting,and then the expression ofCDX2was valued by real-time PCR and Western blot.The cell proliferation activity was determined by MTT method.Results The level of serum miR-92a mRNA in the patients with Hirschsprung's disease was higher than that in the control group(t=12.661,P=0.000).Nestin was positively stained in the ENSCs of early culture stage,which also had the potential to differentiate into double positive cells with Tuj-1 and glial fibrillary acidic protein (GFAP).The over-expression of miR-92a in the ENSCs increased the level ofCDX2mRNA(F=47.212,P= 0.000)and protein(F=48.793,P=0.000)compared to the control group.Cell proliferation activity was inhibited at 24,48 and 72 h after transfection.Conclusions miR-92a may promote the occurrence and development of HD through up-regulation ofCDX2and consequent inhibition of ENSC proliferation.
Hirschsprung's disease;serum miR-92a;CDX2gene;enteric neural stem cell
R726
A
10.3969/j.issn.1005-8982.2016.21.004
1005-8982(2016)21-0019-06
2016-05-06
