阿托伐他汀强化治疗对ACS患者PCI效果的改善作用及其机制
2016-12-05葛彦彦马晓静鹿克风苑海涛
葛彦彦,马晓静,鹿克风,苑海涛
(山东大学附属山东省立医院,济南250021)
·临床研究·
阿托伐他汀强化治疗对ACS患者PCI效果的改善作用及其机制
葛彦彦,马晓静,鹿克风,苑海涛
(山东大学附属山东省立医院,济南250021)
目的 观察阿托伐他汀强化对急性冠状动脉综合征(ACS)患者经皮冠状动脉介入治疗(PCI)效果的改善作用,并探讨其可能的作用机制。方法 将86例ACS患者随机分为常规治疗组40例、强化治疗组46例。常规治疗组PCI术前12 h给予阿托伐他汀20 mg口服、每晚1次,术后上述剂量长期服用;强化治疗组于PCI术前12 h给予阿托伐他汀80 mg顿服,术后40 mg口服,每晚1次,第4周改为20 mg,每晚1次,长期服用。PCI过程中,两组均行冠状动脉造影测定TIMI血流分级和校正TIMI帧数(CTFC);用药第4周用超声心动图测定左室射血分数(LVEF);用药前及用药第1、4周采用ELISA法检测血清IL-35;记录用药4周内发生的药物不良反应及不良心血管事件(MACE)。结果 两组TIMI血流分级3级比例、LVEF、CTFC比较差异有统计学意义(P均<0.05)。与用药前比较,两组用药后第1、4周血清IL-35水平升高(P均<0.05),强化治疗组升高更明显(P均<0.05)。用药4周内,两组药物不良反应及MACE发生情况比较差异无统计学意义(P均>0.05)。结论 阿托伐他汀强化治疗可通过提高PCI中ACS患者IL-35水平从而改善其冠状动脉血流及左室功能。
急性冠状动脉综合征;阿托伐他汀;强化治疗;经皮冠状动脉介入治疗;白细胞介素35
急性冠状动脉综合征(ACS)是一组以冠状动脉内粥样硬化斑块破裂、出血,随后继发血栓形成为病理生理特点,以急性心肌缺血和(或)心肌坏死为共同特征的临床综合征。研究证实,免疫炎性反应参与了动脉粥样硬化的形成、进展及斑块破裂过程。近年发现的新型抗炎免疫细胞因子IL-35可能通过调整调节性T细胞(Treg)和辅助性T细胞17(Th17)的比例发挥作用[1]。他汀类药物具有抗炎作用,目前国内外尚未见其对抗炎因子IL-35的作用及其机制的研究。本研究观察阿托伐他汀强化对ACS患者经皮冠状动脉介入治疗(PCI)效果的改善作用,并探讨其可能的作用机制。
1 资料与方法
1.1 临床资料 选择2013年6月~2015年1月本院收治的接受PCI的ACS患者86例,男53例、女33例,年龄46~83(63.5±10.6)岁,合并高血压40例、糖尿病30例,有吸烟史34例。ACS诊断标准:符合中华医学会2015年急性ST段抬高型心肌梗死诊断和治疗指南、2012年非ST段抬高型ACS诊断和治疗指南中的诊断标准[2,3]。排除标准:急慢性感染、恶性肿瘤、自身免疫性疾病、严重肝肾功能障碍患者。将患者随机分为常规治疗组40例、强化治疗组46例。两组临床资料比较差异无统计学意义。
1.2 治疗方法 常规治疗组PCI术前12 h给予阿托伐他汀(立普妥,辉瑞公司)20 mg口服、每晚1次,术后上述剂量长期服用;强化治疗组于PCI术前12 h给予阿托伐他汀80 mg顿服,术后40 mg口服,每晚1次,第4周改为20 mg,每晚1次,长期服用。两组均根据病情给予阿司匹林、氯吡格雷、低分子肝素、β受体阻滞剂、硝酸酯类药物等进行治疗。如用药期间出现肌痛、肌炎或肌病症状,并且肌酸激酶(CK)高于正常参考值上限3倍,ALT、AST高于正常参考值上限2倍,大量蛋白尿、血肌酐明显上升等不良反应时,停药观察或减量。
1.3 指标观察 ①冠状动脉血流检测:PCI过程中两组均行冠状动脉造影,左冠状动脉至少投照4个体位,右冠状动脉至少投照2个体位;对左主干、前降支、回旋支、右冠状动脉及其主要分支的狭窄程度进行评价,罪犯血管病变由两位心内科有经验的医生判断。术中用普通肝素抗凝,只干预罪犯血管。测定TIMI血流分级和校正TIMI帧数(CTFC)。TIMI血流分级标准:0级(无灌注),血管闭塞,远端无前向血流;1级(渗透而无灌注),造影剂部分通过闭塞部位,但不能充盈远端血管;2级(部分灌注),造影剂可完全充盈冠状动脉远端,但造影剂充盈及清除的速度较正常冠状动脉延缓;3级(完全灌注):造影剂完全、迅速充盈远端血管并迅速清除。②左室功能检测:两组用药第4周行超声心动图检查,测定左室射血分数(LVEF)。③血清IL-35检测:分别于用药前及用药第1、4周清晨空腹抽取患者肘静脉血5 mL,以3 500 r/min的速度离心20 min,取上清液2 mL于-80 ℃冰箱中保存待检。采用ELISA法检测血清IL-35水平,严格按照试剂盒(武汉华美生物工程有限公司)说明书进行操作。④不良心血管事件(MACE)随访:随访并记录患者用药4周内主要MACE(死亡、非致死性心肌梗死、再发心绞痛、靶血管重建)。
2 结果
2.1 两组冠状动脉血流及左室功能比较 常规治疗组TIMI血流分级3级32例(80.0%)、CTFC(28.4±4.6)帧、LVEF(46.7±7.5)%,强化治疗组TIMI分级3级41例(89.1%)、CTFC(23.2±4.2)帧、LVEF(51.8±8.9)%;两组TIMI血流分级3级比例、LVEF、CTFC比较差异有统计学意义(P均<0.05)。
2.2 两组用药前后血清IL-35水平比较 与用药前比较,两组用药后第1、4周血清IL-35水平升高(P均<0.05);用药第1、4周,强化治疗组血清IL-35水平高于常规治疗组(P均<0.05)。见表1。
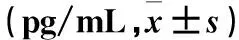
表1 两组用药前后血清IL-35水平比较
2.3 两组用药4周内MACE发生情况比较 用药4周内,常规治疗组CK≥正常3倍1例、ALT≥正常2倍2例、血肌酐升高≥44 μmol/L 1例、死亡0例、再发心绞痛2例、非致死性心肌梗死0例、靶血管重建0例,强化治疗组分别为1、2、1、0、3、1、1例,两组药物不良反应及MACE比较差异无统计学意义(P均>0.05)。
3 讨论
ACS是以冠状动脉内粥样硬化斑块不稳定、破裂,继发血栓形成为病理基础的一组临床综合征。免疫炎性反应贯穿于斑块不稳定及破裂的全过程[4,5]。T细胞介导的免疫炎性反应发挥着重要作用[6],其中Th17与Treg比例失衡意义重大。Th17细胞的过度活化会导致内皮功能受损、促进斑块形成和不稳定,相反Treg细胞则有稳定斑块的作用[7]。最新研究表明,Th17细胞和Treg细胞比例失衡在动脉粥样硬化、ACS等常见心血管疾病的发生发展中发挥重要作用。他汀类药物降低LDL-C,增加斑块稳定性;还可以通过抑制免疫炎性反应稳定斑块[8]。研究提示,对ACS患者进行他汀类药物强化治疗,可使患者进一步获益,显著减少心血管事件,改善预后[9~11]。他汀类药物强化治疗的有效性及安全性在亚洲患者中也得到证实[12]。但是他汀类药物抑制动脉粥样硬化患者免疫炎性反应的机制目前尚未阐明。
IL-35是具有抗炎作用的免疫抑制因子,能促进Treg细胞的分化,并且可以抑制Th17细胞的分化[13],改善Th17和Treg之间的免疫失衡状态。目前已证明,IL-35参与调控关节炎、炎症性肠病、支气管哮喘等自身免疫性疾病[14~16],是针对炎症性疾病、自身免疫性疾病和其他免疫紊乱的关键抑制性治疗因子,因此IL-35是治疗和干预上述疾病很有前景的靶点。本研究发现,ACS患者血清IL-35水平偏低,说明ACS患者中以IL-35为代表的抗炎因子生成减少,这可能会导致Th17与Treg功能失衡,引起Th17的过度活化,可能是导致血管内皮受损、斑块不稳定的原因之一,与文献[17]报道一致。本研究还发现,ACS患者经阿托伐他汀治疗后血清IL-35水平上升,但强化治疗组IL-3升高更明显。强化治疗组在第1周时IL-35水平即高于常规治疗组。强化治疗组与常规治疗组相比,CTFC与LVEF均明显改善,提示阿托伐他汀可能通过提高IL-35水平,改善Th17和Treg之间的免疫失衡状态,从而稳定斑块,改善冠状动脉血流和CTFC,提高左室功能。但是两组患者4周时死亡、非致死性心肌梗死、再发心绞痛、靶血管重建等MACE比较差异无统计学意义,可能是随访时间短,CTFC与左室功能的改善还没有显现出对预后的影响,有待于后续进一步随访。两组药物不良反应比较差异无统计学意义,说明阿托伐他汀强化治疗安全性好。
总之,抗炎因子IL-35可能通过改善Th17细胞与Treg细胞功能的失衡来抑制动脉粥样硬化发生发展过程中的免疫炎症反应,从而稳定动脉粥样硬化斑块,减少斑块破裂和血栓形成。他汀类药物干预特别是强化治疗可提高IL-35的水平,改善患者的冠状动脉血流及左室功能,并且耐受性良好。但是本研究样本较少、随访时间较短,结果需进一步的研究支持。
[1] Wang RX, Yu CR, Dambuza IM, et al. Interleukin-35 induces regulatory B cells that suppress autoimmune disease[J]. Nat Med, 2014,20(6):633-641.
[2] 中华医学会心血管病学分会,中华心血管病杂志编辑委员会.急性ST段抬高型心肌梗死诊断和治疗指南[J].中华心血管病杂志,2015,43(5):380-393.
[3] 中华医学会心血管病学分会,中华心血管病杂志编辑委员会.非ST段抬高型急性冠脉综合征诊断和治疗指南[J].中华心血管病杂志,2012,40(5):353-367.
[4] Chistiakov DA, Orekhov AN, Bobryshev YV. Endothelial barrier and its abnormalities in cardiovascular disease[J]. Front Physiol, 2015(6):365.
[5] Centurión OA. Serum biomarkers and source of inflammation in acute coronary syndromes and percutaneous coronaryinterventions[J]. Cardiovasc Revasc Med, 2016,17(2):119-128.
[6] Hasib L, Lundberg AK, Zachrisson H, et al. Functional and homeostatic defects of regulatory T cells in patients with coronary artery disease[J]. J Intern Med, 2016,279(1):63-77.
[7] Li Q, Wang Y, Wang Y, et al. Treg/Th17 ratio acts as a novel indicator for acute coronary syndrome[J]. Cell Biochem Biophys, 2014,70(2):1489-1498.
[8] 冯慧平,冯慧清,王占启.瑞舒伐他汀对急性心肌梗死患者血清IL-6,GMP-140,BNP水平及心功能的影响[J].山东医药,2014,54(11):38-39.
[9] Patti G, Pasceri V, Colonna G, et al. Atorvastatin pretreatment improves outcomes in patients with acute coronary syndromes undergoing early percutaneous coronary intervention: results of the ARMYDA-ACS randomized trial[J]. J Am Coll Cardiol, 2007,49(12):1272-1278.
[10] Di Sciascio G, Patti G, Pasceri V, et al. Efficacy of atorvastatin reload in patients on chronic statin therapy undergoing percutaneous coronary intervention: results of the ARMYDA-RECAPTURE (Atorvastatin for Reduction of Myocardial Damage During Angioplasty) Randomized Trial[J]. J Am CollCardiol, 2009,54(6):558-565.
[11] Briguori C, Visconti G, Focaccio A, et al. Novel approaches for preventing or limiting events (Naples) II trial: impact of a single high loading dose of atorvastatin on periprocedural myocardial infarction[J]. J Am Coll Cardiol, 2009,54(23):2157-2163.
[12] 余阳阳,白锋,余静,等.阿托伐他汀强化疗法治疗PCI术后急性冠脉综合征患者的疗效观察[J].山东医药,2015,55(37):73-75.
[13] Pandiyan P, Zhu J. Origin and functions of pro-inflammatory cytokine producing Foxp3+ regulatory T cells[J]. Cytokine, 2015,76(1):13-24.
[14] Niedbala W, Wei XQ, Cai B, et al. IL-35 is a novel cytokine with therapeutic effects against collagen-induced arthritis through the expansion of regulatory T cells and suppression of Th17 cells[J]. Eur J Immunol, 2007,37(11):3021-3029.
[15] Wang RX, Yu CR, Dambuza IM, et al. Interleukin-35 induces regulatory B cells that suppress autoimmune disease[J]. Nat Med, 2014,20(6):633-641.
[16] Mohammadnia-Afrouzi M, Hosseini AZ, Khalili A, et al. Altered microRNA expression and immunosuppressive cytokine production by regulatory T cells of ulcerative colitis patients[J]. Immunol Invest, 2016,45(1):63-74.
[17] Lin Y, Huang Y, Lu Z, et al. Decreased plasma IL-35 levels are related to the left ventricular ejection fraction in coronary artery diseases[J]. PLoS One, 2012,7(12):e52490.
国家自然科学基金资助项目(81070188)。
苑海涛(E-mail:yuanhaitao@medmail.com.cn)
10.3969/j.issn.1002-266X.2016.37.014
R714.252
B
1002-266X(2016)37-0044-03
2016-07-20)
