2型糖尿病大血管病变患者血清视黄醇结合蛋白水平变化及意义
2016-12-05马钧黄翠兰徐卫东陈蕾金一王煜芳许华英沙敏吴元健
马钧,黄翠兰,徐卫东,陈蕾,金一,王煜芳,许华英,沙敏,吴元健
(1 南京医科大学附属苏州市立医院,江苏苏州215002;2 无锡市第八人民医院)
·论著·
2型糖尿病大血管病变患者血清视黄醇结合蛋白水平变化及意义
马钧1,黄翠兰2,徐卫东1,陈蕾1,金一1,王煜芳1,许华英1,沙敏1,吴元健1
(1 南京医科大学附属苏州市立医院,江苏苏州215002;2 无锡市第八人民医院)
目的 观察2型糖尿病(T2DM)大血管病变患者血清视黄醇结合蛋白(RBP)水平变化,并探讨其临床意义。方法 将106例T2DM患者分为合并大血管病变组58例、未合并大血管病变组48例,选择体检健康者52例作为正常对照组。用免疫比浊法检测三组血清RBP,按血清RBP水平将T2DM患者分为RBP低水平(RBP≤35 mg/L)组53例、RBP高水平(RBP>35 mg/L)组53例;生化分析仪检测空腹血糖(FPG)、尿酸(UA)、TG、TC、HDL-C、LDL-C、载脂蛋白AⅠ(apoAⅠ)、载脂蛋白B(apoB)、脂蛋白(a)[Lp(a)]、同型半胱氨酸(HCY);用高效液相色谱法检测糖化血红白蛋白(HbA1C);化学发光法检测空腹胰岛素(FINS),计算胰岛素抵抗指数(HOMA-IR);Pearson相关分析RBP与其他指标的相关性;Logistic多元回归分析T2DM大血管病变的影响因素;比较调脂前后T2DM合并大血管病变患者血清RBP水平变化。结果 合并大血管病变组患者血清RBP水平高于未合并大血管病变组及正常对照组(P均<0.05);RBP高水平组年龄、病程、BMI、SBP、FPG、FINS、HOMA-IR、HbA1c、TG、apoB、Lp(a)、LDL-C、UA及HCY与低水平组比较均升高(P均<0.05)。Pearson相关分析结果显示:T2DM大血管病变组血清RBP水平与BMI、病程、SBP、FINS、HOMA-IR、apoB、LDL-C、TG、UA、HCY呈正相关(r分别为0.46、0.38、0.41、0.44、0.36、0.40、0.38、0.62、0.80、0.65,P均<0.05)。Logistic多元回归分析结果显示:年龄、RBP、HCY、Lp(a)、LDL-C是T2DM患者大血管病变的影响因素(OR分别为1.086、1.119、1.514、1.178、3.105,P均<0.05)。T2DM大血管病变患者调脂后血清RBP水平低于调脂前(P<0.05)。结论 T2DMA大血管病变患者血清RBP水平升高,其可能通过导致IR、血脂紊乱等引发或加重T2DM患者大血管病变。
2型糖尿病;视黄醇结合蛋白;大血管病变
视黄醇结合蛋白(RBP)主要由肝脏合成,基因定位于10q,由181个氨基酸组成,在体内的主要功能是转运视黄醇;其经过肾小管滤过代谢,是一种测定肾小管损伤的经典指标。Yang等[1]研究发现,脂肪细胞具有合成并分泌RBP的功能,参与了RBP的代谢;进一步研究发现,RBP参与了肥胖及2型糖尿病(T2DM)患者的胰岛素抵抗(IR)过程,与其他脂肪细胞因子或炎症因子相比,RBP与胰岛素抵抗指数(HOMA-IR)有更显著的相关性。T2DM是一种常见病,易继发各种慢性并发症,70%~80%的T2DM患者可并发大血管病变[2],主要累及心、脑、下肢等外周大血管,是T2DM致死致残的主要病因。本研究探讨T2DM大血管病变患者血清RBP水平水平变化及临床意义,为糖尿病大血管病变的临床治疗及疗效观察提供新方向。
1 资料与方法
1.1 临床资料 选择2014年9月~2015年6月南京医科大学附属苏州市立医院收治的T2DM患者106例,均符合1999年WHO糖尿病的诊断及分型标准,排除成人迟发性自身免疫性糖尿病、T2DM急性并发症、各种感染、严重肝肾功能损害及近期手术患者。其中男56例、女50例,年龄38~76(60±15)岁,糖尿病病程1~12(6.8±1.2)年。根据有无合并大血管病变将T2DM患者分为并发大血管病变组58例(有心绞痛或心肌梗死病史,可经心脏彩超或冠状动脉造影明确诊断;有间歇性跛行等临床表现,彩超显示动脉粥样硬化斑块形成或动脉不规则狭窄;有脑血管意外病史,经脑CT或MRI检查示存在缺血或出血改变[3,4])、未合并大血管病变组48例。T2DM合并大血管病变患者依据病情需调脂治疗46例,调脂方案:以氟伐他汀、阿托伐他汀、普伐他汀等他汀类为一线调脂药,根据患者LDL-C水平及并发症严重程度确定调脂药物的剂量和疗程,TG高的患者加用贝特类药物。治疗3~6个月后经门诊随访资料完整患者38例。同期选择性别、年龄相匹配的体检健康者52例作为正常对照组,男28例、女24例,年龄33~74(58±12)岁。
1.2 BMI、血压、血糖及血脂指标检测 测量各组身高、体质量、血压,计算BMI。过夜空腹10 h抽取静脉血,分离血清保存于-80 ℃冰箱。采用免疫比浊法检测血清RBP。采用日立7600生化分析仪检测空腹血糖(FPG)、尿酸(UA)、TG、TC、HDL-C、LDL-C、载脂蛋白AⅠ(apoAⅠ)、载脂蛋白B(apoB)、脂蛋白(a)[Lp(a)]、同型半胱氨酸(HCY);用高效液相色谱法检测糖化血红白蛋白(HbA1c);发光化学法检测空腹胰岛素(FINS),计算HOMA-IR,HOMA-IR=FINS×FPG/22.5。
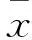
2 结果
2.1 各组临床资料比较 合并大血管病变组、未合并大血管病变组、正常对照组有吸烟史患者比例分别为60.34%(35/58)、52.08%(25/48)、38.46%(20/52),前两组与对照组比较,P均<0.05;高血压史患者比例分别为65.52%(38/58)、41.67%(20/48)、23.07%(12/52),前两组与对照组比较,P均<0.05,前两组间比较,P<0.05。各组临床资料比较见表1、2、3。
2.2 血清RBP不同水平T2DM患者临床资料比较 将106例T2DM患者按血清RBP水平中位数分为RBP

表1 各组病程、BMI、SBP及血糖相关指标比较
注:与正常对照组比较,*P<0.05;与未合并大血管病变组比较,#P<0.05。
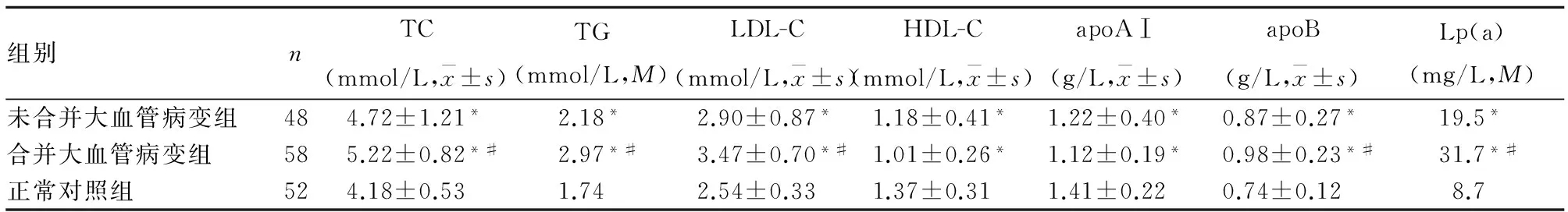
表2 各组血脂水平比较
注:与正常对照组比较,*P<0.05;与未合并大血管病变组比较,#P<0.05。

表3 各组血清RBP、UA、HCY水平比较
注:与对照组比较,*P<0.05;与未合并大血管病变组比较,#P<0.05。
低水平组(RBP≤35 mg/L)53例、RBP高水平组(RBP>35 mg/L)53例。RBP高水平组的年龄、BMI、病程、SBP、FPG、FINS、HOMA-IR、LDL-C、Lp(a)、UA、HCY均高于RBP低水平组(P均<0.05)。见表4、5。

表4 血清RBP不同水平T2DM患者病程、BMI、SBP及血糖相关指标比较
注:与RBP低水平组比较,*P<0.05。

表5 血清RBP不同水平T2DM患者血脂、UA、HCY水平比较
注:与RBP低水平组比较,*P<0.05。
2.3 T2DM大血管病变组血清RBP与其他指标的关系 Pearson相关分析结果显示:T2DM大血管病变组血清RBP水平与BMI、病程、SBP、FINS、HOMA-IR、apoB、LDL-C、TG、UA、HCY呈正相关(r分别为0.46、0.38、0.41、0.44、0.36、0.40、0.38、0.62、0.80、0.65,P均<0.05)。
2.4 T2DM患者大血管病变的影响因素 以大血管病变情况为应变量(有为1、无为0),年龄、BMI、SBP、病程、RBP、FINS、HOMA-IR、TC、TG、LDL-C、Lp(a)、HCY、UA为自变量,建立回归方程。Logistic多元回归分析结果显示:年龄、RBP、HCY、Lp(a)、LDL-C是T2DM患者大血管病变的影响因素(OR分别为1.086、1.119、1.514、1.178、3.105,P均<0.05)。
2.5 T2DM大血管病变患者调脂前后各指标比较 T2DM大血管病变患者调脂前血清RBP水平明显高于调脂后,差异有统计学意义(P<0.05)。与调脂后相比,TC、TG、LDL-C、apoB均明显降低,差异有统计学意义(P均<0.05)。见表6。

表6 T2DM大血管病变患者调脂前后各指标比较
注:与调脂前比较,*P<0.05。
3 讨论
T2DM是以IR为主伴胰岛素分泌不足的慢性代谢性疾病,大部分患者可合并大血管病变,常与脂质代谢异常相关。冠心病、心肌梗死、急性脑血管病变是T2DM患者的主要死因[2]。研究结果显示,RBP能促进IR的发生,并与肥胖等脂质代谢紊乱性疾病相关[5]。
本研究结果显示,T2DM患者血清RBP水平与正常对照组比较差异有统计学意义,T2DM合并大血管病变组血清RBP水平又高于未合并大血管病变组(P<0.05),说明RBP不仅与T2DM有关,且与T2DM大血管病变的发生及发展密切相关。正常对照组与T2DM患者的吸烟史、高血压史、病程、BMI、SBP、血糖相关指标以及脂类指标存在不同程度的差异;合并大血管病变组与未合并大血管病变组高血压史、病程、SBP、FINS、HOMA-IR、HbA1c、TC、TG、LDL-C、apoBⅠ、Lp(a)比较差异有统计学意义。高血压史、病程、SBP及血脂升高均是导致AS的传统指标,而血糖相关指标的升高说明IR在致AS中也发挥了重要作用。将T2DM患者按照血清RBP水平中位数进一步分为低水平组和高水平组,RBP高水平组UA、TG、LDL-C、HCY、FINS及HOMA-IR明显高于低水平组。HDL-C降低,LDL-C、TG升高是T2DM患者并发大血管病变的主要危险因素[6]。随着RBP水平的升高,脂质水平、UA、HCY等致大血管病变的指标水平显著升高。相关性分析显示RBP与致AS的因素UA、TG、HCY呈正相关,与LDL-C、apoBⅠ、病程及SBP也存在相关性,说明RBP水平的高低与大血管病变的发病有明显的关系。RBP致AS机制为RBP是一种新的核受体辅活化子,在视黄酸受体和视黄醇受体等核受体所调控的基因表达过程中发挥作用,引起脂质代谢异常,促进AS的发生[7]。RBP高水平组的FINS及HOMA-IR也明显高于RBP低水平组,RBP与FINS、HOMA-IR呈明显正相关,充分说明RBP与IR之间存在关联,这与相关研究[1,8]结果一致。关于RBP介导IR的机制目前有三种说法:①RBP损伤肌肉组织中胰岛素信号转导途径;②RBP能促进肝糖输出,同时又降低胰岛素抑制肝糖异生的作用;③血清RBP通过葡萄糖非氧化途径降低胰岛素感性[9]。本研究发现,RBP与BMI也存在正相关,提示肥胖与脂质代谢紊乱及IR存在关系,而T2DM患者往往会超重或肥胖,过多的脂肪组织可分泌大量的RBP[1],加重脂质代谢紊乱及IR,增加大血管病变的风险。HCY、Lp(a)作为AS的独立危险因素,此次研究发现RBP与HCY显著相关,不过与Lp(a)无相关性,可能与Lp(a)基因个体表达差异有关。
本研究多元回归分析发现,大血管病变的影响因素为LDL-C、RBP、年龄、HCY、Lp(a)。UA与TG未进入方程,推测两者虽然与大血管病变有关,且与RBP高度相关,但还不是致AS的独立危险因素,与其他因素协同作用可增加大血管病变的危险性。
脂质代谢异常是AS最重要的危险因素,为了探讨RBP与脂质紊乱治疗的关系,本研究对38例T2DM合并大血管病变患者进行调脂治疗,发现调脂治疗后RBP、血脂类指标水平均明显下降。他汀类调脂药在降脂的同时也降低血清RBP水平,充分说明RBP与脂质代谢具有不可分割的关系,脂质代谢紊乱又是致AS的重要因素,而RBP又是介导IR的因素之一,因此推测他汀类调脂药能改善由RBP引起的IR及脂质代谢紊乱,保护大血管的继发性病变。UA作为一种内源性抗氧化剂其致大血管病变的发病机制还存在争议[10]。本研究中,UA在调脂前后并无差异,不过UA与RBP呈正相关,与多种致粥样硬化因子也存在明显的相关性,UA在致AS中也发挥了关键作用。HDL-C作为心血管的保护因子与AS的发生发展呈负相关。本研究未发现RBP与HDL-C存在相关性,推测可能与样本偏少以及调脂等个体差异有关,还需进一步研究验证。
[1] Yang Q, Graham TE, Mody N, et al. Serum retinol binding protein 4 contributes to insulin resistance in obesity and type 2 diabetes[J]. Nature, 2005,436(749):356-362.
[2] Ren YC, Luo XP, Wang CJ, et al. Prevalence of hypertriglyceridemic waist and association with risk of type 2 diabetes mellitus: a meta-analysis[J]. Diabetes Metab Res Rev, 2016,32(4):405-412.
[3] Liu Y, Wang D, Chen H, et al. Circulating retinol binding protein 4 is associated with coronary lesion severity of patients with coronary artery disease[J]. Atherosclerosis, 2015,238(1):45-51.
[4] Sorensen J, Wilks SA, Jacob AD, et al. Screening for peripheral artery disease[J]. Semin Roentgenol, 2015,50(2):139-147.
[5] Park SE, Park CY, Sweeney G. Biomarkers of insulin sensitivity and insulin resistance: Past, present andfuture[J]. Crit Rev Clin Lab Sci, 2015,52(4):180-190.
[6] O'neill S, Bohl M, Gregersen S, et al. Blood-Based biomarkers for metabolic syndrome[J]. Trends Endocrinol Metab, 2016,27(6):363-374.
[7] Zabetian-Targhi F, Mahmoudi MJ, Rezaei N, et al. Retinol binding protein 4 in relation to diet, inflammation,immunity, and cardiovascular diseases[J]. Adv Nutr, 2015,6(6):748-762.
[8] Carvalho E, Kotani K, Peroni OD, et al. Adipose-specific overexpression of GLUT4 reverses insulin resistance and diabetes in mice lacking GLUT4 selectively in muscle[J]. Am J Physiol Endocrinol Metab, 2005,289(4):E551-E561.
[9] Graham TE, Yang Q, Blüher M, et al. Retinol-binding protein 4 and insulin resistance in lean, obese, anddiabetic subjects[J]. N Engl J Med, 2006,354(24):2552-2563.
[10] Li Q, Zhang Y, Ding D, et al. Association between serum uric acid and mortality among Chinese patientswith coronary artery disease[J]. Cardiology, 2016,134(3):347-356.
Changes in levels of serum retinol binding protein in patients with type 2 diabetes mellitus and macroangiopathy
MAJun1,HUANGCuilan,XUWeidong,CHENlei,JINYi,WANGYufang,XUHuaying,SHAMin,WUYuanjian
(1SuzhouMunicipalHospitalAffiliatedtoNanjingMedicalUniversity,Suzhou215002,China)
Objective To observe the changes in levels of serum retinol binding protein (RBP) in patients with type 2 diabetes mellitus (T2DM) and macroangiopathy, and to investigate the clinical significance. Methods Totally 106 T2DM patients were divided into two groups according to with or without macroangiopathy (n=58, 48, repectively), and 52 controls were also selected in this study. After using immunoturbidimetry to detect serum RBP, we divided T2DM patients into RBP low level group (RBP≤35 mg/L,n=53) and RBP high level group (RBP>35 mg/L, n=53). The levels of fasting plasma glucose (FPG), uric acid (UA), TG, TC, HDL-C, LDL-C, apolipoprotein A Ⅰ (apoA Ⅰ), apolipoprotein B (apoB), lipoprotein (A) [Lp (a)] and homocysteine (HCY) were detected by biochemical analyzer; using high performance liquid chromatography (HPLC) to detect glycosylated hemoglobin (HbA1c); using chemiluminescence to detect the fasting insulin (FINS), and calculating homeostasis model assessment of insulin resistance (HOMA-IR) index. Pearson correlation analysis was used to analyze the correlation between RBP and other indicators; Logistic multivariate regression analysis was applied to analyze the influence factors for macroangiopathy of T2DM patients. The serum RBP changes were compared in T2DM patients complicated with macroangiopathy between before and after regulating lipids.Results The serum RBP level was higher in T2DM patients with macroangiopathy than that of T2DM patients without macroangiopathy and that of the control group (allP<0.05). The age, course of disease, SBP, FPG, FINS, HOMA-IR, HbA1c, TG, apoB, Lp (a), LDL-C, UA and HCY were elevated in the group with a higher level of RBP as compared with those with a lower level of RBP (allP<0.05). Pearson correlation analysis showed that serum RBP was positively correlated with BMI, course of disease, SBP, FINS, HOMA-IR, apoB, LDL-C, TG, UA and HCY in T2DM patients with macroangiopathy (r=0.46, 0.38, 0.41, 0.44, 0.36, 0.40, 0.38, 0.62, 0.80 and 0.65, respectively; allP<0.05). Logistic multiple regression analysis showed that age, RBP, HCY, Lp(a) and LDL-C were risk factors for T2DM patients with macroangiopathy (OR=1.086, 1.119, 1.514, 1.178, 3.105, respectively; allP<0.05). The RBP level was significantly decreased after adjustment of lipid as compared with that before (P<0.05). Conclusion Serum RBP may cause or exacerbate macroangiopathy in patients with T2DM and macroangiopathy through IR, dyslipidemia and other mechanisms.
type 2 mellitus diabetes; retinol binding protein; macroangiopathy
国家高技术研究计划项目(863计划)子课题(2014AA022304)。
马钧(1974-),男,副主任技师,主要研究方向为2型糖尿病肾病的早期诊断及临床研究。E-mail: martell_74@163.com
10.3969/j.issn.1002-266X.2016.37.001
R587.2
A
1002-266X(2016)37-0001-04
2016-07-08)
