特异性敲除巨噬细胞CXCR4基因对单侧输尿管梗阻小鼠肾间质纤维化的缓解作用及机制
2016-12-05张翠薇熊小明刘勇阮思蓓马跃荣
张翠薇,熊小明,刘勇,阮思蓓,马跃荣
(1成都中医药大学,成都610000;2西南医科大学附属医院)
特异性敲除巨噬细胞CXCR4基因对单侧输尿管梗阻小鼠肾间质纤维化的缓解作用及机制
张翠薇1,2,熊小明2,刘勇2,阮思蓓2,马跃荣1
(1成都中医药大学,成都610000;2西南医科大学附属医院)
目的 观察特异性敲除巨噬细胞的CXCR4基因对单侧输尿管梗阻(UUO)小鼠肾间质纤维化的缓解作用,并探讨其作用机制。方法 构建巨噬细胞CXCR4基因敲除小鼠模型(KO小鼠)16只并随机分为KO UUO组、KO Sham组各8只;将16只野生型C57小鼠(WT小鼠)随机分为WT UUO组、WT Sham组各8只。构建UUO模型,造模后第12天处死小鼠取左肾组织。用HE染色法评估肾小管病变程度;用Masson染色法评估肾间质胶原沉积程度;用免疫组化染色法评估肾组织巨噬细胞浸润情况并行M1、M2型巨噬细胞计数,计算两型细胞比值(M1/M2);用Western blotting法检测肾组织中基质细胞衍生因子1(SDF-1)、诱导型一氧化氮合酶(iNOS)及CD206蛋白表达。结果 与KO Sham组、WT Sham组比较,KO UUO组、WT UUO组肾小管损伤程度减轻、肾间质胶原沉积程度及浸润的巨噬细胞数量减少,M1/M2升高,肾组织中iNOS、SDF-1蛋白表达升高(P均<0.05),KO UUO组以上指标比WT UUO组变化更明显(P均<0.05)。结论 特异性敲除巨噬细胞的CXCR4基因可缓解UUO小鼠的肾间质纤维化程度,其机制可能为阻止巨噬细胞通过SDF-1/CXCR4轴趋化到肾间质中,减少M1型巨噬细胞向M2型转化。
输尿管梗阻;肾间质纤维化;基质细胞衍生因子1/趋化因子受体轴;巨噬细胞;基因敲除;小鼠
肾间质纤维化是各种慢性肾病终末期的共同表现。研究发现,巨噬细胞在肾脏的聚集促进了肾间质纤维化[1~3]。肾间质纤维化时在肾脏聚集的巨噬细胞主要受基质细胞衍生因子1(SDF-1)/趋化因子受体(CXCR4)轴的趋化[4,5]。2014年9月~2016年4月,本研究尝试通过特异性敲除巨噬细胞的CXCR4基因,进而阻断单侧输尿管梗阻(UUO)小鼠的SDF-1/CXCR4轴对巨噬细胞的趋化作用,从而达到缓解肾间质纤维化的目的。
1 材料与方法
1.1 实验动物及分组 巨噬细胞特异性表达Cre重组酶纯合子(Lyzcre/cre)小鼠、CXCR4 loxp转基因纯合子(CXCR4loxp/loxp)小鼠,均引自美国Jackson Lab。将以上两种转基因小鼠进行饲养并杂交繁殖,子一代小鼠再与CXCR4loxp/loxp小鼠回交获得子二代小鼠,筛选出基因型为Lyzcre/creCXCR4loxp/loxp或Lyzcre/-CXCR4loxp/loxp的小鼠16只。小鼠位于巨噬细胞的Cre重组酶可以被巨噬细胞特异性启动子启动进而能够将巨噬细胞上两个loxp位点间的目的基因序列删除(即巨噬细胞上CXCR4基因被特异性敲除,以下简称KO小鼠)。KO小鼠均按照Jackson Lab推荐的基因鉴定方案进行基因型鉴定。将KO小鼠随机分为KO UUO组和KO Sham组各8只。另从成都达硕实验动物有限公司购得野生型C57小鼠(WT小鼠)16只,将其随机分为WT UUO组和WT Sham组各8只。以上小鼠均为雄性,8周龄,体质量(20±2)g。
1.2 主要试剂 引物,由北京赛百盛基因技术有限公司合成;一步法小鼠基因鉴定试剂盒(PD101-01),购自南京诺唯赞生物科技有限公司;巨噬细胞集落刺激因子(SRP3201),购自美国Sigma公司;抗体anti-F4/80[CI∶A3-1](ab6640)、anti-F4/80(ab100790)、Anti-CXCR4[UMB2](ab124824)、anti-诱导型一氧化氮合酶(iNOS)(ab15323)、anti-CD206 (ab64693)、anti-SDF1(ab25117)和anti-α-Tubulin[DM1A] (ab7291),均购自美国abcam公司。
1.3 UUO模型制备 KO UUO组、WT UUO组行单侧输尿管结扎。小鼠麻醉、消毒后,经腹正中线切口暴露腹腔,游离左侧肾脏及输尿管,在左侧输尿管近肾盂处和输尿管上1/3处分别结扎,剪断输尿管,缝合皮肤。KO Sham组、WT Sham组行假手术,仅开腹、暴露输尿管但不结扎。UUO小鼠于术后第7天开始出现渐进性的肾盂积水,肾皮质萎缩,肾小管管腔塌陷,大量上皮细胞死亡,间质出现纤维结缔组织增生,而肾小球改变不明显。于造模后第12天处死各组小鼠,取1/2新鲜左肾组织提取蛋白行Western blotting检测,取其余1/2左肾组织制备石蜡切片。
1.4 巨噬细胞分离及CXCR4表达检测 骨髓来源的巨噬细胞分离方法参照文献[6],切断小鼠的股骨和胫骨,将骨髓细胞冲洗入培养基;待红细胞裂解后,剩余的细胞计数并接种于培养瓶中,并在培养基中加入10 ng/mL巨噬细胞集落刺激因子;过夜,收集未贴壁细胞,PBS清洗并接种于60 mm培养皿中(10% FBS的DMEM培养基+10 ng/mL巨噬细胞集落刺激因子),7 d后行F4/80和CXCR4免疫荧光双标染色检测CXCR4表达。
1.5 小鼠肾间质纤维化评估方法 ①肾小管病变程度评估:采用HE染色法。取石蜡切片常规HE染色,于光镜(×400)下观察。肾小管病变表现为肾小管扩张、上皮脱落和间质扩增,依据皮质受累程度将肾小管病变程度分为5级,0级:正常;1级:皮质受累范围≤25%;2级:皮质受累范围26%~50%;3级:皮质受累范围51%~75%;4级:皮质受累范围>75%[7]。②胶原沉积程度评估:采用Masson三色染色法。取石蜡切片染色,胶原纤维、黏液、软骨呈亮蓝色,胞质、肌肉和纤维素呈红色,胞核黑蓝色。于高倍镜下(×400)在皮质区随机采集互不重叠的10个视野的图像(避开肾小球和大血管),利用Image J图像分析软件计算出每个视野纤维化的区域(亮蓝色)占总面积的百分比,观察10个视野,取平均值[8]。③巨噬细胞浸润情况评估:采用免疫组化染色法。取石蜡切片,以F4/80作为标记巨噬细胞的一抗,柠檬酸盐煮沸修复抗原,行常规免疫组化染色,巨噬细胞质染色呈棕黄色。于高倍镜下(×400)在皮质区随机采集互不重叠的8个视野的图像(避开肾小球和大血管)。利用Image J图像分析软件计数巨噬细胞数量,观察8个视野,取平均值。M1、M2型巨噬细胞计数方法:M1型巨噬细胞特异性标记iNOS阳性,M2型巨噬细胞特异性标记CD206阳性,二者阳性细胞显示绿色荧光。于高倍镜下(×400)在皮质区随机选取互不重叠的10个视野(避开肾小球和大血管),分别采集不同激发波长的荧光图像,利用Image J图像分析软件计数M1型及M2型阳性细胞个数,计算两型细胞比值(M1/M2)。
1.6 小鼠肾组织中SDF-1、iNOS及CD206蛋白表达检测 采用Western blotting法。取1/2新鲜左肾组织提取总蛋白,测定蛋白浓度后,取等量蛋白经SDS-PAGE电泳分离后转至PVDF膜上。5%脱脂奶粉室温封闭1 h,分别用SDF-1、iNOS、CD206抗体4 ℃孵育过夜,与辣根酶标记二抗室温孵育1 h,然后与发光底物孵育,用Bio-Rad凝胶成像仪成像并使用Image Lab软件检测蛋白条带的表达量。以α-Tubulin为内参,蛋白相对表达量=目的蛋白表达量/内参蛋白表达量。
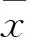
2 结果
2.1 KO小鼠基因鉴定结果 经基因鉴定,KO小鼠的CXCR4 loxp标记是纯合子型,而Lyz Cre标记是纯合子或杂合子型。特异性敲除小鼠巨噬细胞上的CXCR4基因,其他组织、细胞中的CXCR4基因得以保留。对各组小鼠骨髓巨噬细胞进行分离培养,可见细胞一般为圆形或椭圆形,可呈多突形,部分细胞伸出伪足。对原代培养的巨噬细胞进行巨噬细胞特异性抗原F4/80和CXCR4免疫荧光双标染色,巨噬细胞纯度达97%,且KO小鼠的巨噬细胞不表达CXCR4,而WT小鼠有丰富的CXCR4表达。见图1。

注:A为待鉴定小鼠CXCR4基因扩增产物凝胶电泳结果,纯合子(hemo)会在550 bp处出现条带,杂合子(hemi)会在550、481 bp处出现条带;B为待鉴定小鼠Lyz Cre基因扩增产物凝胶电泳结果,纯合子(hemo)会在700 bp处出现条带,杂合子(hemi)会在700、350 bp处均出现条带; C为倒置显微镜(×200)下观察到的原代培养的巨噬细胞。
2.2 各组肾间质纤维化程度比较 见表1。
2.3 各组肾组织中SDF-1、iNOS和CD206蛋白表达比较 见表2。

表1 各组肾间质纤维化程度比较±s)
注:与WT UUO组比较,*P<0.05;与对应的Sham组比较,#P<0.01。

表2 各组肾组织中SDF-1、iNOS和CD206蛋白相对表达量比较±s)
注:与WT UUO组比较,*P<0.05;与对应的Sham组比较,△P<0.05。
3 讨论
肾间质纤维化的特征是细胞外基质在肾间质异常积聚和肾脏结构渐进性改变导致肾功能持续下降。研究发现,在肾脏浸润的巨噬细胞数量的增加程度与临床预后(疾病进展、症状严重程度、纤维化可能性和小管萎缩)呈反比[1,2]。慢性肾病时,肾间质浸润的巨噬细胞主要是血行来源(只有少数来源于肾间质固有巨噬细胞),这些血行来源的巨噬细胞主要是因为慢性肾病时局部的炎性趋化作用转移而来。趋化因子-受体轴(SDF-1/CXCR4)在趋化巨噬细胞归巢中发挥重要作用。SDF-1是一种趋化因子,它有两个特异性的跨膜蛋白受体CXCR4和CXCR7。在慢性肾病时肾组织的SDF-1显著升高,相应的间质巨噬细胞数量也显著升高,说明SDF-1/CXCR4轴在肾病时趋化巨噬细胞到肾脏发挥了重要作用。因为SDF-1/CXCR4轴是高度特异性结合,只要敲除或者阻止CXCR4发挥作用,即可阻止巨噬细胞通过此途径向肾脏趋化聚集。基于此现象,部分研究通过系统性去除巨噬细胞而实现了对肾纤维化的抑制[3,9,10],但是却因为从整体上去除巨噬细胞增加了感染风险和免疫缺陷。而有研究则采用趋化因子阻断剂抑制巨噬细胞的趋化作用[1],但这种广泛性非特异性对趋化作用的阻断会影响很多正常的生理功能,往往会增加严重感染的风险及其他不良反应。鉴于此,本研究只在巨噬细胞上去除趋化因子SDF-1的特异性受体CXCR4而阻止巨噬细胞在病理状态下向肾脏聚集。基因条件性敲除技术与常规的全基因组基因敲除将每一个体细胞上的特定基因位点均敲除掉不同,条件性基因敲除主要通过Cre/floxp位点特异性重组酶系统使靶基因的表达或缺失发生在试验动物发育的某一阶段或某一特定的组织器官。通过该技术可以只敲除巨噬细胞上的CXCR4,进而只阻止巨噬细胞通过SDF-1/CXCR4轴聚集到肾脏。
本研究发现,在模拟肾纤维化的经典模型——UUO模型中[11],肾小管损伤程度、间质纤维化程度与间质巨噬细胞的浸润数量呈正比,说明肾间质聚集的巨噬细胞参与了肾间质纤维化的过程。本研究还发现,在UUO模型的肾组织中SDF-1表达升高,相应的间质巨噬细胞数量也显著升高,这证实了已有的研究结论,即SDF-1/CXCR4轴趋化巨噬细胞到肾脏发挥了重要作用[5]。因此,当本研究利用基因条件性敲除技术只把巨噬细胞上的CXCR4敲除之后,显著减少了巨噬细胞聚集到肾脏的数量;而与KO UUO组巨噬细胞的减少相伴随的是其肾小管损伤程度及间质纤维化程度的降低。不过需要注意的是,在KO UUO组,肾间质仍然聚集了不少巨噬细胞,说明虽然SDF-1/CXCR4轴是趋化巨噬细胞到肾脏的一个重要途径,但是任然存在其他途径可以发挥类似作用。
为进一步了解特异性敲除巨噬细胞CXCR4之后可以缓解间质纤维化程度的机制,本研究做了巨噬细胞M1型特异性标记iNOS和M2型特异性标记CD206的免疫荧光染色,同时对KO UUO组肾组织也做了iNOS及CD206的蛋白定量分析,这两组数据均表明KO UUO组中M1/M2显著升高。但由于KO Sham组和WT Sham组浸润的巨噬细胞很少,加之本研究关注的是在不同条件下实验终末期的M1/M2差异,所以并未测得Sham组iNOS、CD206的免疫荧光。M1型巨噬细胞以分泌促炎因子为主,发挥促炎功能;M2型巨噬细胞以降低炎症反应、发挥组织修复功能为主。多项研究表明,肾间质浸润的M2型巨噬细胞通过多种途径有力地促进了局部纤维化的发生发展[2,12,13]。可见,特异性敲除巨噬细胞的CXCR4可能会阻止M1型巨噬细胞向M2型转化,但是更进一步的机制有待更深入研究。
综上所述,特异性敲除UUO小鼠巨噬细胞CXCR4基因,可阻止巨噬细胞通过SDF-1/CXCR4轴趋化到肾间质中,并且减少M1型巨噬细胞向M2型转化,而缓解UUO模型的肾间质纤维化程度。这一发现为治疗肾间质纤维化提供了新思路。
[1] Duffield JS. Macrophages and immunologic inflammation of the kidney[J]. Semin Nephrol, 2010,30(3):234-254.
[2] Nishida M, Fujinaka H, Matsusaka T, et al. Absence of angiotensin Ⅱ type 1 receptor in bone marrow derived cells is detrimental in the evolution of renal fibrosis[J]. J Clin Invest, 2002,110(12):1859-1868.
[3] Nishida M, Okumura Y, Fujimoto S, et al. Adoptive transfer of macrophages ameliorates renal fibrosis in mice[J]. Biochem Biophys Res Commun, 2005,332(1):11-16.
[4] Wang SC, Yu CF, Hong JH, et al. Radiation therapy-induced tumor invasiveness is associated with SDF-1-regulated macrophage mobilization and vasculogenesis[J]. PLoS One, 2013,8(8):e69182.
[5] Wan X, Xia W, Gendoo Y, et al. Upregulation of stromal cell-derived factor 1 (SDF-1) is associated with macrophage infiltration in renal ischemia-reperfusion injury[J]. PLoS One, 2014,9(12):e114564.
[6] Lee S, Huen S, Nishio H, et al. Distinct macrophage phenotypes contribute to kidney injury and repair[J]. J Am Soc Nephrol, 2011,22(2):317-326.
[7] Tian S, Zhang L, Tang J, et al. HMGB1 exacerbates renal tubulointerstitial fibrosis through facilitating M1 macrophage phenotype at the early stage of obstructive injury[J]. Am J Physiol Renal Physiol, 2015,308(1):F69-F75.
[8] Isaka Y, Tsujie M, Ando Y, et al. Transforming growth factor-beta 1 antisense oligodeoxy nucleotides block interstitial fibrosis in unilateral ureteral obstruction[J]. Kidney Int, 2000,58(5):1885-1892.
[9] Sung SA, Jo SK, Cho WY, et al. Reduction of renal fibrosis as a result of liposome encapsulated clodronate induced macrophage depletion after unilateral ureteral obstruction in rats[J]. Nephron Exp Nephrol, 2007,105(1):e1-e9.
[10] Kitamoto K, Machida Y, Uchida J, et al. Effects of liposome clodronate on renal leukocyte populations and renal fibrosis in murine obstructive nephropathy[J]. J Pharm Sci, 2009,111(3):285-292.
[11] Cochrane AL, Kett MM, Samuel CS, et al. Renal structural and functional repair in a mouse model of reversal of ureteral obstruction[J]. J Am Soc Nephrol, 2005,16(12):3623-3630.
[12] Ikezumi Y, Suzuki T, Karasawa T, et al. Identification of alternatively activated macrophages in new-onset-paediatric and adult immunoglobulin A nephropathy: potential role in mesangial matrix expansion[J]. Histopathology, 2011,58(2):198-210.
[13] Toki D, Zhang W, Hor KL, et al. The role of macrophages in the development of human renal allograft fibrosis in the first year after transplantation[J]. Am J Transplant, 2014,14(9):2126-2136.
Mitigative effect of specific CXCR4 gene knockout in macrophages on renal interstitial fibrosis in mice with unilateral ureteral obstruction
ZHANGCuiwei1,XIONGXiaoming,LIUYong,RUANSibei,MAYuerong
(1ChengduUniversityofTraditionalChineseMedicine,Chengdu610000,China)
Objective To investigate the mitigative effect and mechanism of specific CXCR4 gene knockout of macrophages on renal interstitial fibrosis in mice with unilateral ureteral obstruction (UUO).Methods We set up the mice models of CXCR4 gene knockout (KO mice) and divided them into KO UUO group and KO sham group with 8 rats in each group. Meanwhile, we divided 16 wild type C57 mice (WT mice) into WT UUO group and WT sham group with 8 rats in each group. On the twelfth day after UUO model was made, we sacrificed the mice to obtain the left kidney tissues. Then HE staining was used to evaluate the degree of renal tubular lesions, Masson staining to evaluate the degree of renal interstitial collagen deposition, immunohistochemical staining to evaluate the infiltration of macrophages in renal tissues and calculate the number and cell proportion of M1/M2 macrophages, and Western blotting to detect the expression of stromal cell derived factor 1 (SDF-1), inducible nitric oxide synthase (iNOS) and CD206 protein in renal tissues.Results Compared with the KO sham group and WT sham group, the degree of renal tubular lesions and interstitial collagen deposition was reduced, the number of macrophages was decreased in KO UUO group and WT UUO group. Meanwhile, M1/M2 and the iNOS, SDF-1 protein expression in kidney tissues was increased (allP<0.05). In addition, the above indicators in the KO UUO group changed more significantly than those of the WT UUO group (allP<0.05).Conclusion Specific CXCR4 gene knockout of macrophages could prevent the macrophages from chemotaxis to the renal interstitial via the SDF-1/CXCR4 pathway, reducing M1 macrophage changing into M2 macrophage, thereby alleviating the degree of renal interstitial fibrosis of UUO mouse.
ureteral obstruction; renal interstitial fibrosis; stromal cell derived factor-1/CXC chemokine receptor 4 axis pathway; macrophages; gene knockout; mice
国家自然科学基金面上项目(81473522)。
张翠薇(1984-),女,在读博士,讲师,主要研究方向为肾脏病理。E-mail:623910229@qq.com
简介:马跃荣(1956-),男,硕士,教授,主要研究方向为肾脏病理。E-mail:mayr666@163.com
10.3969/j.issn.1002-266X.2016.37.004
R693
A
1002-266X(2016)37-0011-04
2016-05-13)
