miR-506对结肠癌细胞增殖的影响及其作用机制
2016-12-05祖彩华张国梁刘涛
祖彩华,张国梁,刘涛
(1 天津医科大学一中心临床学院,天津300192;2 天津市第一中心医院)
miR-506对结肠癌细胞增殖的影响及其作用机制
祖彩华1,张国梁2,刘涛2
(1 天津医科大学一中心临床学院,天津300192;2 天津市第一中心医院)
目的 探讨miR-506对结肠癌细胞增殖的影响及其作用机制。方法 将结肠癌细胞SW620随机分为四组,分别转染pcDNA3空载体(pcDNA3组)、miR-506过表达质粒pcDNA3/pri-506(miR-506组)、pSIH1空载体(pSIH1组)及miR-506抑制表达质粒pSIH1/TuD-506(TuD-506组)。采用qRT-PCR法检测各组miR-506 mRNA的相对表达量,CCK-8法检测各组的细胞活性,集落形成试验检测各组的集落形成能力。采用生物信息学软件预测miR-506的潜在靶基因,荧光报告载体试验验证结肠癌细胞SW620中miR-506对靶基因mRNA的调控作用。采用qRT-PCR法和Western blotting法检测miR-506对靶基因mRNA及其蛋白表达的影响。结果 与pcDNA3组比较,miR-506组miR-506 mRNA的相对表达量明显升高,而细胞活性、集落形成能力明显减弱(P均<0.01);TuD-506组与pSIH1组miR-506 mRNA的相对表达量、细胞活性、集落形成能力比较差异均无统计学意义(P均>0.05)。生物信息学软件预测发现,层黏连蛋白γ1(LAMC1)是miR-506的潜在靶基因,经荧光报告载体试验验证,miR-506能够直接作用于LAMC1 mRNA并负性调控其表达。miR-506组LAMC1 mRNA及其蛋白的相对表达量均低于pcDNA3组(P均<0.05),TuD-506组与pSIH1组LAMC1 mRNA及其蛋白的相对表达量比较差异均无统计学意义(P均>0.05)。结论 miR-506可抑制结肠癌的细胞活性、集落形成能力,LAMC1可能是miR-506的直接靶基因;miR-506可能通过抑制LAMC1的表达而抑制结肠癌细胞增殖。
结肠癌;微小RNA-506;细胞增殖;层黏连蛋白γ1
微小RNA(miRNA)是一类内源性、高度保守的单链非编码小RNA,长约22个核苷酸,其主要作用是与下游靶mRNA的3′-非编码区(3′UTR)配对;当二者不完全配对时,可抑制靶mRNA的翻译或促进靶mRNA的降解,导致相应的蛋白表达下降[1,2]。有研究表明,miRNAs在细胞增殖、分化和凋亡中具有重要作用,某些miRNA还具有类似癌基因或抑癌基因作用[3,4]。层黏连蛋白γ1(LAMC1)是层黏连蛋白家族中的一员,在基膜中显著表达,可促进肿瘤转移。有研究发现,LAMC1可能是miR-506的潜在靶点,有可能成为治疗肿瘤的新方向。2015年7月~2016年3月,本研究观察了miR-506对结肠癌细胞增殖的影响,并探寻其下游靶基因,旨在为结肠癌治疗提供新靶点。
1 材料与方法
1.1 材料 结肠癌细胞系SW620,由中国科学院上海生命科学研究院细胞库提供。miR-506过表达质粒pcDNA3/pri-506和miR-506抑制表达质粒pSIH1/TuD-506,由本实验室前期构建。miR-506、U6 snRNA、LAMC1及β-actin特异性PCR引物,由北京天润奥科生物科技有限公司合成。DMEM/F12(1∶1)培养基、FBS,美国Gibco BRL;Opti-MEM Ⅰ无血清培养液、脂质体转染试剂Lipofectamine 2000 Reagent,美国Life Technologies Corporation;兔源人LAMC1和GAPDH抗体,美国Santa Cruz;HRP标记的羊抗兔IgG Fc抗体,美国Abcam;mirVana RNA提取试剂盒,美国Ambion;PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit逆转录试剂盒和SYBR Premix Ex Taq Ⅱ荧光定量PCR试剂盒,日本TaKaRa。LightCycle 96荧光定量PCR仪,瑞士Roche;Alpha Innotech FluorChem FC2凝胶成像分析系统,美国Alpha Innotech;水平/垂直电泳槽和电泳设备,北京六一仪器厂;EnSpireTMMultilabel Reader酶标仪,美国PerkinElmer。
1.2 细胞培养及转染 取结肠癌细胞SW620置于含10% FBS的高糖DMEM培养液中,37 ℃、5% CO2培养箱中培养,每2~3天按1∶3传代一次。取对数生长期细胞,接种于细胞培养板中,待细胞贴壁超过80%时进行转染。质粒转染按照Lipofectamine 2000试剂说明书进行。分别转染pcDNA3空载体(pcDNA3组)、miR-506过表达质粒pcDNA3/pri-506(miR-506组)、pSIH1空载体(pSIH1组)及miR-506抑制表达质粒pSIH1/TuD-506(TuD-506组)。
1.3 相关指标观察
1.3.1 细胞活性 采用CCK-8法。调整各组转染后的细胞密度为1×105个/mL,接种于96孔板中,每孔100 μL。培养48 h,每孔加入CCK-8试剂10 μL,继续培养2 h。酶标仪检测各组450 nm波长处的吸光度(A450)值。试验重复3次,取平均值。
1.3.2 细胞集落形成能力 各组转染24 h,消化计数,并接种于12孔板,每孔100个细胞。每3天更换一次培养液,观察至细胞出现单个集落,停止培养。用2%结晶紫染液染色10 min,1×PBS溶液脱色后,显微镜下拍照观察。以大于50个细胞作为集落形成,计数集落个数。试验重复3次,取平均值。
1.3.3 miR-506的靶基因预测及验证 应用生物信息学软件TargetScanHuman (http://www.targetscan.org/vert_71/),输入miRNA的名称hsa-miR-506,预测miR-506的靶基因。根据生物信息学软件预测的结果,将LAMC1 3′UTR上的miR-506结合位点克隆插入GFP荧光报告基因编码区下游,同时将miR-506“种子序列”位点突变插入GFP编码区下游,分别构建带有野生型(pcDNA3/EGFP-LAMC1-wtUTR)和突变型(pcDNA3/EGFP-LAMC1-mutUTR)结合位点的荧光报告载体。转染前1天,将结肠癌细胞SW620接种于24孔板中。转染当天,将载有荧光报告载体的质粒和载有miR-506过表达或miR-506抑制表达质粒共同转染细胞,每组设3个复孔。转染24 h,将细胞原培养液吸弃,用1×PBS浸洗1次,加入放免分析裂解缓冲液100 μL/孔,冰浴摇床摇动60 min。用移液器反复吹打各孔细胞,将细胞裂解液移至1.5 mL离心管中,4 ℃ 12 000 r/min离心10 min,吸取上清至另一管,得到细胞蛋白样品。取各孔蛋白样品100 μL置于酶标板,用酶标仪检测蛋白样品中绿色荧光蛋白(GFP)的表达强度(激发光为488 nm,发射光为507 nm),以对照组GFP的表达量为1,计算各组校正后GFP的相对表达量。试验重复3次,取平均值。
1.3.4 miR-506、LAMC1 mRNA表达 采用qRT-PCR技术。采用RNA提取试剂盒提取结肠癌细胞的RNA。以此为模板,逆转录生成cDNA。按照qRT-PCR SYBR Green法进行PCR扩增。引物序列:miR-506-Fwd:5′-TGCGGTAAGGCACCCTTCTGA-GTAG-3′;U6-Fwd:5′-TGCGGGTGCTCGCTCGGCAG-C-3′;miR-506/U6-Rvs:5′-CCAGTGCAGGGTCCGAG-GT-3′;LAMC1-Fwd:5′-CATGTATCTGAATACCTCC-3′;LAMC1-Rvs:5′-CATAGCTTGTAACCTG-3′;β-ac-tion-Fwd:5′-CGTGACATTAAGGAGAAGCTG-3′;β-action-Rvs:5′-CTAGAAGCATTTGCGGTGGAC-3′;LA-MC1-wtUTR-top:GATCCACTGTGGACCTTTTATATG-TGCCTTCACTTTAGCTGTTTGCCTTAATCTG;LAMC-1-wtUTR-bottom:AATTCAGATTAAGGCAAACAGCT-AAAGTGAAGGCACATATAAAAGGTCCACAGTG; LA-MC1-mutUTR-top:GATCCACTGTGGACCTTTTATAT-CAGGGATCACTTTAGCTGTTCACGAAAATCTG; LA-MC1-mutUTR-bottom:AATTCAGATTTTCGTGAACA-GCTAAAGTGATCCCTGATATAAAAGGTCCACAGTG。反应条件:95 ℃预变性3 min,95 ℃ 5 s、56 ℃ 30 s、72 ℃ 30 s,扩增40个循环后进行熔解曲线分析,以2-ΔΔCt法进行计算。试验重复3次,取平均值。
1.3.5 LAMC1蛋白表达 采用Western blotting法。收集各组转染后细胞,用RIPA裂解液裂解,提取细胞蛋白。蛋白样品经SDS-PAGE分离并转移至硝酸纤维素膜。以兔抗人LAMC1和GAPDH为一抗,以HRP标记的羊抗兔IgG Fc抗体为二抗,进行Western blotting检测。硝酸纤维素膜经ECL显影液孵育后,应用LabWorksTM凝胶成像系统采集信号。图像经AlPhaView分析软件进行灰度值测定。通过计算每组样品灰度值(目的蛋白条带亮度值-背景值)与对应蛋白灰度值(内参蛋白GAPDH条带亮度值-背景值)的比值,得到校正后目的蛋白的相对表达量。以对照组目的蛋白的表达量为1,计算各组校正后目的蛋白的相对表达量。试验重复3次,取平均值。

2 结果
2.1 各组miR-506 mRNA相对表达量及细胞活性、集落形成能力比较 见表1。

表1 各组miR-506 mRNA相对表达量及细胞活性、集落形成能力比较±s)
注:仅同载体间进行比较;与pcDNA3组比较,*P<0.01。
2.2 miR-506的靶基因预测 生物信息学软件预测发现,LAMC1可能为miR-506的潜在靶基因。
2.3 各组pcDNA3/EGFP-LAMC1-wtUTR、pcDNA3/EGFP-LAMC1-mutUTR相对表达量比较 见表2。
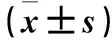
表2 各组pcDNA3/EGFP-LAMC1-wtUTR、pcDNA3/EGFP-LAMC1-mutUTR相对表达量比较
注:仅同载体间进行比较;与pcDNA3组比较,*P<0.01。
2.4 各组LAMC1 mRNA及其蛋白表达比较 见表3。
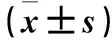
表3 各组LAMC1 mRNA及其蛋白相对表达量比较
注:仅同载体间进行比较;与pcDNA3组比较,*P<0.05。
3 讨论
目前结肠癌发生、发展的分子机制尚不完全清楚。近年研究发现,miRNAs表达失调对结肠癌细胞的侵袭和迁移能力具有一定影响[5~10]。由此推测,miRNAs可能参与了结肠癌的发生、发展。
miR-506是miRNAs的一员,其在不同肿瘤细胞中表达不同。Sun等[11]研究发现,与正常乳腺上皮细胞比较,miR-506在乳腺癌细胞系(T47D、MDA-MB-231、SK-BR-3、HCC1937)中显著低表达。进一步研究发现,miR-506可通过抑制IQGAP1/ERK信号传导通路来抑制乳腺癌细胞的增殖、侵袭。Arora等[12]研究证实,miR-506能抑制乳腺癌细胞系MDA-MB-231的上皮间质转化及癌细胞的黏附、侵袭和迁移。Yin等[13]研究发现,miR-506通过抑制NF-κB p65信号传导通路,增加活性氧的产生,激活p53信号通路,继而导致肺癌细胞的凋亡、抑制肺癌细胞的活性,但在正常肺组织细胞中却无此作用。说明miR-506可选择性杀伤肺癌细胞,有可能成为治疗肺癌的潜在靶点。Wang等[14]研究发现,miR-506在原发性肝癌组织中低表达,在肝癌细胞系HepG2和H7402中,miR-506通过靶定yes相关蛋白(YAP)mRNA的3′UTR来抑制癌细胞的增殖。有研究报道,80%宫颈癌组织miR-506低表达,且与Ki-67的表达呈负相关。表明miR-506可抑制宫颈癌细胞的增殖。但也有研究报道,在黑色素瘤组织中miR-506表达升高,并可促进黑色素瘤的发生、发展[15]。以上研究表明,miR-506可能具有抑癌和促癌双重作用。
本研究发现,与pcDNA3组比较,miR-506组细胞活性、集落形成能力明显减弱;而pSIH1组与TuD-506组细胞活性、集落形成能力比较差异均无统计学意义。因此,尚不能证实抑制miR-506对结肠癌细胞的增殖有影响。其原因可能是结肠癌细胞SW620中miR-506低表达,抑制其表达对其产生的影响微乎其微。其具体原因尚需进一步研究。
层黏连蛋白是由α、β和γ链组成的三聚体化合物,是细胞外基质的重要调节因子,对细胞的分化、迁移和黏附有一定影响[16]。层黏连蛋白表达升高可促进癌细胞的迁移和侵袭[17,18]。LAMC1是层黏连蛋白家族中的一员,Ke等[19]报道,在黑色素瘤细胞中LAMC1表达升高,其表达变化与肿瘤短期内复发及无瘤生存期缩短有关。Nishikawa等[20]研究证实,LAMC1在前列腺癌中高表达。进一步研究发现,miR-29s通过直接靶定LAMC1的信号传导通路而抑制癌细胞的活性。生物信息学软件预测发现,LAMC1可能是miR-506的下游靶点。本研究结果显示,对于带有野生型结合位点LAMC1 3′UTR的荧光报告载体,过表达miR-506能够抑制GFP的表达强度;而对于带有突变型结合位点LAMC1 3′UTR的荧光报告载体,miR-506不能影响报告基因的GFP表达强度。证实miR-506能够直接作用于LAMC1 3′UTR的特定序列,并对结合位点上游荧光报告基因的表达起负性调控作用。本研究还发现,miR-506组LAMC1 mRNA及其蛋白的相对表达量降低,进一步证实LAMC1是miR-506的下游靶点。
综上所述,miR-506能抑制结肠癌的细胞活性和集落形成能力,其作用的靶基因可能是LAMC1。但miR-506是否还调控其他靶基因来影响结肠癌细胞的生物活性尚需进一步研究。
[1] Bartel DP. MicroRNAs: target recognition and regulatory functions[J]. Cell, 2009,136(2):215-233.
[2] Inui M, Martello G, Piccolo S. MicroRNA control of signal transduction[J]. Nat Rev Mol Cell Biol, 2010,11(4):252-263.
[3] Zhang B, Pan X, Cobb GP, et al. MicroRNAs as oncogenes and tumor suppressors[J]. Dev Biol, 2007,302(1):1-12.
[4] Nelson KM, Weiss GJ. MicroRNAs and cancer: past, present, and potential future[J]. Mol Cancer Ther, 2009,7(12):3655-3660.
[5] Zhang L, Dong Y, Zhu N, et al. microRNA-139-5p exerts tumor suppressor function by targeting NOTCH1 in colorectal cancer[J]. Mol Cancer, 2014(13):491-500.
[6] Liu X, Zhang Z, Sun L, et al. MicroRNA-499-5p promotes cellular invasion and tumor metastasis in colorectal cancer by targeting FOXO4 and PDCD4[J]. Carcinogenesis, 2011,32(12):1798-1805.
[7] Wu W, Yang J, Feng X, et al. MicroRNA-32 (miR-32) regulates phosphatase and tensin homologue (PTEN) expression and promotes growth, migration, and invasion in colorectal carcinoma cells[J]. Mol Cancer, 2013(12):30.
[8] Zhang Y, Wang Z, Chen M, et al. MicroRNA-143 targets MACC1 to inhibit cell invasion and migration in colorectal cancer[J]. Mol Cancer, 2012(11):23.
[9] Panza A, Votino C, Gentile A, et al. Peroxisome proliferator-activated receptor γ-mediated induction of microRNA-145 opposes tumor phenotype in colorectal cancer[J]. Biochim Biophys Acta, 2014,1843(6):1225-1236.
[10] Zhang GJ, Xiao HX, Tian HP, et al. Upregulation of microRNA-155 promotes the migration and invasion of colorectal cancer cells through the regulation of claudin-1 expression[J]. Int J Mol Med, 2013,31(6):1375-1380.
[11] Sun G, Liu Y, Wang K, et al. miR-506 regulates breast cancer cell metastasis by targeting IQGAP1[J]. Int J Oncol, 2015,47(5):1963-1970.
[12] Arora H, Qureshi R, Park WY. miR-506 regulates epithelial mesenchymal transition in breast cancer cell lines[J]. PLoS One, 2013,8(5):e64273.
[13] Yin M, Ren X, Zhang X, et al. Selective killing of lung cancer cells by miRNA-506 molecule through inhibiting NF-κB p65 to evoke reactive oxygen species generation and p53 activation[J]. Oncogene, 2015,34(6):691-703.
[14] Wang Y, Cui M, Sun BD, et al. MiR-506 suppresses proliferation of hepatoma cells through targeting YAP mRNA 3′UTR[J]. Acta Pharmacol Sin, 2014,35(9):1207-1214.
[15] Streicher KL, Zhu W, Lehmann KP, et al. A novel oncogenic role for the miRNA-506-514 cluster in initiating melanocyte transformation and promoting melanoma growth[J]. Oncogene, 2012,31(12):1558-1570.
[16] Simon-Assmann P. The laminin family: founding members of the basement membrane[J]. Cell Adh Migr, 2013,7(1):44-47.
[17] Tzu J, Marinkovich MP. Bridging structure with function: structural, regulatory, and developmental role of laminins[J]. Int J Biochem Cell Biol, 2008,40(2):199-214.
[18] Yamaguchi M, Ebihara N, Shima N, et al. Adhesion, migration, and proliferation of cultured human corneal endothelial cells by laminin-5[J]. Invest Ophthalmol Vis Sci, 2011,52(2):679-684.
[19] Ke HL, Ke RH, Li B, et al. Association between laminin γ1 expression and meningioma grade, recurrence, and progression-free survival[J]. Acta Neurochir (Wien), 2013,155(1):165-171.
[20] Nishikawa R, Goto Y, Kojima S, et al. Tumor-suppressive microRNA-29s inhibit cancer cell migration and invasion via targeting LAMC1 in prostate cancer[J]. Int J Oncol, 2014,45(1):401-410.
Effects of miR-506 on proliferation of colorectal carcinoma cells and its mechanism
ZUCaihua1,ZHANGGuoliang,LIUTao
(1FirstCentralClinicalCollegeofTianjinMedicalUniversity,Tianjin300192,China)
Objective To investigate the effects of microRNA-506 (miR-506) on proliferation of colorectal carcinoma cells and to identify the target gene for miR-506. Methods The colorectal carcinoma SW620 cells were respectively divided into pcDNA3 group, miR-506 group, pSIH1 group and TuD-506 group according to different tranfection plasmids. The real-time fluorescent quantitative PCR was used to detect the expression of miR-506. Cell viability and colony-forming ability was measured by CCK8 and colony formation assays, respectively. Furthermore, bioinformatics method was applied to predict potential target genes of miR-506.Green fluorescent protein (GFP) reporter assays were used to verify the direct regulation of miR-506 on target mRNA in SW620 cells. The LAMC1 mRNA and protein levels were detected by quantitative reverse transcription polymerase chain reaction (qRT-PCR) and Western blotting, respectively. Results Compared with the pcDNA3 group, the relative expression of miR-506 in the miR-506 group was significantly higher, while the activity and colony formation ability of the miR-506 group was significantly decreased (allP<0.01). No statistically significant difference was found in the relative expression of miR-506, cell viability and colony forming ability between the TuD-506 group and pSIH1 group (allP>0.05). LAMC1 was predicted to be a potential target gene of miR-506, and GFP reporter assays verified miR-506 directly targeted LAMC1 mRNA and negatively regulated its expression. The expression of miR-506 in the miR-506 group was significantly lower than that of the pcDNA3 group (allP<0.05). No statistically significant difference was found in the LAMC1 mRNA and protein expression between the TuD-506 group and pSIH1group (allP>0.05). Conclusion miR-506 plays a tumor suppressor role in SW620 cells by inhibiting cell viability and colony formation, LAMC1 is a direct target gene for miR-506, and miR-506 inhibits proliferation of colorectal cancer cells by down-regulating the expression of LAMC1.
colorectal carcinoma; miR-506; cell proliferation; laminin γ1
国家自然科学基金资助项目(81402322);2013年度天津市企业博士后创新项目择优资助计划。
祖彩华(1989-),女,硕士在读,研究方向为消化系统疾病。E-mail: caihuazu@163.com
简介:刘涛(1981-),男,主管技师,博士,研究方向为非编码RNA对肿瘤细胞的调控。E-mail: 13821217761@163.com
10.3969/j.issn.1002-266X.2016.40.002
R735.3
A
1002-266X(2016)40-0005-04
2016-03-25)
