外周血循环肿瘤细胞EGFR表达对晚期非小细胞肺癌患者TKI治疗效果及预后的影响
2016-12-05江波金从国涂长玲何文杰杨承纲李高峰
江波,金从国,涂长玲,何文杰,杨承纲,李高峰
(云南省肿瘤医院 昆明医科大学第三附属医院,昆明650118)
外周血循环肿瘤细胞EGFR表达对晚期非小细胞肺癌患者TKI治疗效果及预后的影响
江波,金从国,涂长玲,何文杰,杨承纲,李高峰
(云南省肿瘤医院 昆明医科大学第三附属医院,昆明650118)
目的 探讨外周血循环肿瘤细胞(CTC)表皮生长因子受体(EGFR)表达对晚期非小细胞肺癌(NSCLC)患者EGFR酪氨酸激酶抑制剂(TKI)治疗效果及预后的影响。方法 选择晚期NSCLC患者66例,从三种TKI类药物(吉非替尼、厄洛替尼、盐酸埃可替尼)中任选一种治疗1个月。治疗前随机选取10例患者采集空腹静脉血,采用流式细胞分选技术分选外周血CTC并验证。采用流式细胞术检测所有患者治疗前及治疗1个月外周血CTC EGFR表达,比较EGFR高表达者和低表达者的治疗效果(有效率及控制率)及生存情况。结果 经流式细胞术分选的CD45-CK18+细胞光镜下可见,其细胞核染色加深,染色质变粗,核质比增大,具备恶性肿瘤细胞特征,证实CD45-CK18+细胞为外周血CTC。66例晚期NSCLC患者中,EGFR高表达者30例、低表达者36例。EGFR高表达者和低表达者TKI治疗有效率分别为53.3%(16/30)、27.8%(10/36),控制率分别为80.0%(24/30)、44.4%(16/36),两者比较P均<0.05。EGFR高表达者和低表达者中位无进展生存期分别为11、4个月,中位总生存期分别为21、10个月,1年生存率分别为77.8%、63.3%,2年生存率分别为38.1%、31.2%,3年生存率分别为22.2%、3.3%,两者比较P均<0.05。结论 外周血CTC中EGFR高表达的晚期NSCLC患者TKI靶向治疗效果及预后均优于EGFR低表达者。
非小细胞肺癌;循环肿瘤细胞;表皮生长因子受体;酪氨酸激酶抑制剂
有研究显示,无论是在肿瘤原发病灶切除前还是切除后,患者体内都可检测到循环肿瘤细胞(CTC)[1~3]。CTC存在表皮生长因子受体(EGFR)信号传导通路异常,如EGFR过度表达、EGFR突变等,可促进肿瘤细胞增殖并抑制其凋亡,导致生长调节失控[4]。近年来,分子靶向治疗逐渐得到推广,EGFR是目前研究最多的肺癌治疗靶点。EGFR酪氨酸激酶抑制剂(TKI)是晚期非小细胞肺癌(NSCLC)的常用靶向治疗药物。本研究探讨外周血CTC中EGFR表达对晚期NSCLC患者TKI治疗效果及预后的影响。现报告如下。
1 资料与方法
1.1 临床资料 选择2012年5月~2014年5月云南省肿瘤医院收治的晚期NSCLC患者66例,男40例、女26例,年龄41~78岁;均经组织病理检查明确诊断;病理类型:腺癌58例,鳞癌8例;TNM分期:Ⅲb期4例,Ⅳ期62例;功能状态(PS)评分:0~1分44例,≥2分22例。纳入标准:①组织病理检查明确为NSCLC;②影像学检查(CT或MRI)有可测量的病灶;③入组前未接受过TKI类药物治疗;④预计生存期>3个月;⑤无TKI治疗禁忌证。排除标准:①组织病理检查无法确诊为NSCLC;②既往已进行TKI类药物治疗。
1.2 治疗方法 30例患者口服吉非替尼250 mg,1次/d;10例患者口服厄洛替尼150 mg,1次/d;26例患者口服盐酸埃可替尼125 mg,3次/d。疗程均1个月。
1.3 外周血CTC分选及验证 采用流式细胞分选技术。治疗前随机选取10例患者采集空腹静脉血20 mL,肝素抗凝,将其分成20管,每管1 mL。每管均加入CD45-PC5、CK18-FITC各200 μL,避光保存30 min;加入氯化铵(NH4Cl)溶血素4 mL,反复溶血直到液体透亮,离心后加入培养液,流式细胞仪进行分选。设置SORT的左右收集细胞群,一般左侧为CD45-CK18+细胞,右侧为非CD45-CK18+细胞。根据要求设置收集数目为1 000个,同时在样本收集处安装分选试管,开始收集细胞。流速为10 000~25 000个/s,收集过程中需全程振荡。将分选的CD45-CK18+细胞用玻片收集微球后,进行HE染色,光镜下观察细胞特征。
1.4 外周血CTC EGFR表达检测 采用流式细胞术。66例患者于TKI类药物治疗前及治疗1个月采集肘正中静脉血5 mL。取5 mL无菌试管,加入 CD45-PC5、EGFR-PE和CK18-FITC各20 μL,然后加入肝素抗凝的外周静脉血100 μL摇匀,避光室温保存30 min。加入NH4Cl溶血素2 mL溶血,15 min后上流式细胞仪检测,记录外周血CTC EGFR表达。以外周血CTC EGFR表达的中位数作为界值,大于中位数定义为EGFR高表达,小于中位数定义为EGFR低表达。
1.5 疗效评价及随访 ①疗效评价:治疗1个月后参照WHO实体瘤疗效评价标准[5]评价疗效,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD),以CR+PR计算有效率,以CR+PR+SD计算控制率。②预后情况:治疗后随访3年,记录患者的无进展生存期(PFS)、总生存期(OS)和1、2、3年生存率。PFS指治疗首日至病情进展的时间,OS指治疗首日至死亡日或失访日。比较EGFR高表达者和低表达者的有效率、控制率,中位PFS、中位OS和1、2、3年生存率。

2 结果
2.1 外周血CTC验证 光镜下可见,CD45-CK18+细胞核染色加深,染色质变粗,核质比增大,具备恶性肿瘤细胞特征,证实CD45-CK18+细胞为外周血CTC。见插页Ⅲ图10。
2.2 EGFR高表达者和低表达者疗效比较 66例晚期NSCLC患者中,EGFR高表达者30例、低表达者36例。30例EGFR高表达者CR 2例、PR 14例、SD 8例、PD 6例,有效率为53.3%(16/30),控制率为80.0%(24/30);36例EGFR低表达者CR 0例、PR 10例、SD 6例、PD 20例,有效率为27.8%(10/36),控制率为44.4%(16/36);EGFR高表达者有效率及控制率均高于EGFR低表达者(P均<0.05)。
2.3 EGFR高表达者和低表达者预后比较 EGFR高表达者和低表达者中位PFS分别为11、4个月,中位OS分别为21、10个月,1年生存率分别为77.8%、63.3%,2年生存率分别为38.1%、31.2%,3年生存率分别为22.2%、3.3%。EGFR高表达者中位PFS、中位OS和1、2、3年生存率均高于EGFR低表达者(P均<0.05)。见图1、2。
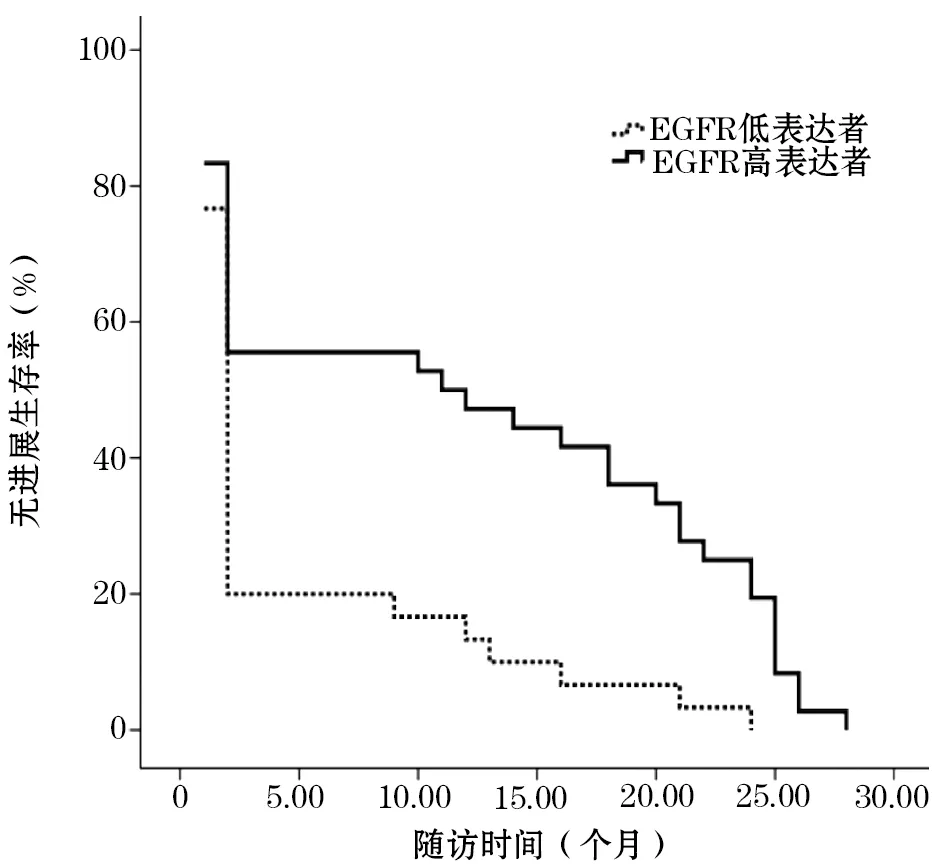
图1 EGFR高表达和低表达者PFS比较

图2 EGFR高表达和低表达者OS比较
3 讨论
EGFR是NSCLC治疗的一个重要靶点,针对该靶点的治疗药物已在临床上广泛应用,是目前临床靶向治疗用药的一个研究热点。临床研究证实,TKI类药物治疗EGFR突变型NSCLC患者的有效率为65%~83%,而对野生型患者的有效率为10%~15%[6]。因此,NCCN指南已把EGFR基因突变阳性作为应用TKI类药物的先决条件。目前在中国获批用于临床的TKI类药物有吉非替尼、厄洛替尼及盐酸埃克替尼。在分子结构上,三种药物均含有喹唑啉母环的基本结构,其中厄洛替尼与盐酸埃克替尼的差别仅在侧链的开环与闭环;在药代动力学上,吉非替尼与厄洛替尼的半衰期较盐酸埃克替尼更长,因此服药时间有所差异(吉非替尼和厄洛替尼为每天1片,盐酸埃克替尼为每天3片);在疗效上,三种药物的客观缓解率、PFS及疗效均无明显统计学差异[7~14]。因此,本研究对治疗药物的选择未进行强行规定,任意一种TKI类药物治疗的晚期NSCLC患者即可纳入研究。
临床上检测EGFR突变的方法有很多,但每种检测方法均依赖于组织标本[7]。目前多数NSCLC患者EGFR基因突变检测均以手术切除的肺癌组织作为检测标本,此时患者多处于早期而未进行靶向治疗,而晚期患者又很难获得足量标本。晚期NSCLC的一线治疗中,40%~50%的NSCLC患者能从TKI靶向治疗中获益,如何从无法获取足量组织标本的患者中筛选出适合TKI靶向治疗者是临床医生所面临的问题。理论上负载肿瘤细胞、基因或蛋白的标本均有可能成为肿瘤组织的替代物,如外周血,其取材方便、标本来源充足。有研究显示,以晚期NSCLC患者外周血CTC和血浆为标本,其EGFR突变的检出率分别为92%和33%,提示CTC可能是更好的组织替代标本。研究发现,接受TKI类药物治疗的NSCLC患者CTC携带的基因信息与肿瘤组织具有高度一致性[7]。目前针对外周血CTC及组织标本进行EGFR突变检测的研究较多,但对其EGFR表达的相关研究报道极少[15,16]。因此,本研究以晚期NSCLC患者的外周血为检测标本。
本研究结果显示,晚期NSCLC患者EGFR高表达者有效率及控制率均明显高于EGFR低表达者。说明EGFR高表达者进行TKI类药物靶向治疗的效果优于EGFR低表达者,临床对晚期NSCLC患者可依据CTC的EGFR表达水平判断是否行TKI类药物治疗,该方法可能对无法进行组织EGFR突变检测的患者是一种有效补充。同时本研究发现,EGFR高表达者中位PFS、中位OS和1、2、3年生存率均明显高于EGFR低表达者,表明EGFR高表达的晚期NSCLC患者经TKI类药物靶向治疗后预后更好。
综上所述,外周血CTC中EGFR高表达的晚期NSCLC患者TKI靶向治疗的效果及预后均优于EGFR低表达者。提示检测外周血CTC中的EGFR表达水平有助于临床筛选适合接受TKI靶向治疗的晚期NSCLC患者,从而提高治疗效果。
[1] Siegel R, Naishadham D, Jemal A, et al. Cancer Statistics, 2013[J]. CA Cancer J Clin, 2013,63(1):11-30.
[2] O′Flaherty JD, Gray S, Richard D, et al. Circulating tumor cells, their role in metastasis and their clinical utility in lung cancer[J]. Lung Cancer, 2012,76(1):19-25.
[3] Hou JM, Krebs M, Ward T, et al. Circulating tumor cells as a window on metastasis biology in lung cancer[J]. Am J Pathol, 2011,178(3):989-995.
[4] Muller P, Schlimok G. Bone marrow micrometastases of epithelial tumors: detection and clinical relevance[J]. J Cancer Res Clin Oncol, 2000,126(11):607.
[5] Yang XN, Wu YL. Response evaluation criteria in solid tumors ---RECIST[J]. J Evid Based Med, 2004,4(2):85-88.
[6] Zhou C, Wu YL, Chen G, etal. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small cell lung cancer(OPTIMAL,CTONG-0802):a multicentre ,open-label,randomised,phase 3 study[J]. Lancet Oncol, 2011,12(8):735-742.
[7] Juchum M, Gunther M, Laufer SA. Fighting cancer drug resistance: opportunities and challenges for mutation-specific EGFR inhibitors[J]. Drug Resist Updat, 2015(20):12-28.
[8] Yung TK, Chan KC, Mok TS, et al. Single-molecule detection of epidermal growth factor receptor mutations in plasma by microfluidics digital PCR in non-small cell lung cancer patients[J]. Clin Cancer Res, 2009,15(6):2076-2084.
[9] Punnoose EA, Atwal S, Liu W, et al. Evaluation of circulating tumor cells and circulating tumor DNA in non-small cell lung cancer: association with clinical endpoints in a phase Ⅱ clinial trial of pertuzumab and erlotinib[J]. Clin Cancer Res, 2012,18(8):2391-2401.
[10] Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonaryadenocarcinoma[J]. N Engl J Med, 2009,361(10):947-957.
[11] Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial[J]. Lancet Oncol, 2012,13(3):239-246.
[12] Yang JC, Wu YL, Schuler M, et al. Afatinib versus cisplatin-based chemotherapy for EGFR mutation-positive lung adenocarcinoma (LUX-Lung 3 and LUX-Lung 6): analysis of overall survival data from two randomised, phase 3 trials[J]. Lancet Oncol, 2015,16(2):141-151.
[13] Yang JJ, Zhou Q, Yan HH, et al. A randomized controlled trial of erlotinib versus gefitinib in advanced non-small-cell lung cancer harboring egfr mutations (CTONG0901)[J]. J Thorac Oncol, 2015(13):1613.
[14] Urata Y, Katakami N, Morita S, et al. Randomized phase Ⅲ study comparing gefitinib (G) with erlotinib (E) in patients (pts) with previously treated advanced lung adenocarcinoma (LA): WJOG 5108L[J]. J Clin Oncol, 2016(28):8041.
[15] Sun Y, Shi Y, Zhang L, et al. A randomized, double-blind phase Ⅲ study of icotinib versus gefitinib in patients with advanced non-small cell lung cancer (NSCLC) previously treated with chemotherapy(ICOGEN)[J]. J Clin Oncol, 2011(29):7522.
[16] Ge MJ, Shi D, Wu QC, et al. Observation of circulating tumor cells in patients with non-small cell lung cancer by real-time fluorescent quantitative reverse transcriptase-polymerase chain reaction in peroperative period[J]. J Cancer Res Clin Oncol, 2006,32(4):248.
云南省科技计划项目(2012FB164);云南省教育厅科学研究基金项目(2013Z113)。
李高峰(E-mail: ligaofenghl@126.com)
10.3969/j.issn.1002-266X.2016.40.029
R734.2
B
1002-266X(2016)40-0086-03
2016-01-04)
