急性出血坏死性胰腺炎大鼠血清二胺氧化酶水平变化及意义
2016-12-03兰涛崔乃强
兰涛,崔乃强
(1天津中医药大学研究生院,天津300193;2沧州市人民医院;3天津市南开医院)
急性出血坏死性胰腺炎大鼠血清二胺氧化酶水平变化及意义
兰涛1,2,崔乃强3
(1天津中医药大学研究生院,天津300193;2沧州市人民医院;3天津市南开医院)
目的 观察急性出血坏死性胰腺炎(AHNP)大鼠血清二胺氧化酶(DAO)水平变化,并探讨其意义。方法 选取60只健康雄性Wistar大鼠,随机分为假手术组和AHNP组各30只。AHNP 组胆胰管逆行注射3.5%牛磺胆酸钠建立 AHNP 动物模型,假手术组以同样方法注射生理盐水。各组大鼠分别于造模后6、12、24 h取腹主动脉血,用ELISA法检测血清DAO,取末端回肠组织行病理学观察和回肠黏膜损伤Chiu′s评分。结果 假手术组造模后各时点血清DAO差异无统计学意义。AHNP组造模后随时间延长血清DAO水平逐渐升高,均较同时点假手术组高,P均<0.05。肉眼及光镜下观察假手术组末端回肠组织无明显异常,AHNP组造模后肠黏膜损伤程度进行性加重。假手术组造模后各时点肠黏膜 Chiu′s评分均为0分;AHNP组造模后6、12、24 h肠黏膜Chiu′s评分分别为(2.20±0.43)、(3.14±0.36)、(4.19±0.52)分,P均<0.05。AHNP组造模后 6、12、24 h血清DAO与回肠黏膜Chiu′s评分均呈正相关关系,相关系数分别为0.639、0.929、0.726,P均<0.05。结论 AHNP大鼠血清DAO水平升高,外周血清DAO水平变化可间接反映肠黏膜损伤程度。
急性出血坏死性胰腺炎;肠黏膜屏障;二胺氧化酶;Chiu′s评分
重症急性胰腺炎(SAP)是一种临床上常见的急腹症,发病急骤,进展迅速,病死率高。SAP可早期导致全身炎症反应综合征(SIRS),导致肠黏膜损伤和肠屏障功能障碍,继发感染和多器官功能障碍(MODS)[1,2],但其具体机制不明。急性出血坏死性胰腺炎(AHNP)是SAP的一种常见类型。2015年5~8月,我们观察了AHNP大鼠血清二胺氧化酶(DAO)水平变化及肠黏膜损伤情况,并分析二者的相关性。现报告如下。
1 材料与方法
1.1 材料 健康雄性Wistar大鼠60只,体质量(250±50)g,由中国医学科学院实验动物研究所提供。牛磺胆酸钠为美国Sigma公司产品;大鼠血清DAO检测ELISA试剂盒为美国UCL公司产品;高速离心机为美国Beckman 公司产品;光学显微镜为日本Olympus公司产品。
1.2 动物分组及AHNP模型建立 将大鼠按随机数字表法分为假手术组和AHNP组,每组30只。AHNP组采用逆行胆胰管注射法制备AHNP模型[3]。大鼠术前禁食不禁水12 h,用10%水合氯醛3 mL/kg腹腔注射麻醉。麻醉成功后固定于手术台,备皮,做长约2 cm 腹部正中切口入腹。找到十二指肠乳头并穿刺乳头对侧十二指肠肠壁,用24 号静脉留置针逆行插入胆胰管0.5 cm;向胆胰管内注入3.5%牛磺胆酸钠1 mL/kg,速度为0.15 mL/min。假手术组以同样方法给予生理盐水注射。缝扎十二指肠穿刺口,关腹,将动物置于清洁、通风的动物室内观察。
1.3 血清DAO检测方法 造模后6、12、24 h取两组大鼠腹主动脉血,3 000 r/min离心10 min分离血清,用ELISA法检测血清DAO,操作按试剂盒说明书进行。
1.4 肠黏膜病理观察方法 造模后6、12、24 h各处死10只大鼠,取末端回肠组织。常规固定、包埋、连续切片,HE染色。肉眼及光学显微镜下观察小肠组织病理学变化,光镜观察黏膜损伤程度并行Chiu′s评分。肠黏膜正常评0分;绒毛顶端上皮下间隙增宽伴毛细血管充血评1分;上皮下间隙进一步增宽伴随上皮层与固有膜分离评2分;大片上皮层从绒毛两边分离并有少量绒毛脱落评3分;大片绒毛脱落后固有膜裸露评4分;固有膜被消化、分解、缺血改变和溃疡形成评5分。

2 结果
2.1 两组大鼠血清DAO比较 假手术组造模后各时点血清DAO差异无统计学意义。AHNP组造模后6、12、24 h血清DAO水平逐渐升高,P均<0.05;AHNP组血清DAO水平均较同时点假手术组高,P均<0.05。见表1。
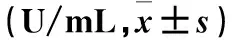
表1 两组大鼠各时点血清 DAO 比较
注:与假手术组比较,*P<0.05;与同组造模后6 h比较,#P<0.05;与同组造模后12 h比较,△P<0.05。
2.2 两组末端回肠组织病理学变化比较 肉眼观察假手术组末端回肠组织肉眼观察无明显异常。AHNP组造模后6 h末端回肠组织充血水肿,可见散在点状出血;造模后12 h末端回肠组织充血水肿明显加重,伴片状出血及散在黑褐色坏死;造模后24 h末端回肠组织充血水肿进一步加重,大片出血及坏死,并有散在皂化斑。光镜下观察假手术组肠黏膜绒毛结构完整,上皮呈高柱状,间质无水肿、无中性粒细胞浸润。AHNP组造模后6、12、24 h各回肠黏膜损伤程度进行性加重,可见回肠间质水肿、散在出血,肠绒毛增粗,高度变短,黏膜厚度变薄,黏膜腺体减少排列稀疏,血管、淋巴管扩张,大量中性粒细胞及淋巴细胞浸润。假手术组造模后各时点肠黏膜Chiu′s评分均为0分。AHNP组造模后6、12、24 h肠黏膜Chiu′s评分分别为(2.20±0.43)、(3.14±0.36)、(4.19±0.52)分,P均<0.05。
2.3 AHNP组各时间血清DAO与回肠黏膜Chiu′s评分的关系 AHNP 组造模后6、12、24 h血清DAO水平与回肠黏膜 Chiu′s评分均呈正相关关系,相关系数分别为0.639、0.929、0.726,P均<0.05。
3 讨论
SAP是临床常见的急腹症之一,它不仅引起胰腺本身及胰周的炎性肿胀、渗出和坏死,而且常导致全身重要脏器功能的损害[4],是一种发病急、进展快、并发症多、病死率高的严重疾病[5]。SAP时常并发MODS,成为SAP的主要死亡原因[6]。AHNP是SAP的一种常见类型。AHNP大鼠肠黏膜血流量减少,肠上皮细胞凋亡增加,细胞间紧密连接损伤,肠黏膜通透性增加,肠屏障功能障碍,细菌易位,出现内毒素血症和多器官功能损伤,进一步加重肠道屏障功能障碍,最后出现肠功能衰竭[7]。
DAO是存在于哺乳动物小肠的黏膜或纤毛上皮细胞中,由脱氨酶激活具有催化二胺氧化功能的细胞内酶[9]。其在肝脏内进行代谢,可通过调节细胞内的离子平衡,影响传导通路,促进细胞修复,对肠黏膜具有保护作用。正常情况下,由于肠黏膜屏障的存在,肠黏膜组织细胞中的大分子物质不能进入外周血循环,外周血中DAO水平很低。小肠黏膜屏障功能衰竭时或肠黏膜细胞坏死时,肠黏膜屏障功能受损,小肠黏膜组织内DAO水平降低,血清和肠腔内DAO水平升高[10~14]。本研究使用3.5%牛磺胆酸钠溶液逆行注射大鼠胰胆管制备大鼠AHNP模型,观察AHNP发生后随着病程进展外周血DAO及末端回肠病理学表现的变化,研究AHNP患者发生肠黏膜屏障功能障碍的机制。结果显示,AHNP大鼠造模后6 h即出现肠壁充血、水肿及肠黏膜萎缩等损伤性改变,此时血清DAO水平亦明显升高,推测肠黏膜受损后DAO即从细胞内释放入血,导致上述表现;造模后12、24 h肠黏膜损伤进一步加重,血清DAO进一步升高,肠壁出现部分坏死,黏膜萎缩、小肠绒毛变短,术后24 h血清DAO达到高峰。同时发现,随着时间的延长,评估肠黏膜损伤的Chiu′s评分逐渐升高,提示AHNP大鼠肠黏膜损伤程度和血清DAO水平变化是同步的。本研究结果显示,AHNP组造模后6、12、24 h大鼠血清DAO与回肠黏膜Chiu′s评分均呈正相关关系,相关系数分别为0.639、0.929、0.726,亦支持上述观点。
综上所述,AHNP大鼠血清DAO水平升高,且与大鼠回肠黏膜损伤程度呈正相关;血清DAO检测具有方法简便、快捷、重复性好、结果稳定等优点,且为无创检查。因此,血清DAO可作为生物学标志用来反映AHNP大鼠肠屏障功能损伤状况。
[1] van Baal MC, van Santvoort HC, Bollen TL, et al. Systematic review of percutaneous catheter drainage as primary treatment for necrotizing pancreatitis[J]. Br J Surg, 2011,98(2):18-27.
[2] Zerem E, Imamovic G, Susic A, et al. Step-up approach to infected necrotising pancreatitis: a 20-year experience of percutaneous drainage in a single centre[J]. Dig Liver Dis, 2011,43(4):478-483.
[3] 刘长宝,崔乃强,王占国,等.加味清胰汤对坏死性胰腺炎细菌易位抑制的实验研究[J].天津中医,2002,19(5):55.
[4] Xiping Z, Hua T, Hangqing C, et al. Effects of Baicalin on inflammatory mediators and pancreatic acinar cell apoptosis in rats withsever acute pancreatitis[J]. J Res Med Sci, 2009,14(1):19-27.
[5] Beduschi MG, Mello AL, VON-Mühlen B, et al. The PANC 3 score predicting severity of acute pancreatitis[J]. 2016,29(1):5-8.
[6] Vengadakrishnan K, Koushik AK. A study of the clinical profile of acute pancreatitis and its correlation with severity indices[J]. Int J Health Sci, 2015,9(4):410-417.
[7] Luk GD, Bayless TM, Baylin SB, Diamine oxidase(histaminase).A circulating marker for rat intestinal mucosal maturation and integrity[J]. J Clin Invest, 1980,66(1):66-70.
[8] 候玥,宫平,杨羽,等.血清二胺氧化酶测定的临床应用进展[J].中国实验诊断学,2015,19(11):1985-1987.
[9] Zhao L, Luo L, Jia W, et al. Serum Diamine Oxidase as a Hemorrhagic Shock Biomarker in a Rabbit Model[J]. PLoS One, 2014,9(8):e102285.
[10] Tian R, Tan JT, Wang RL, et al. The role of intestinal mucosa oxidative stress in gut barrier dysfunction of severe acute pancreatitis[J]. Eur Rev Med Pharmacol Sci, 2013,17(3):349-355.
[11] Zhang JW, Zhang GX, Chen HL, et al. Therapeutic effect of qingyi decotion in sever acute pancreatitis-induced intestinal barrier injury[J].World J Gastroenterol, 2015,21(12):3537-3546.
[12] Feng S, Liu W,Zuo S, et al. Impaired function of the intestinal barrier in a novel sub-health rat model[J]. Moi Med Rep, 2016,13(4):3459-3465.
[13] 谢婷,夏金荣,高俊,等.低聚半乳糖对应激大鼠肠黏膜屏障功能的影响[J].第二军医大学学报,2014,35(1):55-60.
[14] 樊春华,吕永慧,詹源泉,等.肠炎清对受损肠黏膜修复和二胺氧化酶的影响[J].中国中西医结合消化杂志,2009,17(3):175-177.
10.3969/j.issn.1002-266X.2016.38.012
R657.5
A
1002-266X(2016)38-0037-03
2015-09-24)
