顶空固相微萃取-气质联用法结合电子鼻分析鱼精蛋白对草鱼片挥发性气味的影响
2016-12-02王当丰李婷婷刘楠姜杨晋高伟励建荣
王当丰,李婷婷,刘楠,姜杨,晋高伟,励建荣*
1(渤海大学 食品科学与工程学院,辽宁省食品安全重点实验室,辽宁 锦州,121013) 2(大连民族大学 生命科学学院,辽宁 大连,116600)
顶空固相微萃取-气质联用法结合电子鼻分析鱼精蛋白对草鱼片挥发性气味的影响
王当丰1,李婷婷2*,刘楠1,姜杨1,晋高伟1,励建荣1*
1(渤海大学 食品科学与工程学院,辽宁省食品安全重点实验室,辽宁 锦州,121013) 2(大连民族大学 生命科学学院,辽宁 大连,116600)
采用5.0 g/L的鱼精蛋白溶液对草鱼片进行浸泡处理,并通过顶空固相微萃取-气质联用(HS-SPME-GC-MS)及电子鼻对4 ℃贮藏过程中的样品进行挥发性气味检测。结果表明:HS-SPME-GC-MS法共检出挥发性物质132种,其中主要为醛类及醇类物质。在贮藏期内,对照组中醛类及醇类物质含量逐渐增高,酯类物质先增高后降低,酸类及其他类物质呈现较大波动。而处理组中醛类物质不断增加、醇类物质及酯类物质均呈现先降低后增高的趋势,且醇类、醛类及酯类物质的含量均低于对照组。电子鼻检测结果表明,贮藏后期处理组的响应值明显低于对照组。实验结果表明,鱼精蛋白处理能够在一定程度上延缓草鱼的风味劣变。
挥发性成分;顶空固相微萃取;气相色谱-质谱联用;电子鼻;草鱼;鱼精蛋白
草鱼(Ctenopharyngodonidella)又称白鲩,属鲤形目、鲤科、草鱼属,是国内最重要的经济淡水鱼类,广泛分布于我国平原湖泊中[1]。草鱼因其营养丰富、味道鲜美、低脂、低胆固醇等特点而具有广阔的市场前景。但鱼肉中的挥发性成分复杂,对草鱼的风味起着至关重要的作用。研究表明,草鱼死亡后,其体内的ATP在肌肉内源酶的作用下逐渐分解产生苦味物质次黄嘌呤核苷及次黄嘌呤。草鱼富含的脂肪酸及蛋白质极易在微生物作用下发生氧化酸败及降解,使其在贮藏后期产生特有的腥臭味,从而导致草鱼新鲜度下降,货架期缩短,食用品质丧失[2]。因此在贮藏过程中的气味变化是评判草鱼新鲜度的重要特征。此外,以鱼类精巢组织为原料分离得到的鱼精蛋白,作为一种食品的天然防腐剂,在日本等国已成功用于食品的贮藏保鲜[3],其与DNA可结合形成核精蛋白,其中2/3以上的氨基酸组成为精氨酸[4]。李燕等[5]研究表明,鱼精蛋白可有效抑制食品中微生物的生长,在水产贮藏加工领域具有较大的开发价值。
顶空固相微萃取技术(headspace solid-phase microextraction HS-SPME)通过针头涂覆的吸附剂,对处于气-液平衡的组分进行吸附,于气相色谱进样口高温解析后,通过质谱进行定性和定量分析。它集采样、萃取、浓缩、进样于一身,可有效提取样品的挥发性成分,与传统方法相比,其具有成本低,操作简单,灵敏度高,重现性好等特点。目前顶空固相微萃取结合气质联用技术以广泛应用于食品检测中,MIYASAKI等[6]采用HS-SPME-GC-MS结合电子鼻技术,分析了不同种类的鱼在冷藏期间鱼肉挥发性成分的变化。王怡娟等[7]采用HS-SPME-GC-MS的分析方法对养殖的美国红鱼鱼肉中挥发性成分进行了分析,并鉴定出64种挥发性成分。
目前,国内外研究主要集中于草鱼的饲养及保鲜方面,而对于其风味研究较少。本文通过鉴定相关样品在贮藏期间内的挥发性成分变化,研究了贮藏期内鱼精蛋白保鲜处理对草鱼片挥发性物质的影响。
1 材料与方法
1.1 材料及预处理
草鱼,购于锦州市林西路水产市场,平均每尾质量为(1 000±50) g。即杀,去鳞,去内脏,去皮后取脊背肉,切成8~10 cm鱼片。以3.0、4.0、5.0、6.0 g/L为浓度梯度进行单因素实验,选取5.0 g/L的鱼精蛋白溶液为最优,浸泡样品30 min,沥水20 min后,用无菌蒸煮袋密封包装,立即于4℃温度下贮藏,以蒸馏水浸泡30 min作为对照。在贮藏期过程中,定期取样对草鱼片进行顶空固相微萃取-气质联用检测及电子鼻检测。
1.2 仪器与设备
Agilent 7890N/5975气-质联用(GC-MS)仪,美国 Agilent 公司;DF-101S 集热式恒温加热磁力搅拌器,郑州长城科工贸有限公司;20 mL 顶空钳口样品瓶、50/30μm DVB/CAR/PDS SPME 萃取头,美国 Supelco 公司;PEN3 电子鼻,德国 AIRSENSE 公司。
1.3 实验方法
1.3.1 挥发性气味检测
取5 g绞碎的鱼肉于50 mL烧杯中,并用保鲜膜密封,室温下静置0.5 h后顶空进样。每组样品测3次平行。设定检测时间120 s、清洗时间100 s、样品流速300 mL/min。利用电子鼻自带的 Win Muster软件对检测到的指标信息进行分析。
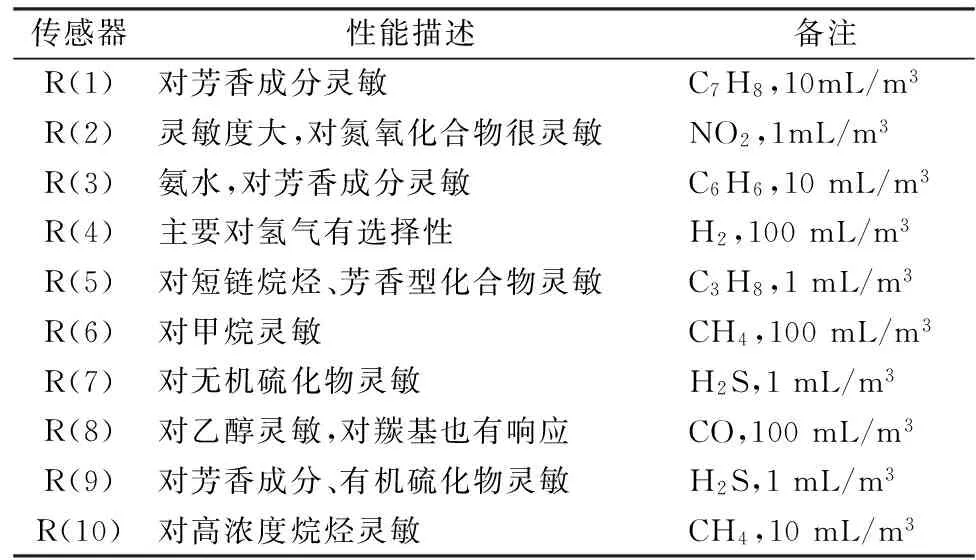
表1 PEN3便携式电子鼻标准传感器阵列及其性能
1.3.2 挥发性成分的萃取
参考XU[8]的方法稍加改进,称取3 g 绞碎的鱼肉,与6 mL 饱和NaCl溶液混合后加入20 mL 样品瓶中,放入微型磁力搅拌子密封后将SPME针插入顶空样品瓶中,调整并固定萃取头在顶空体积中的位置,将样品瓶置于50 ℃恒温磁力搅拌器中平衡15 min,再吸附40 min 后取出萃取头(萃取头老化温度:270 ℃;老化时间:1 h),并迅速插入气相色谱仪进样口中,解析5 min 后拔出。
1.3.3 气相色谱-质谱条件
气相色谱条件:采用HP-5MS 毛细管色谱柱(30 mm×0.25 mm×0.25 μm),进样口温度 250 ℃;柱温 40 ℃,保持 3 min,以3 ℃/min 程序升温到100 ℃,再以 5 ℃/min 升到 230 ℃,保持 5 min,载气(He)流量 0.8 mL/min,解析温度250 ℃,不分流进样。
质谱条件:离子源温度230 ℃,传输线温度280 ℃,四极杆温度150 ℃,质量扫描范围:m/z 30~550,电离电压70 eV。
1.4 数据处理
测出组分经气相色谱分离,通过质谱进行分析鉴定。实验数据经计算机检索及Nist 与Willey 质谱库进行检索与鉴定。冷藏草鱼片挥发性组分的化学组成采用峰面积归一化进行定量分析。
2 结果与讨论
2.1 顶空固相微萃取-气相色谱质谱联用(HS-SPME-GC-MS)分析结果
鱼类的风味主要是由于特定脂肪氧合酶作用于鱼体的多不饱和脂肪酸所产生的衍生物造成的,这种衍生物多为挥发性的羰基化合物与醇类物质等。本文通过HS-SPME-GC-MS技术共测出挥发性物质132种,各成分列于表2。
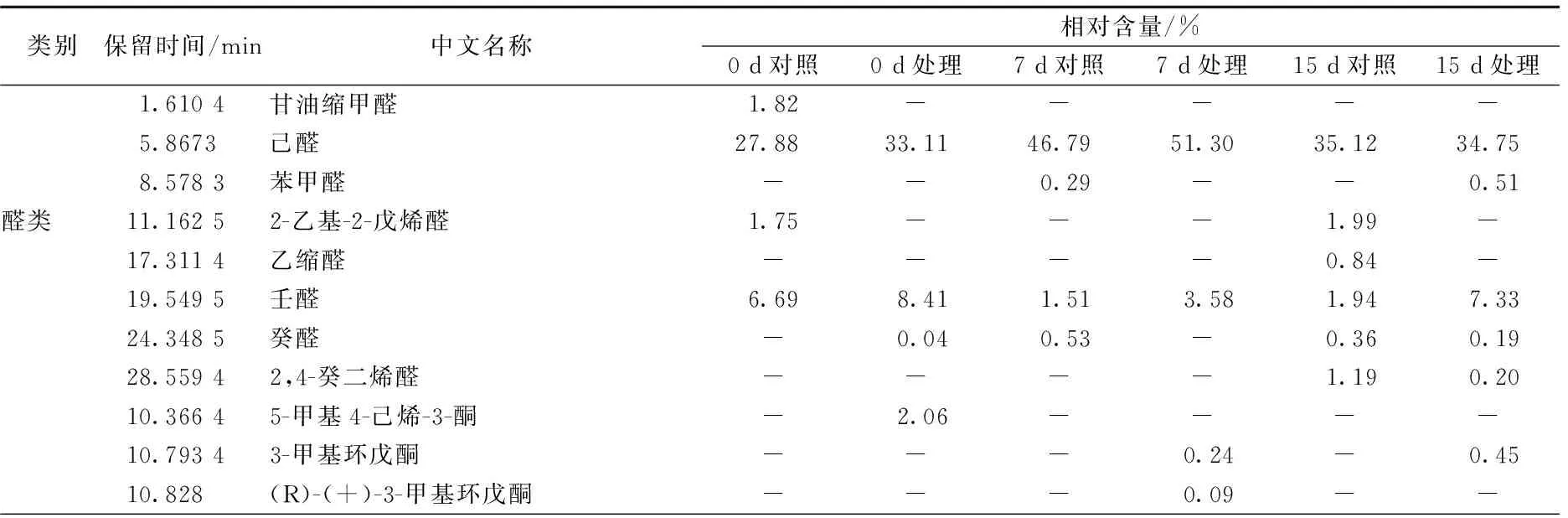
表2 冷藏草鱼片贮藏过程中挥发性成分
续表2

类别保留时间/min中文名称相对含量/%0d对照0d处理7d对照7d处理15d对照15d处理10.8742(R)-(+)-3-甲基环己酮---0.37--11.84322-甲基环己酮1.242.771.221.581.36-11.8664环庚酮-----1.1613.79282,5-辛二酮0.690.870.914.22--酮类32.574香叶基丙酮0.24-----34.0391曲唑酮----0.10-34.03911-(2,4-二甲基苯基)-乙酮0.13-----34.48912-(1-环己烯基)环己酮0.70-----34.50072-环己基-环己酮-0.990.420.450.480.5342.0108环十七烯-9-酮----0.08-48.71352-羟基环十五酮-----1.027.591-己醇12.5515.26----11.3781-辛烯-3-醇13.8915.5722.8716.4219.9014.8714.5443(Z)-2-辛烯-1-醇--10.12---15.34352-癸烯-1-醇0.52-----醇类22.62983,3,5-三甲基,乙酸盐,顺环己醇-----9.8333.42772-亚甲基环几醇----4.78-4.81751,3,5-环庚三烯0.22---0.29-10.29722,3-二甲基-3-乙烯--1.68---10.33193-甲基-3-庚烯----1.34-10.83942-甲基-2-己烯-1.43----10.86252-甲基-3-庚烯--0.63--0.6711.1394顺-3,4,4-三甲基-2-戊烯--2.02---11.4514,4-二甲基-2-戊烯---0.32--11.46242-酮基-4甲基-3-戊烯--0.38---12.47772,3-二甲基-1,3-丁二烯1.17-----12.5123反式-1,4-己二烯----1.43-14.03513,3-二甲基-1-苯基-1-三氮烯0.14-----烯烃18.25752,4,4-三甲基-1-己烯-----0.1218.8919(Z)-5-十一碳烯1.00-0.40---18.9151(E)-5十一碳烯----0.310.8418.892顺-3-十一碳烯---0.74--28.3402苯并环庚三烯----0.08-33.33549-十八烯----0.05-33.4161花侧柏烯--0.08---38.1001环-二十四烯-----0.1538.238510-二十一碳烯-----0.0748.7826(E)-5-二十烯2.58-----49.85561-二十烯-----1.0750.236217-三十五烯----0.45-1.968尿烷----3.34-10.6434环庚烷0.211.92----11.1626顺-1,2-二甲基环己烷---2.24-1.2812.4776乙烯基环丁烷--1.15---12.4777氯代环己烷---1.37-0.9917.20771-碘壬烷-----0.2320.83正戊基环己烷2.631.971.171.820.601.6336.2772二十烷0.150.08-0.830.070.7338.5844十七烷--0.23-0.520.7427.1754-甲基十四烷0.43-----27.1867二十四烷-----0.3427.9133十九烷0.390.18---0.04烷烃27.9135十三烷-0.49---0.23
续表2
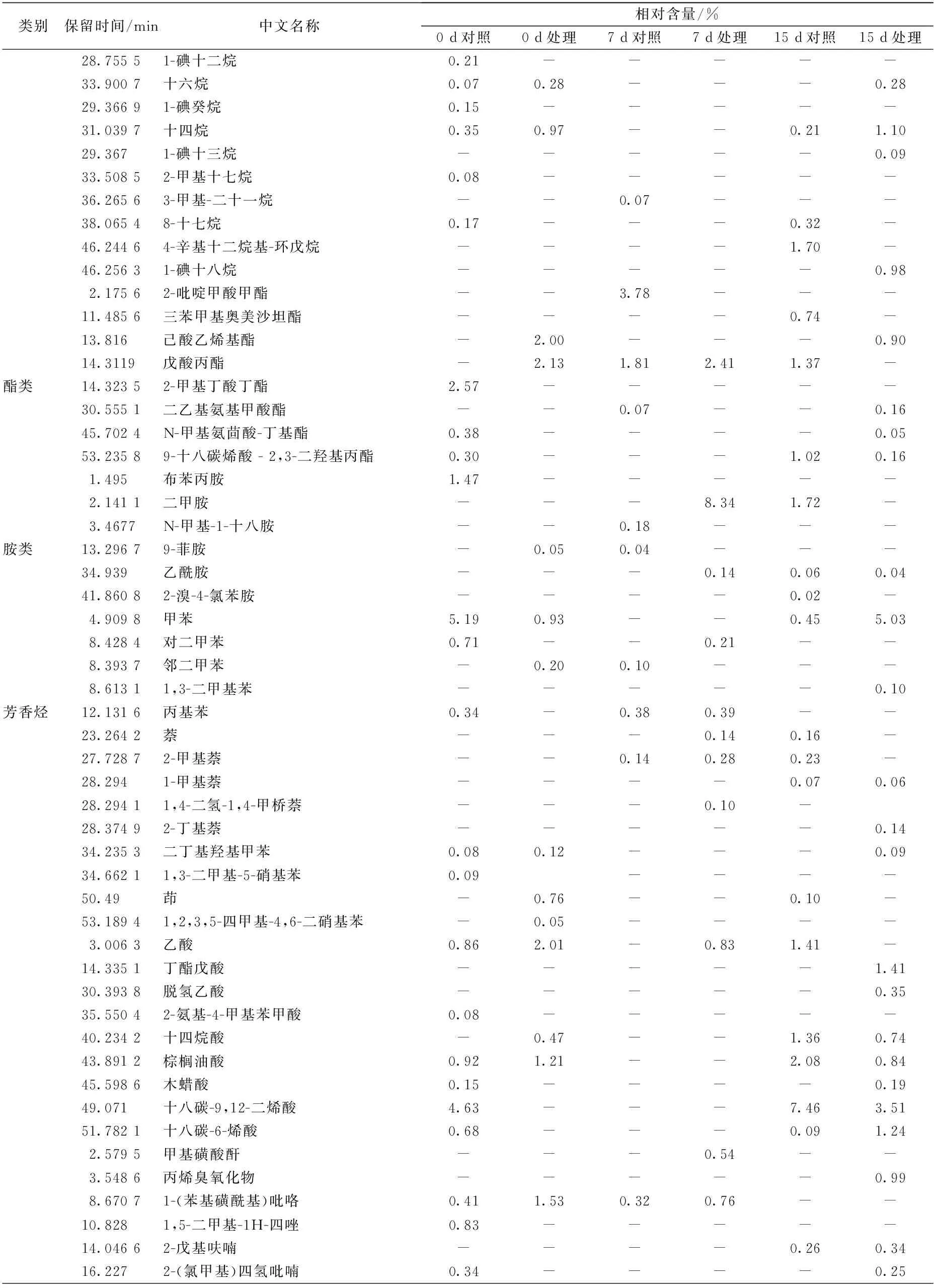
类别保留时间/min中文名称相对含量/%0d对照0d处理7d对照7d处理15d对照15d处理28.75551-碘十二烷0.21-----33.9007十六烷0.070.28---0.2829.36691-碘癸烷0.15-----31.0397十四烷0.350.97--0.211.1029.3671-碘十三烷-----0.0933.50852-甲基十七烷0.08-----36.26563-甲基-二十一烷--0.07---38.06548-十七烷0.17---0.32-46.24464-辛基十二烷基-环戊烷----1.70-46.25631-碘十八烷-----0.982.17562-吡啶甲酸甲酯--3.78---11.4856三苯甲基奥美沙坦酯----0.74-13.816己酸乙烯基酯-2.00---0.9014.3119戊酸丙酯-2.131.812.411.37-酯类14.32352-甲基丁酸丁酯2.57-----30.5551二乙基氨基甲酸酯--0.07--0.1645.7024N-甲基氨茴酸-丁基酯0.38----0.0553.23589-十八碳烯酸-2,3-二羟基丙酯0.30---1.020.161.495布苯丙胺1.47-----2.1411二甲胺---8.341.72-3.4677N-甲基-1-十八胺--0.18---胺类13.29679-菲胺-0.050.04---34.939乙酰胺---0.140.060.0441.86082-溴-4-氯苯胺----0.02-4.9098甲苯5.190.93--0.455.038.4284对二甲苯0.71--0.21--8.3937邻二甲苯-0.200.10---8.61311,3-二甲基苯-----0.10芳香烃12.1316丙基苯0.34-0.380.39--23.2642萘---0.140.16-27.72872-甲基萘--0.140.280.23-28.2941-甲基萘----0.070.0628.29411,4-二氢-1,4-甲桥萘---0.10-28.37492-丁基萘-----0.1434.2353二丁基羟基甲苯0.080.12---0.0934.66211,3-二甲基-5-硝基苯0.09----50.49茚-0.76--0.10-53.18941,2,3,5-四甲基-4,6-二硝基苯-0.05----3.0063乙酸0.862.01-0.831.41-14.3351丁酯戊酸-----1.4130.3938脱氢乙酸-----0.3535.55042-氨基-4-甲基苯甲酸0.08-----40.2342十四烷酸-0.47--1.360.7443.8912棕榈油酸0.921.21--2.080.8445.5986木蜡酸0.15----0.1949.071十八碳-9,12-二烯酸4.63---7.463.5151.7821十八碳-6-烯酸0.68---0.091.242.5795甲基磺酸酐---0.54--3.5486丙烯臭氧化物-----0.998.67071-(苯基磺酰基)吡咯0.411.530.320.76--10.8281,5-二甲基-1H-四唑0.83-----14.04662-戊基呋喃----0.260.3416.2272-(氯甲基)四氢吡喃0.34----0.25
续表2
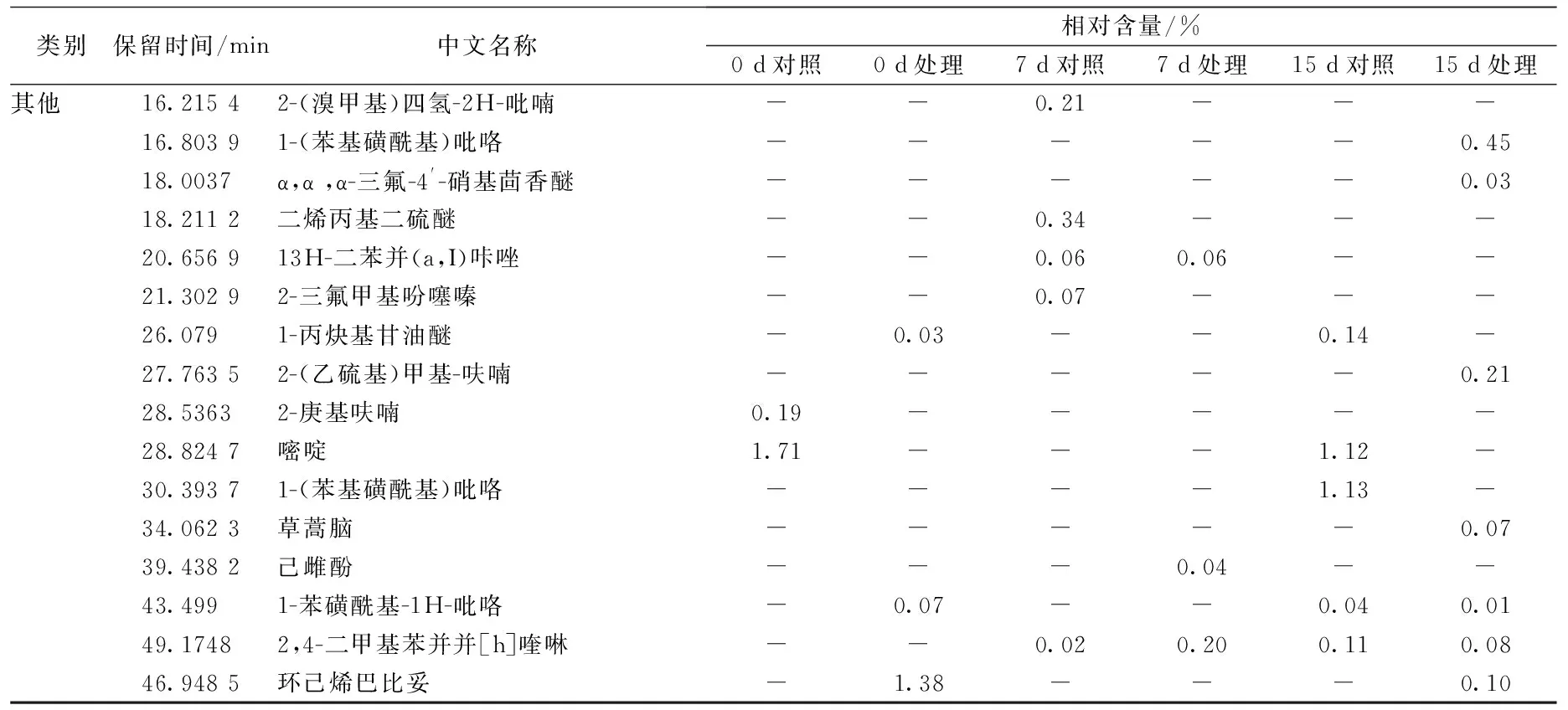
类别保留时间/min中文名称相对含量/%0d对照0d处理7d对照7d处理15d对照15d处理其他16.21542-(溴甲基)四氢-2H-吡喃--0.21---16.80391-(苯基磺酰基)吡咯-----0.4518.0037α,α,α-三氟-4'-硝基茴香醚-----0.0318.2112二烯丙基二硫醚--0.34---20.656913H-二苯并(a,I)咔唑--0.060.06--21.30292-三氟甲基吩噻嗪--0.07---26.0791-丙炔基甘油醚-0.03--0.14-27.76352-(乙硫基)甲基-呋喃-----0.2128.53632-庚基呋喃0.19-----28.8247嘧啶1.71---1.12-30.39371-(苯基磺酰基)吡咯----1.13-34.0623草蒿脑-----0.0739.4382己雌酚---0.04--43.4991-苯磺酰基-1H-吡咯-0.07--0.040.0149.17482,4-二甲基苯并并[h]喹啉--0.020.200.110.0846.9485环己烯巴比妥-1.38---0.10
注:“-”代表未检出。
其中醛类、醇类等物质检出量较多,所占比例较大,被认为是影响草鱼风味的主要物质。对照组样品的醛类物质在第0天、第7天、第15天分别占总量的38.14%、49.12%及41.43%,处理组样品的醛类物质在第0天、第7天及第15天分别占总量的41.55%、54.88%及42.99%。而烷烃类及烯烃类物质检出种类较多,分别为23种及25种,但含量少,所占比例不大,这与刘永乐[9]的研究结论一致。
2.1.1 羰基化合物
草鱼中的羰基化合物主要包括醛类及酮类,醛类物质多为脂肪氧化的产物,且低级醛阈值相对较低,并具有独特的脂香,是影响鱼体风味的重要因素,而C13以上的长链醛阈值相对较高,对鱼体风味贡献不大[10]。贮藏过程中对照组共检出8种醛类物质,而处理组检出5种,这表明鱼精蛋白处理有助于减少鱼肉贮藏过程中醛类物质的产生(见表2)。其中,空白对照组和鱼精蛋白处理组中均检出挥发性成分己醛及壬醛,且己醛含量较高,所占含量比例分别达到6组样品(对照组0、7、15 d及处理组0、7、15 d)物质总量的27.88%、46.79%、35.12%、33.11%、51.30%及34.75%。相关研究表明,己醛具有多种合成途径,如由油酸、亚油酸氧化形成的氢过氧化物的裂解,或由其它不饱和醛,如2,4-癸二烯醛降解生成等[11],且其阈值极低(4.50 μg/kg),已被证实是鱼腥味的主要物质,并常与 C8-,C9-的挥发性化合物对鱼肉的风味起协同作用[12]。壬醛具有柑橘的香气,苯甲醛具有苦杏仁味,并对草鱼腥味具有一定影响。此外,贮藏后期(15 d)2组样品均检出2,4-癸二烯醛,其多为脂肪酸氧化的产物,作为腥味物质广泛存在于鱼类中,并可用来反应鱼体脂肪的氧化程度,为其新鲜度判定提供参考。
鱼体中酮类物质的产生主要是由于微生物作用及脂肪酸氧化等。其阈值通常较高,但可与醛类及其他物质相互作用,增强鱼体的腥味。本实验共检出14种酮类化合物,包括环庚酮、曲唑酮、香叶基丙酮等,并在贮藏前中期样品中均检出2,5-辛二酮,其已被证实可以产生厚重的鱼腥味[13]。
2.1.2 醇类化合物
脂肪酸衍生物及羰基化合物的还原通常被认为是鱼体中醇类物质的主要来源[14]。在醇类物质中,阈值较高的饱和醇对鱼体风味贡献度相对较小,但随着碳链的延长及不饱和度的增加,醇类物质会呈现出一种独特的蘑菇香气及类金属气味,从而影响鱼肉的感官,新鲜草鱼中醇类物质的气味较柔和,表现为淡淡的醇香。由表2可知,贮藏过程中共检出5种醇类物质,且在贮藏初期(0 d)所占比例较高,对照组及处理组分别达到26.96%与30.82%。其中含量较高的为1-辛烯-3-醇,其广泛存在于淡水鱼类的挥发性物质中,是一种亚油酸的氢过氧化物降解产物[15],因阈值较低,且具有较重的土腥味,故被认为是造成鱼体较重泥土味的重要原因。此外,1-己醇在贮藏初期(0 d)样品中也有检出,且占化合物总含量的12.55%及15.57%,相关研究表明其为新鲜淡水鱼植物风味的标志化合物,呈现出特有的青草味[16]。
2.1.3 芳香类及其他类化合物
草鱼的挥发性成分除醛类、酮类及醇类外,还包括约占化合物总量20%的烃类、酸类、胺类及其他化合物。其中烃类物质主要由脂肪酸烷氧自由基裂解产生,阈值相对较高,对鱼体整体气味贡献度不大,但当涉及到一些支链烷烃或芳香烃时,就会对鱼体的风味特征有所贡献[17]。除此之外,烯烃类化合物如3-甲基-3-庚烯等在特定条件下可形成醛与酮,对鱼体风味产生增强作用,这也是产生鱼腥味的潜在因素[18]。本实验共检出芳香烃化合物14种,各组芳香烃所占比例分别为6.41%、0.62%、1.01%、2.05%、1.13%、5.43%。其中1-甲基萘、2-甲基萘、甲苯、对二甲苯、萘和茚等被认为是草鱼在生长环境中富集的污染物,多会产生令人不愉快的风味。
胺类物质在新鲜鱼体内含量较少,但随着贮藏时间的延长,鱼体内的微生物活动更加频繁,使氨基酸、蛋白质等物质被分解并产生胺类物质。实验初期仅检测出一种胺类物质布苯丙胺,占总物质含量的1.47%。但随着贮藏时间的延长,二甲胺、乙酰胺等物质被大量检出,这些胺类散发出具有腐败特征的臭味,其中处理组第7天胺类物质所占比例达到8.48%。此外,在贮藏过程中酸类、脂类、呋喃类物质也有少量检出,如乙酸、棕榈油酸、2-庚基呋喃、戊酸丙酯等,但这些物质阈值较低,对鱼体风味影响较小。
2.2 主要挥发性物质含量变化分析
本实验表明,羰基化合物及醇类为草鱼的主要挥发性物质,且两者阈值相对较低,对鱼体风味总贡献度较大。两者之和占各组物质总量的68.10%、84.66%、68.14%、79.08%、78.25%、及70.86%。图1为2组样品贮藏过程中主要挥发性物质含量的变化趋势图,由图1可知,对照组样品的醛类及醇类物
质含量随贮藏时间的延长而呈上升趋势,酯类物质含量呈先升高,后降低的趋势,酸类物质及其他物质则波动较大。处理组样品中,醛类物质含量随贮藏时间的延长而不断增加,醇类物质、酸类物质及酯类物质均呈现先降低后升高的趋势。在贮藏初期(0 d),处理组样品中仅醛类物质含量较对照组样品稍有降低,其余各组分均无明显变化。这表明实验处理过程对鱼肉的风味物质含量影响较小,此结论与本实验电子鼻检验结果相符。在贮藏中后期,醇类物质含量较对照组显著降低。且贮藏期内,醇类物质、醛类物质及酯类物质含量始终低于对照组,这表明鱼精蛋白在贮藏过程中可以有效降低不良挥发性物质的产生,改善鱼体风味。
2.3 电子鼻检测
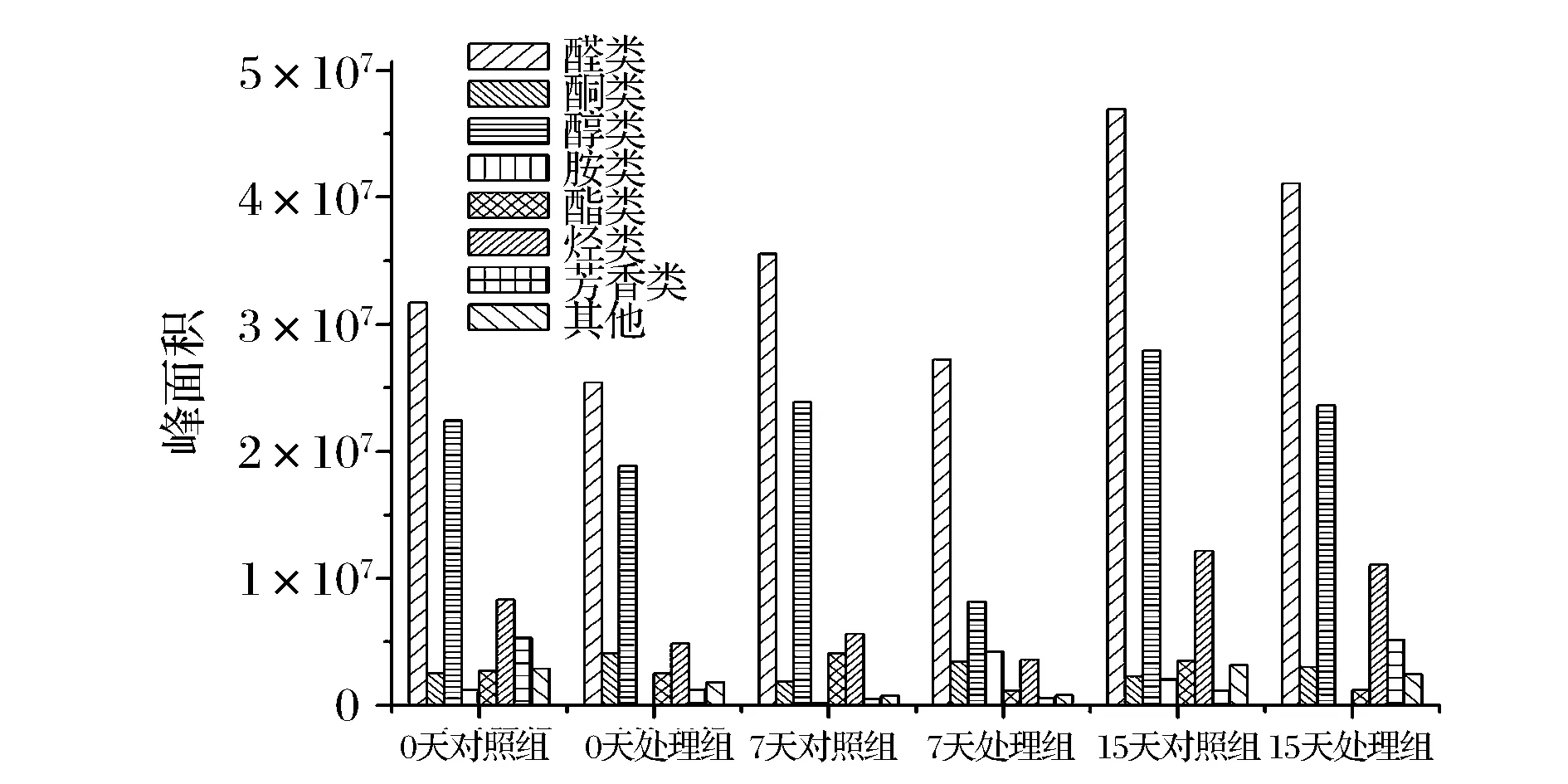
图1 不同样品中挥发性成分总峰面积比较Fig.1 Comparison of the peak area of volatile compounds in samples
电子鼻通过内置传感器搭建仿生嗅觉系统,对样品贮藏期内因腐败而产生的标识性气味如氨气、醇类、硫化物等加以区分,能够客观、准确、灵敏地对样品新鲜度进行预测,避免了复杂的前处理过程对样品的损伤[19-20]。表3为不同样品贮藏过程中鱼肉挥发性物质对传感器的响应值。

表3 草鱼样品电子鼻响应值
注:同一行不同字母表示显著性差异(P<0.05,n=3)。
由表3可知,响应值变化较为显著的传感器为R(7)、R(2)、R(6)及R(8)。这说明草鱼贮藏过程中无机硫化物(R7)、氮氧化合物(R2)、烷烃类(R2)及醇类(R8)物质均有所增加。而贮藏达到第15天时,处理组各传感器的风味信号响应值明显小于对照组,这表明鱼精蛋白在草鱼贮藏期内能够延缓其风味劣变,提高新鲜度。
3 结论
采用HS-SPME-GC-MS法对贮藏期内的2组样品进行检测,共检出挥发性成分132种,其中己醛、壬醛、1-辛烯-3-醇等为草鱼片的主要挥发性物质。随着贮藏时间的延长,对照组中醛类物质及醇类物质含量逐渐增高,酯类物质先增高后降低,酸类及其他类样品呈现较大波动。而处理组中醛类物质不断增加,醇类物质及酯类物质均呈现先降低后升高的趋势。且其含量均低于对照组,这说明鱼精蛋白处理能够在一定程度上延缓草鱼的风味劣变。电子鼻检测结果表明,贮藏后期处理组的各传感器响应值明显低于对照组,说明贮藏后期处理组不良挥发性组分低于对照组,这一结果与GC-MS检测结果相一致。
[1] 李强, 刘永乐, 王发祥, 等. 草鱼肌肉蛋白质在冷藏过程中的变化[J]. 食品科学, 2013, 34(3): 55-58.
[2] 林琳, 高艳艳, 吕顺等. 草鱼低温贮藏过程中的品质变化特性[J]. 食品科学, 2009, 30(24): 433-435.
[3] UYTTENDAELE M, DEBEVERE J. Evaluation of the antimicrobial activity of protamine[J]. Food Microbiology, 1994, 11: 417-427.
[4] 胡晓璐, 刘淑集, 吴成业, 等. 鱿鱼鱼精蛋白的提取工艺优化研究[J]. 福建水产, 2013, 35(6): 434-440.
[5] 李燕, 汪之和, 王麟, 等. 鱿鱼鱼精蛋白的抑菌作用及在保鲜中的应用[J]. 食品科学, 2004, 25(10): 80-84.
[6] MIYASAKI T, HAMAGUCHI M, YOKOYAMA S. Change of volatile compounds in fresh fish me at during ice storage[J]. Journal of Food Science, 2011, 76(9): 1319-1325.
[7] 王怡娟, 娄永江, 陈梨柯. 养殖美国红鱼鱼肉中挥发性成分的研究[J]. 水产科学, 2009, 28(6): 303-307.
[8] XU Y, LIU Y, JIANG C, et al. Determination of volatile compounds in turbot (Psettamaxima) during refrigerated storage by headspace solid-phase microextraction and gas chromatography-mass spectrometry[J]. Journal of the Science of Food & Agriculture, 2014, 94(12):2 464-2 471.
[9] 王建辉,杨晶,刘永乐,等 不同贮藏条件下草鱼肌肉挥发性成分的变化分析[J].现代食品科技,2014,30(9):297-303.
[10] VARLET V, PROST C, SEROT T. Volatile aldehydes in smoked fish:Analysis methods occurrence and mechanisms of formation[J]. Food Chemistry,2007,105: 636-556.
[11] NIETO G, BAN S, GARRIDO M D. Effect of supplementing ewes’ diet with thyme (Thymuszygisssp. gracilis) leaves on the lipid oxidation of cooked lamb meat [J]. Food Chemistry 2011, 125(4): 1 147-1 152.
[12] 王霞,黄健,侯云丹,等.电子鼻结合气相色谱-质谱联用技术分析黄鳍金枪鱼肉的挥发性成分[J].食品科学,2012,33(12):268-272.
[13] 赵庆喜, 薛长湖, 徐杰, 等. 微波蒸馏-固相微萃取-气相色谱-质谱-嗅觉检测器联用分析鳙鱼鱼肉中的挥发性成分[J]. 色谱, 2007, 25(2): 267-271.
[14] FRATINI G, LOIS S, PAZOS M, et al. Volatile profile of Atlantic shellfish species by HS-SPME GC/MS[J]. Food Research International, 2012, 48(2): 856-865
[15] DAVID B,JOSEPHSON D. Identification of compounds characterizing the aroma of fresh whitefish[J].J Agric Food Chem,1983,31: 326-330.
[16] CALKINS C R, HODGEN J M. A fresh look at meat flavor [J].Meat Science, 2007, 77(1): 63-80.
[17] 金燕, 杨荣华, 周凌霄, 等. 蟹肉挥发性成分的研究[J]. 中国食品学报, 2011,11(1): 233-238.
[18] 刘安军, 褚兰玲, 郑婕, 等. 鲤鱼土腥味成分的检测与去除[J]. 现代食品科技, 2011, 27(2): 219-223.
[19] 唐艳, 张宾, 崔博升, 等. 基于电子鼻的鲐鱼新鲜度研究[J]. 食品工业, 2012,33(9): 34-37.
[20] 佟懿, 谢晶, 肖红, 等. 基于电子鼻的带鱼货架期预测模型[J]. 农业工程学报, 2010, 26(2): 356-360.
Analysis of effects of protamine on volatile compounds for grass garp slices by HS-SPME-GC-MS technology combined with electronic nose
WANG Dang-feng1, LI Ting-ting2*, LIU Nan1, JIANG Yang1, JIN Gao-wei1, LI Jian-rong1*
1(Food Science Research Institute of Bohai University, Food Safety Key Lab of Liaoning Province, Jinzhou 121013, China) 2(College of LifeScience,Dalian Nationality of University,Dalian 116600, China)
The volatile compounds of grass carps slices immersed by protamine with 5.0 g/L during 4℃ storage were measured by HS-SPME-GC-MS and electronic nose. The results showed that 132 kinds of volatile components were determined and were mainly aldehydes and alcohols by the technology of HS-SPME-GC-MS. During the storage, volatile aldehydes and alcohols in control samples increased, esters increased then decreased, acids and other components fluctuated. For the treatment group, volatile aldehydes increased, alcohols and esters components of grass carps slices reached their lowest points and then increased during the storage. Alcohols and aldehydes components were much lower than those of control samples. The E-nose result revealed that response values of treatment groups were much lower than those of control groups. In conclusion, the protamine showed a significant effect on postponing flavor deterioration of grass carps slices.
volatile compounds; headspace solid-phase microextraction; gas chromatography-mass spectrometry (GC-MS); electronic nose; grass carp; protamine
10.13995/j.cnki.11-1802/ts.201610027
硕士研究生(励建荣教授,李婷婷副教授为通讯作者,E-mail:lijr6491@163.com,E-mail:tingting780612@163.com)。
国家自然科学基金(31301572,31301418);中国博士后科学基金(2014M552302);中央高校基本科研业务费专项资金资助(DC201501077);重庆市博士后资助(Xm2014041)
2016-01-18,改回日期:2016-03-21
