基于量子点的传感技术在农药残留检测中的应用
2016-12-02张雪瑾马学彬熊晓辉陆利霞迟波
张雪瑾,马学彬,熊晓辉,3,陆利霞,3,迟波*
1(南京工业大学 食品与轻工学院,江苏 南京,211816) 2(南京理工大学 化工学院,江苏 南京,210094) 3(江苏省食品安全快速检测公共技术服务中心,江苏 南京,210009)
基于量子点的传感技术在农药残留检测中的应用
张雪瑾1,马学彬2,熊晓辉1,3,陆利霞1,3,迟波1*
1(南京工业大学 食品与轻工学院,江苏 南京,211816) 2(南京理工大学 化工学院,江苏 南京,210094) 3(江苏省食品安全快速检测公共技术服务中心,江苏 南京,210009)
食品中农药的残留日益威胁人类健康,而基于量子点发展起来的传感技术在农药残留的检测中有着不可比拟的优势。文中阐述了近几年来几种主要的传感技术在农药残留中的应用,并探讨了这些传感技术在农药残留检测中面临的挑战。
量子点;传感;农药残留;检测
食品中农药残留的问题已经成为全世界共同关注的一个复杂的问题[1]。农药的使用一方面可以防治农林病虫害,但另一方面也污染了农产品和生态环境,因其在使用过程中大部分农药残留在环境中,从而进入食物链,最终对人类健康产生不利影响[2]。目前针对农药的检测方法主要有气相色谱法、高效液相色谱法、气相色谱-质谱联用技术和液相色谱-质谱联用技术,电化学法如毛细管电泳法,以及基于酶抑制和免疫的生物分析法,如酶联免疫分析法[3-4]。这些方法具有较高的灵敏度,但是成本高且费时,样品前处理较为繁琐,不能适用于大量样品的快速检测,因此,需要发展快速、简便和高灵敏度的方法检测食品中的农药残留。基于量子点构建的传感系统是近几年发展起来的一种新型的检测农药残留的方法,具有很大的应用潜力。
量子点(quantum dots, QDs)是由半导体材料制成的、直径一般在1~10 nm的纳米粒子,由于电子和空穴被量子限域,连续的能带结构变成具有分子特性的分立能级结构,受激后可以发射荧光。量子点具有优良的光学、电学和催化性能[5],如尺寸选择性,宽的激发光谱,优良的光稳定性和良好的生物相容性[6]等,被广泛的应用于分析检测领域。传感器通常由两部分组成:(1)识别元素,识别元素具有很高的特异性,如酶、抗体、核酸等,因此可以提高检测灵敏度;(2)传感器,传感器一般是单独的化学或物理传感元件,基于电化学、光学、热敏和压电等原理工作[7-8]。其中基于量子点的光学传感器通过比色技术或荧光变化实现传感[9];基于量子点的电化学传感器以通过物理吸附、化学共价结合、电沉积、和氧化还原聚合物电聚合等[10]方法将量子点固定在工作电极上,利用循环伏安法,线性扫描伏安法,差示脉冲伏安法和溶出伏安法等[11]电化学分析的基本方法达到分析目的。基于量子点的传感技术与传统的检测技术相比,具有较高的反应特异性和检测灵敏度,并且便于大量生产,适用性较强[12-13]。本文根据传感器识别元素的不同,从酶、分子印迹聚合物(molecularly imprinted polymer, MIPs)、主-客体系统和核酸适配子等几个方面,介绍基于量子点的光电化学传感技术检测食品中农药残留的方法。
1 基于酶的量子点传感系统
1.1 基于酶抑制作用的量子点传感系统
基于酶抑制作用的传感器主要用于检测有机磷农药(organophosphorus pesticides, OPs)。OPs能与乙酰胆碱酯酶(acetylcholinesterase, AChE)活性位点上的丝氨酸共价结合,导致酶失活,使AChE催化乙酰胆碱生成的乙酸和胆碱发生变化,这种变化可通过光电化学传感器检测到,据此原理检测OPs。ZHENG等[14]利用层层组装技术将聚烯丙基胺盐酸盐、碲化镉(CdTe)量子点与AChE结合,制成光学传感器。根据农药对AChE的抑制机理,检测对氧磷和对硫磷,检出限分别低至1.05×10-11mol/L和4.47×10-12mol/L,且具有较好的重现性和准确度。层层组装技术是建立在分子层和固体基质之间连续转移的一种技术,吸附作用主要依靠静电作用力,这种技术成本低,易操作,能使基于酶抑制的传感器变得稳定[15-16]。
MENG等[17]制备了双酶(AChE和胆碱氧化酶)传感器,检测敌敌畏,从4.49 nmol/L到6 780 nmol/L,有2个线性范围,扩大了敌敌畏的检测范围。ZHANG等[18]利用酶协助的原位生成ZnS量子点的新方法,将中孔碳和壳聚糖包覆在玻璃碳电极(glassy carbon electrode, GCE)上,再把GCE浸入Zn2+溶液中制成电极,由于辣根过氧化物酶(horseradish peroxidase, HRP)促进Na2S2O3还原产生H2S,H2S和Zn2+反应,因此,HRP促进ZnS量子点的形成。而草甘膦可抑制HRP的活性,因此可检测草甘膦,检出限为0.1~10 mmol/L。此方法中,中孔碳不仅使酶保持结构和活性,而且与壳聚糖有协同效应,借助其大的表面积和空隙体积吸收Zn2+离子。
LIANG等[19]利用石墨烯纳米片(graphene nanosheets, GNs)固定CdTe量子点,显著放大电化学发光(electrochemiluminescence, ECL)的信号。ECL负极为功能性AChE-GNs-QDs复合物修饰的GCE,这是第一次报道使用AChE-GNs-QDs传感平台检测OPs。根据OPs对ECL信号的影响,结合酶促反应和溶氧作为共反应剂来检测甲基对硫磷,检出限为0.06 ng/mL。LI等[20]制备石墨烯/CdSe/ZnS/AChE传感器检测对氧磷和敌敌畏,检出限最低为10-14mol/L和10-12mol/L,并能用于实际水果样品检测。这种方法是目前为止最灵敏的光电化学生物传感器。
1.2 基于酶联免疫反应的量子点传感系统
基于酶联免疫反应建立起来的量子点传感系统主要通过特定的农药抗体与抗原特异性识别、结合,根据竞争性抑制原理检测样品中的农药残留。抗原与抗体之间的特异性识别以及量子点优良的光电特性使这种检测方法具有较高的选择性和灵敏度。WANG等[21]利用CdS/ZnS QDs标记分别对磷酸丝氨酸和抗原性AChE有很强的免疫亲和力的2种抗体,二者协同作用形成酶的加成物,然后被双对氯苯基三氯乙烷还原,最大程度的暴露出磷酸丝氨酸部分,通过方波伏安法直接分析用磁性分离方法处理的样品,检测OP残留。由于成本低和便携,可用于现场生物监测和OP的即时诊断。VINAYAKA等[22]发展了一种利用CdTe量子点快速分析2,4-滴的荧光免疫分析法。将巯基丙酸修饰的CdTe与碱性磷酸酶(alkaline phosphatase, ALP)偶联,然后连接到2,4-滴分子上。基于游离的2,4-滴和2,4-滴-ALP-CdTe QDs偶联物之间的竞争性免疫检测2,4-滴,检出限为250 pg/mL。
ZHANG等[23]将磁性材料Fe3O4在TiO2表面功能化,形成的类似三明治的复合物, Fe3O4-TiO2/OP-BChE/QDs-抗-BChE,复合物可以很容易地从样品溶液中分离出来,然后由表面等离子体共振和方波伏安法检测出来。这种方法避免了无效的商业OP特异性抗体,最低检出限为0.01 nmol/L。VALERAA[24]等用CdS纳米颗粒和抗原生物功能化的磁性μ-颗粒标记百草枯的特异性抗体198,制备成电化学纳米探针,首次检测实际样品中的百草枯,最低检出限为1.4 μg/kg。
免疫传感系统检测农药残留具有较高的选择性和灵敏度,且快速、简便。然而要获得具有较高识别能力的抗体并不容易,基于分子印迹聚合物的量子点传感系统克服了这一困难。
2 基于分子印迹聚合物的量子点传感系统
近年来,分子印迹聚合物在分析化学领域有广泛的应用,其制备简单、稳定性强。分子印迹主要包括功能性基团和交联单体在模型分子的存在下进行共聚作用,从聚合物基质中移除模型分子,形成识别位点(空腔)。将分子印迹技术和纳米技术结合,分子印迹的纳米材料具有尺寸小、反应表面积大的特点,能够对被测物进行快速、特异性分析[25-27]。
ZHAO等[4]采用通用的超声方法,依靠范德华力和疏水作用力,成功合成了QDs-MIP复合纳米微球。ZnS∶Mn2+量子点的小尺寸和聚苯乙烯-甲基丙烯酸共聚物富含的羧基使复合纳米微球在水溶液中具有良好的分散性和稳定性。ZnS∶Mn2+(供体)激发态能量转移到二嗪农(受体)上,二嗪农重结合到聚合物的识别空腔上,导致荧光猝灭,最低检出限为50 ng/mL。WANG等[28]设计的MIPs以丙烯酰胺作为功能性单体,偶氮二异丁腈作为引发剂,二甲基丙烯酸乙二醇酯作为交联剂。他们将MIPs功能化的CdTe量子点(CdTe QDs/MIPs)固定在纸基的工作电极上,组装成纸基的传感器。另外,将金纳米粒子电沉积在工作电极上,可以提高电子转移效率。利用此传感器检测高氰戊菊酯,最低检出限为3.2×10-9mol/L。
3 基于主-客体系统的量子点传感系统
主-客体指一些小分子(客体)处在大分子(主体)所形成的空腔中,彼此形成的主体与客体之间的关系。将主体化合物固定在弯曲或平面的纳米材料上,通过独特的主客体互相作用,将会对被测物显示出很好的捕获或传感能力[29]。QU等[30]利用磺化杯芳烃检测螨胺磷和啶虫脒。螨胺磷选择性猝灭游离的CdTe。在pH值为6的条件下,啶虫脒电离为带正电荷的铵盐,嵌入到磺化杯芳烃的腔形成超分子复合物,而磺化杯芳烃在水溶液中可通过SO3-基团连接到量子点表面,因此复合物会被逐渐吸收到量子点表面。啶虫脒选择性地增强QDs的荧光强度,具有浓度依赖性。螨胺磷和啶虫脒的检出限分别为1.2×10-8mol/L和3.4×10-8mol/L。CHEN等[31]通过配体交换的方法合成了甲酸化柱芳烃功能化的CdTe量子点,在水溶液中显示出很高的稳定性。加入桥接的百草枯客体分子,甲酸化柱芳烃通过主客体结合作用,能够有效捕获空腔里的甲基紫精,阻止了CdTe量子点和甲基紫精的直接反应或电子转移。并且甲酸化柱芳烃作为桥能够引发主客体超分子网络的形成和聚集。当量子点表面结合最大量的甲酸化柱芳烃后,加入过量的客体分子,量子点荧光猝灭。
基于主-客体系统的量子点传感系统在水相中有较高的稳定性,用于农残检测具有很高的灵敏度。但由于主客体的相互作用不仅对农药有响应,对于被测样品中存在的其它物质也可能会有响应,因此需要构建特异性更强的主-客体系统或建立更全面的检测方法排除干扰。
4 基于核酸适配子的量子点传感系统
核酸适配子是功能性的单链寡核苷酸序列,通过指数富集过程,从配体的系统演化中选择出来的,具有识别多种目标分子的能力,并且这种识别具有很高的亲和性和特异性,易于制备和修饰[32]。核酸适配子技术在食品安全领域有很大的应用潜力,克服了很多现存的食品检测方法中的缺点,如检测时间长、灵敏度低和抗体制备成本高等[33]。
GUO等[34]建立了一种新型检测小分子啶虫脒的方法,啶虫脒结合的适配子(aptamer, ABA)一方面通过协调作用吸收金纳米粒子表面的负电荷,保护金纳米粒子免受盐的干扰,使CdTe QDs的荧光猝灭,另一方面与啶虫脒的特异性结合又会把ABA从金纳米粒子上释放出来,使CdTe QDs的荧光重新恢复,荧光增强的效率依赖于啶虫脒的浓度。对啶虫脒的最低检出限为7.29 nmol/L。TANG等[35]将量子点第一次通过酰胺反应与氨基修饰的寡核苷酸(amino-modified oligonucleotide, AMO)连接,局部补充到有机磷农药的DNA寡核苷酸适配子上,然后量子点标记的AMO与DNA适配子孵育形成QD-AMO-核酸适配体。当加入有机磷农药时,它们能够特异性结合DNA适配子,释放QD-AMO,通过毛细管电泳激光诱导荧光(capillary electrophoresis with laser-induced fluorescence, CE-LIF),利用比率法检测甲拌磷、丙溴磷、水胺硫磷和氧乐果。这是第一次报道使用量子点作为信号指示器用于OPs检测的方法,并有望发展为一种通用的方法来快速检测适配子-特定的小分子目标物。
5 其他方法
WALIA等[36]利用谷胱甘肽修饰的CdS选择性识别三氯杀螨醇,谷胱甘肽的氨基和羧基与三氯杀螨醇中与之邻近的氯原子相互作用,量子点表面电荷减少,导致纳米颗粒聚集,最终使谷胱甘肽-纳米颗粒荧光强度增加。乐果没有氯原子,不会发生这种相互作用,因此不会使荧光强度增加。这是目前报道的第一个区别检测有机磷和有机氯农药的方法。DONG等[37]根据解磷定和OPs之间的亲核取代反应,建立了一种电化学检测非电活性农药倍硫磷的新型方法。他们将解磷定连接在石墨烯量子点上,利用解磷定作为电活性物质检测倍硫磷,最低检出限为6.8×10-12mol/L,并能用于实际的水样和土壤中倍硫磷的检测。
本文根据传感系统识别元素的不同将部分农药残留的检测方法做了总结,见表1。
6 总结和展望
量子点优异的光学和电化学特性,结合传感技术为食品中农药残留的检测提供了一种新的思路。基于量子点建立起来的传感系统具有更高的检测特异性和灵敏度,部分方法能够做成传感平台,用于现场检测,为农兽药残留的快速检测作出了贡献。对于基于量子点构建的传感器存在的缺点,如基于酶抑制的传感系统选择性较低,酶联免疫系统不能用于多组分分析以及主-客体系统的主体材料选择范围较窄等,研究者可以寻求新的材料和方法,不断地探寻新的原理,发展新的技术构建传感系统。
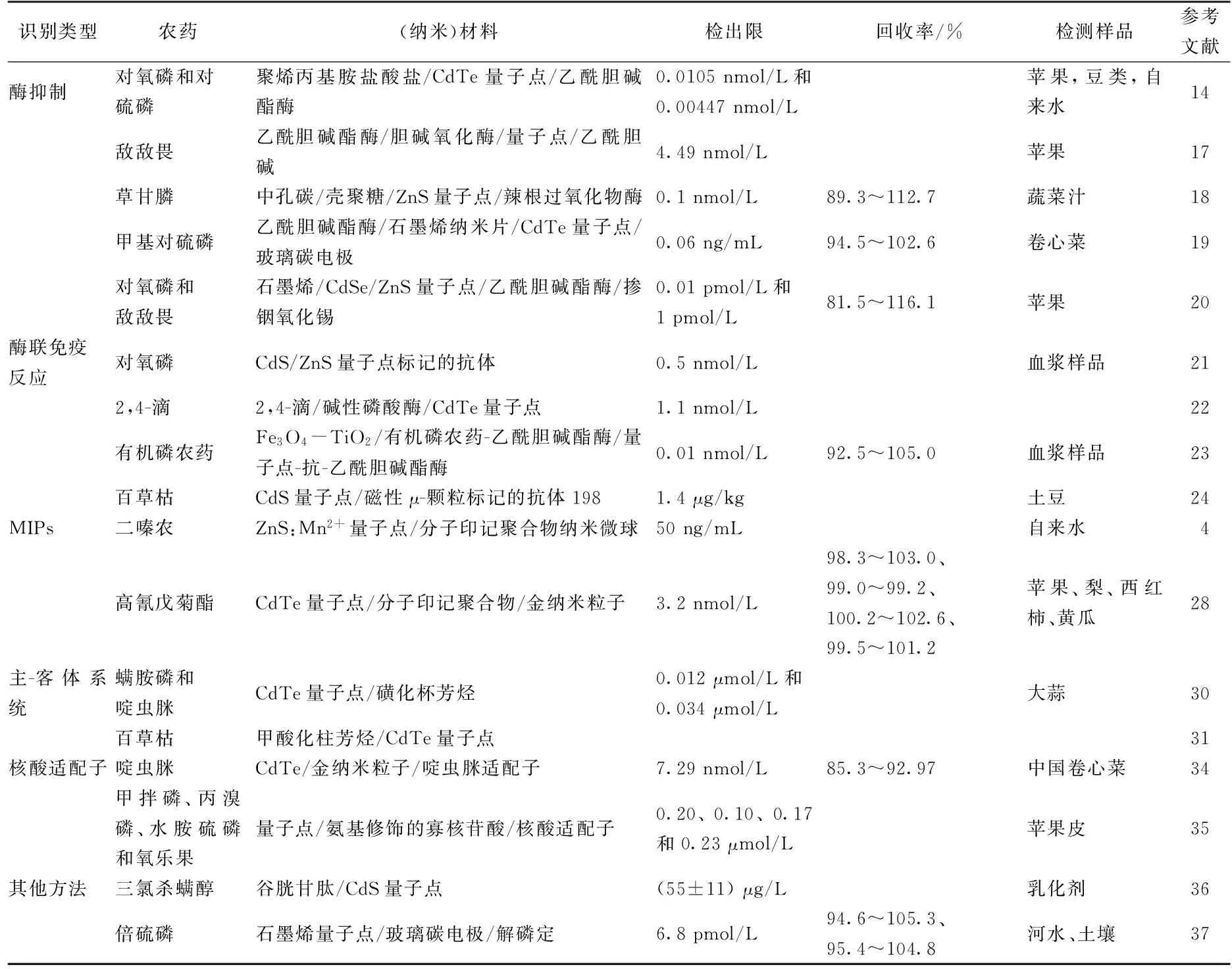
表1 农药残留检测策略
[1] WINTER C K, JARA E A. Pesticide food safety standards as companions to tolerances and maximum residue limits[J]. Journal of Integrative Agriculture, 2015, 14(11):2 358-2 364.
[2] KAUSHIK G, SATYA S, NAIK S N. Food processing a tool to pesticide residue dissipation-a review[J]. Food Research International, 2009, 42(1):26-40.
[3] GAHLAUT A, GOTHWAL A, CHHILLAR A K, et al. Electrochemical biosensors for determination of organophosphorus compounds: review[J]. Open Journal of Applied Biosensor, 2012, 1(1):1-8.
[4] ZHAO Yao-yao, MA Ying-xin, LI Hao, et al. Composite QDs@MIP Nanospheres for specific recognition and direct fluorescent quantification of pesticides in aqueous media[J]. Analytical Chemistry, 2012, 84(1):386-395.
[5] LI Hai-bing, HAN Cui-ping, ZHANG Liang. Synthesis of cadmium selenide quantum dots modified with thiourea type ligands as fluorescent probes for iodide ions[J]. Journal of Materials Chemistry, 2008, 18(38):4 543-4 548.
[6] MANCINI M C, KAIRDOLF B A, SMITH A M, et al. Oxidative quenching and degradation of polymer-encapsulated quantum dots: new insights into the long-term fate and toxicity of nanocrystalsinvivo[J]. Journal of the American Chemical Society, 2008, 130(33):10 836-10 837.
[7] SU Shao, WU Wen-he, GAO Ji-min, et al. Nanomaterials-based sensors for applications in environmental monitoring[J]. Journal of Materials Chemistry, 2012, 22(35):18 101-18 110.
[8] VERMA N, BHARDWAJ A. Biosensor Technology for Pesticides-A review[J]. Applied Biochemistry and Biotechnology, 2015, 175(6):3 093-3 119.
[9] ARAGAY G, PINO F, MERKOCI A. Nanomaterials for Sensing and Destroying Pesticides[J]. Chemical Reviews, 2012, 112(10):5 317-5 338.
[10] WANG Fang, HU Sheng-shui. Electrochemical sensors based on metal and semiconductor nanoparticles[J]. Microchimica Acta, 2009, 165(1-2):1-22.
[11] URBANOVA V, MAGRO M, GEDANKEN A, et al. Nanocrystalline iron oxides, composites, and related materials as a platform for electrochemical, magnetic, and chemical biosensors[J]. Cheminform,2015,46(6):4 188-4 191.
[12] CONSTANTINE C A, GATTAS-ASFURA K M, MELLO S V, et al. Layer-by-layer biosensor assembly incorporating functionalized quantum dots[J]. Langmuir, 2003, 19(23):9 863-9 867.
[13] VINAYAKA A C, THAKUR M S. Focus on quantum dots as potential fluorescent probes for monitoring food toxicants and foodborne pathogens[J]. Analytical and Bioanalytical Chemistry, 2010, 397(4):1 445-1 455.
[14] ZHENG Zhao-zhu, ZHOU Yun-long, LI Xin-yu, et al. Highly-sensitive organophosphorous pesticide biosensors based on nanostructured films of acetylcholinesterase and CdTe quantum dots[J]. Biosensors and Bioelectronics, 2011, 26(6):3 081-3 085.
[15] PATERNO L G, SOLER M A G. Layer-by-layer enabled nanomaterials for chemical sensing and energy conversion[J]. Journal of the Minerals Metals and Materials Society, 2013, 65(6):709-719.
[16] DHULL V, GAHLAUT A, DILBAGHI N, et al. Acetylcholinesterase biosensors for electrochemical detection of organophosphorus compounds: a review[J]. Biochemistry Research International, 2013,2013(7042):1-18.
[17] MENG Xian-wei, WEI Jian-fei, REN Xiang-ling, et al. A simple and sensitive fluorescence biosensor for detection of organophosphorus pesticides using H2O2-sensitive quantum dots/bi-enzyme[J]. Biosensors and Bioelectronics, 2013, 47(18):402-407.
[18] ZHANG Qing-rong, XU Gui-fang, GONG Ling-shan, et al. An enzyme-assisted electrochemiluminescent biosensor developed on order mesoporous carbons substrate for ultrasensitive glyphosate sensing[J]. Electrochimica Acta, 2015, 186:624-630.
[19] LIANG Han, SONG Dan-dan, GONG Jing-ming. Signal-on electrochemiluminescence of biofunctional CdTe quantum dots for biosensing of organophosphate pesticides[J]. Biosensors and Bioelectronics, 2014, 53(16):363-369.
[20] LI Xin-yu, ZHENG Zhao-zhu, LIU Xue-feng, et al. Nanostructured photoelectrochemical biosensor for highly sensitive detection of organophosphorous pesticides[J]. Biosensors and Bioelectronics, 2015, 64:1-5.
[21] WANG Hua, WANG Jun, TIMCHALK C, et al. Magnetic electrochemical immunoassays with quantum dot labels for detection of phosphorylated acetylcholinesterase in plasma[J]. Analytical Chemistry, 2008, 80(22):8 477-8 484.
[22] VINAYAKA A C, BASHEER S, THAKUR M S. Bioconjugation of CdTe quantum dot for the detection of 2,4-dichlorophenoxyacetic acid by competitive fluoroimmunoassay based biosensor[J]. Biosensors and Bioelectronics, 2009, 24(6):1 615-1 620.
[23] ZHANG Xiao, WANG Hong-bo, YANG Chun-ming, et al. Preparation, characterization of Fe3O4at TiO2magnetic nanoparticles and their application for immunoassay of biomarker of exposure to organophosphorus pesticides[J]. Biosensors and Bioelectronics, 2013, 41(6):669-674.
[24] VALERAA E, GARCIA-FEBREROB R, PIVIDORI I, et al. Coulombimetric immunosensor for paraquat based on electrochemical nanoprobes[J]. Sensors and Actuators B-Chemical, 2014, 194:353-360.
[25] XIE Cheng-gen, LI Huai-fen, LI Shan-qi, et al. Surface molecular imprinting for chemiluminescence detection of the organophosphate pesticide chlorpyrifos[J]. Microchimica Acta, 2011, 174(3):311-320.
[26] IRSHAD M, IQBAL N, MUJAHID A, et al. Molecularly imprinted nanomaterials for sensor applications[J]. Nanomaterials, 2013, 3(4):615-637.
[27] PANDEY V, CHAUHAN A, PANDEY G, et al. Optical sensing of 3-phenoxybenzoic acid as a pyrethroid pesticides exposure marker by surface imprinting polymer capped on manganese-doped zinc sulfide quantum dots[J]. Analytical Chemistry Research, 2015, 5:21-27.
[28] WANGA Y, ZANGA D, GE Shen-guang, et al. A novel microfluidic origami photoelectrochemical sensor based onCdTe quantum dots modified molecularly imprinted polymer and itshighly selective detection of S-fenvalerate[J]. Electrochimica Acta, 2013, 107(3):147-154.
[29] YANG Ying-wei, SUN Yu-long, SONG Nan. Switchable Host-Guest Systems on Surfaces[J]. Accounts of Chemical Research, 2014, 47(7):1 950-1 960.
[30] QU Feng-ge, ZHOU Xiu-fen, XU Jing, et al. Luminescence switching of CdTe quantum dots in presence of p-sulfonatocalix[4]arene to detect pesticides in aqueous solution[J]. Talanta, 2009, 78(4-5):1 359-1 363.
[31] CHEN Dai-xiong, SUN Yu-long, ZHANG Yi, et al. Supramolecular self-assembly and photophysical properties of pillar[5]arene-stabilized CdTe quantum dots mediated by viologens[J]. RSC Advances, 2013, 3(17):5 765-5 768.
[32] HYEON J Y, CHON J W, CHOI I S, et al. Development of RNA aptamers for detection of Salmonella Enteritidis[J]. Journal of Microbiological Methods, 2012, 89(1):79-82.
[33] LIU Xiao-fei, ZHANG Xue-wu. Aptamer-based technology for food analysis[J]. Applied Biochemistry and Biotechnology, 2015, 175(1):603-624.
[34] GUO Jia-jia, LI Ying, WANG Luo-kai, et al. Aptamer-based fluorescent screening assay for acetamiprid via inner filter effect of gold nanoparticles on the fluorescence of CdTe quantum dots[J]. Analytical and Bioanalytical Chemistry, 2015,408(2):1-10.
[35] TANG Ting-ting, DENG Jing-jing, ZHANG Min, et al. Quantum dot-DNA aptamer conjugates coupled with capillary electrophoresis: a universal strategy for ratiometric detection of organophosphorus pesticides[J]. Talanta, 2016, 146(2):55-61.
[36] WALIA S, ACHARYA A. Fluorescent cadmium sulfide nanoparticles for selective and sensitive detection of toxic pesticides in aqueous medium[J]. Nanoparticle Research, 2014, 16(12):1-10.
[37] DONG Jing, HOU Ju-ying, JIANG Jian-xia, et al. Innovative approach for the electrochemical detection of non-electroactive organophosphorus pesticides using oxime as electroactive probe[J]. Analytica Chimica Acta, 2015, 885:92-97.
Application of quantum dots sensing technology in the detection of pesticide residues
ZHANG Xue-jin1, MA Xue-bin2, XIONG Xiao-hui1,3, LU Li-xia1,3, CHI Bo1*
1(College of food and light industry, Nanjing University of Technology, Nanjing 211816, China) 2(College of chemical engineering, Nanjing University of Science and Technology, Nanjing 210094, China) 3(Jiangsu public technical service center for rapid detection of food safety, Nanjing 210009, China)
Pesticide residues in food are threatening human health, and sensing technology based on quantum dots has great advantages in the detection of pesticide residues. This paper reviews several main sensing technologies applied in pesticide residues in recent years and discusses the challenges of these sensing technologies in the detection of pesticide residue.
quantum dots; sensing; pesticide residues; detection
10.13995/j.cnki.11-1802/ts.201610042
硕士研究生(迟波副研究员为通讯作者,E-mail:chibo@njtech.edu.cn)。
国家自然科学基金青年基金(31401588)
2016-01-26,改回日期:2016-03-25
